石蒜碱诱导H22荷瘤小鼠体内肿瘤细胞凋亡的活性及机制研究
辛国松 张晶 李吉业 季宇彬 刘斌 李钧 陈鹰翔 于淼


摘 要 目的:探讨石蒜碱诱导H22荷瘤小鼠体内肿瘤细胞凋亡的活性及其机制。方法:以昆明种小鼠为对象,通过前肢腋部皮下接种H22肝癌小鼠腹水构建小鼠实体瘤模型,将造模后的小鼠随机分为阴性对照组、阳性对照组(羟基喜树碱6 mg/kg)和石蒜碱低、中、高剂量组(10、20、40 mg/kg),每组10只。阴性对照组小鼠灌胃等体积生理盐水,各给药组小鼠灌胃相应药物,每天1次,连续给药7天。末次给药后,检测小鼠的瘤体质量并计算抑瘤率。另通过腹腔注射H22肝癌小鼠腹水构建小鼠腹水瘤模型,同法分组、给药。末次给药后,记录小鼠的生存时间并计算生存延长率,采用流式细胞术检测小鼠肿瘤细胞的早期凋亡率;在设立正常对照组(未荷瘤正常小鼠)的基础上,采用荧光探针钙黄绿素乙酰甲酯染色法考察各组小鼠肿瘤细胞的线粒体膜通透性,采用Rhodamine 123染色法考察其线粒体电位变化,采用比色法和Western blot法分别检测其胱天蛋白酶3(Caspase-3)活性和凋亡相关蛋白[Bcl-2、Bax、细胞色素C(Cyt-C)、Caspase-9]的表达情况。结果:与阴性对照组比较,阳性对照组和石蒜碱各剂量组小鼠瘤体质量均显著降低,生存时间均显著延长,肿瘤细胞的早期凋亡率均显著升高(P<0.05或P<0.01);其抑瘤率分别为39.41%、23.36%、36.50%、56.93%,生命延长率分别为49.23%、29.09%、50.19%、69.08%。与正常对照组比较,阴性对照组小鼠肿瘤细胞线粒体膜通透性、Caspase-3蛋白活性以及Cyt-C、Caspase-9蛋白的表达水平均显著升高,线粒体膜电位、Bcl-2/Bax比值显著降低(P<0.05或P<0.01);与阴性对照组比较,各药物组小鼠肿瘤细胞线粒体膜通透性和Bcl-2/Bax比值均显著降低,线粒体通透性、Caspase-3蛋白活性和Cyt-C、Caspase-9蛋白的表达水平均显著升高(P<0.05或P<0.01)。结论:石蒜碱可诱导H22荷瘤小鼠体内肿瘤细胞凋亡,这种作用可能与其开放线粒体膜通透性转换孔以增加線粒体通透性、降低线粒体膜电位、诱导凋亡相关蛋白表达上调有关。
关键词 石蒜碱;荷瘤小鼠;线粒体;抗肿瘤;细胞凋亡;机制
中图分类号 R285.5 文献标志码 A 文章编号 1001-0408(2021)05-0571-07
ABSTRACT OBJECTIVE: To investigate the activity of lycorine to the in vivo apoptosis of tumor cells in H22-bearing mice and its mechanism. METHODS: Kunming mice were inoculated subcutaneously with ascites of H22 hepatoma mice in the armpit of forelimb to establish solid tumor model. After modeling, mice were randomly divided into negative control group, positive control group (hydroxycamptothecin 6 mg/kg), lycorine low-dose, medium-dose and high-dose groups (10, 20, 40 mg/kg), with 10 mice in each group. Negative control group was given constant volume of normal saline intragastrically, and administration groups were given relevant medicine intragastrically, once a day, for consecutive 7 days. After last medication, the weight of tumor was detected and anti-tumor rate was calculated. Ascites tumor model of mice was established by intraperitoneal injection of H22 hepatoma mice ascites, and then were grouped with same method and given relevant medicine as above. After last medication, survival time of mice was recorded and the life prolongation rate was calculated. The early apoptotic rate of tumor cells in mice was detected by flow cytometry. On the basis of normal control group (normal mice without tumor), the mitochondrial membrane permeability of tumor cells in each group was investigated by Calcein AM staining. The changes of mitochondrial potential were investigated by Rhodamine 123 staining. Colorimetry and Western blot assay were adopted to detect the Caspase-3 activity and expression of apoptosis-related protein (Bcl-2, Bax, Cyt-C and Caspase-9). RESULTS: Compared with negative control group, the tumor weight of positive control group and lycorine groups were decreased significantly, while the survival time was significantly prolonged, and the early apoptotic rate of tumor cells was significantly increased (P<0.05 or P<0.01); the anti-tumor rates were 39.41%, 23.36%, 36.50%, 56.93%, and life prolongation rates were 49.23%, 29.09%, 50.19%, 69.08%. Compared with normal control group, the mitochondrial membrane permeability, Caspase-3 protein activity and protein expression of Cyt-C and Caspase-9 were significantly increased, while the mitochondrial membrane potential and Bcl-2/Bax ratio were decreased significantly (P<0.05 or P<0.01). Compared with negative control group, mitochondrial membrane permeability and Bcl-2/Bax ratio were decreased significantly in administration groups, while mitochondrial permeability, Caspase-3 protein activity and protein expression of Cyt-C and Caspase-9 were significantly increased (P<0.05 or P<0.01). CONCLUSIONS: Lycorine can induce the apoptosis of tumor cells in H22-bearing mice, the effects of which may be associated with opening mitochondrial membrane permeability transition pore to increase mitochondrial permeability, decreasing mitochondrial membrane potential and up-regulating the expression of apoptosis-related proteins.
KEYWORDS Lycorine; Tumor-bearing mice; Mitochondrial; Anti-tumor; Apoptosis; Mechanism
石蒜碱广泛存在于石蒜科植物中,是一种异喹啉类生物碱[1-3]。该化合物的分子量为287.30,化学式为C16H17NO4,纯品为无色棱柱状的结构晶体,熔点为275~280 ℃,微溶于氯仿、乙醇和石油醚,可溶于稀酸,但难溶于水[1-3]。现有研究表明,石蒜碱主要是从石蒜的鳞茎、文殊兰的种子和叶片、朱顶红的叶片中被提取出来的[4-7],具有广泛的药理活性,如抗肿瘤、抗病毒、镇静等[8-12]。近年来,国内外专家学者对石蒜碱的抗肿瘤作用进行了诸多研究,发现该化合物对人乳腺癌MCF-7细胞[13-15]、人早幼粒白血病HL-60细胞[16-17]、人白血病U937细胞[18]、人食管癌Eca-109细胞[19]、人肝癌HepG2细胞[20]、人胃癌SGC-7901细胞[21]均具有显著的抑制作用,但现有研究大多以体外试验为主,缺少对石蒜碱体内抗肿瘤药效学研究的相关报道,且抗肿瘤作用机制尚未明确。因此,本研究以此为切入点,通过建立小鼠体内肿瘤模型,从细胞水平、分子水平对石蒜碱的抗肿瘤活性进行探讨,并初步挖掘其作用机制,旨在为石蒜碱抗肿瘤作用机制的阐明以及其相关抗肿瘤新药的研发和应用提供基础数据和理论参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括ECO-170P-230型培养箱(美国NBS公司),CKX-41-32型倒置显微镜(日本Olympus公司),标准型PB-10 pH计(德国Sartorius公司),AR1140型分析天平(美国OHAUS公司),DL-CJ-1N型医用型超净工作台(北京东联哈尔仪器制造有限公司),TCS-SP2型激光共聚焦扫描显微镜(德国Leica公司),L-90K型低温高速离心机(美国Beckman公司),680型酶标仪(美国Bio-Rad公司),DYY-7C型电泳仪、WD-9413C型凝胶成像系统(北京六一仪器厂)等。
1.2 主要药品与试剂
石蒜碱原料药(批号34296,纯度98%)购自阿拉丁试剂有限公司;羟基喜树碱原料药(批号20130112,纯度98%)购自哈尔滨圣泰药业有限公司;荧光染料Rhodamine 123(批号C2215S)、辣根过氧化物酶标记的山羊抗兔IgG(H+L)二抗(批号A0277)、兔Bcl-2多克隆抗体(批号AB116)、小鼠细胞色素C(Cyc-C)多克隆抗体(批号AC908)、小鼠Bax多克隆抗体(批号AB026)、胱天蛋白酶3(Caspase-3)活性检测试剂盒(批号AC033)、兔Caspase-9多克隆抗体(批号AC062)、兔β-肌动蛋白(β-actin)多克隆抗体(批号AF5003)、考马斯亮蓝快速染色液(批号P0017)均购自碧云天生物技术研究所;台盼蓝染液(批号:C0040)购自北京索莱宝科技有限公司;胰酶(批号C0202)、PI染色细胞凋亡试剂盒(批号C1056)、线粒体通透性转换孔(MPTP)检测试剂盒(批号C2006)、荧光探针钙黄绿素乙酰甲酯(Calcein AM)染料(批号C2009S)、裂解液(批号P0013)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上样缓冲液(批号P0015)均购自上海碧云天生物技术有限公司;小牛血清(批号11011-8611)购自浙江天杭生物科技股份有限公司;Reagent A溶液(批號23221)购自北京诺为生物科技有限公司;AP-NBT/BICT显色液(批号5972)购自上海一基生物试剂有限公司;RPMI 1640培养基(批号10491)购自北京博奥华医生物科技有限公司;其余试剂均为分析纯或实验常用规格,水为蒸馏水。
1.3 动物与细胞
清洁级健康昆明种小鼠雌雄各半,5周龄,体质量18~22 g,由黑龙江中医药大学佳木斯学院动物实验室提供[动物使用许可证号SYXK(黑)2017-010];小鼠H22肝癌细胞株由哈尔滨商业大学理学院提供。
2 方法
2.1 石蒜碱对H22荷瘤小鼠抗肿瘤作用研究
2.1.1 H22荷瘤小鼠实体瘤模型的建立 取出冻存好的H22肝癌细胞株复苏后,以RPMI 1640培养基重悬为5×106个/mL的细胞悬液。取小鼠,于腹腔部位消毒后,取上述细胞悬液按0.2 mL/只腹腔接种,常规饲养5~8天,以腹腔明显变大、腹水饱满为接种成功。随后,于无菌条件下对小鼠腹部进行消毒,并用一次性医用注射器抽取接种成功的小鼠的淡黄色腹水(即肿瘤液),使用显微镜观察腹水状态并以细胞计算板进行计数;采用台盼蓝拒染法检测细胞活性(保证其活性在95%以上),然后用4 ℃无菌生理盐水调整细胞密度为5×106个/mL,再按0.2 mL/只皮下接种于正常小鼠右前肢腋部,常规饲养直至出现明显瘤体为造模成功。
2.1.2 H22荷瘤小鼠腹水瘤模型的建立 取出冻存好的H22肝癌细胞株复苏后,以RPMI 1640培养基重悬为5×106个/mL的细胞悬液。取小鼠,按“2.1.1”项下方法接种并抽取淡黄色腹水(即肿瘤液);同法调整细胞密度为5×106个/mL,再按0.2 mL/只接种于正常小鼠腹腔,常规饲养直至其腹腔明显变大、腹水饱满为造模成功。
2.1.3 分组与给药 分别取按“2.1.1”“2.1.2”项下方法成功复制H22实体瘤和腹水瘤模型的荷瘤小鼠各50只,均随机分为阴性对照组、阳性对照组(羟基喜树碱6 mg/kg,剂量设置参考文献[22]和预实验结果)和石蒜碱低、中、高剂量组(石蒜碱10、20、40 mg/kg,剂量设置参考文献[22]和预实验结果),每组10只。阴性对照组小鼠腹腔注射生理盐水0.2 mL,各给药组小鼠腹腔注射相应药液[均以磷酸盐缓冲液(PBS,pH 7.4)配制,下同]0.2 mL,每天1次,连续给药7天。实验期间所有小鼠均正常摄食、饮水。
2.1.4 石蒜碱对H22荷瘤小鼠抑瘤作用的检测 使用实体瘤小鼠模型进行实验。末次给药24 h后,称定小鼠体质量,以颈椎脱臼法将其处死并以仰卧位固定,于胸部消毒后,在其右前肢腋窝处将瘤体剥离;称定瘤体质量,并计算石蒜碱抑瘤率:抑瘤率=(阴性对照组平均瘤体质量-给药组平均瘤体质量)/阴性对照组平均瘤体质量×100%。
2.1.5 石蒜碱对H22荷瘤小鼠生存时间影响的检测 使用腹水瘤小鼠模型进行实验。末次给药后,记录各组小鼠的平均生存时间,观察时间设定为30天(若小鼠生存超过此时间,则按30天进行计算)[23],计算小鼠生命延长率:生命延长率=(给药组平均生存天数-阴性对照组平均生存天数)/阴性对照组平均生存天数×100%。
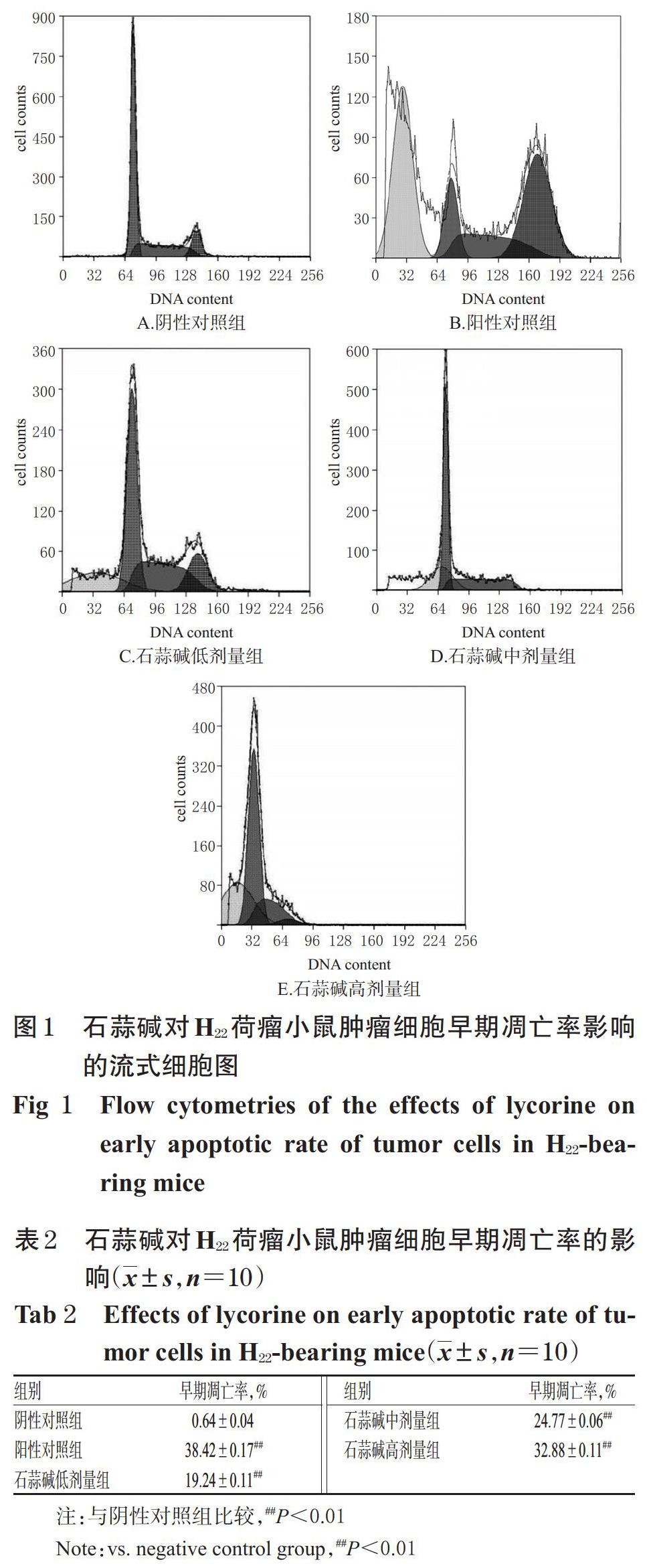
2.1.6 石蒜碱对H22荷瘤小鼠肿瘤细胞早期凋亡影响的检测 使用腹水瘤小鼠模型进行实验,以流式细胞术检测。(1)肿瘤细胞收集:于末次给药次日(于处死前),用注射器于小鼠腹腔中抽取腹水1 mL,以2 000 r/min离心10 min后,弃去上层清液;沉淀用0.85%NH4Cl溶液洗涤3次,然后再用生理盐水洗涤3次,再以2 000 r/min离心10 min,弃去上层清液,即得肿瘤细胞,待用。(2)细胞早期凋亡率检测:将上述H22荷瘤小鼠的肿瘤细胞用PBS吹打并清洗1次,以2 000 r/min离心5 min,弃去上层清液,沉淀用-20 ℃的70%乙醇重悬后于4 ℃固定24 h;随后,以2 000 r/min离心10 min,弃去上层清液,沉淀(即肿瘤细胞)避光加入PI染液800 μL,轻轻吹打、混匀,于室温下避光孵育30 min,滤过,使用流式细胞仪检测细胞的早期凋亡率。
2.2 石蒜碱对H22荷瘤小鼠肿瘤细胞线粒体膜功能影响的研究
2.2.1 分组与给药 取接种成功的腹水瘤模型小鼠50只,按“2.1.1”项下方法分为阴性对照组、阳性对照组(羟基喜树碱,6 mg/kg)和石蒜碱低、中、高剂量组(10、20、40 mg/kg),每组10只;同时取10只不荷瘤的正常小鼠作为正常对照组。阴性对照组和正常对照组小鼠腹腔注射生理盐水0.2 mL,各给药组腹腔注射相应药液0.2 mL,每天1次,连续给药7天。实验期间所有小鼠均正常摄食饮水。
2.2.2 细胞收集 (1)肿瘤细胞:方法同“2.1.6(1)”项。(2)正常小鼠肝细胞:取正常对照组小鼠肝组织适量并切成小块,用PBS清洗后放入试管中,加入胰酶于37 ℃消化15 min,用小牛血清中止消化,濾过,将消化后的组织液以2 000 r/min反复离心2 min×3次,收集沉淀,加入0.85%NH4Cl溶液1 mL以破除血细胞,再以1 500 r/min离心5 min,收集沉淀,即得正常小鼠肝细胞,待用。
2.2.3 石蒜碱对H22荷瘤小鼠肿瘤细胞线粒体膜通透性影响的检测 按“2.2.2”项下方法收集正常对照组小鼠肝细胞和其余各组小鼠肿瘤细胞适量,用Reagent A溶液混匀,以2 000 r/min离心10 min,弃去上层清液,沉淀加入Calcein AM染料避光染色20 min,以1 000 r/min离心10 min,弃去上层清液,沉淀(即受试细胞)用Reagent A溶液清洗后,再加入该溶液500 μL,吹打并混匀。精确吸取该细胞混悬液100 μL,采用激光共聚焦扫描显微镜观察,以检测到的荧光强度(即FI值)来反映细胞的粒体膜通透性,FI值越大则其线粒体膜通透性越低。
2.2.4 石蒜碱对H22荷瘤小鼠肿瘤细胞线粒体膜电位变化影响的检测 按“2.2.2”项下方法收集正常对照组小鼠肝细胞和其余各组小鼠肿瘤细胞适量,用PBS吹打并清洗1次,避光加入Rhodamine 123染料,避光孵育30 min,以2 000 r/min离心10 min,弃去上清液,沉淀(即受试细胞)经PBS清洗2次后,用PBS 400 μL重悬,并使用激光共聚焦扫描显微镜观察,以检测到的FI值来反映细胞的线粒体膜电位,FI值越大则其线粒体膜电位越高。
2.2.5 石蒜碱对H22荷瘤小鼠肿瘤细胞内Caspase-3蛋白活性影响的检测 按“2.2.2”项下方法收集正常对照组小鼠肝细胞和其余各组小鼠肿瘤细胞适量,用PBS吹打并清洗1次,以2 000 r/min离心10 min,弃去上清液,沉淀加入裂解液适量,于冰浴中裂解15 min;于4 ℃下以16 000 r/min离心15 min,取上层清液,使用比色法以酶标仪检测Caspase-3蛋白的活性(严格按相应试剂盒说明书操作)。
2.2.6 石蒜碱对H22荷瘤小鼠肿瘤细胞内凋亡相关蛋白表达影响的检测 采用Western blot法检测。按“2.2.2”项下方法收集正常对照组小鼠肝细胞和其余各组小鼠肿瘤细胞适量,用PBS清洗1次,彻底吸弃PBS溶液后,加入裂解液适量,于冰浴中裂解15 min,再于4 ℃下以16 000 r/min离心15 min,取上层清液置于-80 ℃条件下保存,待用。经考马斯亮蓝法测定该上层清液中的蛋白含量后,加入适量SDS-PAGE上样缓冲液,于100 ℃变性5 min。取变性后的蛋白样品适量,行15% SDS-PAGE。电泳后转膜,以脱脂奶粉封闭2 h,然后加入Bcl-2、Bax、Cyc-C、Caspase-9、β-actin一抗(稀释度均为1 ∶ 200),于4 ℃下孵育过夜;依次用TBST溶液、TBS溶液在室温下洗涤10 min×2次、10 min×1次后,加入相应二抗(稀释度为1 ∶ 500),室温孵育2 h;依次用TBST溶液、TBS溶液在室温下洗涤10 min×2次、10 min×1次,以AP-NBT/BICT显色液显色,再置于凝胶成像系统上成像。使用Image G v2.8.7软件分析,以Cyc-C、Caspase-9蛋白与内参β-actin的灰度值比值表示上述蛋白的表达水平,并记录Bcl-2/Bax的灰度值比值。
2.3 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料均以x±s表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
3 结果
3.1 石蒜碱对H22荷瘤小鼠瘤体质量的影响
与阴性对照组比较,阳性对照组和石蒜碱各剂量组小鼠的瘤体质量均显著降低(P<0.05或P<0.01),且石蒜碱各剂量组小鼠的瘤体质量有随剂量增加而降低的趋势;各给药组的抑瘤率分别为39.41%、23.36%、36.50%、56.93%,详见表1。
3.2 石蒜碱对H22荷瘤小鼠生存时间的影响
与阴性对照组比较,阳性对照组和石蒜碱各剂量组小鼠的生存时间均显著延长(P<0.05或P<0.01),且石蒜碱各剂量组小鼠的生存时间有随剂量增加而延长的趋势;各给药组小鼠的生命延长率分别为49.23%、29.09%、50.19%、69.08%,详见表1。
3.3 石蒜碱对H22荷瘤小鼠肿瘤细胞早期凋亡的影响
与阴性对照组比较,阳性对照组和石蒜碱各剂量组小鼠肿瘤细胞的早期凋亡率均显著升高(P<0.01),且石蒜碱各剂量组小鼠肿瘤细胞的早期凋亡率有随剂量增加而升高的趋势,详见图1、表2。
3.4 石蒜碱对肿瘤细胞线粒体膜通透性的影响
与正常对照组比较,阴性对照组小鼠肿瘤细胞FI值显著升高(P<0.01),提示其线粒体膜通透性明显减弱;与阴性对照组比较,阳性对照组和石蒜碱各剂量组小鼠肿瘤细胞FI值均显著降低,且显著低于正常对照组(P<0.05),同时石蒜碱各剂量组小鼠肿瘤细胞的FI值有随剂量增加而降低的趋势,提示线粒体膜通透性均不同程度地增强,详见图2、表3。
3.5 石蒜碱对H22荷瘤小鼠肿瘤细胞线粒体膜电位的影响
与正常对照组比较,阴性对照组小鼠肿瘤细胞FI值显著升高(P<0.01),提示其线粒体膜电位明显升高;与阴性对照组比较,阳性对照组和石蒜碱各剂量组小鼠肿瘤细胞FI值均显著降低,且显著低于正常对照组(P<0.01),同时石蒜碱各剂量组小鼠的肿瘤细胞FI值有随剂量增加而降低的趋势,提示线粒体膜电位不同程度地降低,详见图3、表3。
3.6 石蒜碱对H22荷瘤小鼠肿瘤细胞内Caspase-3蛋白活性的影响
与正常对照组比较,阴性对照组小鼠肿瘤细胞内Caspase-3蛋白的活性显著增强(P<0.01);与阴性对照组比较,阳性对照组和石蒜碱各剂量组小鼠肿瘤细胞内Caspase-3蛋白的活性均显著增强,且显著强于正常对照组(P<0.01),同时石蒜碱各剂量组小鼠肿瘤细胞内Caspase-3蛋白活性有随剂量增加而增强的趋势,详见表4。
3.7 石蒜碱对H22荷瘤小鼠肿瘤细胞内Bcl-2、Bax、Cyt-C、Caspase-9蛋白表达的影响
与正常对照组比较,阴性对照组小鼠肿瘤细胞内Bcl-2/Bax比值和Cyt-C、Caspase-9蛋白的表达水平均显著升高(P<0.01);与阴性对照组比较,阳性对照组和石蒜碱各剂量组小鼠的肿瘤细胞内Bcl-2/Bax比值和Cyt-C、Caspase-9蛋白的表达水平均显著降低,Cyt-C、Caspase-9蛋白的表达水平均显著升高,且显著低于或高于正常对照组(P<0.01),同时石蒜碱各剂量组小鼠肿瘤细胞内Bcl-2/Bax比值和Cyt-C、Caspase-9的蛋白表达水平有随剂量增加而降低或升高的趋势,详见图4、表5。
4 讨论
石蒜碱具有很高的药用价值,但由于对该化合物抗肿瘤作用的研究起步较晚且不够深入[3],导致其抗肿瘤作用机制尚未完全阐明。因此,为了明确石蒜碱抗肿瘤作用机制,充分发挥其抗肿瘤药用价值,本研究以肝癌细胞H22荷瘤模型小鼠为对象,对石蒜碱的体内抗肿瘤活性进行了研究。此外,羟基喜树碱作为市售抗肿瘤药物,抗肿瘤机制明确[24-25],加之其与石蒜碱同为生物碱,均为五环结构,分子量接近,因此本研究将其选作阳性对照药物。
首先,本研究为验证石蒜碱能否抑制小鼠瘤体增长而采用了实体瘤小鼠模型,拟通过观察瘤体的质量变化来计算石蒜碱抑瘤率;同时,为证实石蒜碱能否有效延长小鼠生存时间并诱导肿瘤细胞发生凋亡而采用了腹水瘤小鼠模型,以便能快速、简便地从小鼠体内取出肿瘤细胞。在细胞发生凋亡的过程中,线粒体是首个发生变化的细胞器:在细胞凋亡初期,线粒体形态会发生改变;而当抗肿瘤药物刺激细胞线粒体时,位于线粒体内外膜中间的MPTP被打开,使得线粒体膜内外渗透压发生改变、膜电位降低,同时细胞质内流导致线粒体体积增加、外膜破裂,从而进一步促进线粒体内膜与外膜之间的凋亡相关因子释放,这些诱导因子可以直接破坏细胞核内染色质,激活Caspase家族蛋白,最终启动细胞凋亡程序;此外有研究指出,当细胞内线粒体膜电位一旦发生异常,即使排除与细胞凋亡有關的所有诱导因素,细胞依然会发生凋亡,并且这种凋亡是不可逆转的,可见线粒体膜电位一旦降低,细胞必然会不可逆转地发生凋亡[26-29]。本研究结果显示,经不同剂量的石蒜碱作用后,各药物组H22荷瘤小鼠的瘤体质量显著降低、生存时间显著延长、早期凋亡率显著升高,石蒜碱低、中、高剂量组的抑瘤率有随剂量增加而升高的趋势;同时,各给药组荷瘤小鼠肿瘤细胞的线粒体膜通透性均显著增强,而线粒体膜电位均显著降低,且均有剂量依赖性趋势,提示石蒜碱能增加肿瘤细胞线粒体膜的通透性和降低其膜电位,破坏线粒体内环境的稳定。
有研究指出,线粒体膜电位的产生主要与线粒体膜内外质子分布不对称有关,抗肿瘤药物刺激线粒体膜,导致MPTP开放,促使线粒体膜电位降低,线粒体膜内外凋亡诱导因子等就会排放或流入细胞质内,这些因子就会激活Caspase家族,导致细胞凋亡[30-32]。基于此,本研究对凋亡启动蛋白Caspase-3活性以及凋亡调控蛋白Bcl-2、Bax、Cyt-C、Caspase-9蛋白的表达情况进行了检测。结果显示,与阴性对照组比较,各药物组小鼠肿瘤细胞内Caspase-3蛋白的活性和Cyt-C、Caspase-9蛋白的表达水平均显著升高,Bcl-2/Bax比值均显著降低,提示石蒜碱能够促进细胞内外膜间的凋亡调控蛋白Cyt-C释放,并与Caspase-9蛋白发生级联反应,最终启动细胞凋亡程序。
综上所述,石蒜碱在H22荷瘤小鼠体内具有抗肿瘤作用;其能通过破坏肿瘤细胞线粒体膜结构功能,导致线粒体内促细胞凋亡因子的释放,进而启动细胞凋亡程序,最终发挥抗肿瘤作用。但本研究只对线粒体膜通透性以及膜电位等指标进行了检测,而未分析线粒体膜损伤的超微结构以及线粒体损伤后的功能变化,有待后续研究进一步深入探索,以便更全面系统地阐释石蒜碱基于线粒体损伤途径的抗肿瘤机制。
参考文献
[ 1 ] WANG LY,QIU BL,XIA H,ET AL. Isoquinoline-derived alkaloid enantiomers from corydalis yanhusuo and their biological activity[J]. J Asian Nat Prod Res,2020,83(2):489-496.
[ 2 ] 果婷婷,王輝强,李玉环,等.石蒜碱及其衍生物的药理作用研究进展[J].中国医药生物技术,2018,13(5):463-466.
[ 3 ] 辛国松,季宇彬,于淼,等.基于线粒体靶向机制的石蒜碱抗肝癌作用研究[J].中草药,2018,49(5):1132-1138.
[ 4 ] KOLACKOVA M,CHALOUPSKY P,CERNEI N,et al. Lycorine and UV-C stimulate phenolic secondary metabolites production and miRNA expression in Chlamydomonas reinhardtii[J]. J Hazard Mater,2020,391:122088.
[ 5 ] LIANG X,ZHANG L,LI F,et al. Autophagy-regulating N-heterocycles derivatives as potential anticancer agents[J]. Future Med Chem,2020,12(3):223-242.
[ 6 ] DE ALMEIDA WAM,DE ANDRADE JP,CHACON DS,et al. Isoquinoline alkaloids reduce beta-amyloid peptide toxicity in Caenorhabditis elegans[J/OL]. Nat Prod Res,2020[2020-08-16].https://www.tandfonline.com/doi/full/10.1080/14786419.2020.1727471. DOI:10.1080/14786419. 2020.1727471.
[ 7 ] 季宇彬,辛国松,曲中原,等.石蒜属植物生物碱类化学成分和药理作用研究进展[J].中草药,2016,47(1):157-164.
[ 8 ] PTAK A,SIMLAT M,MORA?SKA E,et al. Exogenous melatonin stimulated Amaryllidaceae alkaloid biosynthesis in in vitro cultures of Leucojum aestivum L[J]. Ind Crop Prod,2019,138:111458.
[ 9 ] WANG H,GUO T,YANG Y,et al. Lycorine derivative LY-55 inhibits EV71 and CVA16 replication through downregulating autophagy[J]. Front Cell Infect Microbiol,2019,9:277.
[10] TARAKEMEH A,AZIZI M,ROWSHAN V,et al. Scree- ning of Amaryllidaceae alkaloids in bulbs and tissue cultures of Narcissus papyraceus and four varieties of N. tazetta[J]. J Pharm Biomed Anal,2019,172:230-237.
[11] ZHANG P,ZHANG M,YU D,et al. Lycorine inhibits melanoma cell migration and metastasis mainly through reducing intracellular levels of β-catenin and matrix metallopeptidase 9[J]. J Cell Physiol,2019,234(7):10566- 10575.
[12] ZHAO G,WANG Y,YAGN C,et al. Interplay between autophagy and apoptosis in lycorine hydrochloride-induced cytotoxicity of HCT116 cells[J]. Nat Prod Commun,2019,14(7):1934578X1986210.
[13] JI Y,YU M,QI Z,et al. Study on apoptosis effect of human breast cancer cell MCF-7 induced by lycorine hydrochloride via death receptor pathway[J]. Saudi Pharm J,2017,25(4):633-637.
[14] YU M,JI Y,CHANG K,et al. The effect of lycorine on the apoptosis and mitochondrial signal pathway of human breast cancer MCF-7 cell line[J]. Acta Medica Mediterr,2016,32(6):1767-1772.
[15] 石碧炜.石蒜碱对人乳腺癌细胞MCF-7存活率及线粒体膜电位的影响[J].医学综述,2010,16(16):2524-2525.
[16] 胡济梁.石蒜碱诱导HL-60细胞凋亡的分子机制探讨[D].长沙:中南大学,2008.
[17] LIU J,HU WX,HE LF,et al. Effects of lycorine on HL- 60 cells via arresting cell cycle and inducing apoptosis[J]. FEBS Lett,2004,578(3):245-250.
[18] 刘小珊,蒋纪恺.石蒜碱对人白血病U937细胞的凋亡诱导及作用机制[J].山东医药,2008,48(2):35-37.
[19] 彭聰.石蒜碱及盐酸石蒜碱对肺癌A549细胞和食管癌Eca-109细胞增殖和凋亡的影响[D].南充:西华师范大学,2016.
[20] LIU WY,TANG Q,ZHANG Q,et al. Lycorine induces mitochondria-dependent apoptosis in hepatoblastoma HepG2 cells through ROCK1 activation[J]. Front Pharmacol,2019,10:651.
[21] 张淑静,马俊英,杨丹丹.石蒜碱通过ERK信号通路诱导胃癌SGC-7901细胞凋亡及自噬[J].天然产物研究与开发,2020,32(10):1667-1673.
[22] XIN G,YU M,HU Y,et al. Effect of lycorine on the structure and function of hepatoma cell membrane in vitro and in vivo[J]. Biotechnol Biotechnol Equip,2020,34(1):104-114.
[23] 汲晨锋.芦笋多糖、芦笋皂苷抗肿瘤作用及机制研究[D].北京:北京中医药大学,2010.
[24] 许整,黄莉,周勇志,等.复方苦参注射液加羟基喜树碱治疗晚期原发性肝癌临床观察[J].临床肿瘤学杂志,2005,10(5):541-542.
[25] 张齐军,李佑民.生脉注射液合并羟基喜树碱治疗晚期肝癌11例[J].中西医结合肝病杂志,1998,8(4):243.
[26] MA X,YU M,HAO C,et al. Shikonin induces tumor apoptosis in glioma cells via endoplasmic reticulum stress,and Bax/Bak mediated mitochondrial outer membrane permeability[J]. J Ethnopharmacol,2020,263:113059.
[27] DRAHOTA D,ENDLICHER R,KU?ERA O,et al. Factors affecting the function of the mitochondrial membrane permeability transition pore and their role in evaluation of calcium retention capacity values[J]. Physiol Res,2020,69(3):491-499.
[28] FANG X,ZHANG X,LI H. Oxidative stress and mitochondrial membrane potential are involved in the cytotoxicity of perfluorododecanoic acid to neurons[J]. Toxicol Ind Health,2020,36(11):892-897.
[29] SUGANO E,ENDO Y,SUGAI A,et al. Geranylgeranyl acetone prevents glutamate-induced cell death in HT-22 cells by increasing mitochondrial membrane potential[J]. Eur J Pharmacol,2020,833:173193.
[30] XIA P,ZHANG F,YUAN Y,et al. ALDH 2 conferred neuroprotection on cerebral ischemic injury by alleviating mitochondria-related apoptosis through JNK/caspase-3 signing pathway[J]. Int J Biol Sci,2020,16(8):1303-1323.
[31] 王春芳,巩月红,王建华,等.去氢骆驼蓬碱衍生物DH- 330体外对细粒棘球蚴线粒体凋亡通路中Cyt-C和Caspase-3的影响[J].中国病原生物学杂志,2019,14(12):1370-1374、1385.
[32] LI X,FANG F,GAO Y,et al. ROS induced by KilleRed targeting mitochondria (mtKR) enhances apoptosis caused by radiation via Cyt c/Caspase-3 pathway[J/OL]. Oxid Med Cell Longev,2019[2020-08-16]. https://www.ncbi.nlm.gov/pmc/articles/PMC6431512. DOI:10.1155/2019/4528616.
(收稿日期:2020-08-18 修回日期:2021-01-04)
(编辑:张元媛)

