3类降糖药物在2型糖尿病合并动脉粥样硬化性心血管疾病中的应用
顾群 黄琳 罗樱樱

摘 要 目的:为2型糖尿病(T2DM)合并动脉粥样硬化性心血管疾病(ASCVD)患者降糖药物的选择提供参考。方法:以“2型糖尿病”“动脉粥样硬化性心血管疾病”“二甲双胍”“人胰高血糖素样肽1受体激动剂(GLP-1 RA)”“钠-葡萄糖协同转运蛋白2抑制剂(SGLT2I)”的中英文为检索词,通过计算机检索PubMed、Cochrane Library、Embase、ClinicalTrials、中国知网、万方数据库和维普数据库,检索时限为建库至2020年6月,收集降糖药物在T2DM合并ASCVD患者中的应用案例,从临床获益证据、作用机制和安全性方面逐一阐述。结果:二甲双胍、GLP-1 RA和SGLT2I均能显著改善心血管结局,且SGLT2I可以显著降低心衰住院风险,预防和延缓心衰的发生。3类药物心血管保护作用机制有所不同,但均通过多种途径(包括减少肝糖生成、促进胰岛素分泌、抑制葡萄糖吸收等)达到改善心血管结局的目的。在安全性方面,二甲双胍和GLP-1 RA类药物应注意其胃肠道不适等不良反应;SGLT2I类药物应注意其泌尿生殖系统感染以及糖尿病酮症酸中毒等。结论:3类降糖药物均具有心血管保护作用且安全性良好,适用于T2DM合并ASCVD患者; SGLT2I还适用于心衰患者。
关键词 2型糖尿病;动脉粥样硬化性心血管疾病;二甲双胍;人胰高血糖素样肽1受体激动剂;钠-葡萄糖协同转运蛋白2抑制剂;心血管获益
中图分类号 R977.1+5 文献标志码 A 文章编号 1001-0408(2021)05-0634-07
糖尿病患者罹患心血管疾病的风险远远高于非糖尿病患者,这与糖尿病患者长期的高血糖、高胰岛素血症、胰岛素抵抗、脂代谢异常等状态密切相关[1-3]。大规模流行病学研究发现,43.2%的中国糖尿病患者死于心脑血管疾病,其中18.7%死于缺血性心脏病,17.1%死于卒中,7.3%死于其他心血管疾病[4]。另有研究报道,约70%的糖尿病患者死于动脉粥样硬化性心血管疾病(ASCVD)并发症[5]。ASCVD日益成为2型糖尿病(T2DM)患者致死或致残的主要原因[6]。
2019年欧洲心脏病学会(ESC)与欧洲糖尿病研究协会(EASD)联合发布了《2019年ESC/EASD 糖尿病、糖尿病前期与心血管病指南》,对糖尿病治疗的管理提出了新的建议:将心血管事件作为糖尿病管理的主线[7]。这意味着,在糖尿病整体治疗中,应该从预防糖尿病心血管事件、改善合并心衰的治疗入手,进行更加全面、安全、强化的心血管风险管理。然而,降糖药物品种繁多,针对T2DM合并ASCVD患者,应该如何选择风险获益比最优的降糖药物,值得关注。
早在2008年,美国FDA就发布了强制性指导意见,要求所有新批准上市的降糖药物必须进行心血管安全性评估[8]。根据这一意见,目前全球已开展了一系列新型降糖药物的心血管结局研究[9-20]。传统降糖药物由于不受这条强制性要求的制约,缺少心血管结局研究证据,其心血管安全性评估通常基于针对降糖治疗策略的大型随机对照临床试验数据或基于降糖疗效的多项随机对照临床试验的荟萃分析结果。
根据已有的大型心血管结局研究显示,二甲双胍可用于中危心血管风险的体质量超重的T2DM患者[7]。目前进行的心血管结局研究显示,与人胰高血糖素样肽1(GLP-1)高度同源的 GLP-1受体激动剂(GLP-1 RA)和钠-葡萄糖协同转运蛋白2抑制剂(SGLT2I)具有明显的优越性:单用无低血糖反应,且耐受性和安全性良好,同时还能显著改善糖尿病患者的心血管临床预后[21]。因此,目前明确有心血管获益的降糖药物有3类:二甲双胍、GLP-1 RA和SGLT2I[22]。
鉴于此,本文以“2型糖尿病”“动脉粥样硬化性心血管疾病”“二甲双胍”“人胰高血糖素样肽1受体激动剂”“钠-葡萄糖协同转运蛋白2抑制剂”的中英文为检索词,通过计算机检索PubMed、Cochrane Library、Embase、Clinical Trials、中国知网、万方数据库和维普数据库,检索时限为建库至2020年6月,收集上述3类降糖药物在T2DM合并ASCVD患者中的应用案例,从临床获益证据、作用机制和安全性方面逐一阐述,旨在为T2DM合并ASCVD患者降糖药物的选择提供参考。
1 改善T2DM合并ASCVD患者心血管结局的临床获益证据
1.1 二甲双胍
关于二甲双胍心血管获益的大型研究是英国前瞻性糖尿病研究(UKPDS)[23]。 该研究旨在探讨应用二甲双胍强化降糖对初诊T2DM患者心血管终点事件的影响。研究所纳入的4 075例初诊T2DM患者中,有1 704例体质量超重患者。结果发现,与胰岛素或磺脲类药物治疗相比,应用二甲双胍强化降糖有助于降低体质量超重的T2DM患者心血管终点事件风险的发生率,且患者较少发生体质量增加和(或)低血糖。据此,该研究认为二甲双胍较其他传统降糖药具有更多心血管获益,可作为体质量超重的T2DM患者的一线治疗药物。
1.2 GLP-1 RA
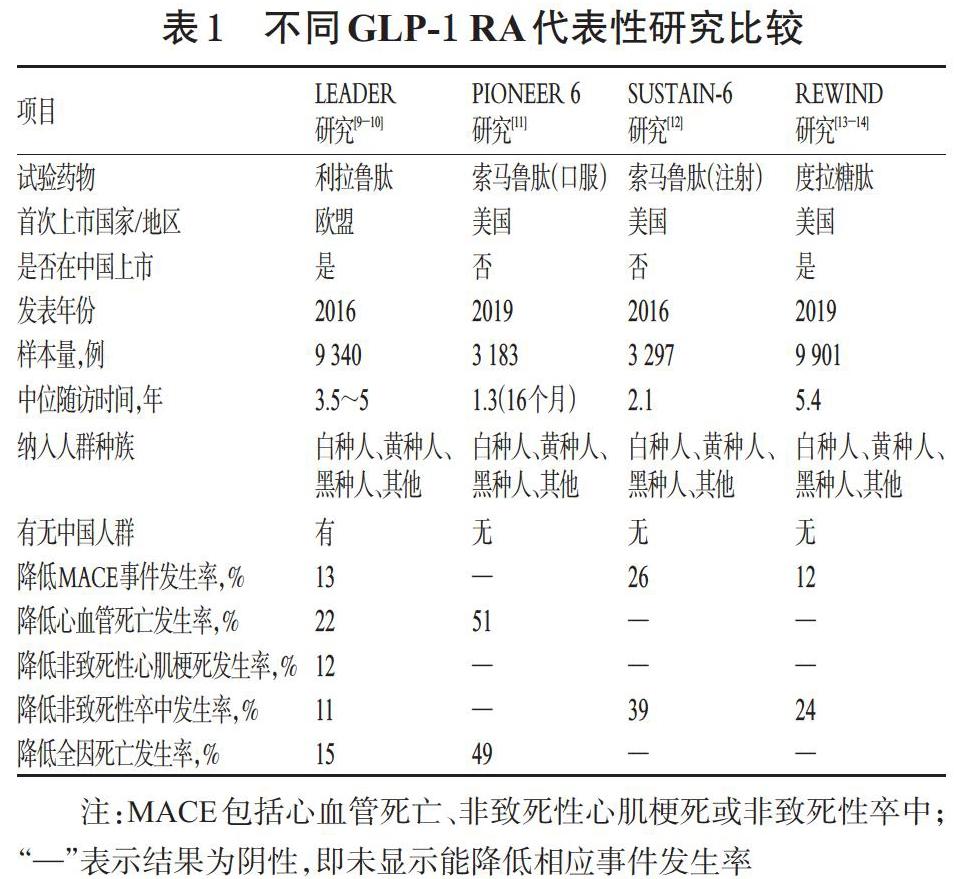
近年发表的研究结果显示,与人GLP-1高度同源的利拉鲁肽、索马鲁肽、度拉糖肽具有确凿的心血管保护作用;而与人GLP-1同源性低的艾塞那肽、利司那肽没有观察到有统计学意义的心血管保护作用[24-25]。LEADER研究(利拉鲁肽)、PIONEER 6研究(口服索马鲁肽)、SUSTAIN-6研究(注射索马鲁肽)、REWIND研究(度拉糖肽)是GLP-1 RA具有代表性的研究[9-14]。
1.2.1 利拉鲁肽 LEADER研究旨在探讨GLP-1 RA利拉鲁肽对具有心血管合并症或高危因素的T2DM患者心血管终点事件的影响[9-10]。该研究共入选了32个国家(包括中国)9 340例T2DM合并ASCVD患者。患者随机接受每日1次皮下注射利拉鲁肽1.8 mg(或最大耐受剂量)或安慰剂,随访3.5~5年。结果显示,利拉鲁肽组患者在心血管方面獲益显著:主要心血管不良事件(MACE)风险降低了13%,其中心血管死亡风险降低了22%,非致死性心肌梗死风险降低了12%,非致死性卒中风险降低了11%,全因死亡风险降低了15%。基于LEADER研究结果,2020年5月14日,国家药品监督管理局批准了利拉鲁肽注射液的心血管适应证:适用于伴有心血管疾病的T2DM成人患者,可降低其MACE风险[26]。
1.2.2 索马鲁肽 目前,索马鲁肽有口服和注射2种剂型上市。PIONEER 6研究主要针对的是口服索马鲁肽对患者心血管结局的影响[11]。该研究共入组3 183例具有较高心血管事件风险的T2DM患者,比较每日1次口服索马鲁肽14 mg或安慰剂的心血管结局差异,随访时间为16个月。结果显示,与安慰剂组相比,口服索马鲁肽组患者的心血管死亡事件发生率降低了51%,全因死亡率降低了49%,但非致死性心肌梗死或非致死性卒中的发生率无显著差异。
SUSTAIN-6研究旨在评估注射用索马鲁肽对T2DM患者心血管事件以及其他长期结局的影响[12]。该研究将患者分为4组,其中索马鲁肽组患者分别接受索马鲁肽0.5、1.0 mg每周1次皮下注射,安慰剂组患者分别接受安慰剂每周1次皮下注射,随访2.1年。结果,2种剂量的索马鲁肽组患者平均体质量分别降低了3.6、4.9 kg,安慰剂组患者的平均体质量分别降低了0.7、0.5 kg;2种剂量的索马鲁肽组患者平均收缩压分别降低了3.4、5.4 mmHg(1 mmHg=0.133 kPa),安慰剂组患者的平均收缩压分别降低了2.2、2.8 mmHg;与安慰剂组相比,索马鲁肽组患者主要终点事件中MACE的发生率降低了26%(其中非致死性卒中风险降低了39%)。上述结果显示,心血管高危的T2DM患者接受索马鲁肽治疗不仅可以降低体质量和血压,还能显著降低MACE发生率。该研究还发现,索马鲁肽组患者在加用降压药少于安慰剂组的情况下,其血压降低幅度仍显著大于安慰剂组,进一步证实索马鲁肽有明显的降压作用;与此同时,索马鲁肽组患者加用他汀类与抗血小板药物的比例也在一定程度上低于安慰剂组,提示索马鲁肽可能对心血管系统具有多方面的有益影响。
1.2.3 度拉糖肽 REWIND研究是探讨在常规治疗基础上,加用度拉糖肽对T2DM患者主要心血管事件的影響[13-14]。该研究纳入受试者9 901例(其中69%的受试者无心血管疾病),在常规治疗基础上分别给予度拉糖肽1.5 mg或安慰剂每周1次皮下注射治疗,随访5.4年。结果显示,度拉糖肽组患者MACE的发生风险降低了12%,其中非致死性卒中风险降低了24%。这表明无论患者是否确诊有心血管疾病,度拉糖肽均能给患者带来一致的MACE获益。
虽然以上GLP-1 RA的研究结果均证实了其心血管获益作用,但不同药物之间仍然显示出了差异,详见表1。从表1可以看出,尽早对T2DM合并ASCVD确诊或高危风险的患者使用利拉鲁肽、索马鲁肽、度拉糖肽,可以延缓其心血管疾病进展,保护其心脑血管[21]。
1.3 SGLT2I
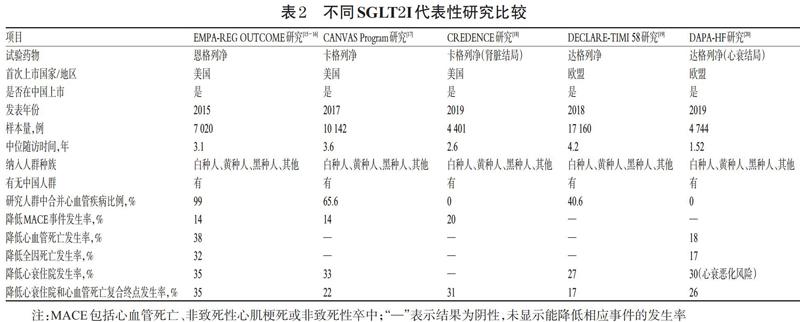
多项大型临床研究显示,SGLT2I对合并ASCVD确诊或高危风险的T2DM患者具有心血管保护作用。代表性研究包括:EMPA-REG OUTCOME研究(恩格列净)、CANVAS Program研究和CREDENCE研究(卡格列净)、DECLARE-TIMI 58研究和DAPA-HF研究(达格列净)[15-20]。
1.3.1 恩格列净 EMPA-REG OUTCOME研究在全球42个国家纳入了7 020例T2DM患者,平均随访3.1年,旨在评估在标准治疗基础上加用恩格列净(10 mg/d或25 mg/d)或安慰剂的效应[15-16]。结果显示,与安慰剂相比,恩格列净可使MACE风险降低14%、心血管死亡风险降低38%、全因死亡风险降低32%。各组患者终点事件曲线在治疗3个月时就开始分离,提示应用恩格列净治疗在短时间内即可出现临床“硬终点”获益。该研究还发现,恩格列净可使患者心衰恶化住院风险降低35%,并可降低心衰导致的住院率或病死率,以及住院的全因死亡风险,还能轻度降低患者的血压和体质量。因此,对于T2DM合并ASCVD患者,在常规治疗基础上加用恩格列净,不仅可以显著降低心血管死亡风险,还可以显著降低心衰住院风险,预防和延缓心衰的发生,延长其寿命。
1.3.2 卡格列净 CANVAS Program研究是卡格列净心血管评估研究,其综合了CANVAS 和 CANVAS-R 2项研究,共纳入10 142例心血管疾病确诊或高危风险的T2DM患者[17]。患者随机接受卡格列净(300 mg/d或100 mg/d)和安慰剂治疗,平均随访188.2周。结果显示,与安慰剂组相比,卡格列净组患者的MACE发生率降低了14%,心衰住院风险降低了33%,心衰住院或心血管死亡复合终点风险降低了22%。
CREDENCE研究探讨的是卡格列净对合并2期或3期慢性肾病并大量蛋白尿的T2DM患者肾脏终点事件的影响[18]。虽然该研究专门针对肾病高危人群而设计,但其结果也为卡格列净的心血管获益提供了有力的证据支持。该研究共纳入4 401例患者,在常规治疗基础上随机接受卡格列净(100 mg/d)或安慰剂治疗,中位随访时间2.6年。结果显示,卡格列净组患者复合心血管终点事件MACE发生率降低了20%,心血管死亡或心衰住院风险降低了31%,因心衰住院风险降低了39%。
1.3.3 达格列净 DECLARE-TIMI 58研究共纳入17 160例合并ASCVD确诊或高危风险的T2DM患者,在常规治疗基础上,分别给予达格列净(10 mg/d)或安慰剂治疗,随访4.5年[19]。结果显示,可能由于纳入较多未确诊ASCVD的患者,达格列净对主要终点事件MACE的影响与安慰剂比较无显著差异,也未显示出能降低全因死亡风险,但达格列净可使因心衰住院或心血管死亡复合终点风险降低17%、心衰住院风险降低27%。由此可知,早期应用达格列净可有效减少T2DM合并ASCVD患者的心血管死亡或心衰住院风险,可在更广泛的人群中实现心血管获益。
DAPA-HF研究旨在评估在心衰标准治疗基础上加用达格列净(10 mg/d)或安慰剂的疗效及安全性差异[20]。该研究共纳入4 744例射血分数降低的心衰患者(其中45%为糖尿病患者),中位随访时间为18.2个月。结果显示,对于射血分数降低的心衰患者,应用达格列净可以显著降低其主要复合终点事件的发生率,可使心血管死亡和心衰恶化复合风险降低26%、心血管死亡风险降低18%、心衰恶化风险降低30%、全因死亡风险降低17%。该研究提示,无论糖尿病患者还是非糖尿病患者,达格列净均能显著降低其心血管死亡或心衰恶化风险,因而达格列净的适用人群可扩展到非糖尿病患者。
虽然以上SGLT2I的研究结果均证实了其心血管获益作用,但不同药物之间仍然显示出了差异,详见表2。在这些药物中,达格列净仅能降低次要终点,即心衰住院或心衰住院和心血管死亡复合终点风险,不能降低主要终点MACE发生风险。恩格列净和卡格列净取得了更好的研究结果,二者均可降低MACE发生风险。其中,恩格列净的研究结论更为突出——不仅可降低MACE风险,还能降低全因死亡风险,并且各种风险降低的幅度均高于或等于另外2种药物,尤其是可降低心血管死亡发生率达38%,效果显著。而卡格列净虽然可以降低MACE风险,但在降低复合终点风险及全因死亡风险方面与对照组比较差异并无统计学意义。这可能与各研究入组患者基线水平不同有关:EMPA-REG OUTCOME研究入选人群中有99%合并心血管疾病,CANVAS Program研究和DECLARE-TIMI 58研究入选人群中仅有65.6%和40.6%合并心血管疾病,其余入选人群为合并有心血管危险因素[27]。3种SGLT2I研究虽然选择人群不一样,但得到的结果却有相似之处,尤其在心衰方面的疗效显著。3种SGLT2I均可以降低患者心衰住院率,甚至在DAPA-HF研究中,达格列净心衰获益人群拓展到了非糖尿病患者(研究纳入非糖尿病患者人数达55%)。因此,对于T2DM合并射血分数降低的心衰患者,SGLT2I应作为首选治疗药物。
2 心血管获益的作用机制
2.1 二甲双胍
二甲双胍可通过减少心血管疾病的风险因素(包括肥胖、血脂异常、胰岛素抵抗等)而起到心血管保护作用[28]。其可能通过改善血脂谱、增加胰岛素的敏感性、改善血管内皮细胞功能、增加血流量、减少一氧化氮(NO)形成、降低动脉粥样硬化斑塊中活化巨噬细胞对脂质的摄取,从而达到抗动脉粥样硬化作用[29]。
2.2 GLP-1 RA
大量研究已证实,与人GLP-1高度同源的GLP-1 RA类药物(利拉鲁肽、索马鲁肽、度拉糖肽)具有确凿的心血管保护作用,可通过多途径、多机制抑制动脉粥样硬化斑块的形成和进展,包括减少低密度脂蛋白胆固醇、改善内皮功能等[30-32]。
2.2.1 保护血管内皮 血管内皮损伤是各种原因造成的动脉粥样硬化的起始环节,GLP-1 RA可通过降低微血管通透性、改善血管舒张功能来减轻炎性因子对血管内皮的损伤[33]。
2.2.2 降低血压和血脂 GLP-1 RA可通过增加血管舒张、抑制平滑肌增生、抑制血小板聚集,从而降低收缩压[34-35]。同时,GLP-1 RA还可以降低总胆固醇、低密度脂蛋白胆固醇、三酰甘油等水平 [33,36-37],从而减少动脉粥样硬化斑块的形成。此外,GLP-1 RA还可以抑制脂肪干细胞的增殖,促进脂肪分解[33]。
2.3 SGLT2I
SGLT2I可通过多种作用机制综合产生心血管效应,最重要的机制体现在降血压、渗透性利尿和降低容量负荷等血流动力学方面;另外,该类药物还可通过降低血糖和体质量、减少内脏脂肪和尿酸等改善代谢异常[22]。
2.3.1 降低血压 SGLT2I的降压机制可能与其渗透性利尿及血管效应等有关[22]。其利尿作用可降低收缩压,但不会导致低血压,因而尤其适用于糖尿病伴有高血压的患者[38]。其通过降低血压可以减轻患者心脏后负荷、降低心肌耗氧量,这对心衰患者也将产生有益影响[22]。
2.3.2 利尿作用 SGLT2I可通过抑制钠离子重吸收而轻度利尿,还可减少细胞外液量而减轻心脏前负荷、降低心肌耗氧量,进而减少心衰患者的容量负荷[22]。
2.3.3 降低血脂 研究证明,SGLT2I可以降低三酰甘油水平,同时升高高密度脂蛋白胆固醇和低密度脂蛋白胆固醇水平,但不增加低密度脂蛋白胆固醇/高密度脂蛋白胆固醇比值[28]。
2.3.4 改变能量代谢及利用模式 心脏能量代谢障碍被认为是心衰发生、发展的重要原因之一[39]。SGLT2I可使能量代谢的底物从碳水化合物转为脂质,同时可减少胰岛素分泌、增加胰高血糖素释放,进而促进酮体的产生[40-41]。酮体被证明是比脂肪酸和葡萄糖更有效的心脏能量来源,酮体增加会使线粒体水平的心脏能量代谢效率提高[42]。因此,SGLT2I可为心脏功能尤其是衰竭的心脏功能带来益处[43-44]。
2.3.5 胰高血糖素效应 胰高血糖素可调节心脏对葡萄糖的利用,并具有一定正性肌力作用[45]。SGLT2I可通过使尿糖排泄增多及对胰腺α细胞的直接作用而提高胰高血糖素水平[46-47],这对于降低T2DM患者心衰住院及心血管死亡风险有一定意义。
3 安全性
3.1 二甲双胍
二甲双胍相对比较安全,主要不良反应是胃肠道不适和维生素B12缺乏等[48]。其中,胃肠道不适主要发生在用药早期,随着治疗时间的延长,大部分患者均可耐受[48]。建议通过从小剂量开始逐渐增加药物剂量、非缓释剂型分次服用、及时更换药物剂型等来避免胃肠道不适的发生。长期服用二甲双胍可能导致维生素B12丢失,引起疲劳、恶性贫血、神经损伤等多方面疾病[28,49],进而加速糖尿病性神经病变的发生。因此,应注意监测患者体内维生素B12水平,适当予以补充。此外,用药前应监测患者肝肾功能,如果其转氨酶水平大于3倍正常上限,或肾小球滤过率低于45 mL/(min·1.73 m2),则需禁用二甲双胍[6]。
3.2 GLP-1 RA
GLP-1 RA类药物在临床使用过程中,应注意其胃肠道不适和胃排空减慢等不良反应。患者主要表现为恶心、呕吐、腹泻、腹胀、消化不良等,呈剂量依赖性,这可能与该类药物的中枢神经调节作用有关[50]。这些不良反应主要发生在用药最初几周,可随着治疗时间延长而减轻[50]。建议临床使用从小剂量开始,逐渐加量;也可以选用胃肠道不良反应较小的药物,如利司那肽等。
3.3 SGLT2I
SGLT2I类药物在临床使用过程中,应注意其可能导致泌尿生殖系统感染以及糖尿病酮症酸中毒。美国FDA近期发布声明,需高度警惕使用SGLT2I后发生男性生殖器坏疽的风险[51],建议患者服药期间注意个人外阴部卫生、适量饮水、保持排尿通畅,以减少感染发生。糖尿病酮症酸中毒是SGLT2I不常见但严重的不良反应,若患者出现腹痛、恶心、呕吐、乏力、呼吸困难,需立即检测其动脉血酮体比和血酸碱度以明确诊断,一旦确诊立即停用SGLT2I;如果患者联合胰岛素治疗,应避免随意停用胰岛素或突然减量;当急性应激状态(如感染、创伤等)发生时,需暂停SGLT2I,待应激状态解除后重新使用[18]。此外,若患者存在血容量过低情况,需警惕使用SGLT2I可增加发生肾功能不全风险;当肾小球滤过率低于45 mL/(min·1.73 m2)时,不建议使用SGLT2I[21]。
4 结语
综上所述,本文从临床证据、作用机制和安全性3个方面梳理了目前明确有心血管获益的3类降糖药物(详见表3)。3类降糖药物均具有心血管保护作用,适用于T2DM合并ASCVD患者;SGLT2I还适用于心衰患者。本文可为临床对T2DM合并ASCVD患者降糖药物的选择提供参考。
近年来,糖尿病的诊治理念已从以血糖管理为中心,全面转变为以大幅降低心血管风险、延长糖尿病患者寿命为中心[21]。预防和延缓糖尿病患者大血管病变和微血管病变,成为治疗T2DM的目标。目前,在糖尿病合并心血管疾病的领域,药物研发过程已在不断推进;未来几年,各种正在进行的大规模的有关降糖药物的心血管结局研究将会提供更多证据,将会有更多更有效的降糖药物来满足传统降糖药未能满足的治疗需求,为T2DM合并心血管疾病的患者提供更多的治疗选择。
参考文献
[ 1 ] HOWARD BV,BEST LG,GALLOW JM,et al. Coronary heart disease risk equivalence in diabetes depends on concomitant risk factors[J]. Diabetes Care,2006,29(2):391-397.
[ 2 ] SHAH AD,LANGENBERG C,RAPSOMANIKI E,et al. Type 2 diabetes and incidence of cardiovascular diseases:a cohort study in 1.9 million people[J]. Lancet Diabetes Endocrinol,2015,3(2):105-113.
[ 3 ] KUUSISTO J,LAAKSO M. Update on type 2 diabetes as a cardiovascular disease risk equivalent[J]. Curr Cardiol Rep,2013,15(2):331.
[ 4 ] BRAGG F,HOLMES MV,IONA A,et al. Association between diabetes and cause-specific mortality in rural and urban areas of China[J].JAMA,2017,317(3):280-289.
[ 5 ] RYD?N L,GRANT PJ,ANKER SD,et al. ESC guidelines on diabetes,pre-diabetes,and cardiovascular diseases developed in collaboration with the EASD;the task force on diabetes,prediabetes,and cardiovascular diseases of the European Society of Cardiology(ESC) and developed in collaboration with the European Association for the Study of Diabetes(EASD)[J]. Eur Heart J,2013,34(39):3035-3087.
[ 6 ] 洪天配,母義明,纪立农,等. 2型糖尿病合并动脉粥样硬化型心血管疾病患者降糖药物应用专家共识[J].中国介入心脏病学杂志,2017,25(7):361-371.
[ 7 ] GRANT PJ,COSENTINO F. The 2019 ESC guidelines on diabetes,pre-diabetes,and cardiovascular diseases developed in collaboration with the EASD[J]. Eur Heart J,2019,40(39):3215-3217.
[ 8 ] FDA. Guidance for industry:diabetes mellitus-evaluating cardiovascular risk in new antidiabetic therapies to treat type 2 diabetes[EB/OL].[2020-12-20]. https://xueshu.baidu.com/usercenter/paper/show?paperid=61a43a6423d29e- 99155a633bf2b70e36&site.
[ 9 ] MARSO SP,DANIELS GH,BROWN-FRANDSEN K, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes[J]. N Engl J Med,2016,375(4):311-322.
[10] MANN JFE,?RSTED DD,BROWN-FRANDSEN K, et al. Liraglutide and renal outcomes in type 2 diabetes [J]. N Engl J Med,2017,377(9):839-848.
[11] HUSAIN M,BIRKENFELD AL,DONSMARK M,et al. Oral semaglutide and cardiovascular outcomes in patients with type 2 diabetes[J]. N Engl J Med,2019,381(9):841-851.
[12] MARSO SP,BAIN SC,CONSOLI A,et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes[J]. N Engl J Med ,2016,375(19):1834-1844.
[13] GERSTEIN HC,COLHOUN HM,DAGENAIS GR,et al. Dulaglutide and outcomes in type 2 diabetes(REWIND):a doubleblind,randomised placebo-controlled trial[J]. Lancet,2019,394(10193):121-130.
[14] GERSTEIN HC,COLHOUN HM,DAGENAIS GR,et al. Dulaglutide and renal outcomes in type 2 diabetes:an exploratory analysis of the REWIND randomised,placebo-controlled trial[J]. Lancet,2019,394(10193):131- 138.
[15] ZINMAN B,WANNER C,LACHIN JM,et al. Empagliflozin,cardiovascular outcomes,and mortality in type 2 diabetes[J]. N Engl J Med,2015,373(22):2117-2128.
[16] WANNER C,INZUCCHI SE,LACHIN JM,et al. Empagliflozin and progression of kidney disease in type 2 diabetes[J]. N Engl J Med,2016,375(4):323-334.
[17] NEAL B,PERKOVIC V,MAHAFFEY KW,et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes[J]. N Engl J Med,2017,377(7):644-657.
[18] PEERKOVIC V,JARDINE MJ,NEAL B,et al. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy[J]. N Eng J Med,2019,380(24):2295-2306.
[19] WIVIOTT SD,RAZ I,BONACA MP,et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes[J]. N Engl J Med,2019,380(4):347-357.
[20] MEMURRAY JJV,SOLOMON SD,INZUCHI SE,et al. Dapagliflozin in patients with heart failure and reduced ejection fraction[J]. N Eng1 J Med,2019,381(21):1995- 2008.
[21] 《改善心血管和腎脏结局的新型抗高血糖药物临床应用中国专家建议》工作组.改善心血管和肾脏结局的新型抗高血糖药物临床应用中国专家建议[J].中国循环杂志,2020,35(3):231-238.
[22] 刘毅龙,陈鹏宇,雷江,等. SGLT-2抑制剂在2型糖尿病合并心血管疾病治疗中的应用研究进展[J].陕西医学杂志,2019,48(3):407-408.
[23] UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34)[J]. Lancet,1998,352(9131):854-865.
[24] PFEFFER MA,CLAGGETT B,DIAZ RJ,et al. Lixisenatide in patients with type 2 diabetes and acute coronary syndrome[J]. N Engl J Med,2015,373(23):2247-2257.
[25] HOLMAN RR,BETHEL MA,MENTZ RJ,et al. Effects of once-weekly exenatide on cardiovascular outcomes in type 2 diabetes[J]. N Engl J Med ,2017,377(13):1228- 1239.
[26] 《国际糖尿病》编辑部.重磅!利拉鲁肽注射液(诺和力?)心血管适应证中国获批[EB/OL].(2020-05-14)[2021- 02-06]. https://www.sohu.com/a/396010534_120051447.
[27] 张泽宇,陶涛,禤伟振,等.钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)治疗2型糖尿病的研究进展[J].临床医学工程,2019,26(S1):60-63.
[28] 曾静,方毅.糖尿病药物治疗的现状及药物研究进展[J].临床药物治疗杂志,2017,15(10):2-5.
[29] STEE MFV,GRAAF AAD,GROEN AK. Actions of metformin and statins on lipid and glucose metabolism and possible benefit of combination therapy[J]. Cardiovasc Diabetol,2018,17(1):94.
[30] 纪立农,邹大进,洪天配,等. GLP-1受体激动剂临床应用专家指导意见[J].中国糖尿病杂志,2018,26(5):353- 361.
[31] 纪立农,郭立新,郭晓蕙,等.钠-葡萄糖共转运蛋白2(SGLT2)抑制剂临床合理應用中国专家建议[J].中国糖尿病杂志,2016,24(10):865-870.
[32] RIZZO M,NIKOLIC D,PATTI AM,et al. GLP-1 receptor agonists and reduction of cardiometabolic risk:potential underlying mechanisms[J]. Biochim Biophys Acta Mol Basis Dis,2018,1864 (9 Pt B):2814-2821.
[33] 李巧巧,温玉洁. 2型糖尿病治疗药物:利拉鲁肽的研究进展[J].华夏医学,2018,31(6):177-178.
[34] COSENTINO F,GRANT PJ,ABOVANS V,et al. 2019 ESC guidelines on diabetes,pre-diabetes,and cardiovascular diseases developed in collaboration with the EASD[J]. Eur Heart J,2020,41(2):255-323.
[35] PAULK W,NORRINA BA,MICHAEL EG,et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APHA/ASH/ASPC/NMA/PCNA guideline for the prevention,detection,eva- luation,and management of high blood pressure in adults:a report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines[J]. Hypertension,2018,71(6):e13-e115.
[36] BERNARD Z,JOHN G,JOHN BB,et al. Efficacy and safety of the human glucagon-like peptide-1 analog liraglutide in comblnation with metformin and thiazolidinedione in patients with type 2 diabetes(LEAD-4 Met+TZD) [J]. Diabetes Care,2009,32(7):1224-1230.
[37] LI Y,DU J,ZHU E,et al. Liraglutide suppresses proliferation and induces adipogenic differentiation of 3T3-L1 cells via the Hippo-YAP signaling pathway[J]. Mol Med Rep,2018,17(3):4449-4507.
[38] FONSECA VA,FERANNINI E,WILDING JP,et al. Active- and placebo-controlled dose-finding study to assess the efficacy,safety,and tolerability of multiple doses of ipragliflozin in patients with type 2 diabetes mellitus[J]. J Diabetes Complications,2013,27(3):268-273.
[39] 夏钰琪,步睿,王晓云.心肌能量代谢与心力衰竭关系的研究进展[J].医学综述,2020,26(5):833-838.
[40] FERRANNINI E,BALDI S,FRASCERRA S,et al. Shift to fatty substrate utilization in response to sodium-glucose cotransporter 2 inhibition in subjects without diabetes and patients with type 2 diabetes[J]. Diabetes,2016,65(5):1190-1195.
[41] BUSE JB,WEXLER DJ,TSAPAS A,et al. 2019 update to:management of hyperglycaemia in type 2 diabetes,2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes(EASD)[J]. Diabetologia,2020,63(2):221-228.
[42] SATO K,KASHIWAYA Y,KEON CA,et al. Insulin,ketone bodies,and mitochondrial energy transduction[J]. FASEB J,1995,9(8):651-658.
[43] 吴易航,张宇辉,张健. SGLT2i恩格列净对2型糖尿病患者心脏保护作用的研究进展[J].心血管病学进展,2020,41(8):787-789.
[44] MUDIALIAR S,ALLOJU S,HENRRY RR. Can a shift in fuel energetic explain the beneficial cardiorenal outcomes in the EMPA-REG outcome study a unifying hypothesis[J]. Diabetes Care,2016,39(7):1115-1122.
[45] JONES BJ,TAN T,BLOOM SR. Minireview:glucagon in stress and energy homeostasis[J]. Endocrinology,2012,153(3):1049-1054.
[46] FERRANNINI E,MUSECELLI E,FRASCERRA S,et al. Metabolic response to sodium-glucose cotransporter 2 inhibition in type 2 diabetic patients[J]. Clin Invest,2014,124(2):499-508.
[47] BONNER C,KERR-CONTE J,GMYR V,et al. Inhibition of the glucose transporter SGLT2 with dapagliflozin in pancreatic alpha cells triggers glucagon secretion[J]. Nat Med,2015,21(5):512-517.
[48] 赵承奇,尚军,邢鲁艳.糖尿病治疗药物研究进展[J].人民军医,2019,62(8):768-773.
[49] 王雪莲,商永光,张镭. 口服二甲双胍对2型糖尿病患者血清维生素B12水平的影响[J].中国医院用药评价与分析,2019,19(10):1220-1223.
[50] VERSPOHL EJ. Novel therapeutics for type 2 diabetes:incretin hormone mimetics (glucagon-like peptide-1 receptor agonists) and dipeptidyl peptidase-4 inhibitors[J]. Pharmacol Ther,2009,124(1):113-138.
[51] FDA. FDA warns about rare occurrences of a serious infection of the genital area with SGLT2 inhibitors for diabetes[EB/OL].[2020-12-20].https://www.fda.gov/drugs/drug- safety-and-availability/fda-warns-about-rare-occurrences- serious-infection-genital-area-sglt2-inhibitors-diabetes.
(收稿日期:2020-09-10 修回日期:2020-02-16)
(編辑:胡晓霖)

