抗菌型胆道支架的研究进展
刘文静 ,李超婧 ,戚晓升,王程毅,关国平,王富军,,王璐,
1 东华大学纺织学院,上海市,201620
2 东华大学纺织面料技术教育部重点实验室,上海市,201620
3 上海交通大学附属第一人民医院,上海市,201620
4 东华大学产业用纺织品教育部工程研究中心,上海市,201620
5 东华大学纺织行业生物医用纺织材料与技术重点实验室,上海市,201620
0 引言
胆道是肝向十二指肠运送胆汁的管道,由肝内胆道和肝外胆道组成。胆道狭窄的表现为胆道壁纤维组织增生、管壁变厚、胆道内腔逐渐缩窄,主要病症为黄疸,其次为肝功能失代偿、胆道硬化及化脓性胆道炎等,内镜逆行胰胆道造影术(ERCP)介入胆道支架是治疗胆道狭窄、胆道梗阻的有效手段之一[1]。目前临床使用的胆道支架包括塑料(PS)和自膨式金属支架(SEMS),金属支架可分为金属裸支架、部分覆膜支架和全覆膜支架,其常见材料如图1所示。
内镜下胆道支架植入术在临床上用于胆道狭窄的治疗已相对成熟,但支架植入后的并发症依旧是一项巨大的挑战。支架植入后的常见并发症有支架故障、支架移位、支架阻塞、支架穿孔以及胆道感染等[2]。
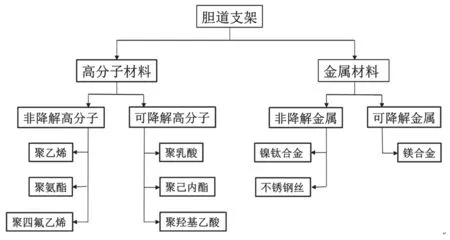
图1 胆道支架常见材料分类Fig.1 Classification of common materials for biliary stents
1 胆道支架抗菌的必要性
1.1 细菌入侵的机制
由于胆道特殊的结构和生理机制,Oddi括约肌的收缩功能可防止肠道内容物回流到胆道,胆汁的流动可周期性地冲刷胆道系统使微生物难以定殖,胆汁中具有抗菌特性的胆汁盐和免疫球蛋白,因此正常的胆道系统处于无菌环境。胆道系统易感性转变及对周围环境病原微生物防御机制的下降是引发胆道感染的主要原因,常见诱因是细菌从小肠上行进入胆道,细菌通过肠壁移位、血行播散以及门静脉血液的细菌污染。胆道感染通常由肠道细菌引起,80%以上的胆道感染患者胆汁培养呈阳性[3]。革兰氏阴性菌是引发胆道感染最常见的细菌,前三位分别为大肠杆菌(25%~50%)、克雷伯氏菌(15%~20%)和肠杆菌(5%~10%),革兰氏阳性细菌中肠球菌(10%~20%)最常见,在混合感染的患者胆道内还分离出少量厌氧菌(5%~10%)[4]。
1.2 细菌入侵的后果
1.2.1 胆道感染
一项回顾性研究表明,接受胆道支架植入术的患者在术后3周到31个月内发生胆道感染的概率高达25.5%,胆道感染使患者发生胆道再狭窄的概率从2.3%增加到13.1%。胆道感染的临床常见症状有右上腹痛、发热伴寒颤及黄疸,临床判断标准为患者首次通过ERCP放置胆道支架,术后反复发作寒战高热(>38 ℃),血常规检验白细胞计数增高,胆汁细菌培养呈阳性,有超声或CT等影像学诊断支持并伴发常见的临床症状[5]。
1.2.2 支架堵塞
目前普遍认为细菌粘附、生物膜形成和胆泥淤积是支架堵塞的主要发病机制,支架表面胆汁污泥形成过程,如图2所示。蛋白等物质首先被吸附在支架表面,继而诱发细菌在支架表面定殖,最后形成胆汁污泥,引发支架堵塞。LEUNG等[6]用含菌胆汁和无菌胆汁灌注胆道支架,实验观察到被含菌胆汁灌注的支架表面上有一层致密的细菌和无定形物质层,而采用无菌胆汁灌注的支架表面未观察到这种现象。胆泥淤积由蛋白质吸附和细菌粘附引发,大肠杆菌和肠球菌都具有粘附蛋白质的倾向,能促进细菌大量繁殖和晶体析出,最后由胆红素钙、棕榈酸钙、胆固醇晶体等物质堆积成污泥,并且在生物膜的基质中还可发现某些返流食物残渣[7],胆汁污泥最终导致导管阻塞。当前处理由污泥淤积造成的支架再狭窄的医学技术包括在清除污泥的同时更换支架,或在再狭窄的支架内植入一个新的支架。
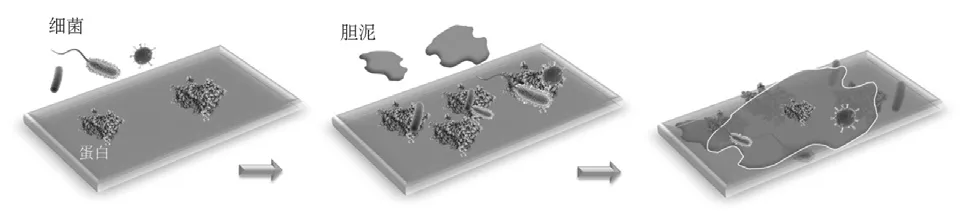
图2 胆汁污泥形成机理Fig.2 Mechanism of bile sludge formation
2 杀菌型胆道支架
根据抗菌机理的差异,可将材料表面分为以杀灭细菌为目的的主动抗菌表面和以抑制细菌粘附为目的的被动抗菌表面以及两者相结合的抗菌表面。主动抗菌表面是通过结合有效的抗菌物质例如抗生素、有机季铵盐、银离子、壳聚糖等来构建主动攻击的抗菌表面。
2.1 有机抗菌剂
有机抗菌剂具有杀菌效率高的特点,其对微生物的破坏机理分为三类:破坏细胞壁和细胞膜系统;破坏体内的蛋白酶或其他活性物质;影响遗传基因[8]。目前用于胆道支架抗菌改性的有机抗菌剂主要包括三氯生、季铵盐类、抗生素类等。
余海亮等[9]研究了不同浓度的三氯生的抑菌效果,并与同浓度的左氧氟沙星和联合紫杉醇的三氯生进行比较。抑菌环实验显示不同浓度的三氯生对于细菌均有明显的抑制作用且优于同浓度的左氧氟沙星和联合紫杉醇组。将三氯生涂层通过旋涂的方式负载到316L医用不锈钢,在体外人胆汁浸泡环境下,三氯生药物涂层组表面吸附的细菌量及吸附的层粘连蛋白均明显少于裸材料组,表明三氯生适用于胆道感染性疾病。使用直接涂层的方式抗菌药物难以达到持续抗菌效果,无法满足理想抗菌胆道支架的需求。OBERMEIER等[10]以聚乳酸为药物载体包覆三种不同类型的有机抗菌剂对胆道塑料支架进行抗菌改性并评价其抗菌效果,涂层中分别包含奥替尼啶(RO)、奥替尼啶和柠檬酸(ROC)、三氯生(RT)、庆大霉素(RG),在所有抗菌支架涂层中观察到药物连续释放至少168 h并在前24 h内达到初始峰值。RT、ROC和RG涂层的支架导致大肠杆菌、粪肠球菌和白色念珠菌的细菌悬液中的细菌数量呈对数下降,其中ROC的抗菌及持续抗菌效果最好且与预防术后胆道炎的理想抗菌胆道支架所需的性能相符。
2.2 无机抗菌剂
无机抗菌剂包含金属型抗菌剂和光催化型抗菌剂,用于胆道支架抗菌的无机抗菌剂多为具有广谱杀菌功能和低毒性的银离子抗菌剂,纳米银颗粒(NP)在对人细胞无毒的浓度下可表现出高杀菌活性[11]。
LEUNG[12]首次对聚氨酯胆道支架进行镀银改性,与对照组相比镀银表面贴壁细菌的数量减少了10~100倍,为纳米银引入胆道支架领域提供了基础。之后多项研究采用化学还原法[13-14]和静电吸附法[15]在聚氨酯支架或聚四氟乙烯支架表面沉积纳米银涂层,结果均表明纳米银可有效抑制细菌在支架表面的粘附。为使银离子缓慢释放,杨富春等[16]采用液相化学还原法,以聚乙烯塑料胆道支架为载体,通过壳聚糖复合银纳米离子和肝素层层组装,涂层厚度小于1 μm且银离子缓释性好,体内实验显示含银支架能显著延长胆道系统的通畅期并提高临床研究存活率,为胆道狭窄的治疗策略提供了新方法。
针对金属胆道支架的抗菌改性,LEE等[17]在覆膜胆道金属支架的有机硅膜中添加粒径为250 nm的银离子制备抗菌型胆道支架,支架内壁生物膜厚度较对照组的10.62 μm降低为3.32 μm,对手术部位组织的炎症反应也有明显的抑制效果。该课题组后续跟踪研究了含银离子的胆道支架产品(ABC Stent,M.I.Tech,Seoul,Korea)对恶性远端胆道梗阻的疗效和安全性,银离子支架的中位通畅天数为179,而同期不含银离子支架的中位通畅天数为116.5,表明抗菌型银离子支架能抑制细菌生物膜的形成并提高支架的通畅时间[18]。
2.3 天然抗菌剂
天然抗菌剂具备安全、低毒、副作用小的优势,壳聚糖是目前广泛使用的天然抗菌剂,抗菌机理可能是壳聚糖的聚阳离子特性会干扰细菌表面的负电荷,壳聚糖与细胞膜之间的相互作用会通过停止细菌的代谢而改变细菌的通透性或抑制细菌的生长,但壳聚糖抗菌能力有限和仅在酸性条件下抗菌的缺点也限制了其应用[19]。
LIN等[20]用甲醇沉淀技术将壳聚糖沉积在氧化的聚乙烯支架管内表面后细菌粘附量明显增多,将其归因于壳聚糖改性后表面增加的粗糙度和正电荷以及PBS和胆汁偏碱性的环境。单独的壳聚糖涂层的抗菌及抗细菌粘附功能并不理想,BRATSKAYA等[21]通过壳聚糖/k-角叉菜胶多层堆积和马来酸酐共价接枝壳聚糖的方式对材料表面进行改性,针对从堵塞的胆道支架中分离出的两种粪肠球菌进行抗细菌粘附和杀菌能力评价,在两种类型的壳聚糖涂层上均观察到初始粘附率以及1 h后粘附细菌的数量均下降,其中多层膜的抗细菌粘附性能优于共价接枝壳聚糖层,高度水合的壳聚糖/k-角叉菜胶多层涂层在抗生物粘附的应用中具有可观的前景。
3 抗细菌粘附型胆道支架
被动防御表面虽然不具备杀菌功能,但可通过调控材料表面的浸润性来实现细菌防粘连。研究人员已经开发出被动防御抗菌表面,通过制造具有亲水或疏水特性的表面来实现细菌抗粘附。对胆道支架表面进行亲水或疏水改性对生物膜的形成及胆泥的淤积提供了一种新的思路。
3.1 亲水型
亲水型表面防细菌粘附的机理可能是亲水基团吸附水分子产生位阻效应,抑制细菌在材料表面粘附,目前胆道支架的亲水改性主要集中于塑料支架。已有研究证明使用亲水型材料制备的胆道支架或对胆道支架进行亲水改性可抑制细菌在支架表面的粘附和生物膜的生长。
Vivathane是一种表面超光滑的亲水型高分子材料,将Vivathane制成的支架在接受含细菌的胆汁灌注后支架表面没有细菌粘附也没有胆泥沉积的倾向,而常规的支架表面出现了旺盛的细菌生长和胆汁淤积[22]。
关于胆道支架亲水改性的研究已有近30年的历史,亲水改性包括表面亲水涂层改性、亲水基团改性、结构改性等。JANSEN等[23]将亲水聚合物涂层的聚氨酯胆道支架与未涂层聚氨酯支架对比,静态细菌粘附实验和动态磷酸盐缓冲液及胆汁灌注实验结果均表明亲水改性涂层对于细菌的粘附有抑制作用。KWON等[24]通过双层涂层的方法在聚乙烯支架和聚氨酯支架的底层使用高粘度涂层,顶层使用高度润滑涂层构建亲水性涂层,加强涂层的耐久性和均匀性。与未涂层支架相比,涂层支架在8周时生物膜形成和管腔狭窄更少。PENG等[25]使用发烟硫酸对聚乙烯胆道支架表面进行磺化基团改性,改善支架表面的亲水性和光滑度。经过48 h胆汁灌注后,大肠杆菌在磺化支架表面的粘附率比未改性支架低10~20倍。SEKIGUCHI等[26]受蜗牛壳的启发,用电子束光刻在Si基底上形成了200 nm的纳米级别的微小凸起,当水进入纳米凸起的空隙时就会形成一层具有超纳米亲水结构的水膜,制备内表面具有仿蜗牛壳微结构的胆道支架,动物实验显示这种纳米结构的支架具有出色的防污性能。
亲水型支架具有出色的防污性能推进了胆道支架的发展,但也有部分临床数据显示亲水改性的胆道支架对提高支架的通畅时间方面未发现明显的优势[27-28],可能原因是支架的亲水型涂层容易被破坏,细菌粘附后对涂层功能的影响导致涂层失去抗粘附的功能,涂层的耐久性差导致其抗细菌粘附的效果不持久[28]。
3.2 疏水型
疏水型表面由于其出色的自清洁功能在细菌的防粘附领域已有广泛的应用,其抗粘附原理是由于支架表面具有与荷叶表面相似的微纳粗糙结构,能防止细菌的附着。超疏水表面用于胆道防细菌粘附的研究较少,主要是在植入过程和在体内胆道环境中其粗糙表面容易磨损,失去疏水功能。
SEITZ等[29]采用有机环氧化合物和无机硅烷通过有机-无机溶胶-凝胶法在聚四氟乙烯支架表面进行疏水改性,添加不含或含氟硅烷的丙基氨基硅烷调节疏水性。疏水改性后的支架表面的胆泥沉积量少于对照组,但是添加氟氨基硅烷增加表面的疏水性会导致污泥的粘附性增加。WEICKERT等[30]使用疏水蛋白以及疏水蛋白和抗生素或肝素的组合对塑料支架进行改性,体外胆汁灌注实验结果显示用疏水蛋白涂覆塑料支架可减少支架表面细菌粘附的数量,肝素的加入可进一步降低细菌的粘附,但是抗生素的加入没有进一步减少细菌的粘附。在之后的体内实验中[31],在自膨式胆道支架表面涂覆疏水蛋白或疏水蛋白和肝素涂层结果却显示与未涂层支架的效果没有差异,分析原因可能是体内胆道环境中十二指肠返流或实验时间较短通畅优势还未凸显。
此外,也有学者受自然界中表面覆盖有滑液的猪笼草的启发,开发了一种能抑制细菌及污垢粘附的注液型光滑表面(SLIPS)[32],研究表明这种光滑型表面对铜绿假单胞菌、金黄色葡萄球菌和大肠杆菌的防粘附率分别达到99.6%、97.2%及96%[33]。在胆道支架内壁进行改性制备超光滑表面也为胆道支架抗胆泥淤积提供了新的思路。
4 小结与展望
细菌是胆道支架感染及再堵塞的重要诱因,开发理想的抗菌型胆道支架具有重要意义,目前所研究的抗菌型胆道支架各有优势与不足。主动抗菌型胆道支架虽然具有显著的抗菌效果,但是死去的细菌会粘附抗菌活性位点,抑制其抗菌性能。将抗菌剂直接涂覆于支架表面,抗菌效果也无法持久,抗菌剂负载于可降解缓释载体或采用其他缓释抗菌方式可达到长效抗菌功效。被动抗菌虽无法直接杀死细菌,但是可从源头抑制细菌的粘附。目前研究的亲水型和疏水型支架为抗菌型胆道支架提供了另一条思路,但是亲水型和疏水型支架在使用过程中其表面容易被破坏或者由于粗糙度的增大,抗粘附效果仍不理想。两种抗菌方式结合的胆道支架可以达到双赢的效果,但是目前杀菌和抗粘附结合的胆道支架研究的较少。结合胆道的特殊环境,制备具有长效杀菌和抑制细菌粘附,符合生物安全性和临床使用需求的胆道支架,仍需要深入的研究。

