CO2合成醇酯类化学品和高分子材料研究进展
白 煜,梁 杰,王利国,曹 妍,贺 鹏,李会泉
(1.中国矿业大学(北京) 化学与环境工程学院,北京 100083;2.中国科学院 过程工程研究所 绿色过程与工程中科院重点实验室,北京 100190;3.中国科学院大学 化工学院,北京 100049;4.大连洁净能源创新研究院,辽宁 大连 116023)
0 引 言
我国煤炭资源储量丰富[1],2019年,我国原煤产量37.5亿t,煤在合成氨、油、烯烃、天然气等产品过程中[1-2],向外界释放大量CO2。同时,全球燃烧化石燃料产生的CO2排放量高达368亿t,因此,CO2进一步利用成为近年来国内外学术界研究热点[3]。CO2是储量丰富、安全、无毒、价廉易得的可再生C1资源,通过化学利用将CO2转化为能源产品或高附加值化学品[4-7],如液体燃料、化学品和高分子材料,不仅可以实现CO2的资源化利用,且有助于缓解能源危机,符合经济社会的可持续发展要求,具有经济价值和现实意义。近年来世界各国都在积极探索CO2资源化利用的有效途径并给予大力支持。美国、欧盟陆续出台了CO2利用的研究计划。美国能源部大力支持人工光合作用、燃煤电厂利用等多项CO2利用研究计划。欧洲2016年发布了未来催化路线图,明确提出以CO2作为重要的碳源,投入数亿欧元资金重点资助资源化利用相关技术研发。近年来,我国也重点支持CO2化学利用研究,布局前瞻性和战略性技术研发。值得注意的是,CO2处于燃烧过程链条中最后一个环节,其化学性质非常稳定,自身含能很少,属于热力学稳定、动力学惰性的分子,常规手段很难实现高效转化,需依赖外部能量供给或高能化合物的引入。目前,CO2资源化利用可以分为直接利用和间接利用,直接利用是以CO2为原料通过加氢、酯化、羧化、聚合等直接合成化学品和材料,包括尿素、低碳醇、碳酸酯、聚碳酸酯和可降解塑料等。同时,CO2的热力学稳定性和动力学惰性在一定程度上限制了其直接利用效率。因此,特定条件下,可行的替代利用策略是通过CO2间接合成化学品,先提供较少的能量将CO2转化为有机化学品中间体,再通过中间体的加氢或酯交换制备醇或碳酸酯等,可有效克服CO2在直接利用过程中存在的动力学与热力学限制。本文将分别从CO2的直接利用和间接利用角度,阐述CO2的资源化利用研究进展。
1 CO2的直接利用

1.1 甲醇
甲醇是重要的化学工业基础原料和清洁液体燃料,以甲醇为原料,进一步可以制备甲醛、乙烯、丙烯、醋酸、苯、甲苯等有机化工品。目前工业上主要采用以煤炭为原料经过气化合成甲醇的技术路线。随着不可再生化石能源的不断消耗,利用可再生的碳源——CO2加氢合成甲醇,是关系资源、能源和经济社会可持续发展的重要研究方向。氢能是一种绿色可再生,且不依赖化石燃料的储量丰富的新能源载体,具有燃烧性能好、无毒、无污染、利用率高、减少温室效应等优点,被视为21世纪极具发展潜力的清洁能源。同时,氢气来源广,可以利用多种化工方法制取。H2和CO2在催化剂作用下反应生成甲醇,可作为能源存储的新形式。研究表明[8],在该反应中表现出较好性能的催化剂主要有铜基催化剂、贵金属催化剂和合金催化剂等。主要通过调节催化剂组成、制备方法、助剂等方法增加催化剂的活性,从而提高CO2的转化率和甲醇的选择性。
1.1.1催化剂类型
1)Cu基催化剂
CO2加氢合成甲醇最早由Ipatieff等[9]首次报道,采用Cu-Al催化剂研究了催化剂组成、反应温度、H2/CO2比例以及压力等对甲醇合成的影响。Ipatieff开发的Cu基催化剂是一次重大突破,实现了低温低压高效合成甲醇的工艺技术。此后关于Cu基催化剂用于甲醇合成的研究蓬勃开展。代表性的Cu基催化剂见表1。近年来,铜基催化剂的研究主要集中在通过对合金催化剂改性、金属掺杂以及MOF修饰等方式改进Cu基催化剂的活性。
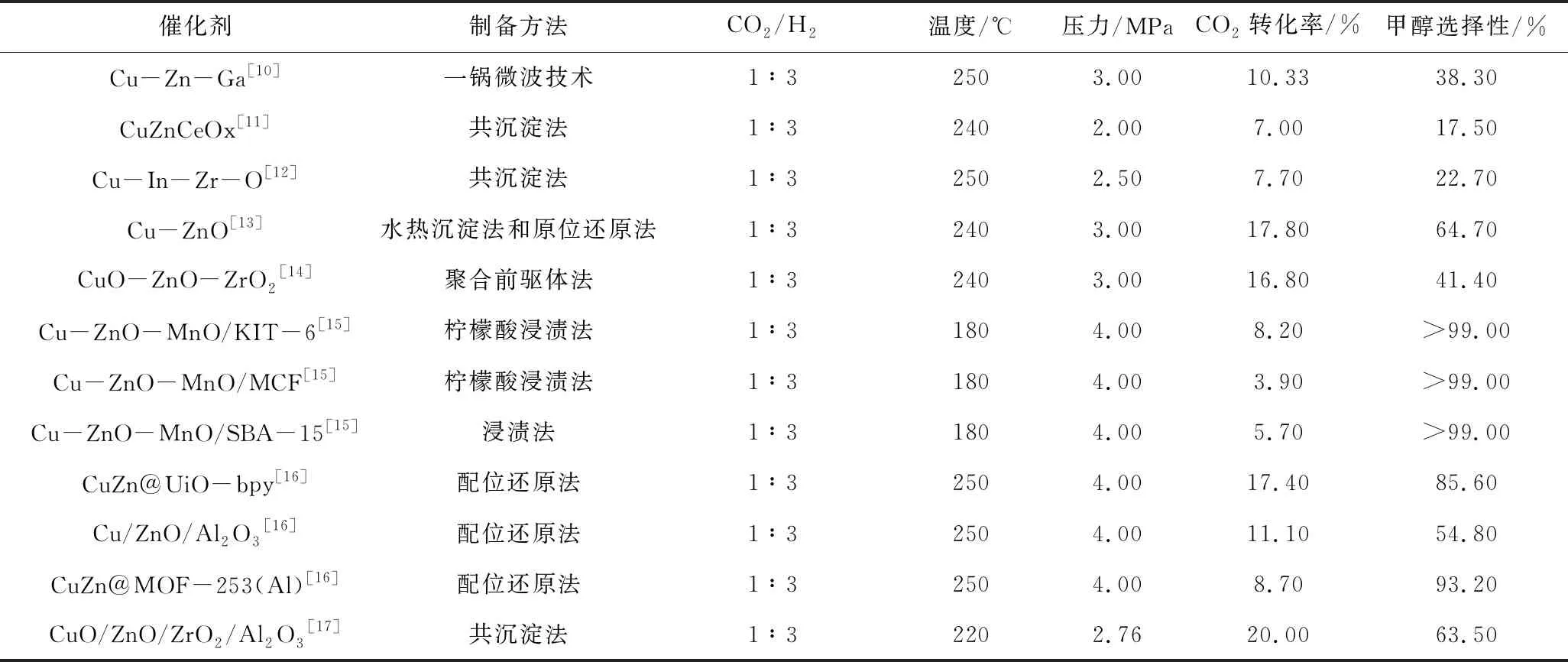
表1 CO2加氢制甲醇的代表性催化剂
Hu等[11]采用并流共沉淀法合成了高效CuZnCeOx催化剂,并对其进行评价,发现含Cu和金属氧化物(ZnO和/或CeOx)的复合催化剂具有明显的协同作用:ZnO可以明显改善CeOx纳米颗粒和活性位点的分散性;而碱性的CeOx则具有强CO2吸附作用。同时,Ce4+和Ce3+之间的转化使CuZnCeOx催化剂上易于形成氧空位,有利于CO2的转化。200 ℃时CO2的转化率和甲醇选择性分别达到4.3%和83.1%。且该催化剂具有优异的稳定性,反应110 h后催化性能仍保持稳定。
厦门大学汪聘教授课题组[16]利用含Zr6簇金属连接点的UiO-bpy MOF(bpy代表2,2′-联吡啶)作为载体,采用bpy连接的Cu2+原位还原MOF的Zr6簇上的Zn2+,制备了超小Cu/ZnOx纳米粒子,实现了UiO-bpy MOF锚定Cu/ZnOx纳米粒子。该催化剂在催化CO2加氢制甲醇反应中展现了高活性和选择性,CO2转化率为17.4%,甲醇选择性为86.5%。
Guo等[18]制备了一种胶囊结构的CZA-r@ CZM催化剂,如图1所示。该催化剂由毫米大小的Cu/ZnO/Al2O3芯(CZA-r)和Cu/ZnO/MgO壳(CZM)组成,胶囊结构CZA-r @ CZM催化剂外壳具有多孔特征,多为中孔(小于40 nm),孔体积较小,而比表面积较大。因此Cu表面原子数量较大,活性位点较多,会形成更多的CO中间体,CO2转化率比非胶囊结构CZA催化剂高2.4倍,稳定性好。在较温和条件下,压力P=3.0 MPa、温度T= 240 ℃、H2/CO2/N2=6∶2∶1、GHSV = 32 000 h-1时,CZA-r @ CZM催化剂CO2的转换率为11.7%,甲醇选择性为73%。
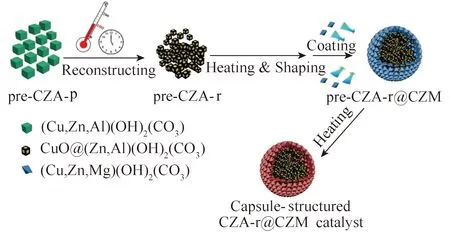
图1 胶囊结构CZA-r@CZM催化剂的合成[18]
Gao等[19]通过共沉淀法制备了由Mn、La、Ce、Zr、Y改性的类水滑石Cu/Zn/Al催化剂,用于CO2加氢合成甲醇。发现CO2转化率取决于暴露的Cu表面积,甲醇的选择性与强碱性位点与总碱性位点的比例有关。结果表明,使用Cu/Zn/Al/Y作为催化剂时,CO2转化率和甲醇的选择性最高,分别为26.9%和47.1%。该团队还采用共沉淀法合成Cu/Zn/Al/Zr类水滑石[20],获得Cu/Zn/Al/Zr混合氧化物,并对其进行评价。结果表明,Zr4+/(Al3++Zr4+)的比值对Cu表面积和Cu分散有一定影响,且在比值为0.3时,展现出高活性,CO2转化率为26.6%,甲醇选择性为43.1%。
以上研究表明,Cu基催化剂对于CO2加氢合成甲醇展现出良好的催化活性。然而,Cu基催化剂仍存在活性铜物质不稳定,易烧结,催化剂活性表面积减少导致快速失活[21]等缺点;另外,CO2直接加氢过程中产生的水也会加速Cu颗粒増大[22],影响其催化效果。通过金属掺杂、改变助剂以及载体修饰等手段实现了催化剂结构与性能的调变,铜粒径减少,相应催化剂的活性比表面积增加,提高了甲醇收率。通过对Cu/ZnO/Ga2O3[23]、Cu/ZnO/WO3[24]等催化剂研究发现,掺杂金属会改变Cu基催化剂的碱性,从而提高CO2的吸附活化[25],增强铜的分散性[21],避免生成的水造成催化剂失活。
2)贵金属及其他催化剂
铜基催化剂虽然被广泛研究,但由于其在加氢过程中产生水而导致团聚或因ZnO迁移而表现出低稳定性。因此,研究者对贵金属催化剂做出进一步研究。贵金属催化剂大部分以过渡金属或贵金属作为催化剂的活性成分。其中,钯基催化剂因具有出色的稳定性以及抗烧结性和抗中毒能力,得到了深入研究。Bahruji等[26]使用2种方法制备钯基催化剂,一种是浸渍法,另一种是基于预制的Pd纳米颗粒的胶体在ZnO载体上的固载化方法,后者优点是可在高温还原条件下将催化剂暴露,可以稳定控制Pd和PdZn颗粒平均粒径在3.1~7.3 nm,形成了具有受控粒径的PdZn合金纳米颗粒。结果表明,采用溶胶法制备的催化剂,在250 ℃和2 MPa条件下CO2加氢制备甲醇的选择性为60%,CO2转化率为11%。
具有不同载体TiO2、ZnO和ZrO2等负载的Au基催化剂对CO2加氢合成甲醇也有良好的催化作用。Wu等[27]采用沉积沉淀法制备了一系列不同Au含量的负载型Au基催化剂,包括Au(1.6)/ZrO2,Au(2.4)/ZrO2,Au(2.5)/CeO2和Au(1.7)/ZnO,与用浸渍法合成的M/ZrO2(M = Co,Ni,Ru,Pd和Pt)催化剂进行对比。结果发现Au(1.6 nm)/ZrO2有低活化势能,较高催化活性和反应选择性。在180 ℃较低温度下、P(H2)=3 MPa、P(CO2)=1 MPa时,甲醇的选择性可达到73%。
双金属纳米颗粒/合金已经成为重要催化剂,因为通过2个元素之间的紧密接触可以改变其电子性能并改变金属表面的吸附性能。Lin等[28]研究了载体(TiO2、ZrO2、CeO2、Al2O3和SiO2)对双金属Pd-Cu催化剂上CO2加氢制甲醇的影响,通过对催化剂表征发现,甲醇的形成主要与PdCu3合金,并和H2/CO2的吸附有关。用TiO2P25负载的Pd-Cu表现出最高的CO2加氢活性,甲醇选择性为25.7%,CO2转化率为16.4%。
综上所述,相比传统的铜基催化剂,贵金属催化剂在CO2加氢过程中具有反应温度较低,活性较高等优势。需要指出的是,由于贵金属的高成本,不可避免增加了工业应用的生产成本,因此,低贵金属含量或非贵金属催化剂是今后研究的重点方向。
1.1.2催化机理
针对重要的Cu基催化剂CO2加氢机理,通过试验和DFT计算提出在Cu基催化剂上CO2加氢的反应机理,主要有2种加氢的反应途径:第1种途径与甲酸盐(·HCOO)中间体有关,第2种是一种新途径,中间体可能是COOH、COHOH、HCOHOH、H2COHOH。
Volnina等[29]提出一种反应路线,认为铜表面的氢气先解离,CO2与解离的氢气相互作用形成单齿甲酸盐HCOO·。该单齿甲酸盐容易转变为双齿甲酸盐,与H+相互作用后,转变为甲酸。甲酸首先在羰基碳上氢化,形成羟基甲氧基(H2COOH·)。后由H2COOH·转化为甲醛,进一步氢化产生甲醇。
Larmier等[30]研究了Cu/ZrO2催化剂上CO2加氢反应机理,提出了CO2转化的3种常见中间体,通过动力学、原位红外和核磁共振以及同位素标记法证实了甲酸盐途径是较有利的途径,如图2所示(右图显示了吉布斯自由能中最低的中间体)。进一步通过DFT对该过程进行模拟,结果表明,甲醇是由甲酸盐加氢作为反应中间体而形成的主要产物,并提出甲酸盐是Cu/ZnO催化剂上甲醇的中间物种。
Santiago-rodriguez等[31]同样通过DFT方法研究了Ga、Mg和Ti掺杂Cu(111)表面上CO2加氢反应,通过Ga/Cu(111)表面上的CO2加氢,涉及路线是HCOO·→HCOOH·→H2COOH·→CH2O·→CH3O·。Mg/Cu(111)涉及到的反应路线是HCOO·→CH2O2·→H2COOH·→CH2O·→CH2OH·,CO2加氢的甲酸盐中间体机理得到进一步证实。
Zhang等[32]使用DFT计算研究了在Pd(111)表面上CO2加氢合成甲醇的机理,如图3所示,进一步证实了甲酸盐中间体机理。该团队提出在Pd(111)表面上,CO2首先氢化为HCOO或COOH,然后其各自与表面H原子反应形成HCOOH。HCOOH分解为OH和HCO,HCO是关键的中间体,可以通过HCO到H3COH(HCO→H2CO→H3CO→H3COH)。

图2 473 K处的能量和标准Gibbs自由能途径[30]

图3 通过Pd(111)表面上的HCOO路线从CO2加氢合成甲醇涉及的甲醇基本步骤的初始、过渡和最终状态[32]
Gao等[33]提出了一个不同于上述甲酸盐中间体的机理。将YBa2Cu3O7催化剂用于CO2加氢合成甲醇,提出了吸附的CO2通过逐步加氢反应生成羧基(COOH)、烃(COHOH)、甲酸(HCOOH)和二氢甲基(HCOHOH)中间体,中间体分别转化为甲酸酯(HCOO)、(H2COO)、甲酰基(HCO)和甲醛(H2CO)。在这种机理中,甲醇形成的关键步骤可能是HCO和H2CO的氢化。
综上所述,通过原位、同位素示踪等试验和DFT模拟等手段分析CO2加氢合成甲醇的机理仍存在争议。未来通过活性位点的性质,以及助催化剂之间相互联系对反应机理的影响的研究,将进一步深化微观机理认识。
1.1.3CO2加氢合成甲醇的工艺放大
目前CO2加氢制备甲醇已形成多套中试装置。
20世纪80年代初,丹麦托普索公司(TOPSOE)与德国鲁奇公司(Lurgi)先后完成了CO2加氢制备甲醇的中试,Lurgi公司设计的低压甲醇为管壳式结构,两段等温甲醇合成工艺(气冷-水冷双塔),管内装填C79-5L催化剂。TOPSOE公司采用BWR合成塔或采用CMD多床绝热式合成塔,使用MK101催化剂,在低压5.0~8.0 MPa、220~270 ℃条件下进行反应。
随后,日本关西电力公司、三菱重工(MGC)和新能源产业技术综合开发机构(NEDO)开发了CO2加氢合成甲醇的工艺技术,并建成小型试验装置。其中NEDO使用单管反应器,用铜、锌、铝氧化物做催化剂,催化剂装填量约3 L,产量为50 kg/a,在523 K、50 MPa和空速10 000 h-1条件下,甲醇收率为95%。2011年,日本三井化学株式会社建成100 t/a CO2加氢中试装置,中试装置中CO2经浓缩后再与氢气反应生成甲醇,甲醇选择性>99%。
冰岛碳循环利用公司(CRI)开发了ETL技术,从工业排放物中获得CO2,进一步合成甲醇,该公司与加拿大联合投资500万美元在冰岛建成第一座甲醇厂以实现投产,2012年年产量1 300 t,2014年扩展到4 000 t。
中国科学院山西煤炭化学研究所开发一种高效铜基催化剂,用于CO2加氢合成甲醇,建成工业单管CO2加氢转化和低成本制备甲醇示范装置,并实现稳定运行。
中国科学院上海高等研究院与上海华谊集团合作开展CO2加氢制甲醇工业化技术的研发,完成了近1 200 h连续的单管试验,实现了中试工艺全流程贯通平稳运行,并完成了年产量已达10万t~30万t工艺包编制。
2020年7月,上海高等研究院和海洋石油富岛有限公司合作的全球首套5 000 t/a二氧化碳加氢制甲醇工业试验装置实现了稳定运行,如图4所示。另外,中国科学院上海高等研究院开发了一种新型纳米复合氧化物高效铜基催化剂,解决了二氧化碳转化率低和催化剂易失活等问题,对二氧化碳资源化利用具有重要意义。

图4 CO2加氢合成甲醇的工业试验装置
中国科学院大连化学物理研究所李灿院士团队开发了廉价、高选择性、高稳定性的固溶体双金属氧化物ZnO-ZrO2催化剂,该催化剂可实现CO2高选择性、高稳定性加氢合成甲醇,单程甲醇选择性大于90%,催化剂运行3 000 h性能衰减小于2%。
综上所述,CO2加氢合成甲醇的催化剂中Cu基催化剂使用最为广泛,催化剂效率高、稳定性好,在实际应用中有更高的应用价值。催化机理方面,大部分认为甲酸盐为CO2加氢合成甲醇的中间体。目前中国科学院山西煤炭化学研究所已完成CO2加氢合成甲醇的单管示范,中国科学院上海高等研究院5 000 t/a CO2加氢合成甲醇的装置平稳运行、中国科学院大连化学物理研究所研发的ZnO-ZrO2催化剂应用于CO2加氢合成甲醇的反应中,可以实现催化剂稳定运行3 000 h。
1.2 乙醇
在二氧化碳合成燃料方面,二氧化碳还原为液体化学燃料是解决能源及环境问题的重要途径之一,受到国内外广泛关注。受能量密度和功率密度影响,依靠C—H化学键的键能存储大量能量是理想的能源存储方式之一。除甲醇外,乙醇是化工领域中一种重要的基础原料,不仅可以替代燃料和清洁汽油添加剂,还可作为化学品和化工原料,有良好的应用前景。传统采用乙酸加氢制乙醇,投资成本较高,设备腐蚀性较强;另一条具有重要应用前景的路线是二甲醚羰基化制乙醇,相比于其他煤基合成乙醇工艺路线,其成本低、工艺简单、原子利用率高、乙醇选择性高。而CO2直接加氢制备乙醇,不仅提高了原子利用率,而且对于CO2的化学转化利用具有重要意义和广阔的应用前景。
1.2.1催化剂
CO2分子结构非常稳定,C—C键偶联极具挑战,因此CO2直接加氢制备乙醇的主要难点仍在于开发高催化性能的催化剂。
1942年,日本的Kyowa Chemical公司开发了Mn-Fe-Cd-Cu催化剂,并成功将其应用于CO2加氢制备乙醇的过程中[34]。近年来,用于CO2加氢制乙醇的催化剂多以均相为主,但是均相催化剂稳定性较差,影响工业应用。因此,高效稳定非均相催化剂的开发成为研究重点。非均相催化剂主要分为贵金属(Rh、Pd、Ru)基催化剂体系和非贵金属(Fe、Cu、Co、Mo)基催化剂体系。2014年中国科学院大连化学物理研究所与陕西延长石油集团有限责任公司合作建立了全球首套10万t/a合成气制乙醇工业装置。
近年来,研究人员开发出代表性的催化体系见表2。
Zhang等[42]提出了一种从CO2、H2和木质素或各种衍生自木质素的芳基甲基醚(苯基醚)合成乙醇的途径。使用Ru-Co双金属催化剂,LiI助催化剂和三光配体在高于140 ℃下可以有效进行反应。LiI使得苯甲醚分解,产生乙醇,使用木质素时,不会产生副产物H2O,乙醇是唯一的液体产物,而三光子可以有效加速反应活性。通过13CO2标记测试乙醇中的甲基(—CH3)来自苯甲醚,—CH2OH基团来自CO2。在最佳条件下,乙醇的TON高达145。
Wang等[40]采用[RuCl2(CO)3]2/Co4(CO)12双金属催化剂,LiI为促进剂,N-乙基-2-吡咯烷酮(NEP)为溶剂,在温和条件下可将CO2加氢反应生成乙醇。LiI的Lewis酸强,Li+较小而I-亲核性更好。NEP具有较强的环张力,有助于使N原子上的孤对电子作为活性位点暴露,并加速反应,可以有效促进RWGS反应,该反应可在较低温度下(160 ℃)有效进行,乙醇的选择性可达65.0%。该催化剂可以重复使用至少5次。
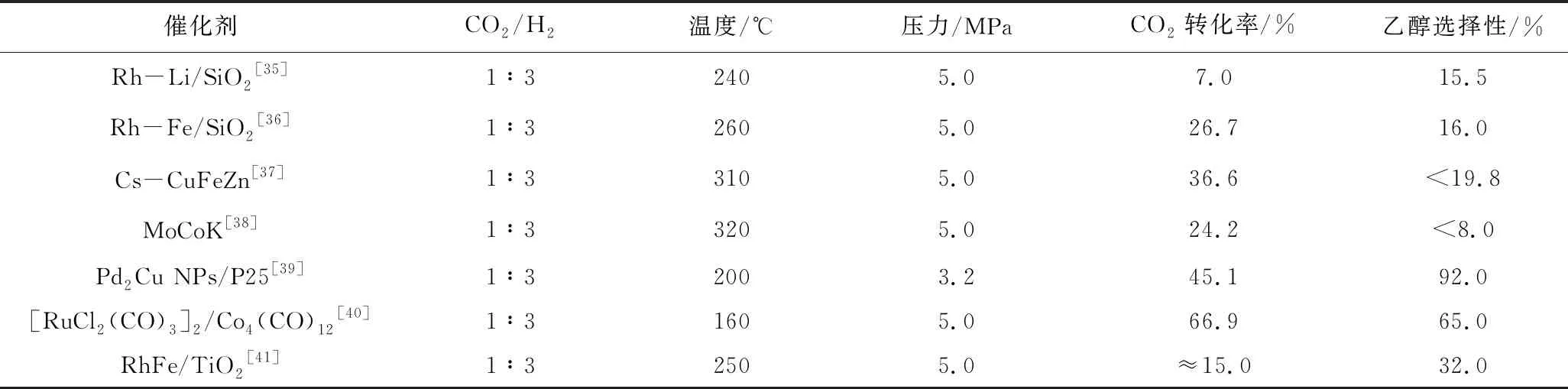
表2 CO2加氢制乙醇的代表性催化剂
Yang等[41]制备了一系列负载在RhFeLi(Rh∶Fe∶Li = 1∶1∶1)的催化剂,并将其用于CO2加氢制备乙醇。Rh基纳米颗粒在TiO2NRs上具有较高分散性,并与高密度羟基协同作用促进加氢反应。由于FeOx可以催化逆水煤气变换反应(RWGS)产生CO,与单组分Rh/TiO2催化剂相比,RhFe/TiO2对乙醇的选择性显着提高,另一方面,添加Li可使Rh/TiO2上的CO2转化率提高,而对乙醇的选择性几乎不变。因此,RhFeLi/TiO2NR催化剂对CO2加氢显示出良好的转化率(≈15%)和乙醇选择性(32%)。
综上,目前报道的CO2加氢制备乙醇的催化剂以多相催化剂为主,仍存在多相催化剂活性低、乙醇选择性低、反应温度高或催化剂成本高昂的缺点,因此如何在温和条件下实现高活性高选择性催化该反应仍具有挑战性。
1.2.2乙醇的催化机理
乙醇的生成涉及C—C偶联和C—OH的形成。研究人员通过试验提出了将CO2加氢合成乙醇的机理,主要包括2种反应途径。第1种途径是先由CO2经逆水煤气变换(RWGS)反应制得CO,随后CO加氢生成乙醇;另一种是生成甲酸中间体,后通过加氢生成乙醇。
Xu等[37]通过原位DRIFTS试验证实乙醇遵循RWGS和经由CH3CHO·中间体插入C(H)O·的串联反应机理,如图5所示。第1步先由CO2经RWGS反应制得CO;第2步CO转化为乙醛(CH3CHO·),这是CO2加氢合成乙醇反应中的重要中间体;第3步CH3CHO·氢化形成CH3CH2O·;第4步后加氢生成乙醇。

图5 Cs-CuFeZn催化剂上CO2加氢合成乙醇反应途径[37]
Zhang等[42]对机理进一步验证,试验表明乙醇的产生主要涉及三级串联反应,如图6所示,裂解醚键以形成CH3I,RWGS反应以生成CO,随后还原性羰基化合成乙醇。CO是乙醇合成的中间体,同时丙醇可以通过乙醇的同系反应生成。
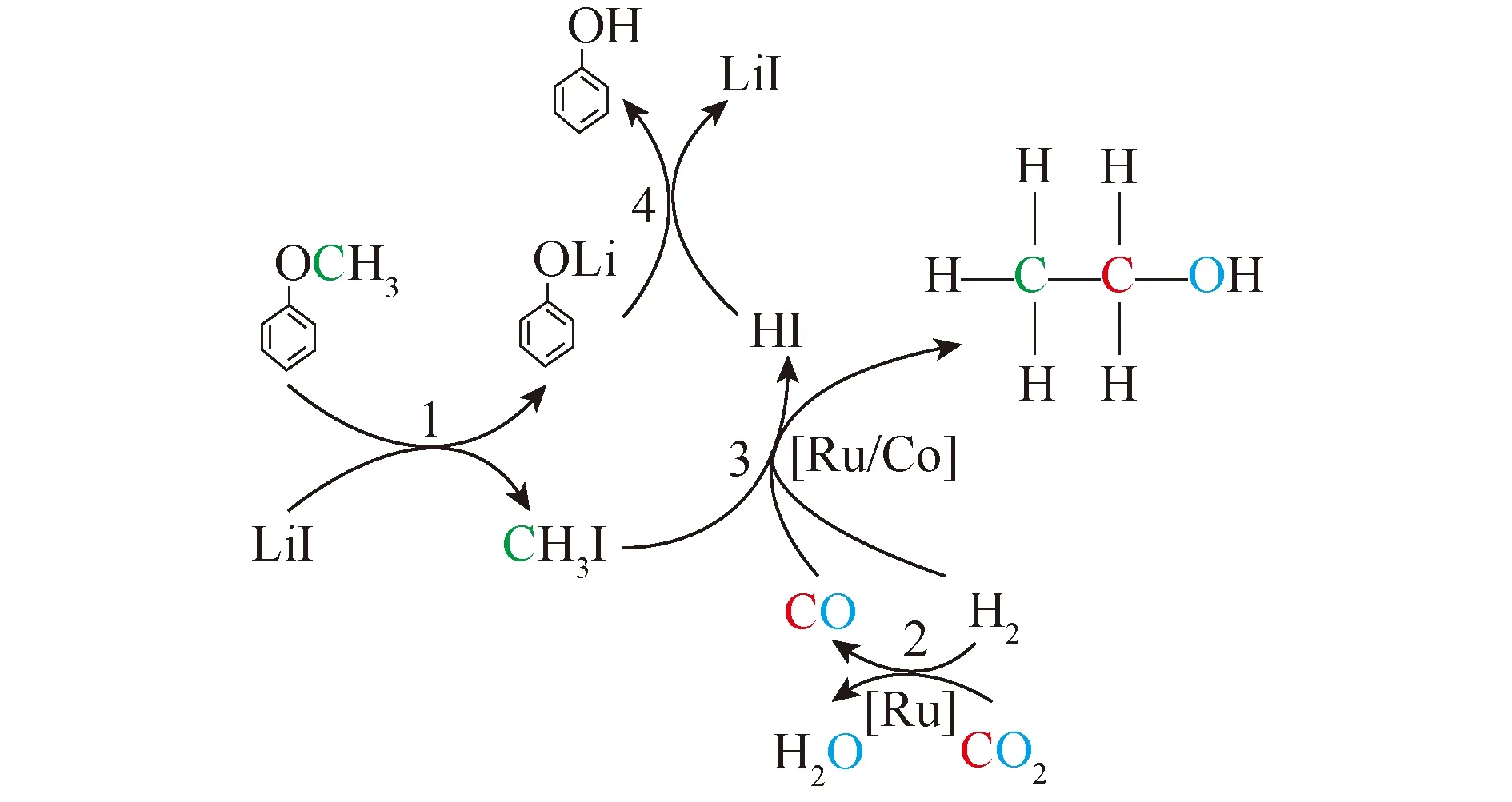
图6 合成乙醇和丙醇的反应途径[42]
Wang等[40]用CH3OD和CH318OH进行示踪试验,证实了—OH在反应过程中从CH3OH解离,先与LiI反应生成CH3I和LiOH(步骤1)。其次,通过将CH3I氧化加成使活性Co物种(Co·)生成CH3Co· I(步骤2)。RWGS反应(步骤3)生成的CO插入CH3—Co·键中,形成CH3COCo·(步骤4)。在H2存在下,从CH3COCo·I中还原乙醛,在此过程中,Co·再生并形成HI(步骤5)。乙醛通过Ru催化剂催化的H2原位还原为乙醇(步骤6),如图7所示。
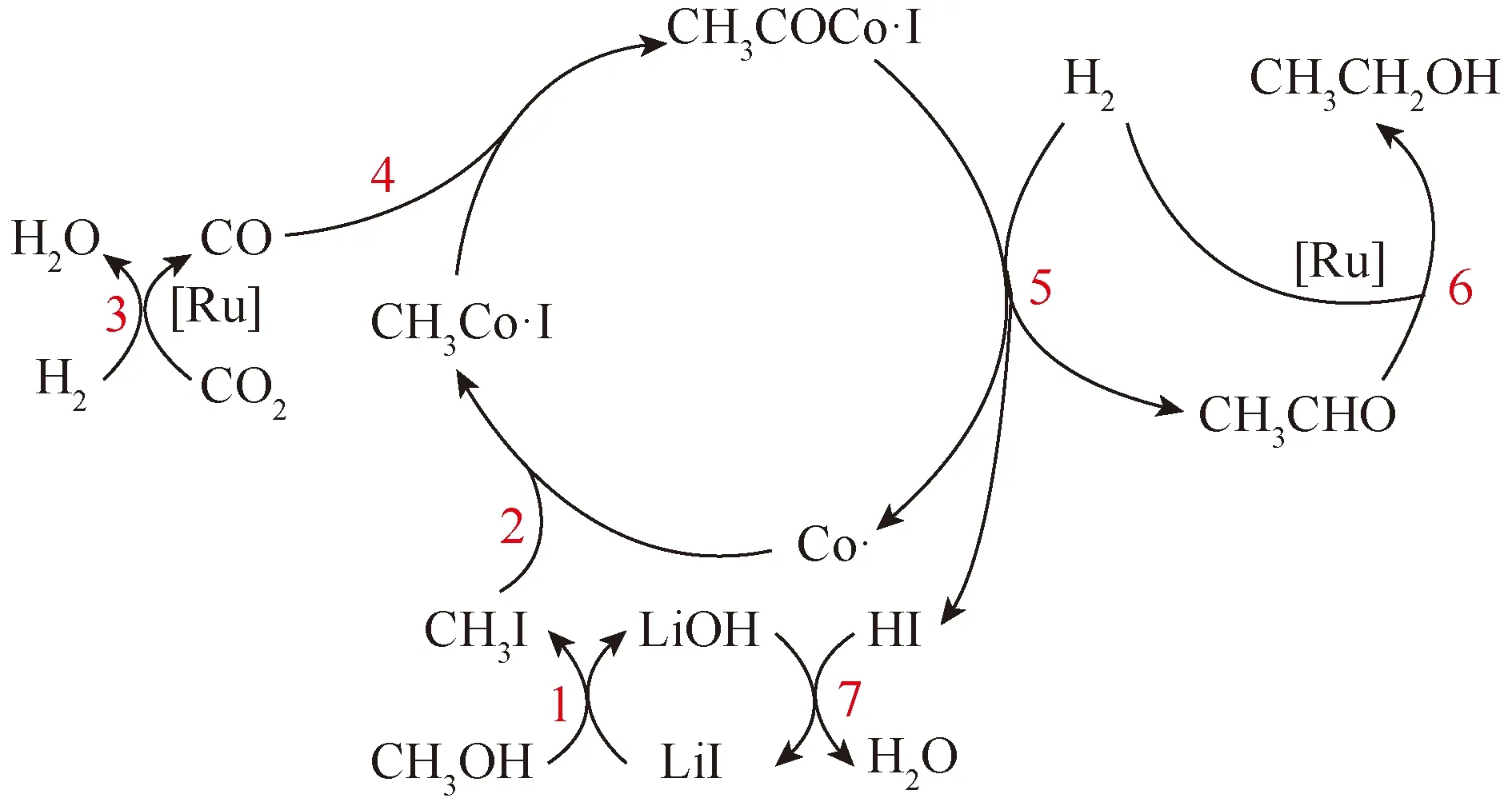
图7 合成乙醇的反应途径[40]
另一种途径是生成甲酸中间体,Bai等[39]认为催化剂经历了CO2吸附/活化,甲酸中间体的形成,中间体的转化或加氢(甲酸酯、·CO、·CH3、·CO插入形成·CH3CO),最终加氢生成C2H5OH,过程如图8所示。·CO氢化为·HCO是C2H5OH选择性高的原因,也是CO2加氢为C2H5OH的速率决定步骤,该猜测已通过DRIFTS得以验证。

图8 CO2加氢合成乙醇的反应途径[39]
基于上述分析,以CO2为碳源直接加氢合成乙醇具有可行性和广阔的应用前景。但该路线目前仍存在CO2转换率低、乙醇选择性低、机理研究不明确等问题,还需进一步研究廉价、活性和稳定性高的催化剂,进一步降低乙醇的制备成本。合成乙醇涉及C—C偶联和C—OH形成,不同催化剂催化CO2加氢合成乙醇的机理不同,第1种机理认为是以CO为中间体,随后CO加氢合成乙醇;另一种机理认为生成甲酸中间体,再通过加氢生成乙醇。
1.3 碳酸二乙酯
CO2作为无毒的C1资源,可以替代光气和CO作为绿色羰基源应用到有机合成,CO2与甲醇、乙醇和1,2-丙二醇分别直接合成碳酸二甲酯(DMC)、碳酸二乙酯(DEC)、碳酸丙烯酯(PC),是具有吸引力和挑战性的路线[44-46],CO2直接合成DMC的反应温度较高、转化率较低,且甲醇与DMC共沸,分离成本较大。因此,CO2直接合成DMC的难度较大。另外,CO2直接合成PC要加入脱水剂,原子经济性较差,分离也比较复杂。DEC具有羰基、乙基、乙氧基等活性基团而广泛用于有机合成。CO2一步羰化法合成DEC工艺简单,原料无毒廉价,且原子利用率高,DEC与生成的乙醇也不存在共沸,因此将CO2直接合成DEC受到广泛关注。但该过程受限于CO2的化学惰性,反应过程中生成副产物H2O,使得平衡常数较低[47-48],导致DEC的收率很低。因此开发高效绿色的催化剂,探索不同的反应途径、工艺条件,并通过原位移除反应体系的水以促进反应的进行,成为该技术改进的重点和实现工业化的关键。
目前,已经用于CO2羰化制备DEC反应的催化剂有ZrO2和双金属催化剂[48-49]等,存在DEC收率较低的问题。二氧化铈(CeO2)是碱性金属氧化物,在CO2醇解反应中具有很高的反应活性,鉴于CeO2比表面积较小,近年来研究主要集中于通过改性CeO2来增加其反应活性。研究人员将CeO2负载于高比表面积载体(如SiO2、Al2O3、TiO2)上,可以增加反应可用活性位点数量,提高DEC的收率。Ganesh等[50]采用金属掺入的二氧化铈(Ce0.9M0.1O2-δ,其中M=Zr4+、Al3+、Cu2+、Ni2+和Zn2+)制备的催化剂,2-氰基吡啶为脱水剂,研究由乙醇和CO2直接合成碳酸二乙酯(DEC)。结果表明,相比于金属掺杂的铈基催化剂,未掺杂的CeO2因具有合适的碱浓度,获得相对较高的DEC收率。在150 ℃、5 MPa、反应3 h的条件下,乙醇的转化率为46.9%,DEC产率为45%。说明碱性是影响催化剂活性的主要因素。
Leino等[51]采用蒸发浸渍法和沉积沉淀法合成了以Al2O3、SiO2和TiO2为载体的二氧化铈催化剂,以环氧丁烷为脱水剂,研究由乙醇和CO2直接合成DEC。考察了二氧化铈负载量、煅烧温度和制备工艺对CeO2-Al2O3、CeO2-SiO2、CeO2-TiO2的碱度,比表面积的影响。发现相比于沉积沉淀法,用蒸发浸渍法制备的16% CeO2-SiO2催化剂比表面积较高,得到了更高的DEC产率,如图9所示。
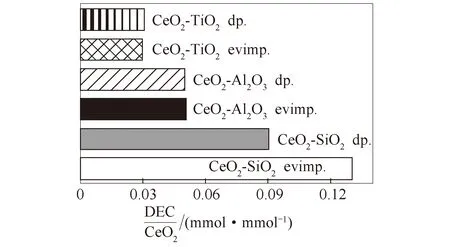
图9 用蒸发浸渍法和沉积沉淀法制备的16%的CeO2负载在TiO2、SiO2和Al2O3催化剂上的碳酸二乙酯收率[51]
Prymak等[48]通过柠檬酸盐法制备CexZr1-xO2(x= 0、0.2、0.5、0.8和1.0)固体,该团队使用活塞流反应器(PFR)以连续模式将乙醇和CO2直接合成碳酸二乙酯(DEC)。催化活性主要与位于Ce-Zr表面的酸碱位强度有关。且Ce-Zr可用于调整酸碱性、还原性、表面空位和固体的晶相以调控催化性能。结果表明,CexZr1-xO2(x=0.8)对DEC表现出最高的活性,DEC收率为0.7%。
如何有效去除DEC反应体系的水是提高DEC收率的关键。近年来,研究者致力于通过无机膜来分离反应体系的水,以此来促进反应向正方向进行。Dibenedetto等[52]采用Nb2O5/CeO2复合金属氧化物催化CO2和乙醇制备DEC,通过渗透蒸发膜分离过程中生成的水含量,使得乙醇的转化率从0.9%提高到2.3%。
Wang等[53]在连续模式下,在膜反应器上采用CexZr1-xO2催化剂,评价了乙醇和CO2直接合成DEC的反应,如图10所示。膜反应器如图11所示。系统研究了乙醇/CO2摩尔比、空速和温度3个主要参数对合成DEC的影响,并对比了4个无机多孔膜: MFI沸石,Si/Al比约为57;MFI沸石,Si/Al比约为270;LTA(NaA)沸石;微孔碳膜。与固定床反应器相比,使用MFI-57膜反应器可以将DEC的产率从32提高到47 mmol/(L·h)。
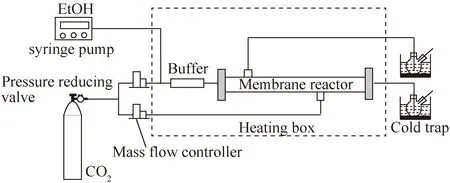
图10 连续合成DEC催化反应装置[53]
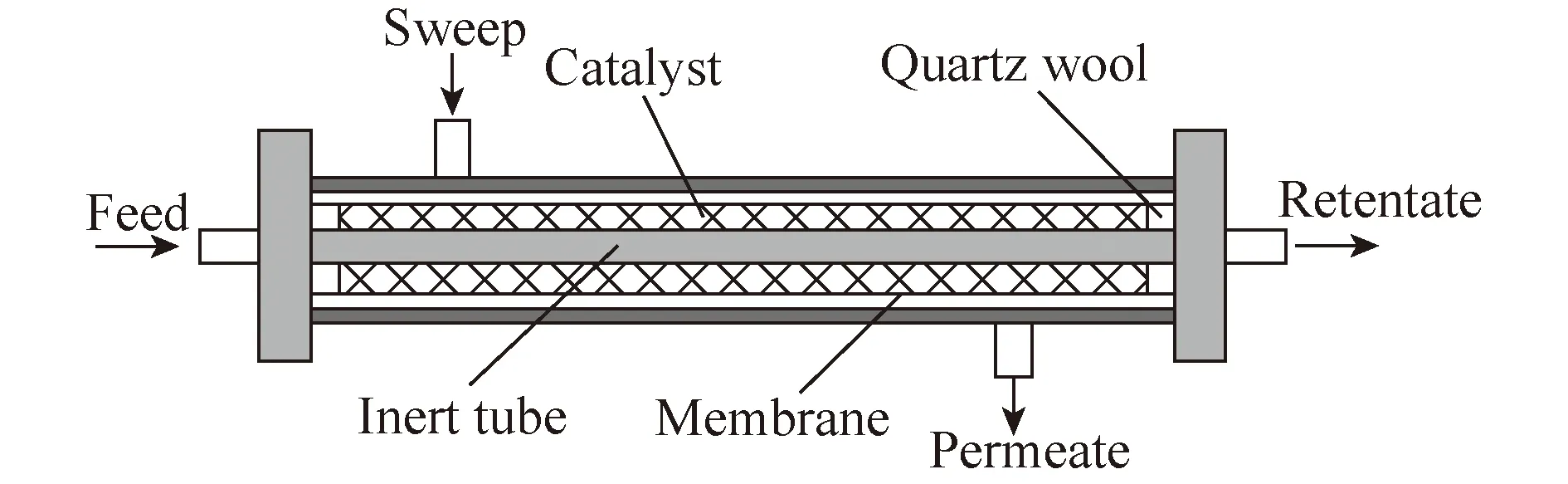
图11 连续合成DEC时用于原位除水的膜反应器的模块方案[53]
Arbeláez等[54]同样利用膜反应器进行CO2直接醇解反应。采用负载在活性炭上的颗粒状Cu-Ni∶3-1催化剂,在沸石A膜催化反应器上评价了乙醇和CO2催化合成DEC反应。吸附膜可以连续去除水而无需重新活化。并在膜反应器中评价了SiO2/γ- Al2O3膜和在Al2O3载体上合成的沸石A膜。发现与常规填充床反应器(PBR)相比,在0.2和0.8 μm Al2O3上制备的膜反应器,其乙醇转化率分别提高了60%和80%。
虽然通过开发膜反应器可以实现CO2醇解过程生成水的分离,但水并不能完全去除,反应效率提高有限。通过采用CO2和环氧化物以及乙醇一锅法可以制备DEC,且反应过程不生成水,有利于与高能化合物耦合,一定程度上克服了CO2直接利用中热力学瓶颈的限制。
Wang等[55]制备了一种包含聚(1-乙烯基-3-乙基咪唑溴盐)(PVEImBr)的交联聚离子液体,以及含有大量碱性位点且比表面积较大的MgO纳米片,将其与PVEImBr组合形成PVEImBr/MgO复合催化剂。通过多相催化剂上的CO2、环氧丙烷(PO)和乙醇耦合反应一锅法直接合成DEC。1H NMR表征和DFT模拟计算表明,PVEImBr的Br-通过与乙醇的羟基形成氢键而产生协同作用,使相对温和反应条件下,PO转化率为95.4%,DEC收率为54.4%。
综上所述,CO2与乙醇直接合成DEC所用的催化剂大多为含铈的多相催化剂,但在该催化体系下CO2转化率和DEC收率不高,且由于生成物中水分的影响,限制了DEC收率。采用环氧化物和CO2反应生成DEC过程中不产生水,可以有效克服热力学的限制,因此高能化合物的耦合路线是高效制备DEC的有效途径。
1.4 CO2/环氧化合物共聚绿色制备聚碳酸酯材料
将CO2转变为性能优良的高分子材料是其直接利用的重要途径。CO2基聚碳酸酯材料[56]是一种全生物降解的高分子材料,在建材、汽车制造、医疗器械、航空航天、光学透镜和电子电器等领域有广泛应用。日本科学家Inoue于1969年首次报道了二乙基锌和水的混合物催化CO2和环氧化物共聚制备聚碳酸酯(PC)[57]。该路线不仅可实现CO2资源的利用,还有助于缓解当前严重的白色污染,为人类提供一条绿色可持续的高分子材料合成路线。
Tan等[58-59]发展了稀土三元催化剂体系(Y(CF3COO)3或Y(RC6H4COO)3(R = H、OH、Me或NO2,以及ZnEt2和甘油)以CO2和环氧丙烷交替共聚得到聚碳酸亚丙酯(PPC),该催化体系解决了共聚反应慢、活性低等难题,同时PPC得到了较高的选择性(>90%)。该团队还设计了一种新型二元三价salen Ti配合物,与四价Ti对应物相比,增加了催化剂的活性,该催化剂可使CO2/PO不间断共聚制得合成交替聚碳酸环己烯酯(PCHC),实现CO2/环氧化物或羰基硫/环氧化物共聚的高立构规整度[60]。夏力[61]利用制备的双核配合物salen Co催化体系催化CO2与PO的共聚反应,生成了目标产物PPC。采用密度泛函理论对配合物进行研究,发现配体骨架的对应选择性越高,轴向配体的阴离子电负性越大,配合物的催化活性越大。在较优的反应条件下,PO转化率为98.85%,PPC选择性为93.04%。
2007年,中国科学院长春应用化学研究所与蒙西集团合作建成了具有完全自主知识产权的20 kt/a的CO2和环氧丙烷共聚合成聚碳酸酯生产线。2009年中国海洋石油总公司和中国科学院长春应用化学研究所建立了3 000 t/a的脂肪族聚碳酸酯示范线。
降解塑料方面,中国科学院广州化学所、浙江大学、中国科学院长春应用化学研究所相继开展了合成可降解塑料的研究,将CO2和环氧化物共聚合成高效催化体系,解决了本体共聚合和后处理过程的传质和传热问题。
2 CO2的间接利用
CO2的直接利用虽然是其化学转化的最直接方式,但由于其分子惰性,直接转化效率比较低,受热力学平衡影响,将CO2通过尿素、碳酸酯等中间体,进一步转化成化学品的间接利用方式则受到更多关注。在众多中间体中,碳酸乙烯酯(EC)可通过CO2与环氧化合物高效反应获得,合成工艺相对成熟。通过EC酯交换合成碳酸二甲酯(DMC)或加氢反应乙二醇和甲醇等是近年来广泛关注的研究领域。
2.1 CO2通过碳酸乙烯酯合成碳酸二甲酯
DMC是20世纪以来发展最迅速的绿色化学品之一。由于其同时含有羰基和甲基,可用于羰基化和甲基化反应中,替代剧毒的光气原料。同时DMC还是一种重要的有机合成中间体,分子中含有多种官能团,可以合成出多种高附加值的精细化学品,包括异氰酸酯、聚碳酸酯、聚氨酯等。另外,DMC也可以作为油品添加剂,还是一种优良的有机溶剂。目前,DMC合成方法主要有光气法、氧化羰化法和酯交换法。光气法由于使用剧毒光气已经被淘汰,氧化羰化法存在设备腐蚀、产物分离和催化剂回收等问题。酯交换法因为反应条件相对温和,同时可以实现CO2的间接利用,近年来备受关注。中国科学院山西煤炭化学研究所研究了尿素与甲醇直接反应生成DMC的路线[62],该路线具有DMC容易与中间产物发生反应、尿素易分解和缩聚、产生其他副产物等缺点。因此,采用尿素和丙二醇反应合成碳酸丙烯酯,再经甲醇酯交换反应生成DMC[63]。Liao等[64]合成了Ca-M-Al(M = Mg、La、Ce、Y)层状双氢氧化物的复合固体碱催化剂,用于甲醇与碳酸丙烯酯的酯交换反应,通过对催化剂的表征和催化性能评价,发现Ca-Mg-Al催化剂的比表面积较高,碱性位点较强,有较高的催化活性。在较优条件下,碳酸丙烯酯的转化率为55.3%,DMC选择性为96.3%。
近年来,由于EC和甲醇之间的酯交换生成DMC和乙二醇的反应具有反应条件温和、低毒和高选择性等优点,受到广泛重视。该路线不仅实现了CO2的间接利用,还在生产DMC的同时,副产重要的乙二醇化工原料,主要用于生产聚酯树脂、润滑油、防冻剂、有机精细化工产品等。中国科学院过程工程研究所张锁江院士团队开发出固载离子液体催化二氧化碳经EC转化制备碳酸二甲酯/乙二醇的绿色工艺,该催化剂基于氢键-静电协同的原理,创新开发了固载离子气液固三相列管式反应器和醇解反应-变压共沸精馏耦合过程强化技术,实现了原子经济性反应和CO2的转化。
Jun等[65]通过共沉淀法制备了一系列CeO2X-MgO(1-X)纳米催化剂,并将碱金属和碱土金属氧化物(MO = Li2O、K2O、Cs2O、SrO和BaO)负载在催化剂上,用于由EC和甲醇合成碳酸二甲酯的反应。研究表明,DMC的选择性与催化剂的碱性密切相关。随着催化剂碱性的增加,DMC产率增加。Li2O/CeO2(0.25)-MgO(0.75)纳米催化剂碱性最强,在合成EC酯交换制备DMC中表现出最佳的催化性能,收率>70%,其反应途径如图12所示。
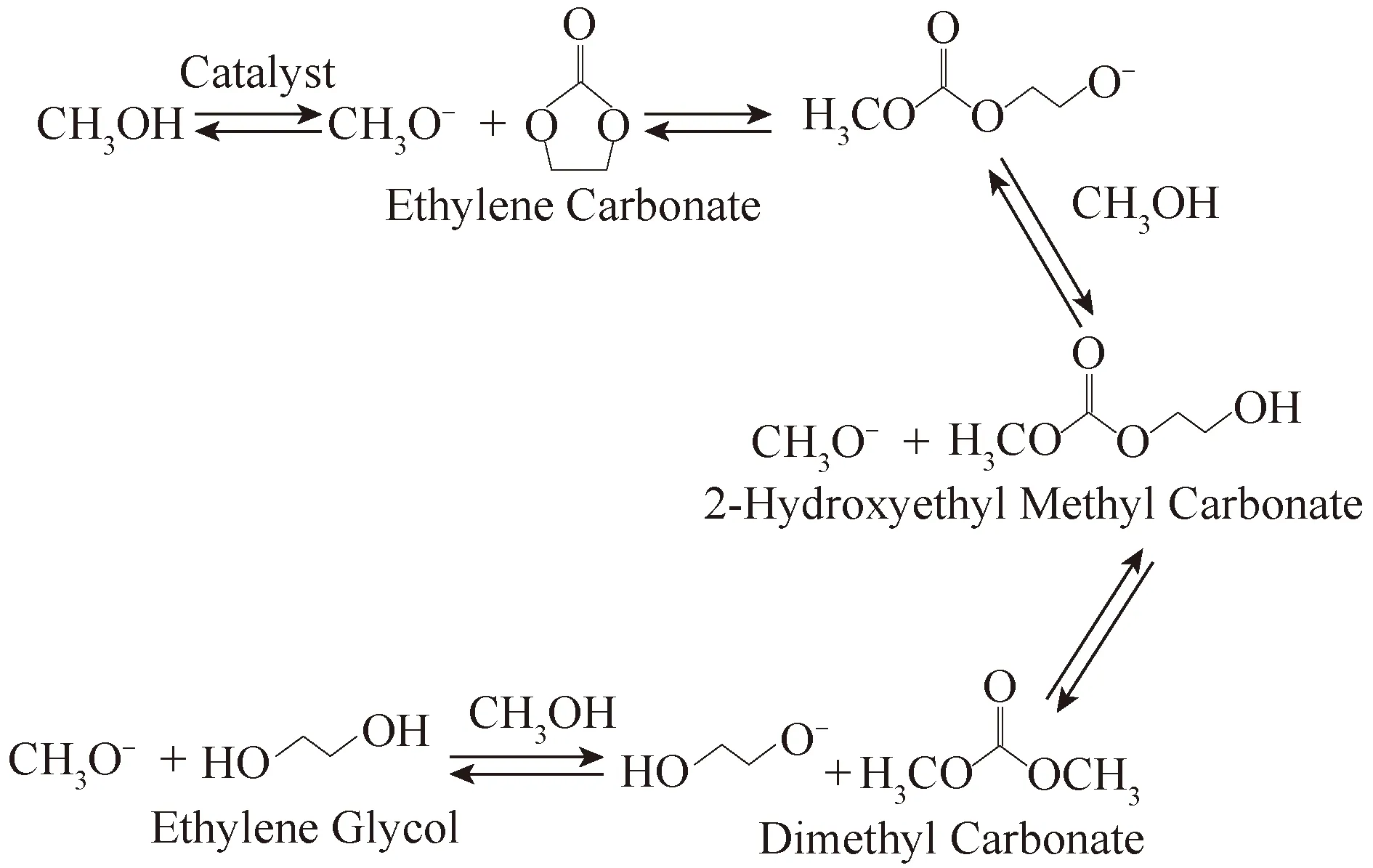
图12 在碱催化剂上由碳酸乙烯酯和甲醇合成DMC的催化机理[65]
由于铈锶混合氧化物催化剂具有良好的化学稳定性和适当的酸碱度,适用于EC酯交换反应合成DMC。Kumar等[66]采用柠檬酸辅助溶胶-凝胶法制备了一系列铈锶复合氧化物催化剂,研究了金属组成对反应性能的影响,发现Ce0.6Sr0.4显示出最高的碱性位点密度,因此显示出最高的EC转化率和DMC收率/选择性。在最佳反应条件下,DMC的选择性、收率和EC转化率分别为87%、71%和82%。
Song等[67]制备了一种质子离子液体[DBUH] [Im](1,8-二氮杂双环[5.4.0]-7-十一碳铝咪唑啉酮)催化剂,70 ℃下,2 h内EC转化率高达97%,DMC产率91%。该离子液体的高活性归因于阴阳离子的协同活化作用,阳离子[DBUH]+可活化EC形成羰基碳,而阴离子[Im]-活化甲醇形成甲氧基。
综上所述,碱性较强的催化剂应用于CO2通过碳酸乙烯酯与甲醇合成DMC,具有产品收率高、反应条件温和的特点。需要指出的是,酯交换法是可逆反应,及时将生成的DMC移出体系,有利于平衡向生成DMC方向移动。另外,反应中及时分离DMC和甲醇的共沸物也可提高产率。
2.2 CO2通过碳酸乙烯酯加氢制备甲醇联产乙二醇
CO2具有低热力学稳定性和克服CO2动力学惯性反应条件苛刻的缺点,在温和条件下通过直接氢化从二氧化碳生成甲醇是学术界和工业界的巨大挑战。借助于CO2与胺、醇、环氧化物等反应生成中间化合物,再经加氢反应,则可以实现温和条件下CO2间接加氢合成甲醇。通过二氧化碳与环氧乙烷加成反应生成EC,再进一步加氢生产甲醇联产乙二醇是重要的CO2间接转化利用方式[64-65]。反应过程不生成水,有效克服了热力学限制,使产品收率大幅提高。
Han等[68]使用一种均相催化剂(PNP)RuII络合物从EC均相加氢,以制得甲醇和乙二醇。该过程可以在无溶剂条件下进行。通过研究其机理发现,反应生成的中间产物是甲酸酯、甲醛。反应路径如图13所示。在最优条件下,EC转化率为89%,甲醇和EG收率分别为84%和87%。
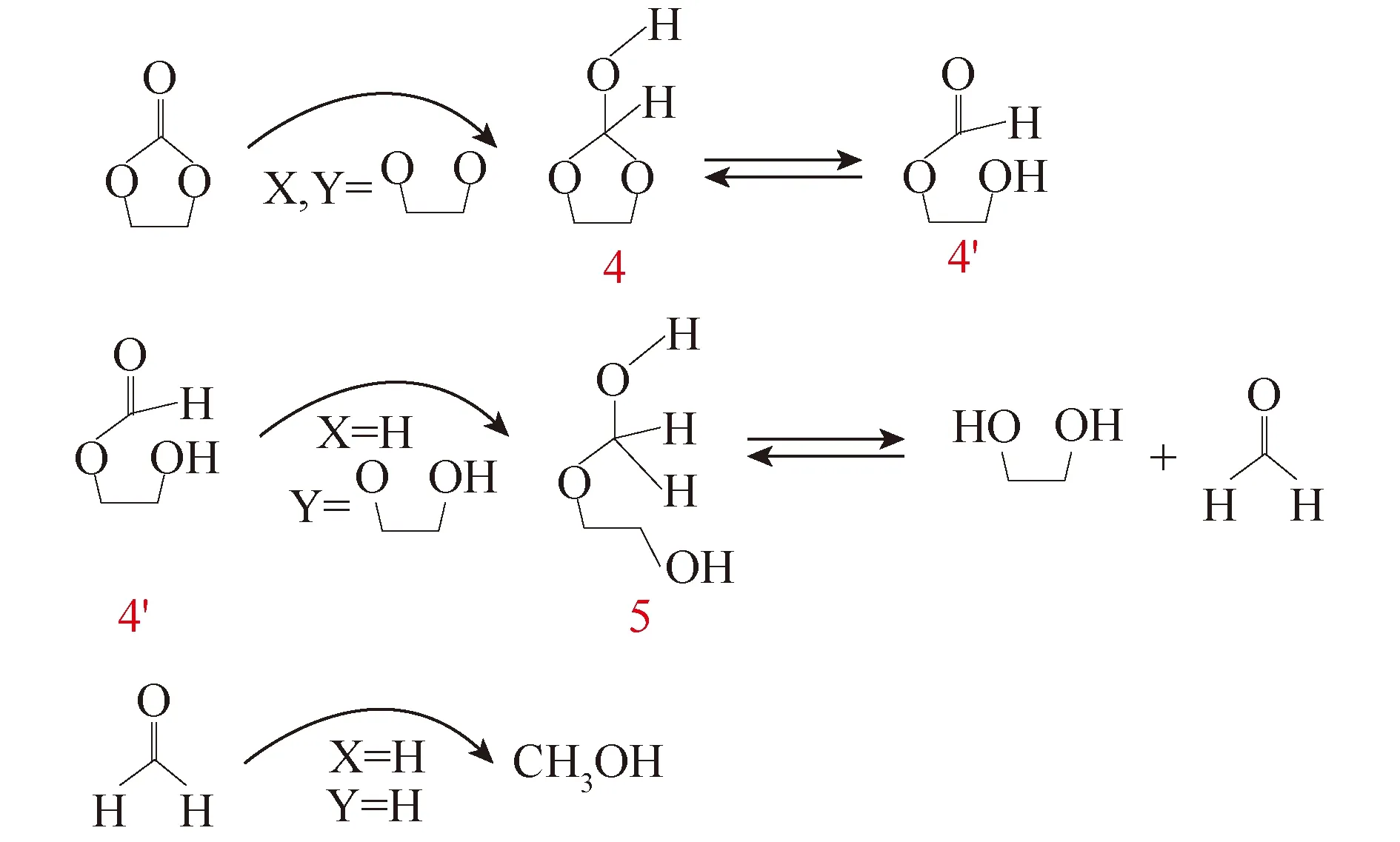
图13 (PNP)RuII催化环状碳酸酯加氢的机理[68]

Lian等[70]通过水热法制备了多相CuCr2O4纳米催化剂,该催化剂可将EC选择性氢化为甲醇和EG,选择性分别为60%和93%。由于CuCr2O4纳米催化剂要用H2预处理,会生成一些低价态的Cu(Cu0或Cu+),使得CO2衍生的EC加氢生成甲醇和乙二醇非常有效。
Liu等[71]通过沉淀凝胶法制备具有均匀铜分散体的铜-二氧化硅纳米复合催化剂,在CO2衍生的环状碳酸酯加氢中非常有效,能将CO2间接转化为甲醇和乙二醇。70% Cu-SiO2-PG掺入了B2O3(1%)催化剂在间歇式和固定床连续流反应器中均有显著稳定性。催化剂的铜粒度、表面酸碱度和铜的价态是获得良好催化活性的关键。其中,Cu0和Cu+协同作用对获得高产率的甲醇和乙二醇起关键作用。
Li等[72]采用蒸氨法成功制备了3种铜基催化剂Cu/SBA-15、Cu/KIT-6和Cu/MCM-41用于EC加氢反应。结果表明,Cu/SBA-15具有相对较高的催化活性,在4 h反应时间内EC转化率可达到100%,EG收率94.7%和甲醇收率62.3%。通过DFT计算与EC加氢相关的不同主副反应的热力学数据,结果表明,通过EC中间体进行的CO2间接加氢比直接进行CO2加氢更具有热力学优势。
Wu等[73]将二甲基吡啶桥联的N-杂环卡宾(NHC)配体和商业化的Ru前体用于催化EC加氢生成乙二醇和甲醇,NHC配体具有强大的σ供体能力,相应的金属-NHC配合物对空气和湿气稳定,RuII-NHC络合物显示出有效的催化性能,EC转化率为99%,乙二醇转化率为92%,甲醇产率为42%。
Liu等[74]通过蒸氨法(AE)制备了系列β-环糊精改性的Cu/SiO2催化剂用于EC加氢反应。催化剂构效表明,Cu+和Cu0都是甲醇和乙二醇合成的活性位点。DFT计算结果表明,Cu+是吸附EC分子的主要活性位点。Cu+/(Cu++Cu0)比例在催化性能中发挥重要作用。453 K下,4 h后EC转化率为94.2%,乙二醇选择性为98.8%,甲醇选择性为71.6%。

图14 碳助催化剂xCu@SiO2-β-P的制备示意[75]
Zhang等[75]报告了在聚(乙二醇)-嵌段-聚(丙二醇)-嵌段-聚(乙二醇)(P123)辅助下通过一种简便的水解沉淀法制备β-环糊精改性的Cu@SiO2催化剂,如图14所示,并成功用于EC加氢反应中。该催化剂具有2.0 nm以下超细Cu粒子的独特花瓣状结构和均匀分散介孔。结果表明,引入β-环糊精改善了铜的分散性并增加了更多的活性位点。同时,Cu0和Cu+之间的协同作用有利于提升催化性能。其中,25Cu@SiO2-β-P催化剂表现出相对较高的催化活性,EC转化率为97.4%,EG选择性为95.5%和甲醇选择性为64.6%。通过碳改性催化剂,使其具备良好的稳定性。
综上所述,在碳酸乙烯酯加氢制备甲醇和乙二醇的反应中,铜基催化剂研究较多,Cu0和Cu+的协同作用有利于反应进行,提高乙二醇的和甲醇的产率。因此,进一步研究催化剂稳定化机制,提高甲醇的选择性是以后研究重点。
3 结语及展望
CO2化学利用已经成为资源循环利用和绿色化工领域最活跃的研究方向之一,其共性基本科学和技术问题的不断突破,将为碳资源的闭合循环发挥不可替代的作用。将煤化工等排放的CO2化学转化合成醇酯类化学品和高分子材料是重要的研究方向,近年来国内外进行了大量研究工作,并取得了显著进展。我国明确提出争取在2060年实现“碳中和”,其中CO2化学利用将是实现碳中和的重要途径。CO2转化为脂肪族聚碳酸酯等新型材料,加氢制备甲醇等高附值化学品具有重要研究意义,有望带动CO2的大规模化学利用。围绕如何实现相对温和条件下的CO2还原转化以及CO2的资源化利用,有以下几点思考:

2)化学、物理、材料、生物等多学科交叉对于CO2的有效活化和高效利用非常重要。利用生物法微藻固定CO2是重要的发展方向,涉及多学科交叉,同时可在温和条件下将CO2转化为生物燃料(脂肪酸甲酯、醇类等)及其他高附加值产品。
3)外场耦合和催化过程强化是提高CO2转化效率的重要手段:新催化材料和耦合利用手段层出不穷,诸如热催化转化、光催化、电催化、光电耦合、光热耦合、生物固碳、光化学-生物等方法,将是实现CO2温和活化和提升利用效率的重要手段。
4)从不同尺度深化CO2利用规律性认识:如从反应过程认识碳-氧键活化和碳-碳(氮)键生成机制,从工艺角度对比分析不同路线的优缺点和经济性,从转化形式实现多元手段的耦合强化,丰富CO2规模化应用制备化学品和新材料技术路径。
5)CO2定向转化合成单一高附加值化学品,有利于减少后续产品分离复杂性和合成成本,发展高选择性功能催化体系高效制备高值化学品将是未来研究重点。
综上所述,开拓新的CO2资源转化利用途径,提升碳氧资源利用效率,对于人类经济社会的可持续发展具有重要意义。

