干旱胁迫对‘菊花桃’幼苗生长及生理特性的影响
,,, ,,
(1.中南林业科技大学 林学院,湖南 长沙 410004;2.湖南汇智农林工程咨询设计有限公司,湖南 长沙 410004)
桃Prunus persica系蔷薇科Rosaceae李属Prunus桃亚属Amygdalus落叶小乔木,原产于中国,根据其应用价值可分成果桃和观赏桃。桃花是中国传统的“十大名花”之一,‘菊花桃’Prunus persicacv.Juhuatao 为观赏桃中的一种。‘菊花桃’是重瓣花,盛开时如菊花,花色粉红或红色,加上树形优美,观赏价值高,深受人们喜爱。干旱胁迫对经济林木的生长发育和生理生化等方面会产生不同程度的影响,从而影响其经济效益,探明其影响机制并提高品种的干旱性成为了经济林木品种选育研究的热点。曾继娟等[1]经研究发现,扁桃幼苗具有较强的抗旱性,扁桃地径和苗高的生长均受到了水分胁迫的抑制。蒋晋豫等[2]通过对长柄扁桃的研究,发现随着干旱胁迫时间的延长,MDA 含量、抗氧化酶SOD 和POD 的活性呈先上升、后下降的变化趋势。金丽萍[3]经研究发现,随胁迫时间的延长和程度的加强,蒙古扁桃叶片相对含水量、叶绿素a 含量、叶绿素b 含量和叶绿素总含量总体呈下降趋势;脯氨酸、可溶性糖和可溶性蛋白质含量呈上升趋势;MDA 含量呈先升后降的趋势。曹原[4]对光核桃进行了研究,发现干旱条件下抗氧化酶SOD、POD 和CAT 活性呈升高趋势。目前,有关观赏桃的研究报道较广泛,但有关干旱胁迫特定处理对观赏桃幼苗生长和生理特性影响的研究鲜有报道。
本试验中以‘菊花桃’幼苗为试验材料,对干旱胁迫下其幼苗形态、苗高生长量、地径生长量、叶片相对含水量、丙二醛含量、叶绿素含量、可溶性蛋白含量以及POD、SOD 活性进行测定,研究‘菊花桃’幼苗的抗旱性,以期为观赏桃新品种的选育提供参考依据。
1 材料与方法
1.1 试验材料处理
试验对象为1年生‘菊花桃’嫁接苗。2020年3月29日,将裸根苗移栽到花盆(上口径23 cm、下口径18 cm、高25 cm)中,栽培基质选用泥炭土、蛭石、珍珠岩、园土的混合基质(体积比3∶2∶2∶3),上盆时将腐熟的有机肥和缓释复合肥混合作为基肥。将供试苗木放于大棚内缓苗,其间进行正常的水肥管理。2020年5月17日,选取长势基本一致且无病虫害的苗木,2 周后进行干旱胁迫处理,其间保持水肥供应,保证苗木正常生长。
1.2 试验设计
2020年5月31日,开始进行干旱胁迫处理。设置土壤含水量占土壤最大田间持水量的95%~100%(对照,CK)、75%~80%(轻度干旱,T1)、55% ~60%(中度干旱,T2)、35%~40%(重度干旱,T3)4 个处理水平,每个处理15 盆,重复3 次。试验开始后,连续控水30 d,每天18:00—19:00 通过称取盆栽质量得出土壤失去的水分质量,并补充水分,维持每处理设定的田间持水量。在胁迫处理进行4、8、12、16和30 d 后的7:30—8:30,每处理组随机选取3 株苗木,采集健康且长势一致的成熟叶片,带回实验室进行各项生理指标的测定。
1.3 指标测定
1.3.1 生长指标
在胁迫开始时测定各处理植株的苗高(H0)、地径(D0),处理30 d 后再测定苗高(H1)、地径(D1)。地径用游标卡尺测定,苗高用钢卷尺测定。苗高生长量(ΔH)和地径生长量(ΔD)的计算公式:
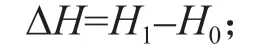
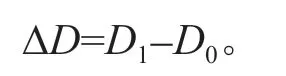
1.3.2 叶片相对含水量
采用烘干法测定叶片相对含水量[5]。
1.3.3 生理指标
采用分光光度法测定光合色素含量[5];采用硫代巴比妥酸法测定丙二醛(MDA)含量[5];采用考马斯亮蓝染色法测定可溶性蛋白含量[5];使用北京索莱宝科技有限公司生产的过氧化物酶(POD)试剂盒和超氧化物歧化酶(SOD)试剂盒分别测定POD、SOD 活性。
1.4 数据分析
使用Microsoft excel 2019 软件对试验数据进行整理分析,数据为“平均值±标准差”。使用SPSS 20 软件进行差异显著性分析。
2 结果与分析
2.1 干旱胁迫对‘菊花桃’幼苗形态的影响
干旱胁迫不同时长后,‘菊花桃’幼苗的形态见表1。由表1可知,在轻度、中度和重度干旱胁迫下‘菊花桃’幼苗均可成活。轻度干旱胁迫处理下,植株形态与对照相比未表现出明显的差异,仅少部分叶片萎蔫;中度干旱胁迫处理下,‘菊花桃’幼苗约1/2 的叶片萎蔫卷曲,叶尖和叶缘泛黄,且叶片上出现少量白色斑点;重度干旱胁迫处理下,‘菊花桃’幼苗大部分叶片卷曲、枯黄,且伴有叶片掉落,同时叶片有大量白色斑点。

表1 干旱胁迫不同时长后‘菊花桃’幼苗的形态Table 1 Morphology of P.persica cv.Juhuatao seedlings after different duration of drought stress
2.2 干旱胁迫对‘菊花桃’幼苗生长的影响
干旱胁迫30 d 后‘菊花桃’幼苗的生长量见表2。由表2可知,‘菊花桃’幼苗高和地径的生长量随干旱胁迫程度的加强而下降。轻度干旱胁迫处理下,苗高生长量与对照相比下降了20.05%,且差异显著;地径生长量与对照相比下降了11.69%,但差异不显著。中度和重度干旱胁迫处理下,苗高生长量与对照相比分别下降了71.36%、80.22%,地径生长量分别下降了29.85%、41.54%,且差异均显著。

表2 干旱胁迫30 d 后‘菊花桃’幼苗的生长量†Table 2 Increment of P.persica cv.Juhuatao seedlings after 30 days of drought stress cm
2.3 干旱胁迫对‘菊花桃’幼苗叶片相对含水量的影响
干旱胁迫不同时长后,‘菊花桃’幼苗叶片的相对含水量见表3。由表3可知,在干旱胁迫处理30 d 期间,干旱胁迫导致‘菊花桃’幼苗叶片的相对含水量呈下降趋势,对照叶片的相对含水量未发生明显变化。

表3 干旱胁迫不同时长后‘菊花桃’幼苗叶片的相对含水量Table 3 The relative water content of P.persica cv.Juhuatao seedling leaves after different drought stress duration %
胁迫4 d 后,轻度干旱处理下叶片的相对含水量与对照之间无显著差异,中度和重度干旱处理下叶片的相对含水量均显著下降。胁迫8 d 后,轻度干旱处理下叶片的相对含水量与对照之间无显著差异,中度和重度干旱处理下叶片的相对含水量分别下降了3.63%和5.79%。随着胁迫时长的增加,叶片相对含水量逐渐降低,至胁迫12 d 后,轻度、中度和重度干旱处理下叶片的相对含水量分别下降了3.71%、10.68%和14.79%。胁迫30 d后,轻度、中度和重度干旱处理下叶片的相对含水量分别下降了8.03%、14.50%和25.48%。
胁迫4 d 后,叶片的相对含水量在轻度干旱处理下最大,为68.89%,在中度干旱处理下次之,在重度干旱处理下最小,为66.63%。胁迫8 d 后,在轻度干旱处理下最大,为68.02%,在中度干旱处理下次之,在重度干旱处理下最小,为64.70%。胁迫12、16、30 d 后,叶片的相对含水量均是在轻度干旱处理下最大,在中度干旱处理下次之,在重度干旱处理下最小。
由此表明:随胁迫时长的增加,轻度、中度和重度干旱处理下叶片的相对含水量均逐渐降低,且均在胁迫30 d 后降至最小值;在相同的胁迫时长后,随胁迫程度加强,叶片的相对含水量依次降低。
2.4 干旱胁迫对‘菊花桃’幼苗叶片光合色素含量的影响
2.4.1 对叶绿素a 含量的影响
干旱胁迫不同时长后,‘菊花桃’幼苗叶片的叶绿素a 含量如图1所示。由图1可见,在干旱胁迫处理30 d 期间,干旱胁迫导致‘菊花桃’幼苗叶片的叶绿素a 含量呈先上升、后下降的变化趋势,对照叶片叶绿素a 含量未发生明显变化。
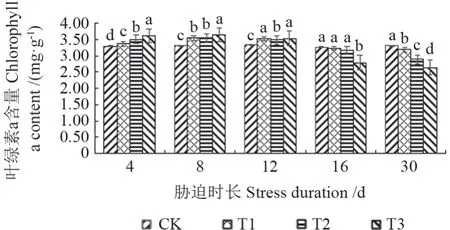
图1 干旱胁迫不同时长后‘菊花桃’幼苗叶片的叶绿素a含量Fig.1 The content of chlorophyll a in the leaves of P.persica cv.Juhuatao seedlings after different drought stress duration
随胁迫时长的增加,叶绿素a 含量在轻度、中度和重度干旱处理下均为胁迫8 d 后上升至最大值,分别上升了7.10%、7.22%和10.40%。在轻度、中度和重度干旱处理下,叶绿素a 含量均为胁迫30 d 后降至最小值,分别下降了3.33%、12.68%和19.95%。
随胁迫程度的加强,在试验初期,叶绿素a 含量在轻度、中度和重度干旱处理下依次上升。胁迫4 d 后,在轻度干旱处理下最小,为3.367 mg/g,在中度干旱处理下次之,在重度干旱处理下最大,为3.614 mg/g;胁迫8 d 后,在轻度干旱处理下最小,为3.541 mg/g,在中度干旱处理下次之,在重度干旱处理下最大,为3.650 mg/g。在试验中期和后期,叶绿素a 含量在胁迫12 d 后,在中度干旱处理下最小,为3.488 mg/g,在轻度干旱处理下次之,在重度干旱处理下最大,为3.538 mg/g;在胁迫16、30 d 后,均为在轻度干旱处理下最大,在中度干旱处理下次之,在重度干旱处理下最小。
2.4.2 对叶绿素b 含量的影响
干旱胁迫不同时长后,‘菊花桃’幼苗叶片的叶绿素b 含量如图2所示。由图2可见,在干旱胁迫处理30 d 期间,干旱胁迫导致‘菊花桃’幼苗叶片的叶绿素b 含量呈先上升、后下降的变化趋势,对照叶片叶绿素b的含量未发生明显变化。

图2 干旱胁迫不同时长后‘菊花桃’幼苗叶片的叶绿素b含量Fig.2 The content of chlorophyll b in the leaves of P.persica cv.Juhuatao seedlings after different drought stress duration
随胁迫时长的增加,叶绿素b 含量在轻度干旱处理下为胁迫4 d 后升至最大值,在中度和重度干旱处理下均为胁迫8 d 后升至最大值,分别上升了2.27%、10.78%和13.82%。叶绿素b 含量在轻度、中度和重度干旱处理下均为胁迫30 d 后降至最小值,分别下降了6.24%、30.82%和47.75%。
随胁迫程度的加强,在试验初期,叶绿素b含量在轻度、中度和重度干旱处理下依次上升。胁迫4 d 后,在轻度干旱处理下最小,为1.621 mg/g,在中度干旱处理下次之,在重度干旱处理下最大,为1.747 mg/g;胁迫8 d 后,在轻度干旱处理下最小,为1.615 mg/g,在中度干旱处理下次之,在重度干旱处理下最大,为1.755 mg/g。在试验中期和后期,叶绿素b 含量在胁迫12 d 后,在中度干旱处理下最小,为1.605 mg/g,在轻度干旱处理下次之,在重度干旱处理下最大,为1.612 mg/g;在胁迫16、30 d 后,均为在轻度干旱处理下最大,在中度干旱处理下次之,在重度干旱处理下最小。
2.4.3 对类胡萝卜素含量的影响
干旱胁迫不同时长后,‘菊花桃’幼苗叶片的类胡萝卜素含量如图3所示。由图3可见,在干旱胁迫处理30 d 期间,干旱胁迫导致‘菊花桃’幼苗叶片的类胡萝卜素含量呈先上升、后下降的变化趋势,对照叶片的类胡萝卜素含量未发生明显变化。
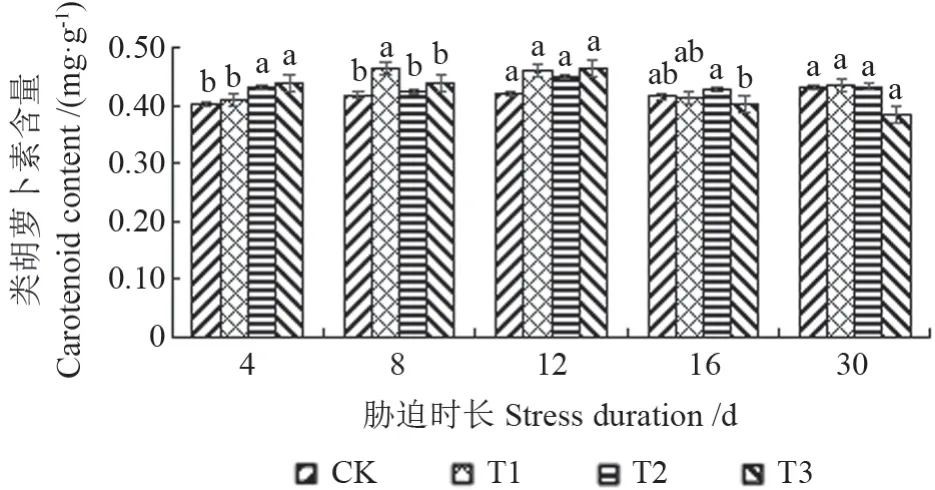
图3 干旱胁迫不同时长后‘菊花桃’幼苗叶片的类胡萝卜素含量Fig.3 The carotenoid content of P.persica cv.Juhuatao seedling leaves after different drought stress duration
随胁迫时长的增加,类胡萝卜素含量在轻度干旱处理下胁迫8 d 后升至最大值,在中度和重度干旱处理下均为胁迫12 d 后升至最大值,分别上升了11.04%、7.22%和10.39%。类胡萝卜素含量在轻度、中度和重度干旱处理下分别为胁迫4、8、30 d 后降至最小值。
随胁迫程度的加强,在试验初期,类胡萝卜素含量在胁迫4 d 后,在轻度、中度和重度干旱处理下依次上升,在轻度干旱处理下最小,为0.410 mg/g,在中度干旱处理下次之,在重度干旱处理下最大,为0.439 mg/g;胁迫8 d 后,在中度干旱处理下最小,为0.424 mg/g,在重度干旱处理下次之,在轻度干旱处理下最大,为0.465 mg/g。在试验中期和后期,类胡萝卜素含量在胁迫12 d后,在中度干旱处理下最小,为0.450 mg/g,在轻度干旱处理下次之,在重度干旱处理下最大,为0.463 mg/g;在胁迫16 d 后,在重度干旱处理下最小,为0.403 mg/g,在轻度干旱处理下次之,在中度干旱处理下最大,为0.428 mg/g;在胁迫30 d后,在重度干旱处理下最小,为0.385 mg/g,在中度干旱处理下次之,在轻度干旱处理下最大,为0.435 mg/g。
由此表明:随干旱胁迫时长的增加,叶绿素a 和叶绿素b 含量在试验初期上升,试验中期和后期下降,至胁迫30 d 后均降至最小值;随胁迫程度加强,叶绿素a 和叶绿素b 含量在试验初期呈依次上升趋势,在重度干旱处理下最大,在试验中期和后期呈依次下降趋势,在重度干旱处理下降至最小。类胡萝卜素含量总体上与叶绿素a 和叶绿素b 含量的变化趋势相似。
2.5 干旱胁迫对‘菊花桃’幼苗叶片丙二醛含量的影响
干旱胁迫不同时长后,‘菊花桃’幼苗叶片的丙二醛含量见表4。由表4可知,在干旱胁迫处理30 d 期间,干旱胁迫导致‘菊花桃’幼苗叶片丙二醛含量呈逐渐上升的变化趋势,对照叶片丙二醛含量未发生明显变化。
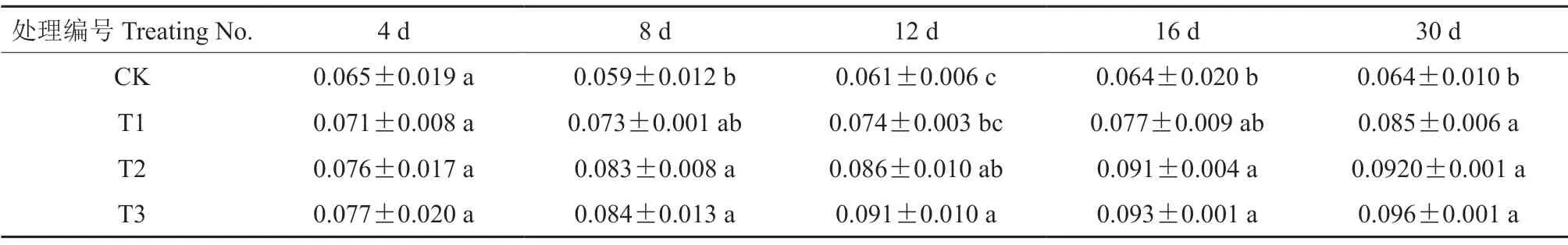
表4 干旱胁迫不同时长后‘菊花桃’幼苗叶片的丙二醛含量Table 4 MDA content of P.persica cv.Juhuatao seedling leaves after different drought stress duration μmol/g
胁迫4 d 后,轻度、中度和重度干旱处理下叶片丙二醛含量分别上升了10.23%、17.21%和18.76%;胁迫8 d 后,轻度、中度和重度干旱处理下丙二醛含量分别上升了23.48%、40.71%和41.72%;随干旱胁迫时长的增加,至胁迫12 d 后,轻度、中度和重度干旱处理下丙二醛含量分别上升了22.64%、41.65%和50.25%;当胁迫30 d 后,轻度、中度和重度干旱处理下丙二醛含量分别上升了33.23%、43.37%和49.45%。轻度、中度和重度干旱胁迫4 d 后,轻度干旱处理下丙二醛含量最小,为0.071 μmol/g,重度干旱处理下丙二醛含量最大,为0.077 μmol/g;轻度、中度和重度干旱胁迫8 d 后,轻度干旱处理下丙二醛含量最小,为0.073 μmol/g;随胁迫程度加强,在胁迫12、16、30 d 后,轻度干旱处理下丙二醛含量均为最小,重度干旱处理下丙二醛含量均为最大。
由此表明:丙二醛含量随胁迫时长的增加,在轻度、中度和重度干旱处理下均逐渐上升,且均于胁迫30 d 后上升至最大值;随胁迫程度加强,在相同的胁迫时长后,在轻度干旱处理下上升值最小,在中度干旱处理下次之,在重度干旱处理下上升值最大。
2.6 干旱胁迫对‘菊花桃’幼苗叶片可溶性蛋白含量的影响
干旱胁迫不同时长后,‘菊花桃’幼苗叶片的可溶性蛋白含量见表5。由表5可知,在干旱胁迫处理30 d 期间,干旱胁迫导致‘菊花桃’幼苗叶片可溶性蛋白含量呈先上升、后下降的变化趋势,对照叶片可溶性蛋白含量未发生明显变化。

表5 干旱胁迫不同时长后‘菊花桃’幼苗叶片的可溶性蛋白含量Table 5 The soluble protein content of P.persica cv.Juhuatao seedling leaves after different drought stress duration mg/g
胁迫4 d 后,轻度、中度和重度干旱处理下叶片可溶性蛋白含量分别上升了9.61%、12.15%和12.93%;随着胁迫时长的增加,胁迫8 d 后,轻度、中度和重度干旱处理下可溶性蛋白含量均上升至最大值,分别上升了18.70%、16.37%和24.48%;胁迫30 d 后,轻度、中度和重度干旱处理下可溶性蛋白含量均下降至最小值,分别显著下降了24.67%、38.57%和45.37%。试验初期,随胁迫程度加强可溶性蛋白含量均逐渐上升,胁迫4 d 后,轻度干旱处理下可溶性蛋白含量最小,为35.261 mg/g,重度干旱处理下含量最大,为36.331 mg/g;胁迫8 d 后,轻度、中度和重度干旱处理下可溶性蛋白含量均分别达最大值,其中轻度干旱处理下含量最小,为38.317 mg/g,中度干旱处理下次之,为37.563 mg/g,重度干旱处理下含量最大,为40.181 mg/g。试验中期和后期,胁迫12 d 后,轻度、中度和重度干旱处理下可溶性蛋白含量均下降,其中中度干旱处理下下降最为缓慢;胁迫30 d 后,轻度干旱处理下含量最大,中度干旱处理下次之,重度干旱处理下含量最小。
由此表明:可溶性蛋白含量随胁迫时长的增加,在轻度、中度和重度干旱处理下均于胁迫8 d后上升至最大值,胁迫30 d 后,在轻度、中度和重度干旱处理下降至最小值。随胁迫程度加强,试验初期,在轻度干旱处理下上升值最小,在中度干旱处理下次之,在重度干旱处理下上升值最大;试验中期和后期,在重度干旱处理下可溶性蛋白含量比在轻度和中度干旱处理下下降显著。
2.7 干旱胁迫对‘菊花桃’幼苗叶片POD 活性的影响
干旱胁迫不同时长后,‘菊花桃’幼苗叶片的POD 活性见表6。由表6可知,在干旱胁迫处理30 d 期间,干旱胁迫导致‘菊花桃’幼苗叶片POD 活性总体呈先上升、后下降的变化趋势,对照叶片POD 活性未发生明显变化。
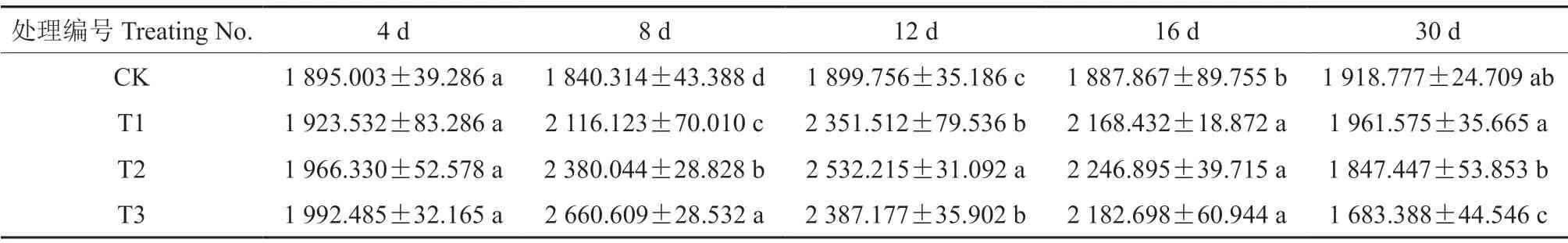
表6 干旱胁迫不同时长后‘菊花桃’幼苗叶片的POD 活性Table 6 POD activity of P.persica cv.Juhuatao seedling leaves after different drought stress duration U/g
胁迫4 d 后,轻度、中度和重度干旱处理下叶片POD 活性分别上升了1.51%、3.76%和5.14%;胁迫8 d 后,轻度、中度和重度干旱处理下POD活性分别显著上升了14.99%、29.33%和44.57%;轻度和中度干旱处理下POD 活性均于胁迫12 d 后上升至最大值,分别上升了23.78%和33.29%,重度干旱处理下POD 活性于胁迫8 d 后上升至最大值,上升了44.57%;随胁迫时长的增加,胁迫30 d 后,轻度、中度和重度干旱处理下POD 活性均分别降至最小值。试验初期,轻度、中度和重度干旱处理下POD 活性均逐渐上升,胁迫4 d 后,在轻度干旱处理下值最小,为1 923.532 U/g,在重度干旱处理下值最大,为1 992.485 U/g;胁迫8 d后,轻度干旱处理下值最小,为2 116.123 U/g,重度干旱处理下值最大,为2 660.609 U/g。试验中期和后期,胁迫12 d 后,轻度和中度干旱处理下POD 活性均上升,重度干旱处理下POD 活性下降,重度干旱处理下POD 活性大于轻度干旱处理而小于中度干旱处理;胁迫30 d 后,重度干旱处理下POD 活性小于轻度和中度干旱处理。
由此表明:随胁迫时长的增加,轻度、中度和重度干旱处理下POD 活性均在试验初期上升,至胁迫30 d 后降至最小值。随胁迫程度的加强,试验初期,在轻度干旱处理下POD 活性最小,在中度干旱处理下次之,在重度干旱处理下最大;试验中期和后期,重度干旱处理下POD 活性下降较显著,胁迫30 d 后降至最小值,且小于轻度和中度干旱处理下的活性值。
2.8 干旱胁迫对‘菊花桃’幼苗叶片SOD 活性的影响
干旱胁迫不同时长后,‘菊花桃’幼苗叶片的SOD 活性见表7。由表7可知,在干旱胁迫处理30 d 期间,干旱胁迫导致‘菊花桃’幼苗叶片SOD 活性呈先上升、后下降的变化趋势,对照叶片SOD 活性未发生明显变化。
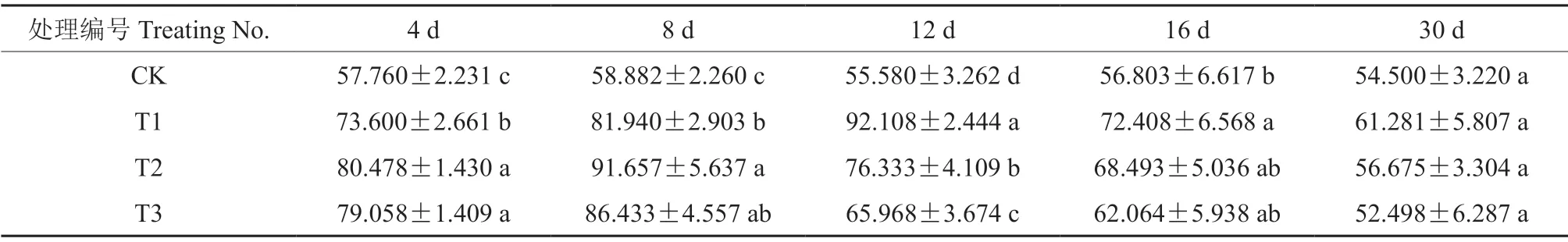
表7 干旱胁迫不同时长后‘菊花桃’幼苗叶片的SOD 活性Table 7 SOD activity of P.persica cv.Juhuatao seedling leaves after different drought stress duration U/g
胁迫4 d 后,轻度、中度和重度干旱处理下叶片SOD 活性分别显著上升了27.42%、39.33%和36.87%;胁迫8 d 后,轻度、中度和重度干旱处理下SOD 活性分别显著上升了39.16%、55.66%和46.79%;随胁迫时长的增加,轻度干旱处理下SOD 活性在胁迫12 d 后达最大值,中度和重度干旱处理下均在胁迫8 d 后达最大值,分别上升了65.72%、55.66%和46.79%;干旱胁迫30 d 后,轻度、中度和重度干旱处理下SOD 活性均降至最小值。试验初期,轻度、中度和重度干旱处理下SOD 活性呈先上升、后下降的变化趋势,胁迫4 d后,中度干旱处理下活性值最大,为80.478 U/g,重度干旱处理下次之,轻度干旱处理下值最小,为73.600 U/g;胁迫8 d 后,中度干旱处理下活性值最大,为91.657 U/g,重度干旱处理下次之,轻度干旱处理下值最小,为81.940 U/g。试验中期和后期,随胁迫程度的加强,轻度、中度和重度干旱处理下SOD 活性逐渐降低,胁迫12、16 和30 d 后SOD 活性值均为轻度干旱处理下最大,中度干旱处理下次之,重度干旱处理下最小。
由此表明:SOD 活性随胁迫时长的增加,轻度、中度和重度干旱处理下均先上升、后下降,至胁迫30 d 后均分别降至最小值;随胁迫程度的加强,试验初期,轻度、中度和重度干旱处理下SOD 活性均表现为先上升、后下降的变化趋势,试验中期和后期,重度干旱处理下SOD 活性的下降值均比轻度和中度干旱处理下的低。
3 结论与讨论
在轻度、中度和重度干旱胁迫处理下,‘菊花桃’幼苗形态、生长指标和生理指标的变化趋势:随胁迫时长的增加,试验后期的变化幅度比试验初期和中期更大;随胁迫程度的加强,重度胁迫下的变化幅度比轻度和中度胁迫下的更大。结果表明,‘菊花桃’幼苗具有较强的抗旱性。
3.1 干旱胁迫对‘菊花桃’幼苗叶片形态和幼苗生长的影响
干旱胁迫对植物可以产生各种影响,阻碍植物进行正常的生命活动[6]。随胁迫程度的加强和胁迫时长的增加,植物生长受到的抑制越显著[7]。在本试验中,‘菊花桃’幼苗的株高和地径的生长量随干旱胁迫时长增加和胁迫程度加强而出现逐渐降低的趋势,幼苗的形态也发生了相应变化。轻度干旱胁迫处理下‘菊花桃’幼苗植株形态与对照相比未表现出明显的差异;中度干旱处理下,约1/2 的叶片萎蔫卷曲,叶尖和叶缘泛黄,且叶片有少量白色斑点;重度干旱处理下,大部分叶片卷曲、枯黄,且伴有叶片掉落,叶片有大量白色斑点。中度和重度胁迫严重阻碍了植株苗高和地径的生长,这与贾瑞丰等[8]对降香黄檀和欧芷阳等[9]对蚬木幼苗的相关研究结果一致。
植物对干旱胁迫的反应是植物体生理生化变化综合作用的结果[10],植物叶片的相对含水量可以直接反映出当土壤水分不足时植物体水分的亏缺状况[11]。植物的抗旱能力通常与叶片含水量正相关[12-13]。本试验结果表明,对照‘菊花桃’幼苗叶片可以保持相对较高的含水量,叶片形态正常,并保持良好的生长,但轻度、中度和重度干旱处理下随着胁迫程度加强和胁迫时长增加,叶片相对含水量有逐渐降低的趋势,中度和重度处理下叶片出现了不同程度的萎蔫卷曲、叶片颜色变黄、白色斑点增多和叶片掉落等现象,这与贺苏华等[14]对红檵木的相关研究结果一致。说明干旱胁迫时长增加和胁迫程度加强到一定值时,因为土壤水分不足,‘菊花桃’幼苗吸水量减少,植株体内严重失水,这可能是‘菊花桃’为了维持水分平衡出现叶片卷曲等相关反应的原因。
3.2 干旱胁迫对‘菊花桃’幼苗叶片光合色素含量的影响
有研究结果表明,干旱胁迫会降低植物光合色素合成酶的活性,减少光合色素合成的量,从而使叶片中的光合色素含量降低[15]。在本试验中,干旱胁迫前期,随干旱胁迫程度的加强,‘菊花桃’幼苗叶片的叶绿素a 和叶绿素b 含量呈先上升、后下降的趋势,类胡萝卜素含量呈上升的趋势;干旱胁迫后期,光合色素含量呈下降的趋势。轻度胁迫前期,‘菊花桃’幼苗叶片的叶绿素a 和叶绿素b 含量有所上升,且含量均比对照高,这可能是干旱处理使叶片的相对含水量减少造成的;中度和重度胁迫后期,与对照相比,下降的幅度较大。这与陈雪妮等[16]对蓝莓的相关研究结果一致。由此可知,当土壤水分严重不足时,会导致植物含水量减少,光合色素合成受阻和分解加快。
3.3 干旱胁迫对‘菊花桃’幼苗叶片丙二醛含量的影响
丙二醛含量是判断植物受逆境环境伤害程度的一个重要指标[17]。在逆境中,细胞内活性氧的产生与清除失去平衡,活性氧积累,导致膜质过氧化,最终产生丙二醛。当植物的质膜系统遭到破坏,细胞内的物质将不受质膜选择透过性的控制而外渗,导致电导率发生相应变化。在本试验中,随着胁迫程度的增强和胁迫时长的增加,丙二醛含量增加,这与由佳辉等[18]对葡萄的相关研究结果相似。
3.4 干旱胁迫对‘菊花桃’幼苗叶片可溶性蛋白含量的影响
当土壤水分不足时,植物会通过积累有机溶质来维持细胞的膨压,保证细胞的渗透平衡,从而保持植物的生长[19]。在本试验中,随干旱胁迫时长的增加,‘菊花桃’幼苗叶片可溶性蛋白含量呈先上升、后下降的变化趋势,胁迫前期随干旱程度的加强呈上升趋势,胁迫后期呈下降趋势,中度和重度胁迫下下降的趋势较轻度胁迫下更为显著。这与王磊等[20]对光叶珙桐幼苗的相关研究结果相似。说明胁迫前期‘菊花桃’幼苗可以通过积累可溶性蛋白来维持细胞的膨压,使细胞水分保持平衡,后期因为干旱时长增加和胁迫程度增强,细胞失水过于严重,导致可溶性蛋白无法正常合成。
3.5 干旱胁迫对‘菊花桃’幼苗叶片保护酶活性的影响
在干旱胁迫环境中,植物体内会累积大量的活性氧,如果活性氧未被及时清除,将会出现次生氧化胁迫,从而使植物生成相应的抗氧化酶来清除积累的活性氧[21]。抗氧化酶类的活性决定其自由基清除能力,酶的活性越强,其减弱蛋白质、DNA 和脂肪酸等细胞生物大分子的损伤的效果越好[22]。本试验结果表明,轻度、中度和重度胁迫下,随胁迫时长的增加,‘菊花桃’幼苗的POD 活性和SOD 活性呈先上升、后下降的趋势,这与郑鹏丽等[23]的相关研究结果相似。由此说明,干旱处理前期‘菊花桃’幼苗可以通过POD 和SOD 的作用,使植物体内自由基维持在不产生损伤的范围内,但随着干旱处理时长增加和胁迫程度加强,POD 活性和SOD 活性降低。

