菟丝子提取液质量标准研究
胡 杨,李先芝,2,刘 洋,林 露,石 豪,毛琼丽,严 玲
(1.劲牌有限公司,湖北大冶 435112;2.中药保健食品质量与安全湖北省重点实验室,湖北大冶 435112)
菟丝子为旋花科植物南方菟丝子(Cuscuta australisR.Br.)或菟丝子(Cuscuta chinesisLam.)的干燥成熟种子,表面灰棕色至棕褐色,其味甘性平,归肝、肾、脾经,具有补益肝肾,固精缩尿,安胎,明目之功效[1]。菟丝子作为一种补益类中药,在我国有着悠久的历史。已有研究发现,菟丝子主要含有黄酮类、生物碱类、氨基酸及多糖类等有效活性成分[2-6],具有抗衰老,抗氧化,调节免疫力,改善生殖系统,预防骨质疏松[7-14]等功效,拥有很高的药用保健价值,是保健酒用原料之一。
菟丝子提取液是以菟丝子原药材为原料,以50%食用酒精为提取溶剂,经过提取、离心、过滤、浓缩等工序获取。目前对菟丝子活性成分研究已有报道[15-17],但对菟丝子提取液的质量标准研究报道鲜为少见。本文通过建立菟丝子提取液指纹图谱及其主要活性成分含量的检测,为合理评价菟丝子提取液质量提供参考。
1 材料与方法
1.1 材料、试剂及仪器
样品:10批菟丝子提取液由劲牌公司提供。
对照品:金丝桃苷(批号111521—201708 纯度95.1 %)(中国药品检定研究院),紫云英苷(批号CFN98733 纯度98%)(ChemFaces)。
试剂:甲醇、磷酸(色谱纯),95 %乙醇(分析纯),水为超纯水。
仪器设备:高效液相色谱仪(赛默飞公司,uLtiMate 3000,美国),电子分析天平(赛多利斯SQP,德国),数控超声波清洗仪(上海科导超声仪器有限公司,中国),PURELAB-超纯水仪(PURELAB classic UV,英国)。
1.2 试验方法
1.2.1 菟丝子提取液的指纹图谱
1.2.1.1 标准溶液的制备
分别取对照品金丝桃苷、紫云英苷适量,精密称定,用50%乙醇配制成每1 mL 中含有金丝桃苷90 μg、紫云英苷25 μg的对照品溶液。
1.2.1.2 菟丝子提取液的制备
菟丝子提取液是由劲牌公司生产车间规模提取。称取一定量的菟丝子药材投入提取容器中,加入8倍量的50%食用酒精,充分提取3次,每次2 h,合并提取液,对提取液进行离心分离,离心后的澄清液依次用陶瓷膜、超滤膜进行分离,最后采用纳滤膜进行浓缩,即得菟丝子提取液。
1.2.1.3 供试品溶液的制备
直接吸取菟丝子提取液过0.45 μm 微孔滤膜,过滤,即得。
1.2.1.4 色谱条件
色谱柱:Agilent ZORBAX SB-C18柱(4.6 mm×250 mm,5 μm);流动相:甲醇(A)-0.1 %磷酸水溶液(B),梯度洗脱见表1;流速:1 mL/min;柱温:30 ℃;进样量:10 μL;检测波长360 nm。在此色谱条件下记录色谱图。

表1 菟丝子提取液检测流动相洗脱程序
1.2.2 金丝桃苷、紫云英苷含量检测
1.2.2.1 色谱条件
同“1.2.1.4”项。
1.2.2.2 对照品溶液的制备
分别取对照品金丝桃苷、紫云英苷适量,精密称定,制成每毫升含有金丝桃苷595.35 μg、紫云英苷56.2275 μg的对照品溶液母液。
1.2.2.3 菟丝子提取液的制备
制备方法同“1.2.1.2”。
1.2.2.4 供试品溶液的制备
精密量取菟丝子提取液10 mL 至20 mL 的量瓶中,用50%乙醇定容至刻度线,摇匀,用0.45 μm微孔滤膜过滤,取续滤液即得。
2 结果与分析
2.1 菟丝子提取液的指纹图谱构建
2.1.1 精密度试验
取同一批次的菟丝子提取液适量(编号:S10),按照1.2.1.2 供试品溶液制备方法进行供试品溶液的制备,按照1.2.1.4 色谱条件连续进样6 次,以金丝桃苷峰为参照,记录各个共有峰的相对保留时间及相对峰面积。结果显示,9 个共有峰的相对保留时间和相对峰面积的RSD 值均小于2 %(n=6),表明仪器的精密度良好。
2.1.2 稳定性试验
取同一批次的菟丝子提取液适量(编号:S10),按照1.2.1.2 供试品溶液制备方法进行供试品溶液的制备,按照1.2.1.4 色谱条件分别在0、8 h、10 h、13 h、18 h、24 h 进样,以金丝桃苷峰为参照,记录各个共有峰的相对保留时间及相对峰面积。结果显示,9 个共有峰的相对保留时间和相对峰面积的RSD 值均小于2 %(n=6),表明菟丝子提取液在室温下放置24 h稳定性良好。
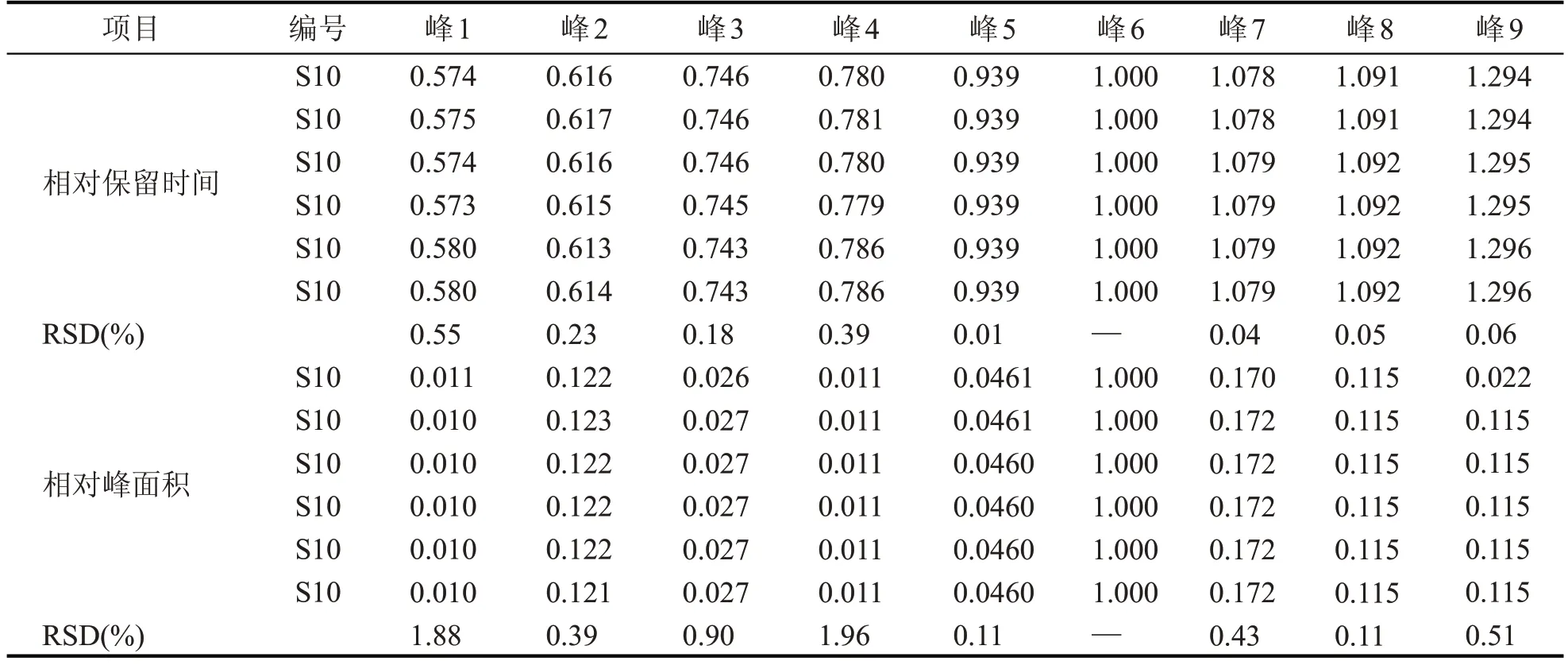
表2 菟丝子提取液中9个共有峰的相对保留时间和相对峰面积结果
2.1.3 重复性试验
取同一批次的菟丝子提取液6 份(编号:S10),按照1.2.1.2 供试品溶液制备方法进行供试品溶液的制备,按照1.2.1.4 色谱条件进行测定,以金丝桃苷峰(峰6)为参照,记录各个共有峰的相对保留时间及相对峰面积,结果见表2。9 个共有峰的相对保留时间和相对峰面积的RSD 值均小于2 %(n=6),表明此方法的重复性良好。
2.1.4 指纹图谱共有模式的生成及共有峰的确定
取10批不同批次的菟丝子提取液,按照1.2.1.2供试品溶液制备方法进行供试品溶液的制备,按照1.2.1.4色谱条件进行测定,得到10批菟丝子提取液的色谱图见图1,并对得到的样品色谱图中各色谱峰进行积分处理,得到样品叠加图见图2。通过与对照品色谱图比较,9 个色谱峰中6 号峰为金丝桃苷,7号峰为紫云英苷。
2.1.5 10批菟丝子提取液指纹图相似度评价(表3)
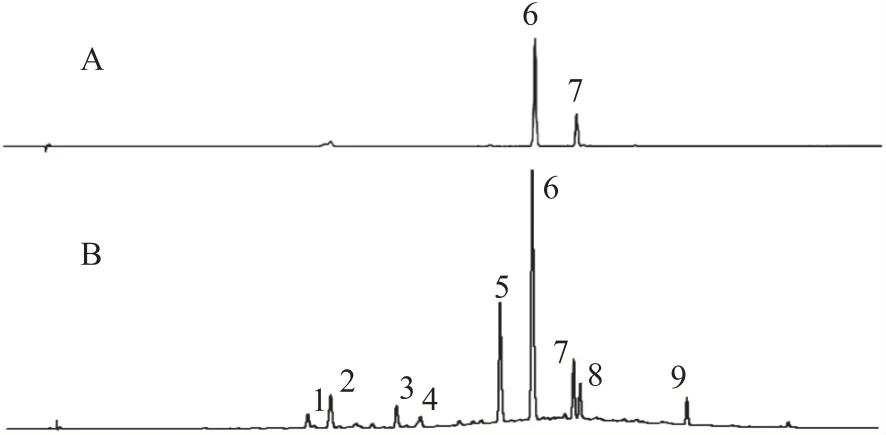
图1 混合对照品(A)色谱图与菟丝子提取液(B)指纹图谱共有模式
将10 批不同批次的菟丝子提取液高效液相指纹图谱导入中药色谱指纹图谱相似度评价系统软件,进行色谱峰匹配以及相似度的分析,并采用中位数法生成共有模式对照图谱。结果显示,10批次的菟丝子提取液样品的指纹图谱的相似度在0.95以上,说明不同批次的菟丝子提取液具有良好的一致性。
2.2 金丝桃苷、紫云英苷含量检测
2.2.1 线性关系考察
将金丝桃苷对照品溶液母液分别吸取0.2 mL、0.5 mL、1.0 mL、1.5 mL、2 mL 至10 mL 量瓶中,将紫云英苷对照品溶液母液分别吸取0.2 mL、0.5 mL、1.0 mL、1.5 mL、3 mL 至10 mL 量瓶中,制成5 个不同浓度水平的对照品混合溶液,精密吸取5 个不同浓度的对照品混合溶液10 μL,注入液相色谱,得到各浓度的各色谱峰的峰面积,以浓度为横坐标,相对应的色谱峰面积为纵坐标建立标准曲线,得出线性关系及范围。金丝桃苷线性关系回归方程Y=0.4009X+0.0386(R2=0.9999),线性范围为11.907~119.07 μg/mL;紫云英苷线性关系回归方程Y=0.3550X+0.0205(R2=1.0000),线性范围3.7485~56.2275 μg/mL。
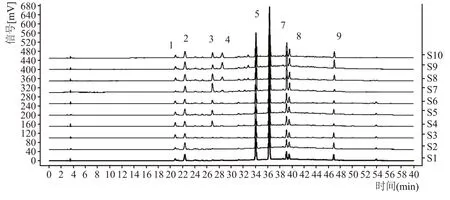
图2 10批菟丝子提取液的HPLC指纹图谱叠加图

表3 10批菟丝子提取液的HPLC指纹图谱相似度评价
2.2.2 精密度试验
取同一批次的菟丝子提取液(编号:S10),按照1.2.2.3 供试品溶液制备方法制备供试品,按1.2.2.1色谱条件进行连续进样6 次,记录峰面积。金丝桃苷、紫云英苷峰面积的RSD 分别为0.27 %、0.57 %(n=6),表明该仪器精密度良好。
2.2.3 重复性试验
取同一批次的菟丝子提取液6 份(编号:S10),按照1.2.2.3 供试品溶液制备方法制备供试品,按1.2.2.1 色谱条件进行测定,记录峰面积。结果显示,金丝桃苷、紫云英苷峰面积的RSD 为0.67 %、0.95%,表明该方法重复性良好。
2.2.4 稳定性试验
取同一批次供试品溶液(编号:S10),按1.2.2.1色谱条件分别于0、11 h、13 h、19 h、22 h、28 h进样,记录峰面积。结果显示,金丝桃苷、紫云英苷峰面积的RSD 分别为0.64%、0.57%(n=6),表明供试品溶液在室温下放置28 h稳定性良好。
2.2.5 加样回收率
精密量取已知含量的同一批次的菟丝子提取液(编号:S10)5 mL 至20 mL 量瓶中,共9 份,分别按照提取液中金丝桃苷、紫云英苷含量的50 %、100 %、150 %共3 个水平加入对照品适量,按“1.2.1.2”制备方法进行样品制备,按照1.2.2.1 色谱条件进行测定,金丝桃苷、紫云英苷加标回收率结果见表4。
由表4 可知,金丝桃苷的加标回收率范围为91.51 %~99.92 %,平均回收率为95.03 %;紫云英苷加标回收率范围为94.57 %~101.61 %,平均回收率为98.81%,RSD值分别为3.72%、3.20%。
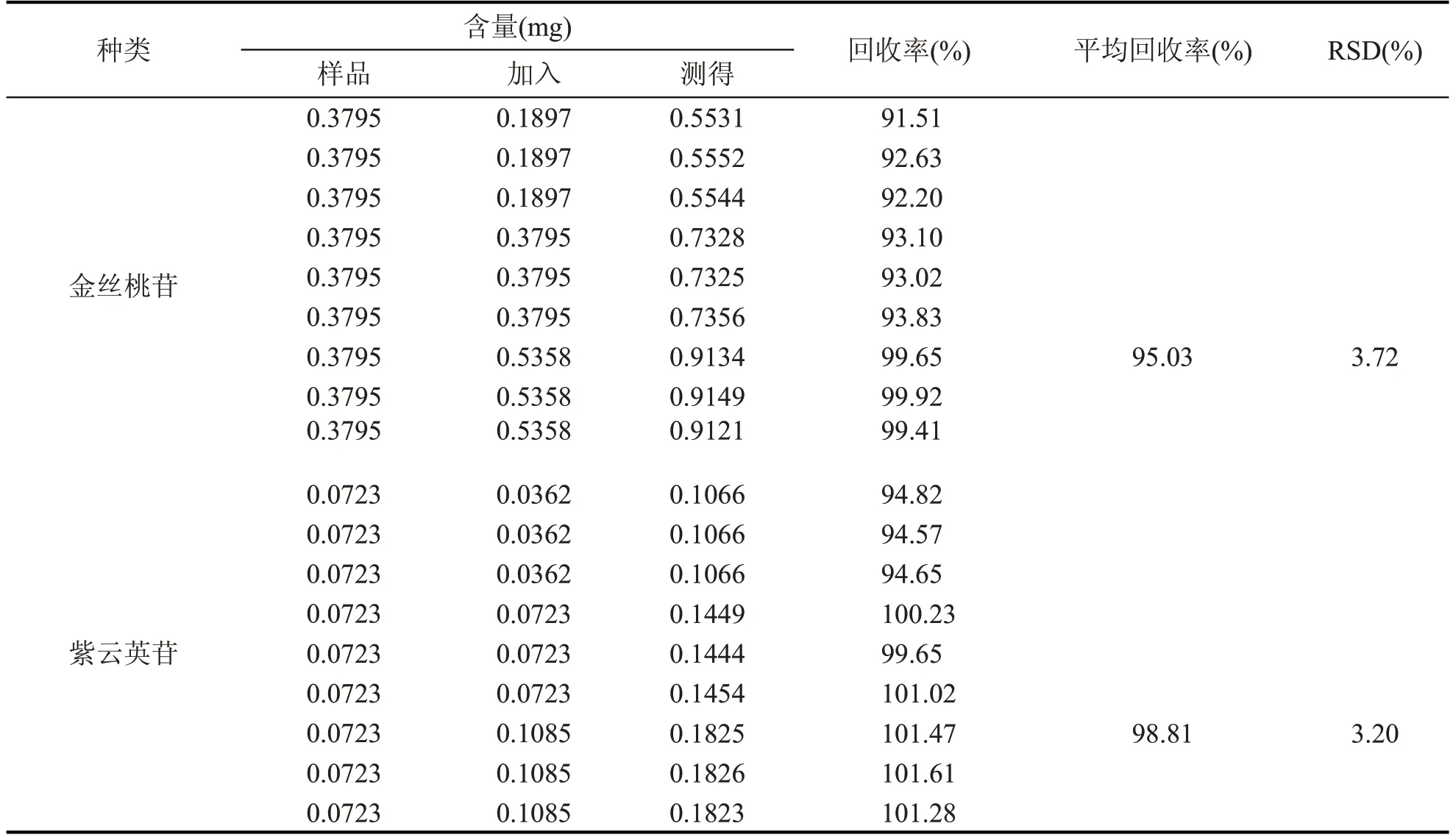
表4 菟丝子提取液中金丝桃苷、紫云英苷的加标回收率(n=9)
2.2.6 含量测定
精密吸取对照品溶液10 μL,菟丝子提取液供试品溶液10 μL,按照1.2.2.1 色谱条件测定,带入线性方程计算金丝桃苷及紫云英苷的含量,见表5。
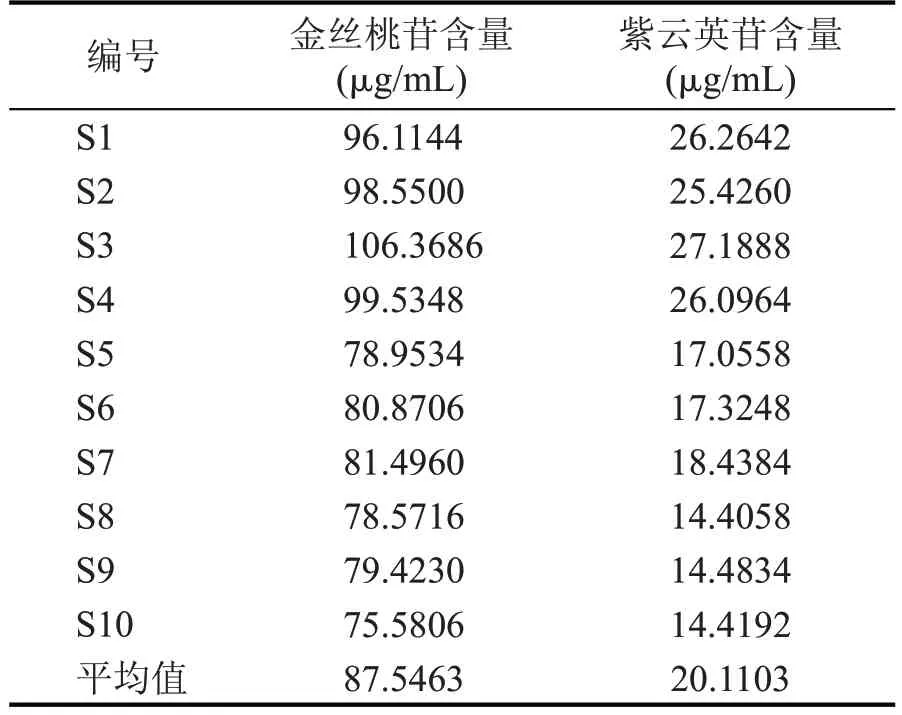
表5 10批菟丝子提取液检测结果
由表5 可知,10 批菟丝子提取液中金丝桃苷含量范围为75.5806~106.3686 μg/mL,平均含量为87.5463 μg/mL,紫云英苷含量范围为14.4058~27.1888 μg/mL,平均含量为20.1103 μg/mL。在这10 批菟丝子提取液中金丝桃苷与紫云英苷含量存在着差异,可能造成的原因为药材本身的差异性。张燕丽等[3]研究了不同产地菟丝子中6 种主要活性成分含量,其中内蒙古地区种植的菟丝子中金丝桃苷和紫云英苷的含量最高。
3 讨论
在预实验中,对金丝桃苷、紫云英苷对照品在190~400 nm 范围内进行全波长扫描,发现金丝桃苷、紫云英苷在360 nm 处均有较大的吸收峰,且在此波长下各成分之间的干扰较小,基线平稳,故选择360 nm作为检测波长。
本文通过HPLC 法研究了菟丝子提取液指纹图谱及金丝桃苷、紫云英苷2 种活性成分的含量,研究结果显示,10批菟丝子提取液指纹图谱相似度高于0.95,表明这10批菟丝子提取液具有良好的一致性,其中金丝桃苷平均含量为87.5463 μg/mL,紫云英苷平均含量为20.1103 μg/mL,加标回收率在91.51%~101.61%之间,RSD 值在3.20%~3.72%之间,表明该方法准确度高,稳定性好,能够很好的用于菟丝子提取液指纹图谱及金丝桃苷、紫云英苷的含量测定,为菟丝子提取液的质量评价提供参考依据。

