脉管Ⅱ号胶囊对大鼠后肢缺血后血管再生的影响及其机制
王世军, 杨尾莲, 陈福伟, 张美吉, 杨 旭
(福建中医药大学附属人民医院外科,福建 福州 350004)
外周动脉疾病是缺血性卒中和糖尿病等主要大血管并发症之一,是动脉粥样硬化的一种表现形式,其发病率在世界范围内呈上升趋势,对患者生活质量产生严重影响[1-2]。随着外周血管粥样硬化情况逐渐加重,下肢的血液供应减少,严重者将导致血管闭塞,最终形成下肢缺血导致的坏疽、足部溃疡、甚至截肢等严重后果[3-4]。治疗外周动脉疾病的药物较少,研究[5-6]表明:虽然溶栓治疗可提高肢体存活率,但易导致颅内出血症等并发症。血管生成素1(angiopoietin-1,Ang-1)是血管成熟和抗炎的重要成分,对缺血动物模型血管生成具有重要作用[7]。血管生成标志物,如血管内皮生长因子、血管生成素(angiopoietin,Ang)及酪氨酸激酶受体2(tyrosine kinase receptors 2,Tie2) 可能是评估外周动脉疾病患者死亡率的标记物[8]。
脉管Ⅱ号胶囊是福建省著名老中医郑则敏主任的家传验方,由君药赤芍、牡丹皮清热凉血,活血化瘀,臣药水蛭、莪术破血逐淤,佐使药全蝎、蜈蚣解毒散结,通络止痛,共奏清热活血和化瘀通脉之功效[9]。前期研究[10]显示:脉管Ⅱ号胶囊可通过调控Ang-1/Tie2 信号通路表达促进血管生成。临床数据亦显示脉管Ⅱ号胶囊对下肢动脉硬化闭塞症具有较好的治疗效果[11]。因此,为了探讨脉管Ⅱ号胶囊是否通过调控Ang-1/Tie2 信号通路作用于外周动脉疾病,本研究通过构建大鼠后肢缺血模型,经脉管Ⅱ号胶囊治疗后,检测大鼠肌肉组织血管再生以及Ang-1/Tie2表达变化,以期为脉管Ⅱ号胶囊治疗外周动脉疾病提供一定的数据资料。
1 材料与方法
1.1 实验动物、药物、主要试剂和仪器60 只SPF级雌性SD 大鼠,3 月龄,体质量(254±22)g,实验动物生产许可证号:SCXK(鄂)2015-0018,购于湖北省疾病预防控制中心。饲养环境室温控制在23 ℃左右,湿度60%左右,自然光源,标准饲养,自由饮水1 周,适应环境。脉管Ⅱ号胶囊(福建中医药大学,闽药制字:Z06106040),主要成分:全蝎、水蛭、延胡索和玄参等;复方丹参(广州白云山制药厂,批号:D18A034)。Tie-2 兔抗(美国abcam 公司,货号:AB227219);Ang-1 兔抗(中国BIOSWAMP 公司,货号:PAB31570);3-磷酸甘 油 醛 脱 氢 酶 (glyceraldehyde-3-phosphate dehydrogenase, GAPDH) 兔 抗 ( 中 国BIOSWAMP 公司,货号:PAB36264)。石蜡切片机(徕卡纤维系统有限公司,型号:RM2235),电泳仪(上海天能科技有限公司,型号:EPS300),全自动化学发光分析仪(上海天能科技有限公司,型号:Tanon-5200)。
1.2 造模和分组参考陈兵等[12]大鼠慢性后肢缺血模型的造模方法进行造模。将大鼠分为正常对照组、 模型组、 假手术组、阳性对照组(0.202 5 g·kg-1复方丹参)、低剂量脉管Ⅱ号胶囊组(30 mg·kg-1)和高剂量脉管Ⅱ号胶囊组(90 mg·kg-1),每组10 只。模型制备:大鼠腹腔内注射1%戊巴比妥钠30 mg·kg-1,麻醉成功后,固定大鼠呈仰卧位,腹股沟区备皮常规消毒,纵行切开一后肢正中皮肤,分离出股动脉,范围从腹股沟韧带直至膝关节,用7-0 丝线结扎股动脉及其于股部的所有分支,大鼠的另一后肢仅分离股动静脉而不结扎,5-0 丝线缝合皮肤。假手术组大鼠仅分离股动静脉而不结扎,5-0 丝线缝合皮肤。手术结束后将大鼠置于37 ℃孵箱中直到麻醉苏醒,再将动物转移回饲养笼。
造模后,连续观察后肢皮肤颜色变化及闭塞缺血情况。后肢皮肤颜色呈现紫色,后肢行动受阻,后肢行动受阻的标准[13]如下:0 级,后肢完全瘫痪,刺激肌肉时未产生任何收缩反应,记为5 分;1 级,肌肉收到刺激后有轻微的收缩,后肢有小动作,记为4 分;2 级,后肢能作运动,但肌力差,不能克服重力,不能抬起脚掌,记为3 分;3 级,肌肉可抗阻力,后肢能正常运动,部分时间可抬起脚掌,记为2 分;4 级,肌力较好,跛行,记为1 分;5 级,能正常行走,记为0 分。且分数达到2 分及以上表示造模成功。低和高脉管Ⅱ号胶囊组大鼠分别给予15 和45 mg·kg-1脉管Ⅱ号胶囊,灌胃体积10 mL·kg-1,每日灌胃2 次[10]。正常对照组大鼠给予等体积生理盐水;阳性对照组大鼠每天给予复方丹参片0.202 5 g·kg-1[14]。观察大鼠每天的状态,观察大鼠趾甲的变化以及两侧后肢皮肤颜色和闭塞缺血情况。检测大鼠后肢的温度差。两后肢温度差=假手术后肢温度—缺血造模后肢的温度。
1.3 HE 染色观察大鼠后肢肌肉组织病理形态表现将大鼠后肢肌肉组织经过脱水,包埋于蜡块中,以5 μm 的厚度均匀切片。将苏木精加入蒸馏水内加温溶解,冷却后加入酒精和甘油,备用。石蜡切片脱蜡至水,用苏木精液染核7 min,置于容器中,流水冲洗2 h。以1% 的盐酸酒精溶液分化3 s,用伊红染液染色5~10 min。用95%酒精、无水酒精和二甲苯透明,中性树胶封固。显微镜下观察大鼠后肢肌肉组织病理形态表现。
1.4 免疫组织化学检测大鼠肌肉组织中Ang-1 和Tie2 阳性表达细胞数组织玻片脱蜡后用柠檬酸钠缓冲液进行抗原修复,玻片置于500 mL 的柠檬酸钠缓冲液(0.01 mol·L-1,pH 6.0)中,微波炉加热沸腾10 min,冷却至室温,磷酸盐缓冲液(phosphate buffer solution,PBS) 洗涤3 次,每次5 min,H2O2灭活内源性过氧化氢酶15 min,PBS缓冲液冲洗,加0.2%Triton X-100 通透10 min,滴加10%山羊血清封闭,室温孵育20 min,然后滴加Ang-1(稀释比例1∶100)和Tie2(稀释比例1∶100)抗体,阴性对照滴加PBS 缓冲液,4 ℃过夜,PBS 缓冲液洗涤3 次,每次5 min,滴加Ang-1和Tie2 二抗试剂,室温孵育20 min,PBS 缓冲液洗涤3 次,每次5 min,滴加DAB 显色,镜下观察,当目的蛋白显色发生变化时,立即浸泡在去离子水中,终止反应。然后进行核染。苏木精溶液中染色4 min,去离子水浸泡1 min。于显微镜下观察细胞核的颜色,若染色过深,在分化液中浸3 s,去离子水洗涤5 min。促蓝1 s,去离子水浸泡1 min。再于电子显微镜下观察细胞核的颜色;如果细胞核的颜色过浅,可再用苏木精复染,直至染出理想的颜色。核染以后,在室温晾干片子,浸二甲苯透明,中性树胶封片。将玻片晾干,在显微镜下拍片。正常组织细胞核呈蓝色,阳性表达细胞主要为黄色或棕黄色,分析阳性区域平均光密度(average optical density,AOD)值,得出阳性表达细胞数。
1.5 免疫组织化学检测大鼠微血管密度免疫组织化学检测过程同“1.4”,CD31兔抗稀释比1∶100。显微镜下观察切片染色结果,细胞核呈蓝色,CD31 阳性表达细胞被染成棕色或棕黄色,是微血管形成的特征。通过CD31 阳性表达细胞数进而分析AOD 以评价微血管密度。
1.6 Western blotting 法检测大鼠肌肉组织中Ang-1 和Tie2 蛋白表达水平提取后肢肌肉组织蛋白并定量,取25 μg 处理好的蛋白,60 V 预电泳30 min;100 V 电泳1 h,转膜缓冲液中100 V 转膜30 min, TBS封闭液封闭1 h, 兔 抗Ang-1(1∶1 000) 和Tie2 抗体(1∶2 000) 4 ℃过夜后,分别加入二抗室温孵育1 h,ECL 发光显色,以GAPDH 为内参,对显影条带进行灰度分析,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参GAPDH 条带灰度值。
1.7 统计学分析采用SPSS 17.0 统计学软件进行统计分析。各组大鼠后肢温度差、肌肉组织中Ang-1 和Tie2 阳性表达细胞数、微血管密度及Ang-1 和Tie2 蛋白表达水平均呈正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠一般情况大鼠手术侧后肢皮肤温度偏低,皮肤呈现暗红色,后肢体出现紫绀和趾甲脱落等现象发生。正常对照组(0.02 ℃±0.08 ℃)和假手术组(-0.01 ℃±0.10 ℃) 大鼠两后肢温度差较低;模型组(2.76 ℃±0.13 ℃) 大鼠两后肢温度差明显高于假手术组(P<0.05),即模型组大鼠缺血后肢温度降低比较明显。阳性对照组(0.56 ℃±0.20 ℃)、低剂量脉管Ⅱ号胶囊组(1.05 ℃±0.49 ℃) 和高剂量脉管Ⅱ号胶囊组(0.67 ℃±0.27 ℃)大鼠后肢温度差明显降低(P<0.05),即缺血后肢温度回升。
2.2 各组大鼠后肢肌肉组织病理形态表现正常对照组和假手术组大鼠显示正常横纹肌结构;模型组大鼠后肢肌肉组织呈现染色不均,细胞肿胀明显,横纹消失,部分细胞核染色深、密集,并出现肌束膜内肌原纤维萎缩;低和高剂量脉管Ⅱ号胶囊组大鼠以上情况有所缓解。见图1。
2.3 各组大鼠肌肉组织中Ang-1 和Tie2 阳性表达细胞数免疫组织化学染色结果显示:正常对照组和假手术组大鼠肌肉组织中Ang-1 和Tie2 阳性表达细胞较少,Ang-1 和Tie2 阳性表达细胞数差异无统计学意义(P>0.05);与假手术组比较,模型组大鼠肌肉组织中Ang-1 和Tie2 阳性表达细胞数明显减少(P<0.05);与模型组比较,阳性对照组和高剂量脉管Ⅱ号胶囊组大鼠组织中Ang-1 和Tie2 阳性表达细胞数明显升高(P<0.05)。见图2、图3和表1。
2.4 各组大鼠微血管密度与正常对照组(0.31±0.05) 比较,假手术组(0.30±0.06) 大鼠微血管密度差异无统计学意义(P>0.05);与假手术组比较,模型组(0.20±0.08)大鼠微血管密度明显降低(P<0.05);与模型组比较,阳性对照组(0.31±0.02) 和高剂量脉管Ⅱ号胶囊组(0.33±0.04) 大鼠微血管密度均明显升高(P<0.05)。与模型组比较,低剂量脉管Ⅱ号胶囊组(0.25±0.07)大鼠微血管密度也有升高,但差异无统计学意义(P>0.05)。见图4。
2.5 各组大鼠肌肉组织中Ang-1 和Tie2 蛋白表达水平与正常对照组比较,假手术组大鼠肌肉组织中Ang-1 和Tie2 蛋白表达水平差异无统计学意义(P>0.05);与假手术组比较,模型组大鼠肌肉组织中Ang-1 和Tie2 蛋白表达水平明显降低(P<0.05);与模型组比较,阳性对照组和高剂量脉管Ⅱ号胶囊组大鼠肌肉组织中Ang-1 和Tie2 蛋白表达水平均明显升高(P<0.05)。见图5 和表2。
表1 免疫组织化学染色观察各组大鼠肌肉组织中Ang-1 和Tie2 阳性表达细胞数Tab. 1 Number of cells with positive expressions of Ang-1 and Tie2 in muscle tissue of rats in various groups observed by immunohistochemistry staining (n=10,±s)
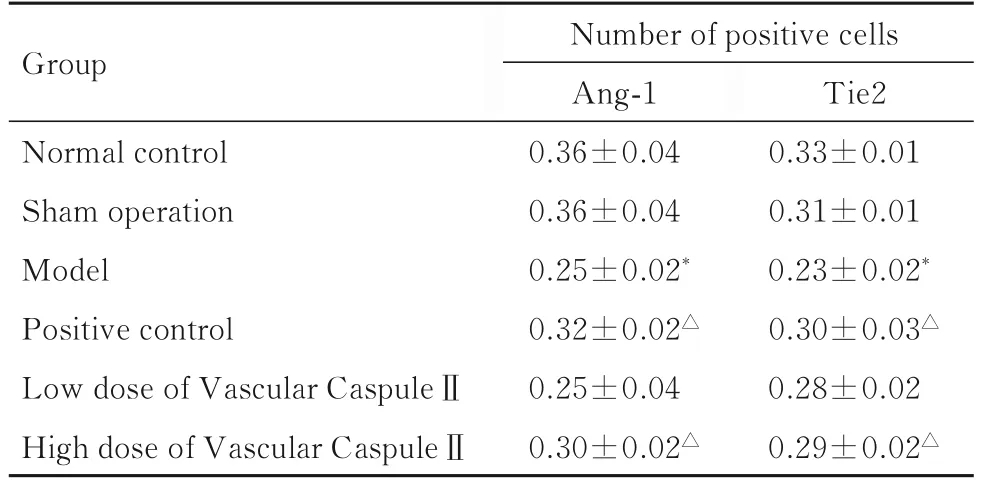
表1 免疫组织化学染色观察各组大鼠肌肉组织中Ang-1 和Tie2 阳性表达细胞数Tab. 1 Number of cells with positive expressions of Ang-1 and Tie2 in muscle tissue of rats in various groups observed by immunohistochemistry staining (n=10,±s)
*P<0.01 vs sham operation group;△P<0.05 vs model group.
Group Number of positive cells Ang-1 0.36±0.04 0.36±0.04 0.25±0.02*0.32±0.02△0.25±0.04 0.30±0.02△Normal control Sham operation Model Positive control Low dose of Vascular CaspuleⅡHigh dose of Vascular CaspuleⅡTie2 0.33±0.01 0.31±0.01 0.23±0.02*0.30±0.03△0.28±0.02 0.29±0.02△
3 讨 论
外周动脉疾病导致动脉狭窄或闭塞,组织和器官则会出现血供应不足,处于缺血状态,机体会生成代偿性的侧支血管,这种现象称为生理性的血管新生[15]。结扎或切断股动脉及其分支是目前最普遍应用的后肢缺血模型的制备方法[16],邹伟等[17]采用左下肢股动脉结扎并切断股动脉构建小鼠下肢缺血模型,小鼠出现左下肢无法站立、足部出现严重发黑和坏死情况及趾甲发黑等缺血症状。本研究采用股动脉结扎术建模发现:大鼠下肢动脉缺血后,出现手术侧后肢皮肤温度偏低、皮肤颜色暗红、肢体紫绀和趾甲脱落等现象,证明模型建立成功。
血管生成过程受多种信号通路调控,Ang-1 及其特异性受体Tie2 是最重要的血管生成信号通路之一。Ang/Tie2 信号通路可作用于血管内皮细胞和周细胞以及血管平滑肌细胞,从而促进血管的新生和重塑[18]。Ang-1 作为一种内皮特异性保护因子,通过激活内皮细胞表达的Tie2 促进血管完整性,有利于促血管生成[19]。Ang-1 与受体Tie2 相结合并活化,发生自身磷酸化后被激活,才可发挥相应的生物学效应[20-21]。微血管密度是直接反映侧支血管循环最可靠的指标,CD31 作为内皮细胞标志物,其表达可反映微血管密度[22]。研究[23]显示:在糖尿病后肢缺血大鼠缺血区域附近的肌肉组织中Ang-1 以及血管内皮生长因子的表达明显下降。在局灶性脑缺血大鼠的缺血组织中,上调Ang-1/Tie2 表达可促进血管再生[24]。本研究结果显示:经过脉管Ⅱ号胶囊治疗后,大鼠后肢肌束间有产生微血管的趋势,且Ang-1 和Tie2 蛋白表达水平明显升高,提示脉管Ⅱ号胶囊可能是通激活Ang-1/Tie2 信号通路,促进缺血组织的血管再生能力,增加微血管的形成。
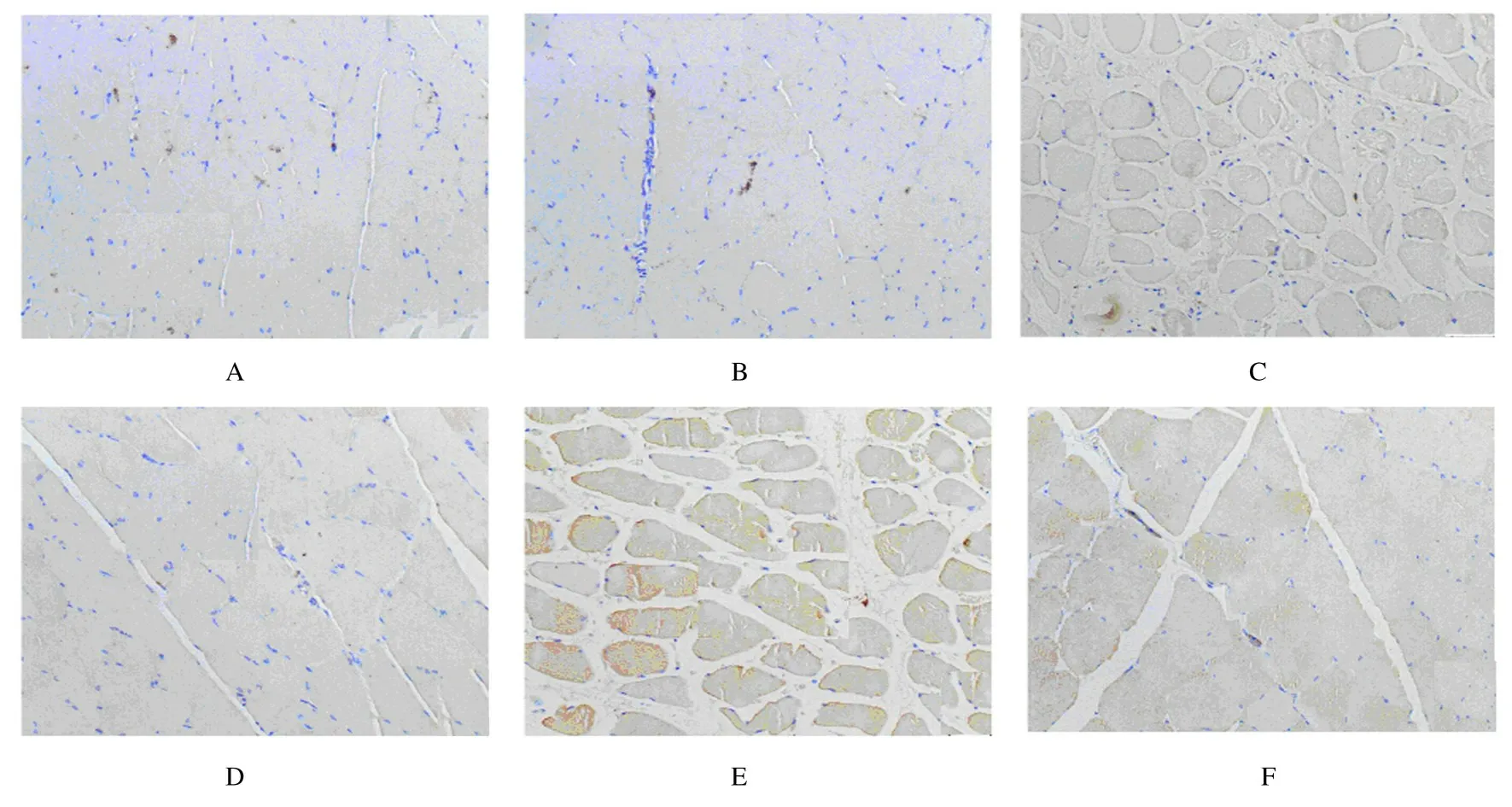
图4 免疫组织化学染色观察各组大鼠肌肉组织微血管密度(×200)Fig.4 Microvessel densities of muscle tissue of rats in various groups observed by immunohistochemistry staining(×200)
表2 Western blotting 法检测各组大鼠肌肉组织中Ang-1 和Tie2 蛋白表达电泳图Tab. 2 Electrophoregram of expressions of Ang-1 and Tie2 in muscle tissue of rats in various groups detected by Western blotting method (n=10,±s)
*P<0.01 vs sham operation group;△P<0.05 vs model group.
Group A value Ang-1 1.00±0.10 0.96±0.14 0.39±0.11*0.75±0.09△0.51±0.06△0.72±0.09△Normal control Sham operation Model Positive control Low dose of Vascular CaspuleⅡHigh dose of Vascular CaspuleⅡTie2 1.00±0.05 0.94±0.05 0.38±0.05*0.78±0.06△0.53±0.09△0.73±0.08△
综上所述,脉管Ⅱ号胶囊对下肢动脉缺血症状产生一定的缓解作用,可能是通过激活Ang-1/Tie2 信号通路、促进血管再生成。结合前期研究[9-11]结果,提示脉管Ⅱ号胶囊对下肢缺血具有一定的治疗效果,应进行更深入全面的研究,进而为外周动脉疾病的新药研发提供更多的理论基础。

