禽腺病毒血清4型贵州流行株分离及其致病性分析
李乔斌,张云丹,何玲,岳筠,尹德晶,文明,2,程振涛,2*
(1.贵州大学动物科学学院,贵州 贵阳 550025;2.贵州省动物疫病与兽医公共卫生重点实验室,贵州 贵阳 550025;3.贵州省动物疫病预防控制中心,贵州 贵阳 550008)
禽腺病毒(fowl adenovirus,FAdV)属于腺病毒科禽腺病毒属,分为Ⅰ、Ⅱ和Ⅲ群。Ⅰ群禽腺病毒分为5个种(A、B、C、D和E种),12个血清型[1]。Ⅰ群禽腺病毒感染病例主要表现为包涵体肝炎(IBH)和鸡心包积液综合征(hydropericardium syndrome,HPS)[2]。安卡拉病(AD)即鸡心包积液综合征是由Ⅰ群禽腺病毒C种血清4型(FAdV-4)引起,其主要临床症状为心包积液和包涵体肝炎[3],因其于1987年在巴基斯坦安卡拉地区首先报道而得名。目前HPS在世界很多国家地区暴发,包括北爱尔兰、美国、加拿大、日本、匈牙利、秘鲁、印度、西班牙、中国等[4-6]。我国自2012年,HPS的临床病例在全国范围内开始增加,2015年在全国大范围暴发,病原被确定为FAdV-4[7]。2016年7月贵州某肉鸡场发生一起急性传染病,主要引起3~6周龄鸡群发病[8],病死鸡心包积液呈现稻草色胶状,多数病例呈现肝炎和肾炎,死亡率达到30%至90%[9],怀疑为FAdV-4感染所致。研究资料表明,各地鸡心包积液综合征病原毒株存在不同程度的变异,而毒株的差异也带来致病性的差异。本文开展了FAdV-4贵州株的分离鉴定以及动物感染试验,并对其培养特性和致病性进行探究,为明确FAdV-4在贵州省的流行情况和开展防控研究奠定基础。
1 材料与方法
1.1 病料、试验动物和细胞
FAdV-4核酸阳性鸡肝脏组织样本,采自贵州毕节地区某肉鸡养殖场;SPF鸡胚购自山东益吉达生物科技有限公司;鸡肝癌细胞系(LMH)由贵州大学动物科学学院重点实验室提供。FAdV-4 疫苗株,由贵州福斯特生物有限公司提供。
1.2 主要试剂
DMEM细胞培养基、胎牛血清,购自Gibco公司;鼠抗鸡IgG-FITC,购自武汉金开瑞生物工程有限公司;FAdV-4阳性血清,购自贵州福斯特生物有限公司;病毒DNA提取试剂盒、DL 2000 DNA Maker、2×TaqPCR Mix均购自TaKaRa公司。
1.3 引物设计与合成
参照FAdV-4全基因序列(GU188428),以Hexon为靶基因,选择其保守序列片段,应用Primer Pemier 5.0软件设计合成1对普通引物FAdV-4F/R,1对real time荧光引物(FAdV-4F1/R1)和1条探针(FAdV-4-T),在探针的5′端标记荧光报告基团(FAM),在探针的3′端标记非荧光淬灭基团(BHQ),以上探针和引物均由生工生物工程(上海)有限公司合成。

表1 引物信息
1.4 病毒分离培养及PCR检测
将FAdV-4核酸阳性鸡肝脏样本加入PBS磨碎,冻融3次,12 000 r/min、4 ℃离心7 min。取上清液过滤除菌,滤液作为接种样本,接种于LMH细胞在37 ℃、5% CO2恒温培养,每24 h观察的细胞病变(CPE),同时设好阴性对照。待85%细胞培养到出现CPE,收集病变细胞的培养物,8 000 r/min 4 ℃离心15 min后,取上清接种LMH细胞传代,传5代后,取24 h、48 h、72 h细胞培养物,分别提总DNA,用引物FAdV-4-F/R PCR检测FAdV-4。
1.5 间接免疫荧光试验(IFA)检测
按照0.2 mL/孔接种5代细胞培养物,同时设置未接种培养物的细胞作为空白对照,在37 ℃、5% CO2培养48 h。细胞培养物经戊二醛固定后,加入5% BSA封闭1 h,以FAdV-4阳性血清(1∶50)为一抗,鼠抗鸡IgG-FITC(1∶500)为二抗,经IFA检测确定是否感染FAdV-4。
1.6 分离病毒细胞培养物的电镜观察
参照文献[10]方法,收集5代细胞培养物,1 200 r/min、4 ℃离心10 min后弃上清,加入细胞固定液制作切片,然后经磷钨酸负染后,进行电镜观察。
1.7 动物感染试验
1.7.1 纯化分离病毒及TCID50测定
准备LMH细胞,按照每孔100 μL/孔加入96孔细胞培养板中,待细胞铺满75%细胞培养板时,用DMEM培养基把病毒液进行10倍梯度进行稀释(从10-1至10-11),将稀释后的病毒接种LMH细胞,每孔50 μL,每个稀释度重复8孔,观察CPE至72 h,按照Reed-Muench法计算病毒的TCID50;将所测病毒液用聚乙二醇(PEG)沉淀法进行病毒纯化,-80 ℃保存备用。
1.7.2 鸡胚感染试验
对7日龄的SPF鸡胚进行注射1.7.1所纯化的病毒液(0.2 mL/胚),37 ℃培养120 h后无菌收集鸡绒毛尿囊膜,盲传3代,解剖鸡胚并观察病理变化;提取鸡绒毛尿囊膜的DNA样本,应用引物(FAdV-4-F/R)进行PCR检测,同时设置正常鸡胚对照。
1.7.3 雏鸡感染试验
将1日龄的SPF鸡胚分成感染组和对照组,每组10只,接种方式为肌肉注射,感染组接种已纯化的病毒液,0.2 mL/只,对照组接种ddH2O,0.2 mL/只。每天观察各组鸡群临床表现,随机采集5只病死或人工处死鸡的心脏、心包积液、肝脏、肺脏、脾脏和肾脏等样本,研磨处理后,提取各组织样本DNA,按照文献[11]所建立的实时荧光定量PCR(qPCR)检测方法进行检测。以引物FAdV-4F1/R1和探针FAdV-4-T经qPCR检测各组织样品中的 FAdV-4。20 μL qPCR反应体系(Premix ExTaq10 μL,DNA 模板2 μL,FAdV-4 F1/R1 各1 μL,FAdV-4-T 1 μL,ddH2O 补足至20 μL。)反应程序为:95 ℃预变性30 s;95 ℃ 10 s,58 ℃ 20 s,40个循环。
2 结果
2.1 病毒分离培养与PCR检测
将FAdV-4核酸阳性肝脏样本匀浆滤液接种于LMH细胞,同时设正常细胞对照,结果可见肝脏样本接种LMH细胞后于72 h出现CPE,而正常细胞无CPE,见图1。
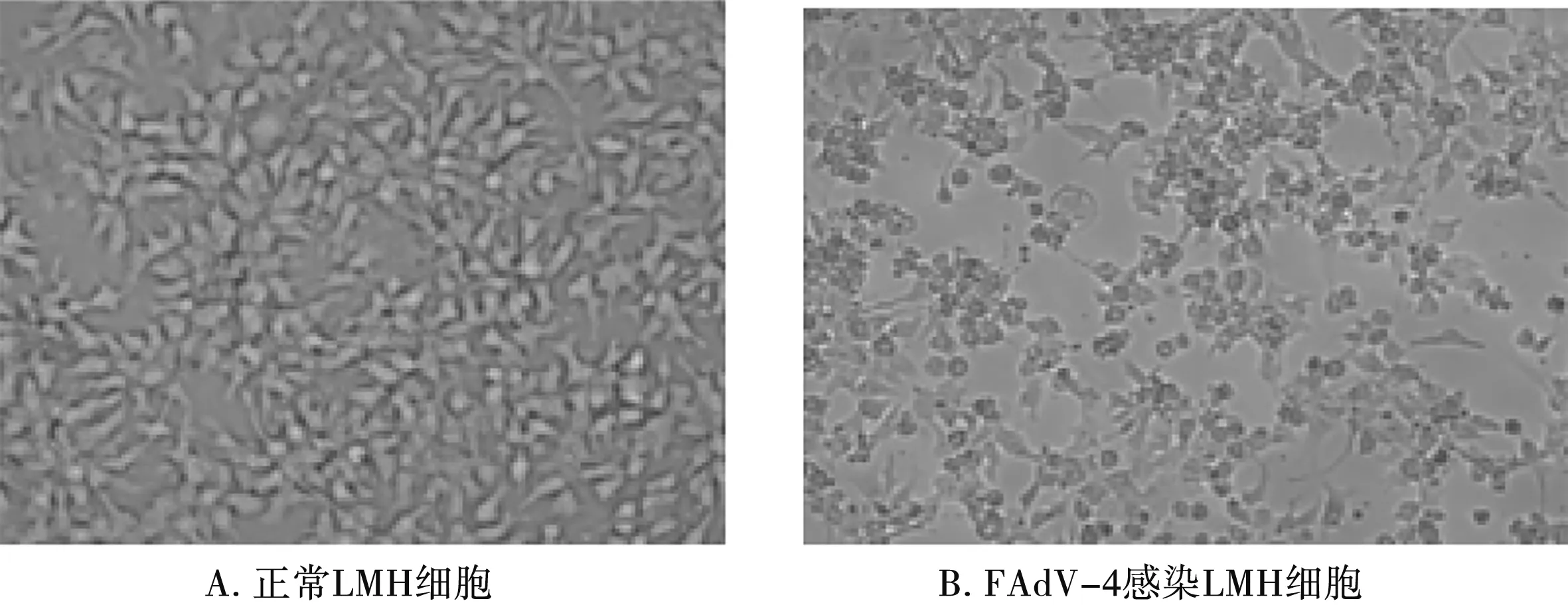
图1 LMH细胞病变情况
将FAdV-4感染LMH细胞培养物盲传5代后,取24 h、48 h、72 h细胞培养物提取DNA进行PCR检测。结果显示,FAdV-4分离株第5代24 h、48 h、72 h培养物均能扩增出295 bp目的基因条带,而正常细胞对照无条带扩增(图2)。上述结果表明,细胞培养物中存在FAdV-4。

M.DL 2000 DNA Marker;+.FAdV-4疫苗毒株;-.去离子水对照;1~3.感染FAdV-4 24 h、48 h、72 h细胞培养物;4~6.24 h、48 h、72 h正常细胞图2 细胞培养物中FAdV-4 PCR检测结果
2.2 分离病毒的IFA检测
对FAdV-4感染后细胞进行间接免疫荧光试验,同时设置空白对照(正常细胞)。试验结果见图3。FAdV-4感染的细胞观察到绿色荧光(图3A),而空白对照组无绿色荧光(图3B)。结果表明,感染细胞48 h的培养物中存在FAdV-4,从抗原水平上进一步证实感染细胞中FAdV-4的存在。
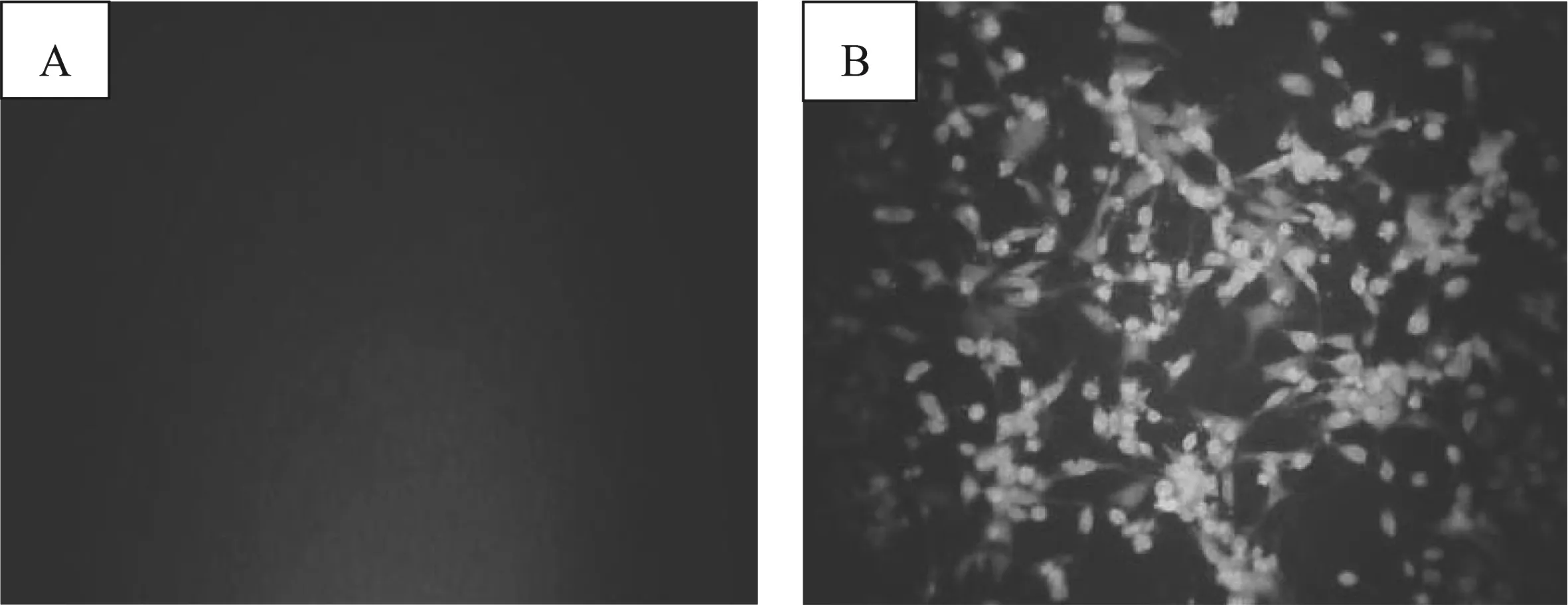
A.正常细胞;B.FAdV-4感染细胞图3 间接免疫荧光检测结果(400×)
2.3 分离病毒的电镜观察
将感染FAdV-4的第5代细胞培养物制作切片,加入细胞固定液,然后经磷钨酸负染后,进行电镜观察,结果见图4。在电镜下可以明显的观察到病毒粒子呈球形、无囊膜、直径70~90 nm,呈晶状体布列,具有禽腺病毒典型的二十面体对称结构。而正常细胞对照无特定病毒粒子结构存在。表明用FAdV-4核酸阳性肝脏样本接种LMH细胞后,细胞中存在FAdV-4病毒粒子。
通过对肝脏样本接种细胞进行FAdV-4 PCR、IFA和电镜检测,证实从采集自贵州毕节某养殖场的FAdV-4核酸阳性肝脏样本中分离获得FAdV-4,命名为FAdV-4-GZJS。

A.正常LMH细胞;B.FAdV-4感染LMH细胞图4 FAdV-4病毒粒子电镜观察(20 000×)
2.4 动物感染试验
2.4.1 纯化FAdV-4的TCID50测定
将接种LMH细胞的FAdV-4病毒液进行纯化过后,10倍梯度稀释(从10-1至10-11),每个梯度重复8孔,观察CPE至72 h,按照Reed-Muench法计算病毒的滴度为1×107TCID50/mL。
2.4.2 鸡胚感染试验
将所纯化病毒液接种SPF鸡胚,盲传3代,可以观察到3代鸡胚都没有死亡。解剖第3代感染鸡胚和空白对照组(未感染鸡胚),检察鸡胚各组织病理变化结果显示,感染组鸡胚发育不良,胚体蜷缩矮小,鸡胚绒毛尿囊膜呈灰白色,而对照组鸡胚发育正常。表明FAdV-4感染SPF鸡胚能导致鸡胚发育异常,但对鸡胚致死性不强。收集接毒后连续传3代的鸡胚绒毛尿囊膜,提取病毒DNA进行PCR扩增,结果显示阳性(图5)

M.DL 2000 DNA Marker;+.FAdV-4细胞培养物;-.正常鸡绒毛尿囊膜;1~3.FAdV-4接种1~3代鸡绒毛尿囊膜图5 SPF鸡胚绒毛尿囊膜FAdV-4 PCR检测
2.4.3 雏鸡感染性试验
对1日龄雏鸡进行肌肉注射FAdV-4病毒液(0.2 mL/只),感染剂量为0.2×107/mL,感染后前2 d未出现明显症状,第3天开始,雏鸡表现沉郁、羽毛呈束、甩鼻、排黄色稀粪等症状。第4天雏鸡有死亡现象,其剖检主要病变可见心肌柔软、心包内有大量黄色透明液体;肝脏肿大、呈黄色、并且伴有出血点;其他组织器官均有不同程度的水肿;空白对照组(未攻毒雏鸡)剖检组织器官无异常。结果表明,雏鸡易感染FAdV-4,有很强的感染风险,其病理变化均呈现FAdV-4典型致病特征。
采集感染鸡组织样本,应用qPCR方法对FAdV-4含量进行检测。结果显示,感染雏鸡肝脏样本中FAdV-4含量最高,其次是心包积液,心脏组织中也存在较高病毒含量,而脾脏、肺脏和肾脏中FAdV-4病毒含量低或检测不出;正常对照组雏鸡均未检测到FAdV-4病毒核酸(图6)。结果表明,FAdV-4主要侵害感染雏鸡肝脏、心脏组织,对其他组织脏器侵害程度低。

+.FAdV-4细胞培养物;-.正常雏鸡肝脏;1~2.肝脏;3~4.心包积液;5~6.心脏;7~8.脾脏;9~10.肺脏;11~12.肾脏图6 组织样本FAdV-4核酸qPCR检测
3 讨论
近年来,HPS在国内流行范围持续扩大,河南、山东、河北、安徽、湖北、贵州等省份都有报道[12],造成经济损失较大。各地报道致病性和毒株特征不尽相同,河北秦皇岛地区分离到的毒株为禽腺病毒C群,其临床病例均有典型症状,死亡率大约在20%~80%,4株分离株与标准株对比进行生物信息学分析,均有不同ORF区域缺失碱基[13]。辽宁地区临床疑似禽腺病毒感染鸡肝脏进行病毒分离,确定分离毒为FAdV-4,和国内毒株对比,penton、Fiber1、Fiber2基因核苷酸序列均有不同碱基突变[14]。研究资料表明,各地鸡HPS病原毒株存在不同程度的变异,而毒株的差异也带来致病性的差异。因此,本研究基于贵州省本地病例,开展FAdV-4毒株的分离与鉴定,将有助于研究FAdV-4贵州株变异情况、致病特征和致病机理。
Ⅰ群禽腺病毒增殖最好的宿主是鸡胚,但禽腺病毒Ⅱ、Ⅲ群均难在鸡胚中病毒增殖[15]。目前关于禽腺病毒的分离培养技术有鸡胚分离培养、细胞分离培养和动物分离培养[16]。本试验对FAdV-4分离株的鸡胚感染性试验证实,该病毒可在鸡胚中增殖,但并不完全致鸡胚死亡,这与梁广成等[17]的报道相同。FAdV-4也可以在细胞中进行培养,但是不同的细胞对其增殖效果不同,LMH、鸡胚成纤维细胞(CEF)、鸡胚肾细胞(CEK)等都可以对此病毒进行分离培养[18]。本试验应用LMH细胞培养FAdV-4,显示FAdV-4能在LMH细胞中增殖且引起明显CPE,与陈天骜[19]用CEF、CEK增殖和分离FAdV-4相比具有一定优势,病毒增殖快,分离纯度高。罗思思等[20]在LMH细胞中增殖且引起明显CPE,也表明LMH细胞对FAdV-4的培养分离更具有优势。FAdV-4能够在禽类细胞组织中进行增殖,并导致感染动物出现典型的临床症状[21]。本试验分离获得FAdV-4贵州株感染雏鸡,能引起感染鸡出现死亡,且表现典型的心包积液和肝炎病理变化。
病毒的鉴定方法主要通过细胞病变效应(CPE)观察、病原核酸检测、中和试验、间接免疫荧光技术、电镜观察等,分别从病原核酸、病原抗原蛋白、病毒致病性、病毒形态等多方面验证病毒粒子的存在和基本特征[22]。本试验CPE观察、病毒粒子电镜观察、病原核酸检测和免疫荧光检测结果均提示,已成功从临床疑似病例组织中分离获得FAdV-4毒株,且该分离毒株能在SPF鸡胚和雏鸡中感染增殖,能引起雏鸡死亡并出现典型的心包积液和肝炎的症状。雏鸡组织样本FAdV-4核酸定量检测也间接反映,病毒对心脏和肝脏的侵袭性较其他脏器强,这与病例表现的临床症状相吻合。研究结果为FAdV-4致病机制和疾病防治研究奠定基础。

