血浆循环核酸应用于肝细胞癌诊断与预后评价的初步探索
王 瑨,柳俨哲,陈 况,钱自亮,胡明根
解放军总医院第一医学中心 肝胆外科,北京 100853
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一[1]。肝切除术仍然是HCC患者的重要治疗选择。遗憾的是肝癌患者接受根治性切除后的5年生存率约为50%,以往报道的5年复发率高达70% ~ 80%[2]。通过术后病理检查确诊的微血管浸润(microvascular invasion,MVI)与肿瘤的病理进展相关,是HCC患者预后不良的重要因素。如果能在术前预测MVI,可以为术式选择以及药物治疗方案提供参考依据[3]。已有许多报道基于影像学和实验室检查结果建立预测术前MVI的模型[4],其中影像学方法的主观因素影响较大[5],不利于普及,而现有的实验室检查普遍特异性不高[6],因此没有得到推广。循环核酸(circulating free DNA,cfDNA)是指循环血中游离于细胞外的部分降解的机体内源性DNA[7]。在肿瘤快速增殖过程中,死亡并裂解的肿瘤细胞会释放出细胞内的肿瘤基因组DNA片段,这些片段进入人体的血液循环系统,被称为循环游离肿瘤DNA(circulating tumor DNA,ctDNA)[8]。ctDNA由于来源于癌细胞,所以发生基因变异、缺失、畸形的概率大大增加,且ctDNA的变异程度与肿瘤亚型、肿瘤进程相关。正因如此,肿瘤患者的cfDNA因为包含了ctDNA,呈现出高度的染色体不稳定性[9]。目前已经有研究表明cfDNA检测可用于HCC的早期诊断,相对于甲胎蛋白有更高的特异性[10]。然而,cfDNA与HCC患者肿瘤进程的相关性尚未见报道。本课题旨在研究术前cfDNA变异程度与肝癌患者MVI风险的关系,为HCC患者的治疗方案评估提供新的参考。
资料和方法
1 研究对象 选取解放军总医院第一医学中心肝胆外二科2019年3 - 10月收治的肝占位患者61例。纳入标准:1)确诊为肝占位;2)行根治性手术治疗(肝切除术或射频消融术);3)术后病理诊断为肝细胞肝癌、肝血管瘤、肝局灶性结节增生。排除标准:1)肝占位非主要入院诊断;2)未进 行根治性手术治疗;3)年龄<18岁或>80岁;4)合并妊娠;5)严重合并发症,包括终末期肺病,不稳定型冠心病或充血性心力衰竭3 ~ 4级,慢性肾病4 ~ 5期,肝硬化(Child-Pugh)2 ~ 3级;6)免疫缺陷;7)数据记录不完整。最终49例患者纳入本研究。解放军总医院第一医学中心伦理委员会批准了本研究(伦审第S2018-250-01号)。所有 招募的受试者均签署了书面知情同意书。
2 研究方法 收集患者基线资料(包括年龄、性别、身高、体质量、入院时间、手术时间、出院时间、诊断和基础疾病等)、术前实验室检查指标(生化、肿瘤标志物、乙肝五项,乙肝病毒DNA计数,CTC)、术后病理报告等。采集患者术前血样,并对术后病理报告为肝细胞肝癌(43例)和良性病变(6例)的患者进行血浆cfDNA提取、测序以及染色体不稳定性分析。所有患者术后随访至2 020年7月30日。 。
3 微血管浸润 微血管侵犯,也称微血管癌栓,主要指肝癌组织在显微镜下于内皮细胞衬覆的血管腔内见癌细胞巢团。本研究MVI结果采集自患者术后的病理报告。M0为未发现 MVI;M1为少于或等于5 个 MVI,且发生于近癌旁肝组织区域(≤1 cm);M2为多于5 个 MVI,或 MVI 发生于远癌 旁肝组织区域(>1 cm)。
4 超灵敏染色体非整倍体检测cfDNA染色体不稳定性分析[11]用QIAseq cfDNA提取试剂盒(QIGEN)从血浆中提取cfDNA。执行下一代测序。将DNA片段化为300 bp(ctDNA无片段化),然后用100 ng的片段化基因组DNA(cfDNA 10 ng)制备测序文库(NEBNext Ultra II)。将8 bp条形码测序接头与DNA片段连接后进行PCR扩增[12]。用Illumina X10进行分析,应用R包DNACopy中的循环二进制分割(CBS)算法寻找有意义的基因组断裂点和拷贝数变化的基因组片段,分析拷贝数变化。为每个样本收集了至少1 000万个成对的读数。这些读数被定位到人类参考基因组hg19。然后使用软件Samtools mpileup计算基因组每个200 k数据集的平均覆盖率。使用公式1对所有数据集的平均覆盖率进行归一化:

最后利用公式2将全基因组与人类参考基因组对比的变异程度,总结为染色体不稳定分数( CIN分数)。∑

5 统计学方法 应用SPSS17.0和R软件3.4.3版。计量资料以 x¯±s (正态分布)或Md(IQR)(非正态分布)表示,分类变量资料使用例数和百分比表示。计量资料组间比较采用方差分析或秩检验,分类变量采用χ2检验或Fisher’s精确检验。运用受试者工作特征(ROC)计算曲线下面积(AUC)及95% CI评估各项指标预测MVI的价值,并计算敏感度、特异性、阳性预测值和阴性预测值。运用Kaplan-Meier乘积限法建立生存曲线模型,组间生存率比较为log-rank检验。P<0.05为差异有统计学 意义。
结 果
1 患者一般及临床资料 本研究共纳入49例患者。43例HCC患者中男性38例,女性5例,平均年龄58岁。6例良性肿瘤患者中男性1例,女性5例,平均年龄58岁,病理类型包括坏死性结节、梅毒树胶肿、上皮样肿瘤、胆管囊腺瘤以及肝 局灶性结节样增生。
2 49例肝肿瘤患者染色体不稳定性及其评分 如图1所示,相较于良性病变患者,HCC患者的血浆样本中有显著的染色体拷贝数变异。染色体1q、6p和8q的获得频率较高。染色体4q和10q经常丢失。如图2A所示,对患者的CIN评分进行log10转换后,HCC患者的CIN评分高于良性病变患者,差异有统计学意义(3.152±0.421 vs 2.282±0.099,P<0.05)。如图2B所示,当染色体不稳定性评分取值788.8时,可以预测62.8%的恶性肿瘤,特异性为100%,曲线下面积达到最大值0 .748,是用于预测恶性肿瘤的最佳取值。
3 HCC患者一般情况与CIN评分的关系 CIN评分 ≥ 788.8与肿瘤大小、甲胎蛋白水平有关,而与性别、年龄、乙肝病毒拷贝数、肿瘤计数无关(表1)。43例肝癌患者中有3例(6.98%,95%CI:2.40% ~ 18.6%)CTC筛查阳性,27例(62.8%,95% CI:47.9% ~ 75.6%)CIN评分 ≥ 788.8。CTC筛 选HCC患者的阳性率低于CIN评分(P<0.05)。

图 1 染色体拷贝数变异覆盖率图示(A:HCC患者;B:良性肿瘤患者)Fig.1 Chromosome copy number coverage chart (A: HCC patients; B: Benign tumor patients)

图 2 49例患者的染色体不稳定性评分及ROC曲线A:HCC患者及良性肿瘤患者CIN评分比较;B:CIN评分为788.8时预测HCC的能力Fig.2 . Results of CIN scores and ROC curves in 49 patients A: Comparison of CIN score between the HCC patients and the benign tumor patients; B: Ability to predict HCC with CIN score of 788.8

图 3 CIN评分与微血管侵犯的相关性A:不同MVI程度患者以及良性肿瘤患者CIN平均值;B:CIN评分≥1 679.5预测MVI;C:CIN评分≥1 679.5预测MVI 2Fig.3 Correlation between CIN scores and MVI A: Mean CIN of patients with different degrees of MVI and benign tumors; B: CIN score ≥ 1 679.5 in predicton of MVI; C: CIN score≥ 1 679.5 in predicton of MVI 2

表 1 HCC患者各项临床指标与CIN评分的关系(n)Tab. 1 Relationship between clinical indicators and CIN score in the HCC patients (n)
4 CIN评分与微血管侵犯的关系 如图3A所示,随着疾病进展,肝细胞癌患者血浆CIN评分升高。良性病变、不同程度的MVI(M0、M1、M2)患者的CIN评分平均值分别为643、1 218、2 314、3 487。HCC患者中,MVI阳性组的血浆CIN评分明显高于MVI阴性组(P<0.05)。如图3C所示,当CIN评分取值为1 697.5时,可得最大曲线下面积0.772。此时预测MVI阳性的敏感度为76.9%,特异性为86.7%,而甲胎蛋白的曲线下面积为0.646(图3B)。血浆CIN评分预测MVI=2的敏感度为100%,特异性为86.7%。曲线下面积为0.908,而甲胎蛋白的曲线下面积为0.758(图3C)。如表2所示,CIN评分可作为预测MVI的参数(OR=2.09,95%CI:1.27~3.76,P=0.007)。甲胎蛋白和碱性磷酸酶预测MVI的OR值分别为1.17 (95% CI:0.99~1.39,P=0.075)和1.02 (95%CI:1.00~1.05,P=0.066),P值接近0.05。其他指标包括血浆胆红素、白蛋白、天冬氨酸氨基转移酶、丙氨酸氨基转移酶、γ-谷氨酰转移酶、HBV DNA拷贝数、主要病灶大小、患者年龄和性别均无 统计学差异。
5 CIN评分与术后复发的关系 截至2020年7月30日,7例(16.3%)患者术后复发,无病生存期分别为41 d、74 d、132 d、163 d、169 d、188 d和208 d(图4A)。其中5例患者CIN评分较高(≥1 679.5),1例 患 者CIN筛 查 阳 性(≥ 788.8)。CIN评分较高(≥ 1 679.5)的患者与其他患者相比,无病生存率较低(log-rank检验:P<0.05,图4B)。14例cfDNA CIN评分较高(≥ 1 697.5)的患者中有5例在随访期内复发(35.7%,95% CI:16.3~61.2%)。而cfDNA CIN评分较低者(<1 697.5)仅有2例 复 发(5.71%,95% CI:1.58~18.6%)。CIN升高不仅预测MVI,还可预测复发(图4,H R=5.71,95% CI:2.47~13.2,P=0.019)。
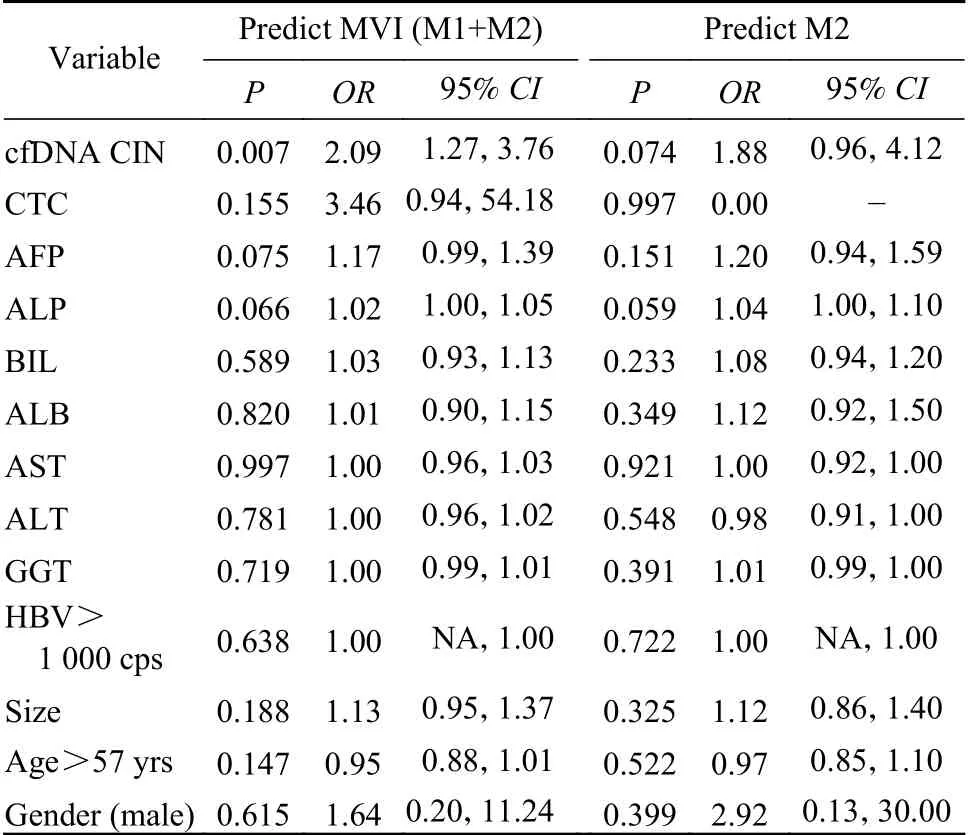
表 2 各项检查指标与MVI的关系Tab. 2 Relationship between each index and MVI

图 4 CIN高评分(≥ 1 679.5)与术后复发的相关性A:HCC患者的CIN评分与术后随访,其中黑色线代表CIN高评分,蓝色系代表CIN低评分,红色线代表肿瘤复发,绿色线代表未复发;B:HCC患者术后无病生存曲线,红色代表CIN低评分,蓝色代表CIN高评分Fig.4 Correlation between CIN ≥ 1 679.5 and postoperative recurrence A: CIN score and postoperative follow-up of HCC patients,in which the black line represents the CIN high score, the blue line represents the CIN low score, the red line represents tumor recurrence, and the green line represents no recurrence;B: Postoperative disease-free survival curve for HCC patients,with red representing low CIN score and blue representing high CIN score
讨 论
本研究首次提出以cfDNA的染色体不稳定性评分作为指标在术前预测MVI,血浆CIN评分预测MVI阳性的敏感度为76.9%,特异性为86.7%,预测MVI=2的敏感度为100%,特异性为86.7%。这种高效的检测方法为医生提供了一个更好的术前预测患者MVI的工具,并且根据初步的随访结页码 电子书="21" 纸书="15"/>果,cfDNA的染色体不稳定性与患者的不良预后相关,这提示其可作为一个预后指标,对术后患者是否选择积极使用经导管动脉栓塞化疗术(transcatheter arterial chemoembolization,TACE)、靶向药物等治疗提供参考。
肝细胞肝癌患者肿瘤的数量、大小、位置、血管侵犯和肝功能是评估患者病情和制订治疗方案的重要标准[13]。近年的研究表明,MVI也是HCC患者术前选择治疗方案的重要参数。对于BCLC分期极早期的患者,建立有效预测MVI的模型有助于协助临床决断是否使用扩大手术边界的肝切除方式,以及采用视频消融治疗是否合理。对于BCLC进展期的患者,术前预测为低MVI风险的患者选择积极的手术治疗较TACE可获得更好的生存获益[14]。
由于MVI对于HCC患者选择治疗方案具有指导意义,而MVI只有在术后对切除的标本进行显微镜检查后才能被诊断出来。所以目前有多项研究试图通过术前的影像学和液体活检对患者的MVI进行预测。
在影像学方面,Chou等[15]将肿瘤的CT检查结果分为3种亚型:1)规则的单结节型;2)向周围组织凸起生长的单结节型;3)多结节融合型。其应用该分型对HCC患者进行了前瞻性研究。结果表明,后两种亚型与MVI存在明显相关性,并且预测MVI的敏感度为81.7%,特异性为88.1%。Huang等[16]对HCC患者术前Gd-EOB-DTPA动态增强MRI进行回顾性分析,发现肿瘤直径较大、肿瘤边缘不规则和动脉中期肿瘤周围增强是MVI的预测因素。此预测模型的敏感度和特异性分别为52.9%和93.0%。虽然肿瘤的影像学特征能够用于术前预测MVI,但如何界定这些影像学特征主要依赖医生的主观判断,缺乏客观量化的指标,这导致这些研究成果存在争议,难以普及[17]。
在液体活检方面,You等[18]通过回顾性研究提出AFP>400 µg/L、肿瘤直径>3.1 cm、脾功能亢进与MVI独立相关,且预测模型的敏感度为75.6%,特异性为75.3%。Zhu等[19]构建了ALP与淋巴细胞比例(ALP-to-lymphocyte ratio,ALR)的预测模型,ALR预测MVI的敏感度和特异性分别为76.0%和76.4%。另外还有研究表明血清GGT、淋巴细胞与单核细胞比例、衍生的中性粒细胞与淋巴细胞比例与MVI有相关性[20-21]。
对于目前已存在的术前预测MVI的方法,cfDNA的染色体不稳定性评分作为液体活检较影像学检查更具有普及性。本研究中,cfDNA的染色体不稳定性评分预测MVI阳性的敏感度为76.9%,特异性为86.7%(以优化的临界值1 697.5为标准),优于现有的液体活检检测模型。
目前射频消融广泛用于治疗早期肝细胞肝癌患者,相对于肝切除手术,射频消融治疗对患者的损伤更小,有报道指出对于2~5 cm的单发病灶,射频消融与手术切除的预后基本相同[22],但也有研究指出,对于有高危复发因素的患者,无论其肿瘤大小,都应该优先考虑解剖性切除而不是射频消融[23]。对于CIN评分较高(≥ 1 697.5)能够在术前有效的预测MVI风险的患者,解剖性切除可能是更安全的治疗方法。
根据现有随访数据得出的cfDNA的染色体不稳定性评分与术后早期复发的相关性值得深入研究,cfDNA的染色体不稳定性评分预测MVI高危组M2的敏感度为100%,特异性为86.7%,这提示MVI与肿瘤的细胞学进展密切相关,高危组的患者具有更高的复发风险,cfDNA的染色体不稳定性评分能够更好地筛选出这些患者,制订个性化的术后治疗方案,及早联合使用免疫治疗、靶向药物治疗、TACE治疗等辅助治疗方法,以期降低术后复发率,延长生存时间,使患者受益[24]。
本研究存在一定的局限性。首先,本项研究纳入的病例数较少,且来自单个研究中心,数据有其固有的缺陷,本医院作为高级别大型三甲医院,许多患者在当地医院无法切除后来我院治疗,所以病例存在手术难度较大的情况,这也是本组患者的术后复发率为16.3%的主要原因。后期研究应设计更好的前瞻性多中心研究,以进一步评估cfDNA预测HCC患者是否有MVI的作用。其次,cfDNA阳性患者与cfDNA阴性患者的长期预后是否也如短期预后一样呈现差异性,有待进一步随访和研究。
综上所述,我们的研究首次证明cfDNA是预测HCC患者MVI风险的一种可行且简单的方法。这种新的方法的优点是敏感度较高、可靠和且兼具诊断和预后预测功能,可以在术前较为准确地预测MVI。我们的研究结果证明基因和染色体变化与肝癌患者的MVI风险相关。

