西藏牦牛源枯草芽孢杆菌的分离培养及鉴定
谢晓佩,王 琦,孔新平,吴庆侠*,董海龙,李家奎,曾江勇
(1.西藏农牧学院 动物科学学院,西藏 林芝 860000;2.西藏自治区农科院 畜牧兽医研究所,西藏 拉萨 850000)
近年来,益生菌(Probiotics)制剂受到了众多关注并获得了广泛的研制及应用,以避免使用抗生素带来的DNA污染、细菌耐药性、甚至超级细菌等危害。2001年世界卫生组织(WHO)和世界粮农组织(FAO)将益生菌定义为摄入一定数量后对宿主健康有益的活菌[1]。益生菌具有改善动物胃肠道平衡、促进动物生长、提高饲料利用率、增进动物健康、改善畜产品品质和养殖环境等作用[2]。由于饲料加工贮藏运输过程中需要对菌体进行灭活处理,所以提高益生菌制品的稳定性很重要。芽孢菌因特殊的结构决定了其特殊的物理性质,抗逆性强,存活率高,易生长,是无毒、无残留、无污染的绿色添加剂。枯草芽孢杆菌作为饲料添加剂的两种芽孢杆菌之一,具有广阔的发展前景和巨大的生态效益和社会效益[3]。牦牛生长环境特殊,牦牛用益生菌最好分离自健康牦牛[4]。本试验采集西藏林芝健康牦牛的新鲜粪便,分离并筛选出具备较好耐受性的牦牛源枯草芽孢杆菌,为牦牛专用益生菌制剂的研发提供参考。
1 材料与方法
1.1 试验设备与试剂
Milli-O○RAdvantage A10○R超纯水系统-超纯水机,高压灭菌锅,恒温恒湿培养箱(购自上海博讯实业有限公司),生化培养箱,恒温水浴锅,磁力搅拌器(购自金坛市盛蓝仪器制造有限公司),超净工作台(购自江苏苏静集团),离心机(购自美国Thermo公司),摇床(购自河南兄弟仪器设备有限公司),显微镜(购自日本OLYMPUS公司),梯度PCR仪(购自日本TAKARA公司),电泳仪,凝胶成像系统(购自杭州朗基科学仪器有限公司)等。
MRS培养基,LB培养基,普通营养肉汤(NB)培养基,麦康凯培养基,各浓度酒精,3%双氧水,牛肉膏,Kovac氏试剂,琼脂糖,细菌基因组DNA提取试剂盒(离心柱型),二甲苯等由西藏农牧学院兽医楼提供。快速革兰氏染色液,芽孢染色液,细菌药敏纸片,糖类生化反应管,明胶液化培养基,猪胆盐,硫化氢微量发酵管,Simmons枸橼酸盐等由杭州滨和微生物试剂有限公司提供。通用引物由武汉擎科创新生物有限公司提供。
1.2 样品的采集和处理
适量采取健康牦牛的新鲜粪便,分装加入到经灭菌冷却后的营养肉汤培养基中,置于摇床中37 ℃预培养15 min,然后经80 ℃水浴处理15 min,每5 min震荡摇匀一次[5-6],可初步筛选过滤掉部分杂菌。然后于离心机中以4 000 r/min的转速离心15 min,吸取上层液体,接种于营养肉汤培养基,于摇床中37 ℃倒置培养24 h。
1.3 枯草芽孢杆菌的分离
用移液枪吸取适量营养肉汤培养基中的培养物,用接种针分别涂布于选择培养基、MRS琼脂培养基、LB营养琼脂培养基,进行划线分离培养,于恒温培养箱37 ℃培养24 h。挑选在培养基上形态疑似枯草芽孢杆菌的单菌落,涂片,染色,显微镜观察。经多次分离培养,得出牦牛源枯草芽孢杆菌在选择培养基上的生长状况最好。之后从选择培养基上挑取疑似枯草芽孢杆菌的单个菌落,多次接种于选择培养基上划线分离,纯化培养。
1.4 枯草芽孢杆菌的增菌培养
经纯化培养和多次涂片染色镜检后,挑取选择培养基上疑似枯草芽孢杆菌的单菌落接种于营养肉汤培养基、选择液体培养基、MRS液体培养基、LB液体培养基中进行增菌培养。经多次培养,得出枯草芽孢杆菌在营养肉汤培养基上的生长状况最好。之后显微镜观察细菌形态,确定液体培养物为纯培养物,不含杂菌。
1.5 枯草芽孢杆菌的鉴定
1.5.1 形态学鉴定 做细菌抹片,分别采用革兰氏染色、孔雀石绿染色、芽孢染色,置油镜观察。
1.5.2 生化鉴定 根据《兽医微生物学实验指导》实验七“细菌的生化试验”对分离细菌进行常规的生理生化鉴定[7]。(1)糖类分解试验:用移液枪吸取枯草芽孢杆菌的24 h纯液体培养物,分别接种至葡萄糖、麦芽糖、蔗糖、乳糖、半乳糖、甘露糖、甘露醇、蕈糖、菊糖等糖类生化反应管中,37 ℃培养24 h。(2) 吲哚试验:以接种环将选择培养基上枯草芽孢杆菌的纯培养物接种于灭菌处理后的Dunham氏蛋白胨水溶液中,37 ℃培养48 h,向培养液中加入2~3 mL二甲苯,摇匀,静置片刻,然后沿试管壁加人2 mL Kovac氏试剂。(3) VP试验:取枯草芽孢杆菌的24 h纯培养物,用无菌接种环接种于葡萄糖蛋白胨水培养基中,于37 ℃培养48~72 h。取出后在培养液中先加0.6 mLVP试剂甲液,再加乙液0.2 mL,充分混匀。放在试管架上,静置15 min后培养液呈红色者为阳性,不变色为阴性。(4)枸橼酸盐利用试验:取适量枯草芽孢杆菌的24 h纯液体培养物,用移液枪接种至枸橼酸盐生化管中,37 ℃培养48 h。(5)硫化氢试验:用移液枪吸取适量枯草芽孢杆菌的24 h纯液体培养物,接种至硫化氢生化管中,37 ℃培养24 h。(6)过氧化氢酶试验:用接种环勾取枯草芽孢杆菌的单一菌落,置于干净的玻片中央,加一滴3%双氧水于菌落上,立即观察有无气泡出现。(7)脲酶试验:用移液枪吸取适量枯草芽孢杆菌的24 h纯液体培养物,接种至尿素生化管中,37 ℃培养24 h。(8)淀粉水解试验:将枯草芽孢杆菌划线接种于3%可溶性淀粉琼脂平板上,37 ℃培养24 h。取出平板,在菌落处滴加少许碘液,观察滴加碘液处的培养基颜色是否变蓝。(9)硝酸盐还原试验:用移液枪吸取适量枯草芽孢杆菌的24 h纯液体培养物,接种至硝酸盐(还原)生化管中,37℃培养24 h。再分别滴加3~5滴VP甲液和VP乙液,若30 s内出现红色即为阳性。若不变红,加入少量的锌渣然后变红的为阴性。(10)明胶液化试验:取枯草芽孢杆菌的纯培养物,用接种针或接种环穿刺接种于明胶培养基中,22 ℃培养24 h。观察培养基的液化状态,观察时,将其倒置,然后用手指轻轻弹动玻管,观察是否有液体流动,有则为阳性,无则为阴性。
1.5.3 分子鉴定 (1)提取DNA:按照细菌基因组DNA提取试剂盒(TIANamp Bacteria DNA Kit)(离心柱型)说明书操作。(2)PCR扩增:枯草芽孢杆菌的16s rRNA 扩增引物采用通用引物,正向引物为27F:5'-AGAGTTTGATCCTGGCTCAG-3',反向引物为1492R:5'-GGTTACCTTGTTACGACTT-3'[8]。PCR反应体系(50 μL):2×Es Taq MasterMix(Dye), 25 μL;Forward Primer,10 um,2 μL;Reverse Primer,10 um,2 μL;Template DNA,2 μL;双蒸水(ddH2O),19 μL。以提取的DNA为模板,按以上PCR反应体系依次加入模板DNA和其他试剂,置于PCR仪中开始扩增。扩增条件为:预变性,94 ℃,2 min;变性,94 ℃,30 s;退火,55~65 ℃,30 s;延伸,72 ℃,30 s;25~35个循环;终延伸,72 ℃,2 min[9]。PCR反应产物用琼脂糖凝胶电泳检测。(3)分子检测:将以上试验所得的疑似枯草芽孢杆菌送由生工生物工程(武汉)股份有限公司进行16s rRNA测序。(4)16s rRNA系统发育树的构建及同源性分析:将所测得的16s rRNA序列用NCBI中的BLAST网站与GenBank数据库进行同源性分析,运用MEGA 4 软件进行序列同源性分析并制作系统发育树[10]。
1.6 细菌的保存
配置50%浓度的甘油,高温高压灭菌后,按50%甘油:菌液为1:1的比例充分混合,先置于-20 ℃冰箱24 h,然后置于-80 ℃冰箱保存[11]。
1.7 枯草芽孢杆菌的筛选
1.7.1 牦牛源枯草芽孢杆菌的抑菌试验 对复苏的4株牦牛源枯草芽孢杆菌的12 h培养物进行3 500 r/min离心5 min。将指示菌大肠埃希菌(血清型为O111)、金黄色葡萄球菌(ATCC29213)复苏,指示菌菌液浓度稀释至1 cfu/L。分别取已稀释好的大肠埃希菌(血清型为O111)菌液0.4 mL和金黄色葡萄球菌菌液0.4 mL,用灭菌的三角环均匀涂布在NA培养基上,用镊子取出已被灭菌的牛津杯,轻轻放在已涂布过大肠杆菌O111菌液和金黄色葡萄球菌菌液的NA培养基上,每个培养基上放4只牛津杯,注意4只牛津杯的分布位置要均匀。然后将其放入4 ℃冰箱中,30 min后取出。分别吸取0. 25 mL离心后的Yak-KC1,Yak-KC5,Yak-KC6,Yak-KC7的上清液,然后分别注入4个牛津杯中,先将其放入4 ℃冰箱扩散24 h,然后接着将其放入37℃恒温培养箱中培养24 h,观察有无抑菌圈产生,用游标卡尺精准测量抑菌圈直径。该试验操作3次,取平均值。
1.7.2 人工肠液耐受性试验 细菌复苏后,离心收集菌体,用营养肉汤培养基重悬至108CFU/mL,加入1%的胰蛋白酶,37 ℃培养1 h,10倍倍比稀释,涂布于选择培养基,37 ℃培养24 h,采用平板稀释法计数[12]。
1.7.3 猪胆盐试验 配制含有猪胆盐溶液的选择培养基,浓度分别为0.03 g/100 mL,0.10 g/100 mL,0.20 g/100 mL和0.30 g/100 mL。高温高压灭菌后,接种枯草芽孢杆菌的纯培养物,37 ℃培养24 h,计算其存活率[13]。
1.7.4 高温耐受性试验 将枯草芽孢杆菌菌液分别置于85 ℃、90 ℃、95 ℃、100 ℃水浴锅30 min,以室温下未水浴加热的为对照组。重复3次,计算其存活率[14]。
1.8 数据统计分析
试验重复3次。所得试验数据用SPSS17.0软件进行单因素方差分析,试验结果用“平均数±标准差”表示(P<0.05为差异显著,P<0.01为差异极显著)。
2 结果与分析
2.1 枯草芽孢杆菌的形态学鉴定结果
由图1可以看出,培养基菌落形态为圆形或不规则,表面粗糙[15],呈白色至黄色;革兰氏染色为阳性;孔雀石绿染色芽孢呈绿色,菌体呈红色;芽孢染色液染色菌体呈蓝色,芽孢不着色。
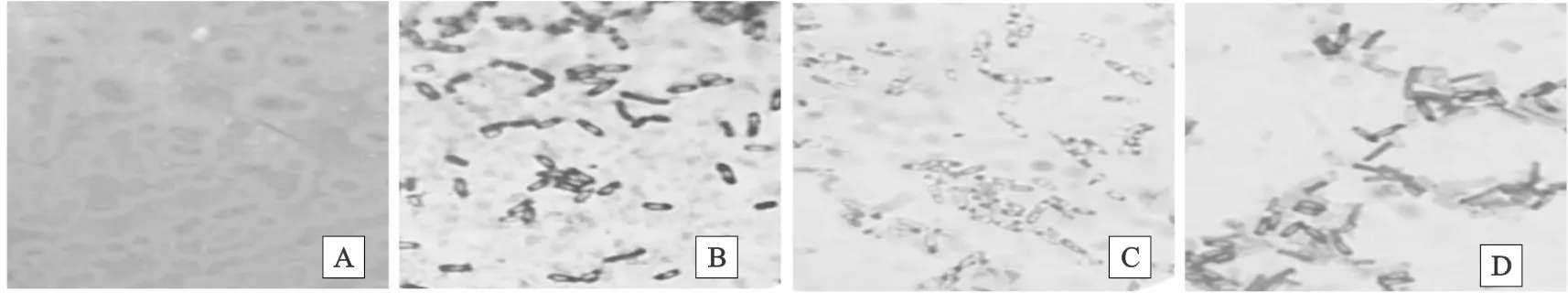
图1 枯草芽孢杆菌形态学鉴定A. 选择培养基菌落形态;B. 革兰氏染色(10×100);C. 孔雀石绿水溶液染色(10×100);D. 芽孢染色(10×100)Fig. 1 Morphological identification of Bacillus SubtilisA.colony morphology of selected medium;B. gram staining(10×100);C. staining with malachite green water solution(10×100);D. spore staining(10×100)
2.2 枯草芽孢杆菌的生化鉴定结果
4株分离株生理生化鉴定结果见表1。由表1可知,葡萄糖、蔗糖、麦芽糖等生化管与试验菌株反应由紫色变为黄色,结果为阳性,过氧化氢酶试验、淀粉水解试验、明胶液化试验等结果均为阳性,与赵小琪等[16]的《猪源性芽孢杆菌的筛选与鉴定》结果一致,初步鉴定4株菌均属于芽孢杆菌属。芽孢位于菌体中央或次极端,形状为椭圆形,淀粉水解、吲哚试验、明胶水解、硝酸盐还原、产气、VP试验、菊糖、甘露醇、蕈糖(海藻糖)、水杨苷等试验结果,均符合《临床微生物学手册》,初步鉴定为枯草芽孢杆菌[17]。鉴定结果见表1。
2.3 枯草芽孢杆菌的分子鉴定结果
由图2可见,基因组 DNA 琼脂糖凝胶检测结果,显示试验菌的PCR条带在1 500 bp左右,与预期结果一致[18]。
西藏牦牛源枯草芽孢杆菌分离株16s rRNA系统进化分析见图3。由图3可知,10个序列的进化树的进化距离为0.0020,说明各序列之间的同源性较近,包括10个序列的系统发育树显示1个分支。由图4可知,Yak-KC1,Yak-KC5,Yak-KC6,Yak-KC7之间的同源性在98.4%~99.5%,试验菌和数据库的相关菌株的同源性均高于98.1%,且最高达到99.6%,其中Yak-KC7与标准株枯草芽孢杆菌(GU902972.1)处于较近位置。结合生理生化结果,鉴定Yak-KC1,Yak-KC5,Yak-KC6,Yak-KC7均为枯草芽孢杆菌。

表1 4株分离株生理生化鉴定结果Table 1 Physiological and biochemical identification results of 4 isolates

图2 基因组DNA琼脂糖凝胶检测结果 Fig. 2 Agarose gel test results of genomic DNA M. DNA Marker DL 2000;1. Yak-KC1,2. Yak-KC5;3. Yak-KC6;4. Yak-KC7
2.4 枯草芽孢杆菌的筛选结果
2.4.1 抑菌试验 4株牦牛源枯草芽孢杆菌对大肠埃希氏菌(血清型为O111)和金黄色葡萄球菌都具有抑菌作用,但抑菌效果不同。对金黄色葡萄球菌,Yak-KC9的抑菌效果最佳,抑菌直径最大达到26 mm;其次是Yak-KC1,Yak-KC5,Yak-KC7,抑菌直径分别达到(16±1)mm,(20±2)mm,(20±1)mm。对大肠埃希氏菌(血清型为O111),Yak-KC9的抑菌效果最佳,抑菌直径达到(25±1)mm;其次是Yak-KC1,Yak-KC5,Yak-KC7,抑菌直径分别达到(17±1)mm,(22±2)mm,(20±2)mm。Yak-KC9对金黄色葡萄球菌的抑菌效果极显著高于Yak-KC1(P<0.01),显著高于Yak-KC7(P<0.05),与Yak-KC5差异不显著。对大肠埃希氏菌的抑菌效果,Yak-KC9极显著高于Yak-KC1(P<0.01),显著高于Yak-KC1和Yak-KC5(P<0.05)。

图4 西藏牦牛源枯草芽孢杆菌分离株(Yak-KC1,Yak-KC5,Yak-KC6,Yak-KC7)16s rRNA同源性分析Fig. 4 Homology analysis of 16s rRNA isolates of yak-derived Bacillus subtilis from Tibet (yak-kc1, yak-kc5, yak-kc6, yak-kc7)
2.4.2 人工肠液耐受性试验结果 由表2可知,4个菌株在人工肠液环境下存活率达到74.5%以上,均有较好的人工肠液耐受能力(P>0.05)。同比,Yak-KC7的人工肠液耐受性最佳。

表2 4株枯草芽孢杆菌在人工肠液环境下的存活率Table 2 Survival rate of 4 Bacillus subtilis strains in artificial intestinal fluid environment %
2.4.3 猪胆盐试验试验结果 由表3可知,随胆盐浓度上升,4株枯草芽孢杆菌的存活率下降,同比,猪胆盐试验中Yak-KC7的耐受性最佳。
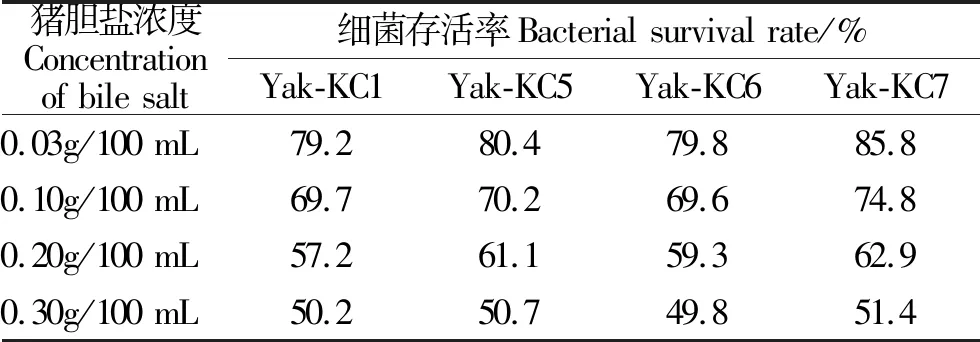
表3 不同浓度猪胆盐环境下枯草芽孢杆菌的存活率Table 3 Survival rate of Bacillus subtilis under different concentrations of pig bile salts[19]
2.4.4 高温耐受试验结果 由表4可知,菌株在85 ℃ 条件下存活率明显高于100 ℃条件下的存活率,并随着温度的上升存活率下降明显[20],同比,Yak-KC7的高温耐受性最佳。
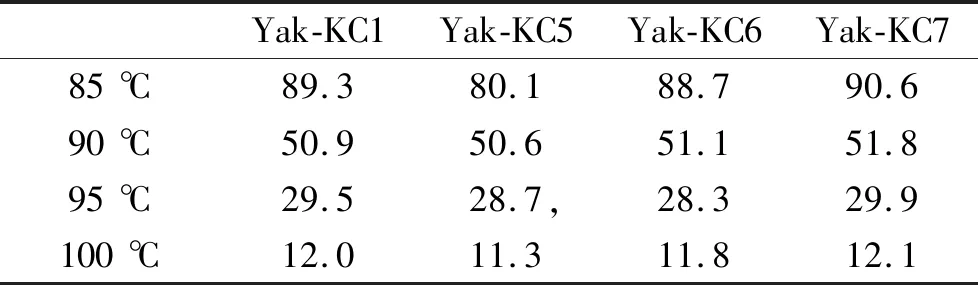
表4 不同温度下枯草芽孢杆菌的存活率Table 4 Survival rate of Bacillus subtilis at different temperatures
3 讨 论
枯草芽孢杆菌能调解肠道菌群平衡,改善动物肠道的健康状况,提高动物的生产性能,提高动物的免疫力,因为枯草芽孢杆菌特有的益生效果,能保护肠道黏膜组织,所以枯草芽孢杆菌是一种重要的肠道益生菌[21]。
本试验中 ,从形态学鉴定及生化试验结果均符合《临床微生物学手册》“表26-1芽孢杆菌属、土壤芽孢杆菌属和类芽孢杆菌属部分种的鉴别特征”中对枯草芽孢杆菌的特征鉴定。形状为椭圆形或稍长,PCR扩增条带位置在1 500 bp左右,16s rRNA测序同源性比较结果高达99.6%,鉴定为枯草芽孢杆菌。
枯草芽孢杆菌在动物体内发挥益生性的前提是必需具备良好的肠液、胆盐耐受性;作为饲料中抗生素的优良替代益生菌的前提是,在饲料加工过程中接受高温灭活处理后仍具备活性的能力[22]。本试验设普通培养基为对照组,人工肠液、猪胆盐、高温处理培养基为试验组。研究结果表明,Yak-KC1、Yak-KC5、Yak-KC6、Yak-KC7在人工肠液环境下的存活率均超过75%;在猪胆盐环境中的存活率随猪胆盐浓度的上升而下降,存活率范围在49.8%~85.8%;在高温环境下,随温度上升菌株存活率明显下降,85 ℃的存活率显著高于100 ℃的存活率,范围在11.3%~90.6%之间。4个菌株均具有一定的肠液、胆盐、高温耐受性,Yak-KC7的耐受性最好。

