温度和重复测定对秦岭细鳞鲑快速启动反应、游泳性能及力竭后代谢特征的影响
彭敏锐,郑雪丽,李 平,李秀明,夏继刚,*
1 进化生理与行为学实验室,重庆市动物生物学重点实验室,重庆师范大学生命科学学院, 重庆 401331 2 陕西省水产研究所,西安 710086
温度是水生生态系统中决定鱼类等外温动物生存与分布的关键因子[1- 5]。气候变化模型预测本世纪末全球将升温0.3—4.8℃[6]。温度增加将造成很多鱼类物种丧失其最佳的栖息地环境,生理功能受限进而导致其适合度下降[7- 11]。在全球气候变暖的背景下,迫切需要对鱼类(特别是冷水性鱼类)的温度适应性问题进行深入系统的探究。
温度显著影响鱼类的代谢率[10- 12]。代谢率体现了能量吸收、转化和分配的速率,是基本生物学速率[13],与动物的运动能力、生长性能、热适应特性等密切相关[13-15]。正如遗传理论被认为是进化生物学研究的基础一样,生态代谢理论(Metabolic theory of ecology)被认为是大部分生态学研究的基础[13]。有关鱼类应对温度升高的生理响应,Sandblom等[11]形象地提出了“可塑的底层与凝固的天花板(Plasticoors and concrete ceilings)”假说,即温度升高将导致鱼类维持能量消耗(标准代谢率Standard metabolic rate, SMR)增加,而最大代谢率(Maximum metabolic rate, MMR)却保持不变甚至下降,其结果是导致有氧代谢空间(Metabolic scope,MS)变小。MS是动物各种生理功能可能占用的潜在代谢空间,MS变小被认为主要是与高温下心鳃系统供氧功能不足以满足机体的氧需求有关(基于氧供需能力限制的热忍耐假说Oxygen- and capacity-limited thermal tolerance, OCLTT)[12,16],这种生理功能的限制最终将对鱼类的游泳性能、生长发育、繁殖等产生抑制效应[9-12,15]。
由于水体环境的特殊性,游泳运动作为鱼类集群、洄游、觅食及逃避捕食者等行为实现的主要方式,为鱼类的生存与繁衍提供了基本保证,与其适合度密切相关[15,17]。鱼类为实现不同生理活动所采用的游泳方式不同。快速启动(Fast-start)是鱼类逃避天敌得以生存的基本方式,体现了鱼体运动系统和神经系统的整体性能[15];快速启动持续时间通常少于1 s,但与鱼类的捕食或逃逸对策密切相关[18- 19]。步法转换速度(Gait transition speed,Ugait)指随着水流速度增加,鱼体开始出现“爆发-滑行”姿态变化且在水流中相对位置上下移动这一行为时的游泳速度,该速度有时也被认为是鱼类的最大有氧运动速度,之后鱼体开始大量动用白肌提供能量完成高速游泳[20- 21]。匀加速游泳速度(Constant acceleration test speed,Ucat)通常指以恒定的加速度持续增加水流速度直至鱼体出现力竭状态时的游泳速度,匀加速游泳是一种快速的高能耗游泳运动,在鱼类捕食—逃避敌害、尤其是穿越激流寻找适宜生境等生存活动中发挥重要作用[15,22-23]。然而,由于加速游泳主要依赖于无氧代谢供能,导致白肌中ATP、磷酸肌酸和糖原的大量消耗以及肌肉和肝脏中乳酸的累积[24-27],力竭运动后的代谢恢复能力将直接影响鱼类后续的加速游泳性能[25,28]。鱼类的游泳性能易受温度变化的影响[5,23,27,28],对不同温度下重复游泳性能及其力竭后代谢特征的评估是十分必要的,有助于洞察温度影响下鱼类生理功能与生态表现的稳定性与可持续性。
秦岭细鳞鲑(Brachymystaxlenoktsinlingensis)隶属于鲑形目、鲑科、细鳞鲑属,是目前世界上分布最南端的两种鲑科鱼类之一,为国家Ⅱ级重点保护水生野生动物[5,29-31]。该物种是第四纪冰川时期自北方南移的残留物种,为典型的陆封型冷水性山麓鱼类,地域分布范围狭窄、生境特殊、主要分布于秦岭山系海拔900—2300 m的山涧溪流及深潭中[29- 30]。调查研究发现,该物种对生境水温有严格要求,易受全球气候变化和人为活动的影响,近20年来,其生存海拔下限已显著提升了200—300 m[5,31-32]。然而,尽管水温是决定该物种生存与分布的关键因子,迄今为止其热生物学相关研究十分匮乏。游泳性能对秦岭细鳞鲑生存繁衍至关重要,为其生殖洄游(需具备较强的有氧运动能力)、穿越激流等复杂生境(需要具备较强的加速游泳能力)以及快速追击捕食(需具备较强的快速启动能力)提供了基本保障,加之气候变化和筑坝等人为活动导致生境水流变化又对其游泳性能提出了更高的要求[33]。本研究考察了温度和重复测定对秦岭细鳞鲑快速启动反应、游泳性能及力竭后代谢特征的影响,以期为该物种的保护生理学研究与实践提供参考。
1 材料与方法
1.1 实验鱼
秦岭细鳞鲑幼鱼((22.1±0.98)g,(11.4±0.14)cm,n=27)采自陕西太白湑水河珍稀水生生物国家级自然保护区(33°744′N, 107°460′E),将实验鱼于自净化循环控温系统(500 L)驯养21 d以使之适应实验室环境。驯养条件如下:实验用水为充分曝气脱氯并经过活性炭过滤的自来水,水温(13.5±0.5)℃(与采样点的温度接近),水体溶氧≥90%饱和溶氧,氨氮浓度<0.01 mg/L,水体底部放置若干大石块以模拟自然生境;每日8:00饱足投喂黄粉虫幼虫(Tenebriomolitor)一次,投喂20 min后,吸去残饵并更换1/5水体以保持水质清洁。
1.2 实验方案
本研究共设置6℃、12℃和18℃ 3个生态相关的温度梯度(其中,18℃代表了实验鱼栖息地夏季最热月份的平均温度,6—12℃为实验鱼的繁殖适宜温度,当春季温度高于6℃时实验鱼向上游产卵洄游而当冬季温度低于6℃时向下游越冬洄游[5])。适应结束后,将实验鱼随机平均分为3组,每组9尾(n=9),分别移养至3个相同的自净化循环控温水槽;然后,将各组水温从(13.5±0.5)℃开始以1℃/d的速率升温或降温至设定的3个驯化温度(6、12、18℃),并将实验鱼在各自相应的温度下驯化21 d。温度驯化期间,除了水温不同外,其余水质环境条件以及喂养水平等与驯养适应期间保持一致。
驯化结束后,将实验鱼禁食24 h,连续两次测定其快速启动表现,两次测试的时间间隔为15 min。之后,将实验鱼放回原有驯养水体恢复适应24 h,24 h后连续两次测定其游泳性能及力竭前后的代谢特征,两次测试的时间间隔为30 min。最后,分析驯化温度(6、12、18℃)和重复测定(测定I、测定II)及其交互作用对实验鱼快速启动反应、游泳性能以及力竭后代谢特征的影响。驯化和测试期间,水温精度控制在±0.1℃。
1.3 快速启动测定
将单尾实验鱼转入直径为1 m的圆形水槽并给予15 min的适应期以消除转移胁迫。水槽中水深15 cm,水温与实验鱼驯化温度一致。为减少外界环境干扰,水槽置于独立的行为观测室,观测室四周避光,水槽正上方3 m处设有一5 W的节能灯,高速摄像机(500帧/s, BASLER A504K, Germany)置于水槽正上方2 m处。通过玩具枪在距离实验鱼尾部约10 cm处射入直径为0.5 cm的子弹,以刺激实验鱼检测其快速启动表现。在子弹射出的同时开启高速摄像机对实验鱼进行拍摄,拍摄历时2 s,通过摄像机捕获的图像以子弹接触水面的瞬间作为刺激起始时刻。采用图像处理软件(nEO iMAGING和ACDsee 12)对拍摄的图像进行处理,采用软件TpsUtil和TpsDig(http://life.bio.sunysb.edu/morph/)将图像数字化以测量实验鱼质心位移,依据鱼体的状态变化和质心轨迹计算出反应率(Reaction rate,R)、反应时滞(Latency time,Tlatency)、快速逃逸(实验鱼逃离原有位点,质心发生显著偏移)比例等参数[15,19]。其中,R是对环境刺激有响应的个体数占实验鱼总数的百分比,测定时将对刺激有反应的个体记为1、无反应的个体记为0;Tlatency是指从环境刺激发生到鱼体作出可被察觉的行为反应所经历的时间[15]。
1.4 游泳性能及力竭前后代谢特征测定
1.4.1日常代谢率(Routine metabolic rate, RMR)
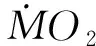
式中,DOk和DOk+1分别为测定时间点k及k+1时刻呼吸室内的溶氧水平(mg/L);V(L)为呼吸室体积与实验鱼体积的差值;t(h)为时间点k与k+1的时间间隔;m(kg)为实验鱼的体重。为了消除体重差异对代谢率测定的影响,将实验鱼体重标准化为1 kg,0.75为体重校正指数[5,31,34]。
1.4.2Ugait和Ucat
RMR测定完成后,将游泳管中的水流速度以0.167 cm/s2的加速度持续增加(游泳管连接计算机,管内的水流速度由编写的程序控制),直至实验鱼到达运动力竭状态。将实验鱼首次出现“爆发-滑行”姿态变化且在水流中相对位置上下移动这一行为时的游泳速度记为Ugait,将实验鱼力竭时的水流速度记为Ucat。力竭状态的评判标准为实验鱼无力前进游泳并停留在游泳管末端筛板20 s以上[23,28,35]。为避免造成低氧胁迫,每次加速测定前短暂打开游泳管后盖以实现内外水体交换(时长为20 s),然后再密闭游泳管。
1.4.3力竭后代谢特征
Ugait和Ucat测定结束后(实验鱼力竭后),将游泳管内的水流降至12 cm/s(与适应期相同),立即使用溶氧仪对游泳管内水体的溶氧水平进行测定,每1 min测定1次,连续测定30 min,得出实验鱼代谢率随力竭后恢复时间延长的变化特征。将实验鱼代谢恢复过程中的最大代谢率记为MMR,将MMR与RMR的差值记为MS[28]。实验鱼代谢恢复过程中游泳管内水体溶氧不低于饱和溶氧的80%[5]。
1.5 数据分析
采用SPSS 19.0对数据进行统计分析。首先对实验数据进行正态性(Shapiro-Wilks检验)和方差齐性检验。若数据满足正态性和方差齐性,采用双因素方差分析(Two-way ANOVA)和Tukey′s HSD多重比较检验差异显著性;若数据不满足正态性和方差齐性,采用Scheirer-Ray-Hare分析[19]检验差异显著性。数据均以平均值±标准误表示,显著性水平设为P<0.05。
2 结果与分析
2.1 温度和重复测定对实验鱼快速启动反应的影响
温度和重复测定对实验鱼的反应率R均无显著影响(P>0.05,表1,图1)。温度对实验鱼的反应时滞Tlatency影响显著(P<0.05,表1,图1),Tlatency随温度升高而变短。此外,温度和重复测定对实验鱼快速逃逸比例无影响,前后两次测试每个温度处理组均只有1尾鱼展现出快速逃逸行为。
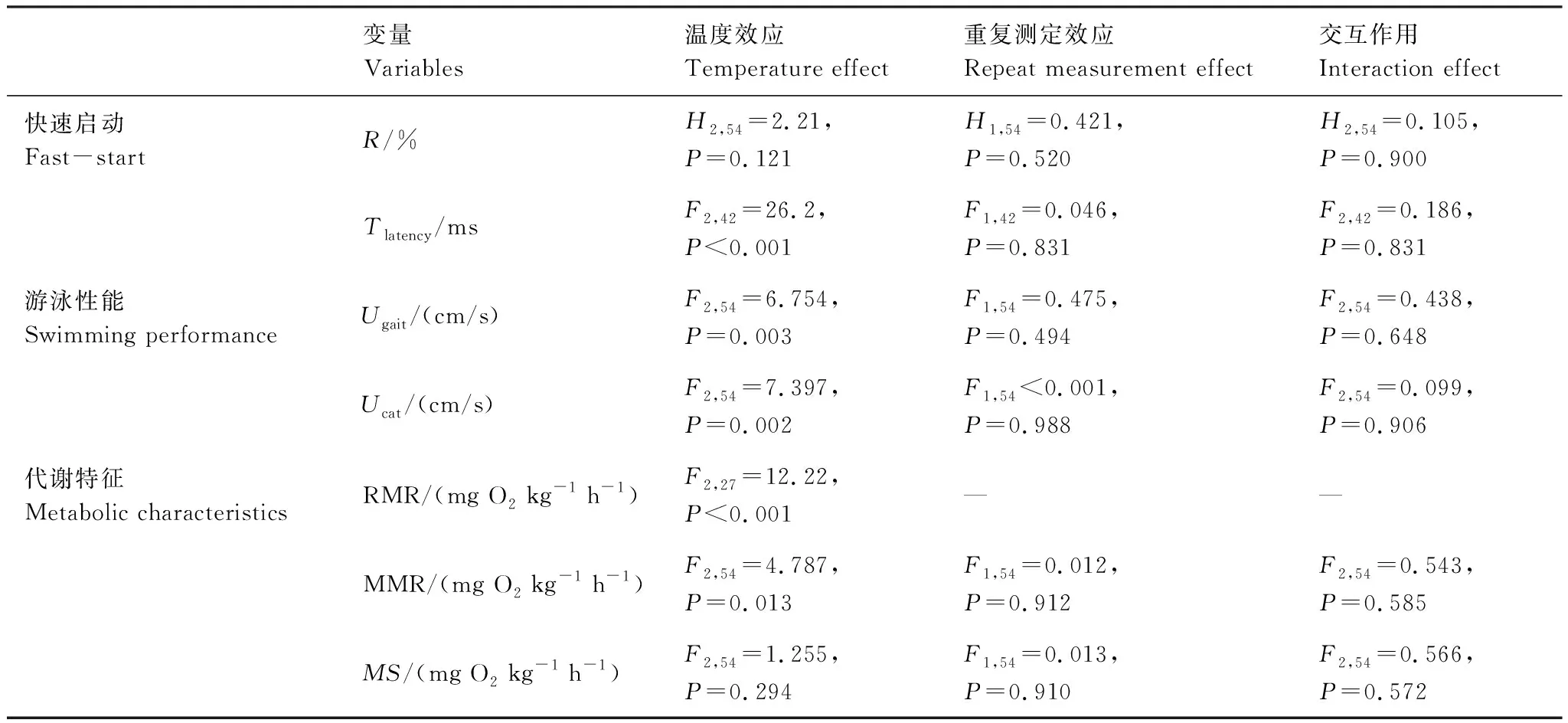
表1 温度和重复测定对秦岭细鳞鲑快速启动反应、游泳性能及力竭后代谢特征的影响

图1 温度和重复测定对实验鱼快速启动反应的影响Fig.1 Effects of temperature and repeat measurement on fast-start of Brachymystax lenok tsinlingensisa—c上标字母不同表示首次测定不同温度组间差异显著(P<0.05);x, y无共同上标字母表示重复测定不同温度组间差异显著(P<0.05)
2.2 温度和重复测定对实验鱼游泳性能的影响
温度对实验鱼的Ugait和Ucat影响显著(P<0.05,表1,图2),重复测定对实验鱼的Ugait和Ucat无显著影响(P>0.05,表1,图2)。

图2 温度和重复测定对实验鱼游泳性能的影响Fig.2 Effects of temperature and repeat measurement on swimming performance of Brachymystax lenok tsinlingensisUgait: 步法转换速度 Gait transition speed; Ucat: 匀加速游泳速度 Constant acceleration test speed; a-b上标字母不同表示首次测定不同温度组间差异显著(P<0.05);x, y无共同上标字母表示重复测定不同温度组间差异显著(P<0.05)
2.3 温度实验鱼运动前日常代谢率RMR的影响
温度对实验鱼的RMR影响显著(P<0.05,表1),RMR随驯化温度的升高而升高,6℃、12℃、18℃驯化下的RMR分别为(118.6±10.1)、(151.4±9.11)、(182.0±7.86)mg O2kg-1h-1。
2.4 温度和重复测定对实验鱼力竭后代谢特征的影响
不同温度下的实验鱼力竭后的代谢恢复特征见图3。无论是初次运动后的代谢恢复期I还是再次运动后的恢复期II,实验鱼代谢率都急剧上升达到峰值,随后快速下降并逐步恢复到运动前水平。温度对实验鱼的MMR影响显著(P<0.05,表1,图4)、对实验鱼的MS无显著影响(P>0.05,表1,图4),重复测定对实验鱼的MMR和MS均无显著影响(P>0.05,表1,图4)。

图3 不同温度下实验鱼力竭后的代谢恢复特征Fig.3 Metabolic recovery after exhaustive swimming in Brachymystax lenok tsinlingensis at different acclimation temperature

图4 温度和重复测定对实验鱼力竭后代谢特征的影响Fig.4 Effects of temperature and repeat measurement on metabolic characteristics after exhaustive swimming in Brachymystax lenok tsinlingensisMMR: 最大代谢率 Maximum metabolic rate; MS: 代谢范围 Metabolic scope; a-b上标字母不同表示首次测定不同温度组间差异显著(P<0.05)
2.5 温度系数Q10
特定温度范围内实验鱼不同生理参数的温度系数Q10见表2。无论是首次测定还是重复测定,相较于6—12℃范围内生理参数的Q10值,12—18℃范围内所有生理参数的Q10值均较小。6—12℃范围内,首次测定Ugait的Q10值小于重复测定、而MMR和MS的Q10值大于重复测定;12—18℃范围内,首次测定各种生理参数的Q10值与重复测定相近。

表2 秦岭细鳞鲑不同生理参数的热敏感性
3 讨论
3.1 温度和重复测定对实验鱼快速启动的影响
鱼类快速启动游泳的温度效应与物种的热敏感性、热经历、生理状态以及生态对策等均有关联[15,19,36-37]。由于温度影响机体能量供给和肌肉收缩时间[38],在一定范围内,鱼类的快速启动游泳能力往往随着温度的升高而提升。例如,Yan等[37]发现,采用电刺激下草鱼(Ctenopharyngodonidellus)、鲫鱼(Carassiuscarassius)、中华倒刺鲃(Spinibarbussinensis)、鳊鱼(Parabramispekinensis)、鲤鱼(Cyprinuscarpio)、白甲鱼(Onychostomasima)等几种鲤科鱼类的快速逃逸能力(逃逸最大速度、逃逸距离)在25℃下与15℃下相比均显著提升。诚然,逃逸反应是多数鱼类遭遇环境风险刺激时的主要生存对策,但是作为另一种适应性选择,也有一些鱼类会表现出隐匿行为或者惊恐状的静息僵直(Freezing behavior)或退缩行为(Withdrawal behavior)[39-40],例如欧洲鳎(Soleasolea)、比目鱼(Hippoglossus)等一些隐蔽性强的鱼类和具有保护性盔甲的鱼类,在遭遇环境刺激时往往采取静息不动的行为策略以降低被捕食的风险[39]。由于鱼类对各种环境刺激方式的敏感性不同,快速启动的测定方法目前尚未统一。以往研究中,采用电刺激的方法由于重现性较好、易于控制和标准化,并且能够更准确地检测鱼体逃逸反应动力学参数,在相关研究中被广泛采用[15,19,36-37],然而其缺点是难以模拟鱼类在自然界遭遇的真实环境,生态关联度不强,并且容易陷入实验动物伦理的争议中,近年来已不被该研究领域的多数科学家所接受。本研究采用的刺激方式更为接近自然界真实状况,因此检测结果也更能反映动物真实的快速启动表现。但遗憾的是,该刺激方式仅检测出了实验鱼的快速启动反应(认知响应能力)、并不能有效诱导实验鱼的快速逃逸行为(爆发逃逸能力)。作者也曾尝试采用食物诱导、化学捕食信号等其他方式刺激,效果均不理想。未来研究中,在其野生生境下实测其快速启动表现可能是必要的。有幸的是,本研究也发现了一些有趣的实验结果,随温度升高,秦岭细鳞鲑的Tlatency显著减少,但温度和重复测定对反应率R和快速逃逸比例均无显著影响,前后两次测试每个温度处理组均只有1尾鱼(占比11.1%)展现出快速逃逸行为。由于秦岭细鳞鲑栖息生境主要为一些乱石底质的山涧溪流、易于隐匿,且其体色与周围环境相近、不易被发现。我们推测,静息不动可能是该物种适应于山涧溪流生境、应对低强度机械刺激一种有效的生态策略,为未来的野外生态学研究提供了有益启示。
3.2 温度和重复测定对实验鱼游泳性能的影响
鱼类游泳性能与温度的关系通常呈“钟型”曲线[41-42],在适宜温度范围内,游泳性能随温度升高而上升。本研究中,温度对秦岭细鳞鲑Ugait和Ucat影响显著,6℃驯化组的Ugait和Ucat低于12℃和18℃驯化组,但18℃和12℃驯化组间并无差异。研究结果与Xia等[5]对秦岭细鳞鲑临界游泳速度(Critical swimming speed,Ucrit)的研究结果相一致。此外,由于24℃条件已经对秦岭细鳞鲑造成了严重热胁迫、导致高死亡率,因此,依据“钟型”曲线模型,推测秦岭细鳞鲑游泳性能的最适温度介于12℃和18℃之间[5]。相较于12—18℃,6—12℃范围内秦岭细鳞鲑Ugait和Ucat的温度系数Q10较高,其热敏感程度与变化趋势与Ucrit相似[5]。综合秦岭细鳞鲑Ugait、Ucat和与Ucrit对温度的响应规律来看,该物种游泳性能对温度变化的敏感性较高。秦岭细鳞鲑Ugait和Ucrit的值接近[5],二者均显著小于Ucat(6、12、18℃下Ugait分别为Ucat的62.1%、60.2%、53.2%,Ucrit分别为Ucat的61.2%、65.0%、60.2%),表明与有氧运动能力相比其无氧运动能力相对较强,这可能与该物种栖息的乱石底质生境及其水流环境特点有关。然而,值得注意的是,总体上该物种的运动性能较弱,无论是有氧运动能力还是无氧运动能力均弱于常见淡水鱼类,例如鲤科鱼类Ucrit一般可达到体长的6—8倍,Ucat通常可达到体长的8—10倍[15],而不同温度下秦岭细鳞鲑Ugait和Ucrit均在5倍体长以下,Ucat均在7倍体长以下。提示气候变化和筑坝等人为活动导致生境水温和水流变化可能容易对其生存与分布造成限制[33]。
由于生存活动的需要,鱼类通常需要多次重复游泳运动[28,43-44]。Jain和Farrell[43]探究了季节温度变化对虹鳟(Oncorhynchusmykiss)重复游泳能力的影响,发现低温(8.4℃)驯化下两次测定的Ucrit值接近、而较高温(14.9℃)驯化下测定II的Ucrit值显著低于测定I,认为高温下重复游泳能力的降低主要和机体乳酸积累等代谢功能损伤有关。MacNutt等[44]发现,无论是急性(48 h)和亚慢性(21 d)驯化,驯化温度对克拉氏鲑(Oncorhynchusclarkiclarki)重复游泳Ucrit值的恢复率均无显著影响。Pang等[28]发现,较低温度(10、15、20℃)驯化下,中华倒刺鲃测定II和测定I的Ucat值无显著差异、而高温(25、30℃)驯化下测定II的Ucat值显著低于测定I。本研究中,不同温度下测定I与测定II秦岭细鳞鲑的Ugait和Ucat无显著差异,提示该物种游泳性能具备较佳的恢复力和可重复性,研究结果与MacNutt等相近[44]。
3.3 温度和重复测定对实验鱼力竭前后代谢特征的影响
温度通过影响外温动物的生化反应与合成速率显著影响其代谢水平[45]。鱼类RMR通常随温度升高而升高[41],但MMR与温度的关系尚无一致观点。有研究者认为,MMR与温度的关系呈“钟型”曲线[28,41],也有研究者认为MMR与温度的关系是线性的、随温度升高而上升[42]。例如,急性温度增加可以导致尖吻鲈(Latescalcarifer)MMR持续升高直至38℃(已接近其临界温度上限)[46]。本研究中,温度对秦岭细鳞鲑的MMR影响显著,测定I中6℃驯化组的MMR显著低于12℃和18℃驯化组。低温下MMR降低主要是由于心鳃循环系统功能下调致机体摄氧能力降低所致[47]。然而,测定II中不同温度组间MMR的差异性消失,并且6—12℃范围MMR的Q10值也从测定I中1.64下降到1.27,提示低温下前期运动锻炼对动物MMR的提升可能具有积极作用。运动力竭后的代谢恢复包括能量代谢底物的恢复、代谢产物的清除以及内环境(体液酸碱度、渗透压等)的重新平衡,代谢恢复能力将决定后续加速游泳能力的发挥[48]。值得关注的是,无论初次运动后的恢复期I还是再次运动后的恢复期II,秦岭细鳞鲑代谢率都急剧上升达到峰值,随后快速下降并逐步恢复到运动前水平,并且重复测定对其力竭后的代谢参数(MMR和MS)均无显著影响,暗示该物种具备较佳的代谢恢复能力。
综上,秦岭细鳞鲑对低强度机械刺激主要采用静息而非逃逸的生态策略,高温下的快速启动反应更为迅速。秦岭细鳞鲑游泳性能对温度变化的敏感性较高,最适温度估计介于12—18℃。尽管不同温度处理下,该物种的代谢恢复与重复运动能力较佳,但总体上该物种的游泳性能较弱,提示生境水温和水流变化可能对其生存与分布造成限制。

