固本畅枢法对肥胖糖尿病大鼠糖脂代谢及胰岛β细胞凋亡的影响*
唐咸玉,孙 璐,何 柳,曾慧妍,何嘉莉,谢雯雯,朱胜伶
(广东省中医院,广州 510120)
我国超重人群中2型糖尿病(type 2 diabetes mellitus,T2DM)患病率高于美国(15.45% vs. 8%~9%)[1],糖尿病合并肥胖存在的糖脂代谢紊乱可启动内质网应激,导致胰岛β细胞凋亡[2],加速糖尿病的进展。改善糖脂代谢、抑制糖脂毒性诱导的内质网应激、减少β细胞凋亡可能成为防治肥胖T2DM的新途径。中医认为,此类患者的主要病机为脾肾阳虚、枢机不利、痰瘀内阻。前期临床研究证实,运用具有“温补脾肾之阳,和畅枢机”功用的固本畅枢法可改善肥胖T2DM 患者胰岛素抵抗(Insulin resistance,IR),减轻其体质量及临床症状[3]。本研究复制肥胖糖尿病大鼠模型,通过体内实验了解固本畅枢法对模型大鼠糖脂代谢的影响,以及胰腺β细胞凋亡时典型的形态学改变;通过体外培养小鼠胰岛β细胞MIN6,采用流式细胞术定量分析β细胞凋亡情况。本文运用生物化学、形态学与定量分析相结合,旨在进一步研究固本畅枢法对胰岛β细胞凋亡的干预作用。
1 材料与方法
1.1 动物及饲养
无特定病原体动物(specific pathogen free,SPF)级成年雄性sprague-dawley(SD)大鼠,体质量140~160 g共40只,购自广东省医学实验动物中心,许可证号SCXK(粤)2013-0002,实验动物伦理学批准号2016054。SPF组鼠料为广东省医学实验动物中心供应(饲料合格证号0082700)。高脂高糖饲料由北京博爱港公司提供,组分包括玉米、猪油、蔗糖、胆固醇、豆粕、小麦麸、次粉、鱼粉、麻油、大豆油、磷酸氢钙、石粉、胆酸钠、赖氨酸、食盐、氯化胆碱、多种维生素及矿物元素。维持料65%+猪油10%+蔗糖20%+胆固醇2.5%+胆酸钠1%+混调剂(鸡蛋麻油花生)1.5%。
1.2 细胞及培养
小鼠胰岛β细胞MIN6(广州铭善上生物科技有限公司提供),细胞复苏后将MIN6细胞用含15%胎牛血清、100U/mL青霉素、100U/mL链霉素、5μl/Lβ-巯基乙醇的DMEM-高糖培养基于37 ℃、5%CO2培养箱内培养。
1.3 药物
固本畅枢方组成:熟附子10 g,茯苓20 g,山药20 g,干姜10 g,丹参15 g,苍术10 g,党参20 g,玄参10 g,葛根30 g,黄芪30 g,大枣15 g,柴胡10 g,黄芩6 g,法半夏10 g。药材由广东省中医院药房提供,经药剂科鉴定均为纯正药材。将中药制成粗粉,煎药取汁并过滤,置于水浴箱内浓缩成含生药2.2 g/mL的混悬液,药液常温冷却后置于4 ℃冰箱内保存备用。
1.4 主要试剂与仪器
链脲佐菌素(streptozocin,STZ)(sigma公司,货号S0130);TUNEL试剂盒(Roche公司,货号11684795910);原位荧光标记试剂盒(DAPI)(Roche公司,货号11684817910);甘油三酯(Triglyceride,TG)、总胆固醇(Cholesterol,TC)、低密度脂蛋白胆固醇(Low density lipoprotein,LDL-C)、高密度脂蛋白胆固醇(High density lipoprotein,HDL-C)测试盒(南京建成生物工程研究所,货号分别为A110-2、A111-1、A113-1、A112-1);胰岛素ELISA试剂盒(Mercodia公司,货号10-1247-01);胎牛血清、RPMI-1640培养基、DMEM-高糖培养基、青链霉素(Hyclone,货号分别为Cat.No.SH30087.01、Cat.No.SH30809.01B、Cat.No.SH30022.01B、Cat.No. SH30010);β-巯基乙醇(BBI公司,货号ZY60);Annexin V-FITC细胞凋亡检测试剂盒(keygen,货号KGA106);96孔板细胞培养板(NEST,Cat.No.PPP-001-030);HERACELL150i型细胞恒温培养箱(Thermo scientific);Multiscan MK3型酶标仪(Thermo Fisher Scientific);FACSCalibur型流式细胞仪(BD); DMI6000B型倒置荧光显微镜(Leica);CM10 型透射电镜(Philips);1X71型显微成像系统(日本Olympus)。
2 方法
2.1 造模、分组及干预方法
SPF级成年雄性SD大鼠随机分为正常对照组(10只)及模型组(30只),正常对照组给予普通饲料喂养,模型组给予普通饲料适应性喂养1周,再给予高糖高脂饲料喂养8周后,按30 mg/kg单次腹腔注射STZ溶液,72 h后尾静脉采血测定其空腹血糖及空腹胰岛素水平(禁食8 h以上),糖尿病大鼠模型的确立标准是空腹血糖≥11.1 mmol/L,未成模者剔除。造模成模率为86.7%,成模后大鼠按随机数字表法分为治疗组及模型组各13只。治疗组及模型组继续给予高糖高脂饲料喂养,治疗组以18.8 g/(kg·d)剂量每日2次灌胃固本畅枢方混悬液,正常对照组和模型组灌胃等量蒸馏水,持续给药4周,所有组别均未出现大鼠死亡。
MIN6细胞分为正常组、凋亡模型组(8.3 mmol/L的葡萄糖+5 μL/Lβ-巯基乙醇+2μg/mL衣霉素培养24 h)和含药血清组(凋亡模型+10%含药血清)。
2.2 标本采集
2.2.1 血清标本采集 给药结束后各组大鼠尾静脉穿刺采血测血糖;心脏穿刺采血,离心分离血清,-80 ℃保存备用。
2.2.2 组织及细胞标本采集 各组大鼠心脏穿刺采血后处死,无菌操作取出胰腺、肝脏、大腿肌肉组织、脂肪组织,分别切取部分组织(胰腺宜取胰尾)在4%多聚甲醛液中固定4~6 h,常规石蜡包埋,待做HE染色及TUNEL、DAPI检测。MIN6细胞悬液从细胞培养板中转移到一个干净的离心管内,离心保存备用。
2.3 指标检测及方法
2.3.1 血糖、血脂及胰岛素测定 TG、TC采用GPO-PAP酶法,LDL、HDL采用直接法,空腹血糖(fasting blood glucose,FBG)采用葡萄糖氧化酶法,空腹胰岛素(fasting insulin,FINS)采用ELISA测定,具体步骤严格按照试剂盒说明书操作。计算胰岛素敏感性指数(IAI):IAI=1/(G0+I0)[I0为空腹血胰岛素,G0为空腹血葡萄糖]。
2.3.2 胰腺、肝脏、大腿肌肉及脂肪组织的病理变化 石蜡包埋的组织切取5 μm 厚的切片,将切片进行HE 染色,用光学显微镜观察以上4种组织的病理变化并摄片。每组选3只大鼠,分别取胰脏、肝脏、大腿肌肉组织、脂肪组织,切至0.1 cm×0.1 cm×0.1 cm大小,固定于2.5%戊二醛液中,经PBS 漂洗、丙酮梯度脱水、Epon812包埋后,LKB超薄切片机切片,透射电镜下观察细胞超微结构的变化并摄片。
2.3.3 TUNEL-DAPI共染色法检测胰腺细胞的凋亡 TUNEL染色法:将石腊包埋的胰腺组织切片进行脱腊、水化,PBS漂洗,蛋白酶K(1∶10 PBS 稀释)37 ℃孵育10~20 min后PBS漂洗2次,甩干(擦干)组织周边,检测样本和阳性对照样本,加入TUNEL reaction mixture 50μL,阴性对照样本加入Label Solution,37 ℃湿盒避光孵育60 min,PBS漂洗3次,封闭内源性过氧化物酶活性,在脱氧核苷酸末端转移酶(terminal deoxynucleotidy transferas, TDT)与荧光素连接的核苷酸混合缓冲液内孵育,NBT-BCIP显色。阴性对照不加TDT。阳性细胞呈现蓝色荧光。
DAPI染色法:用中性树胶圈定组织片的界限,加入200 μL RNase A,37 ℃避光作用30 min,滴加300μL PBS,滴加60μL DAPI饱和工作液摇匀,室温下避光作用10 min弃染液,PBS洗涤3次,封片后荧光显微镜下观察(设置为WB滤色孔)并照相。结果判断:健康细胞的细胞核体积较大,发散均匀、微弱的淡绿色荧光;凋亡细胞的细胞核缩小、致密,发散高亮的绿色荧光。
光镜下观察和摄片,每组选10张,每张切片选20个视野,计算每20个放大100倍视野里胰腺凋亡阳性细胞数,分组汇总后计算其平均数。
2.3.4 MTS法检测MIN6细胞增殖 消化细胞后吹打散细胞计数,调整细胞浓度1×105个/mL,分到96孔板,每孔100μL,即每孔细胞为1×104个。贴壁细胞需待细胞贴壁后收集各个时间点的细胞(0 h、24 h、48 h、72 h),加入cell Titer96AQ单溶液细胞增殖检测试剂(Promega,Cat.No.G3582),比例为1/10,即100 μL培养液加入10 μL检测液。孵育4 h后酶标仪读板,MTS检测读取OD490数据。
2.3.5 流式细胞术检测MIN6细胞凋亡 将细胞培养板各组的培养基分别转移到15 mL 的锥形管中并置于冰上,用2 mL PBS 溶液轻轻润洗培养板内细胞,去除PBS 溶液,加入0.5 ml 0.25%胰酶不含EDTA孵育,直到显微镜下观察到细胞开始从培养板壁脱落,轻轻连续拍打使细胞从培养板壁上完全脱落,将细胞重悬于预冷的1×结合缓冲液中使其密度大约为1×106细胞/ml,将0.5 mL 细胞悬液从细胞培养板中(5×105个细胞)转移到一个干净的离心管内,加入1.25 μL Annexin V-FITC,室温(18~24°C)避光反应15 min,室温1000×g 离心5 min,去除上清,将细胞用0.5 mL 预冷的1×结合缓冲液轻轻重悬,加入10 μL Propidium Iodide,将样本放置在冰上避光保存,立即用流式细胞仪检测分析。
2.4 统计学方法
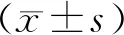
3 结果
3.1 治疗后各组大鼠一般情况比较
表1示,正常组大鼠毛发自然有光泽,行动正常,无多饮、多食及多尿。糖尿病模型组大鼠毛发晦暗粗糙,行动偏迟缓,有多饮、多食、多尿症状。治疗组大鼠上述症状有一定改善,与模型组比较差异有统计学意义(P<0.01)。
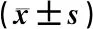
表1 各组大鼠治疗后饮水、摄食及尿量水平比较
3.2 治疗后各组大鼠血清FBG,FINS及IAI比较
表2示,模型组与正常组比较,FBG与FINS水平均升高(P<0.01),IAI水平下降(P<0.01);治疗组与模型组比较,FBG与FINS水平均下降(P<0.01),IAI水平升高(P<0.01),差异均有统计学意义。
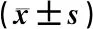
表2 治疗后各组大鼠FBG、FINS、IAI水平比较
3.3 治疗后各组大鼠血脂水平比较
表3示,模型组与正常组比较,TG与TC水平均升高(0.05,P<0.01),HDL水平下降(P<0.01),LDL水平也有下降,但与正常组比较差异无统计学意义;治疗组与模型组比较,HDL水平明显升高(P<0.01),其余指标也有所改善,但差异无统计学意义。

表3 治疗后各组大鼠血脂水平比较
3.4 各组大鼠病理检测结果比较
3.4.1 各组大鼠胰腺组织病理比较 正常组大鼠胰岛呈椭圆形,细胞形态饱满,排列紧密,边界清晰,结构规则,胞浆充实饱满。模型组大鼠胰岛萎缩,形态不规则,边界不清晰,结构紊乱,胞浆疏松,有的存在空泡。治疗组大鼠胰岛形态基本规则,胰岛与外分泌部界限较清晰,胞浆少量空泡(见图1)。
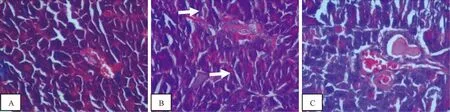
注:A.正常组;B.糖尿病;模型组;C.治疗组(箭头所示为模型组典型改变)图1 各组大鼠胰腺组织病理学结果比较(HE染色×40)
3.4.2 各组大鼠肝脏组织病理比较 正常组大鼠肝脏组织结构完整、清晰,肝小叶结构正常,肝细胞形态正常,肝索排列均匀规则,无坏死。糖尿病模型组大鼠肝小叶变形,界限不清晰,肝索排列紊乱,肝细胞肿胀变形,大小不均匀,可见局部坏死,细胞质中见大小不等的脂肪空泡。治疗组大鼠肝小叶结构清晰,肝细胞形态基本正常,大小基本均匀,细胞质中脂肪空泡减少(见图2)。

注:A.正常组;B.糖尿病;模型组;C.治疗组(箭头所示为模型组典型改变)图2 各组大鼠肝脏组织病理学结果比较(HE染色×40)
3.4.3 各组大鼠肌肉组织病理比较 正常组大鼠肌纤维排列规则,肌间隙均匀一致,无肌纤维扭曲、断裂、溶解和坏死现象。糖尿病模型组肌大鼠肌纤维排列紊乱、断裂、扭曲,肌间隙大小不一。治疗组大鼠肌纤维较模型组排列规则,无明显断裂扭曲,肌间隙均匀(见图3)。
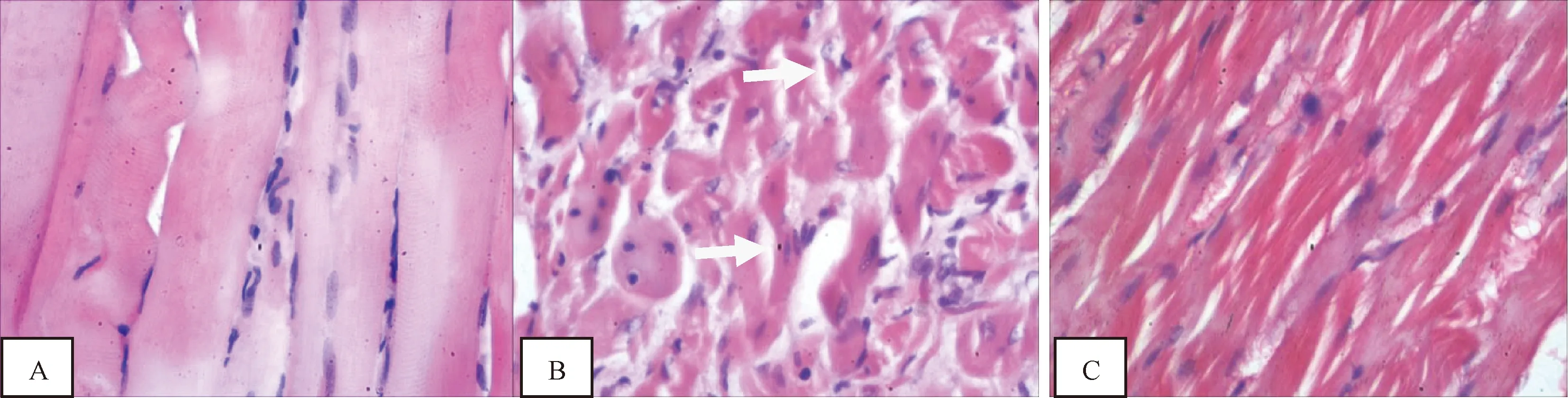
注:A.正常组;B.糖尿病模型组;C.治疗组(箭头所示为模型组典型改变)图3 各组大鼠肌肉组织病理学结果比较(HE染色×40)
3.4.4 各组大鼠脂肪组织病理比较 正常组大鼠脂肪细胞结构清晰、分界清楚呈蜂窝状。糖尿病模型组大鼠脂肪细胞体积明显增大,轮廓变形。治疗组大鼠脂肪组织细胞体积较模型组减小,轮廓清晰(见图4)。
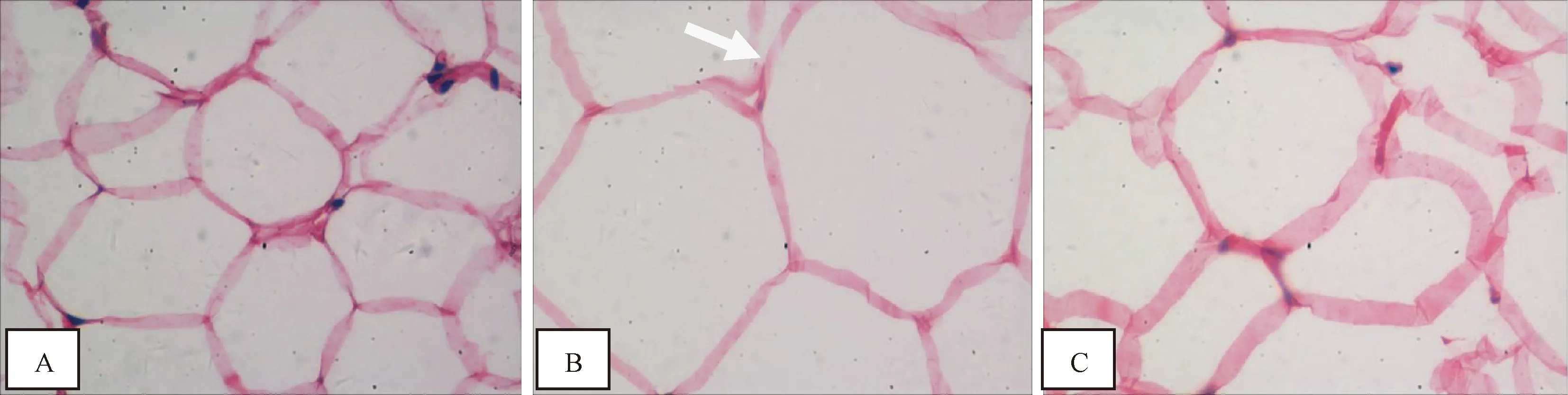
注:A.正常组;B.糖尿病模型组;C.治疗组(箭头所示为模型组典型改变)图4 各组大鼠脂肪组织病理学结果比较(HE染色×40)
3.5 各组大鼠胰腺β细胞凋亡比较
细胞在发生凋亡时会激活一些DNA内切酶,DNA断裂暴露的3’-OH可以在末端脱氧核苷酸转移酶的催化下加上荧光素标记的dUTP,TUNEL检测呈现蓝色[4-6]。凋亡细胞的细胞核在DAPI检测中呈现高亮的绿色荧光。
表4图5示,正常组、模型组、治疗组均有蓝色荧光,表明实验结果有效。与正常组比较,糖尿病模型组蓝色荧光区域明显增加,并可见绿色散在荧光,TUNEL、TUNEL/DAPI值显著升高(P<0.01),提示胰腺β细胞凋亡增加;治疗组蓝色荧光较糖尿病模型组减少,偶见绿色荧光,TUNEL、TUNEL/DAPI值低于模型组(P<0.01),差异有统计学意义,表明固本畅枢方能有效抑制糖尿病模型大鼠胰腺β细胞的凋亡。
表4 治疗后各组大鼠胰腺TUNEL/DAPI检测结果比较

注:A.正常组;B.糖尿病;模型组;C.治疗组(箭头所示为凋亡细胞)图5 TUNEL染色与DAPI染色重叠拍照(40×10)
3.6 各组MIN6细胞增殖比较
图6示,细胞形态观察显示,凋亡模型组细胞数量明显减少,细胞体积变小,细胞间隙增大,细胞核固缩;含药血清组(干预48 h)细胞形态较模型组有不同程度的改善。图7示,MTS法检测细胞增殖,0 h各组MIN6细胞药物敏感性无差异,干预12 h、24 h、48 h后,凋亡模型组MIN6细胞药物敏感性明显下降,含药血清组在24 h、48 h有不同程度上升。

注:A.正常组;B.凋亡模型组;C.含药血清组(箭头所示为凋亡细胞)图6 各组MIN6细胞干预48 h形态学观察比较(10×10)
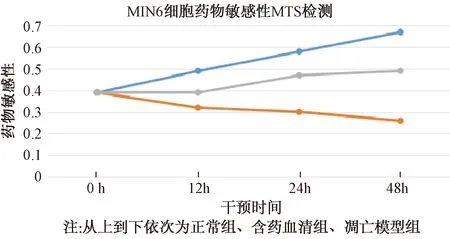
图7 MIN6细胞药物敏感性MTS检测
3.7 各组MIN6细胞凋亡比较
Annexin V被公认为检测细胞早期凋亡的灵敏指标之一。将Annexin V进行绿色荧光(fluorescein isothioc yanate, FITC)标记,以标记的Annexin V作为探针,利用荧光显微镜或流式细胞仪可检测细胞凋亡的发生。碘化丙啶(propidium iodide, PI)是一种核酸染料,不能透过正常细胞或早期凋亡细胞的完整细胞膜,但对凋亡中晚期细胞和坏死细胞,PI能够透过细胞膜染红细胞核。因此将Annexin V与PI匹配使用,可以将处于不同凋亡时期的细胞区分开来。
图8示,在双变量流式细胞仪的散点图上,Q4象限显示活细胞,Q3象限为早期凋亡细胞,Q2象限为凋亡晚期细胞和坏死细胞。结果提示,模型组Q2+Q3象限细胞数显著升高,含药血清干预组Q2+Q3象限细胞数较模型组少(29 vs. 14.05),提示固本畅枢方含药血清可以改善MIN6细胞早期及晚期凋亡。

注:A.正常组;B.凋亡模型组;C.含药血清组(箭头所示为凋亡细胞象限)图8 各组MIN6细胞凋亡比较
4 讨论
糖尿病属于中医学“消渴”范畴。既往课题组经过长期临床实践发现,脾肾阳气虚损在糖尿病发病过程中有重要作用,即阳气易虚、阳虚致消、枢机不利、阳气失用、痰饮、瘀血等病理产物亦是由于正虚、阳气的运行障碍所致[4]。因此,从正气亏虚、脾肾阳(气)不足在疾病发生发展中所起的主导作用入手,提出阳虚枢机不利为肥胖2型糖尿病的基本病机。治疗以固本畅枢为法,方拟茯苓四逆汤、施今墨降糖对药方合小柴胡汤加减进行临床研究,组方中附子、干姜、黄芪温肾助阳,重在激发先天之原动力,使其蒸腾气化津液到达全身脏腑组织;葛根、黄芩生津止渴,口干口渴诸症缓解以免精微物质外流;党参、茯苓、山药、大枣、苍术健脾益气,培补后天之本,使水谷精微得以四布、脏腑得养、湿浊得化、精微得布;法半夏、丹参、柴胡枢畅气机,运血周流全身,以免瘀血形成。前期研究显示,固本畅枢方能降低肥胖糖尿病患者血糖血脂,改善IR,减轻口干、多饮、多尿及乏力等临床症状[3]。组方的主要中药药理学研究发现,黄芪化合物可以改善胰岛素抵抗,减轻糖耐量异常[5-6];葛根中的葛根素能通过提高葡萄糖的利用率,改善葡萄糖耐量并降低血糖[7-8];山药多糖能显著降低2型糖尿病大鼠空腹血糖,其降血糖作用与二甲双胍相当[9];茯苓粗提物具有类似于二甲双胍改善外周胰岛素抵抗的作用[10];丹参可以降低糖尿病模型大鼠血糖水平[11],其有效成分丹酚酸A以剂量依赖的方式增加葡萄糖的消耗和摄取[12]。中药复方相互协同,以不同方式发挥降糖作用。
研究表明,T2DM患者体内的胰岛β细胞损伤呈进行性加重,这可能与糖脂代谢紊乱、氧化应激、炎症反应等有关[13-14]。胰岛β细胞凋亡过多会造成胰岛β细胞功能障碍,因此改善T2DM患者体内糖脂代谢环境、抑制胰岛β细胞凋亡对防治2型糖尿病有重要意义。临床实践中暂未发现可以同时改善糖脂代谢紊乱及胰岛β细胞凋亡的药物,所以本研究未设阳性对照药物组。本研究提示,糖脂代谢紊乱肥胖大鼠模型可通过长期高脂高糖饮食+小剂量STZ腹腔注射诱导成功,长期高脂高糖饮食可导致大鼠体质量增加、胰岛素抵抗及糖耐量减低,小剂量STZ可引起胰岛β细胞破坏,其病理生理改变符合肥胖2型糖尿病的胰岛素抵抗及胰岛β细胞功能缺陷两大特点[15]。糖尿病模型组大鼠的饮水、摄食、尿量明显增加,伴随高血糖、高脂血症、空腹胰岛素水平升高,胰岛素敏感性下降,而经固本畅枢法治疗后以上症状均能得到不同程度改善,体现了该治法降低血糖血脂、改善胰岛素抵抗的综合调节作用。组织HE染色观察提示,治疗组大鼠的组织病理学表现得到一定程度的修复,有利于胰岛β细胞功能恢复,进一步促进胰岛素分泌,减少肝糖原的输出,增加肌肉、脂肪组织对胰岛素的敏感性,从而起到降低血糖的作用。
细胞凋亡是一种活跃的细胞死亡模式,在多细胞生物的发育过程中发挥着重要作用[16]。大量的DNA双链断裂被认为是凋亡中最显著的特征[17]。但是TUNEL染色的局限使凋亡细胞和坏死细胞无法区分,其特异性降低,假阳性增加。故结合DAPI染色能准确反映细胞核中的DNA断裂及染色定位,阳性细胞和阴性细胞对比颜色鲜明,容易辨认[18]。本研究发现,糖尿病模型组可见明亮的蓝色及绿色荧光,TUNEL、TUNEL/DAPI值显著升高,提示胰腺β细胞凋亡增加;治疗组蓝色荧光比糖尿病模型组少,偶见绿色荧光,TUNEL、TUNEL/DAPI值低于模型组,提示固本畅枢方能有效抑制糖尿病模型大鼠胰岛β细胞的凋亡。体外实验结果提示,固本畅枢方含药血清可以改善MIN6细胞凋亡模型组的细胞形态,干预24 h及48 h后含药血清组MIN6细胞的敏感性有所提升;流式细胞术检测提示,固本畅枢方含药血清能够减少MIN6细胞凋亡模型的早晚期凋亡细胞及坏死细胞的数量。本研究应用2种方法相结合检测细胞凋亡,其结果更准确。
综上,固本畅枢法能够改善肥胖糖尿病模型大鼠糖脂代谢紊乱,其作用机制与修复胰腺、肝脏、肌肉及脂肪组织的病理形态、抑制胰岛β细胞凋亡有关。

