间充质干细胞条件培养基对HPV18型阳性人子宫颈癌HeLa细胞凋亡的影响
邱杰洪?张昌林?李田

【摘要】目的 觀察人脐带间充质干细胞条件培养基(MSC-CM)对HPV18型阳性人子宫颈癌HeLa细胞(HPV18 HeLa细胞)凋亡相关基因的调控作用,以及对HPV18 HeLa细胞凋亡的影响。方法 制备MSC-CM,设置空白组、低剂量组和高剂量组,配制相应浓度分别为0%、20%和60%的MSC-CM处理HPV18 HeLa细胞,使用CCK-8法、克隆形成实验检测细胞活力和克隆形成能力;磷脂结合蛋白Ⅴ-异硫氰酸荧光素/碘化丙啶双染法凋亡染色和流式细胞术检测细胞凋亡的变化;实时荧光定量PCR检测凋亡相关基因mRNA表达量。结果 与空白组相比,在低剂量组或高剂量组的MSC-CM作用下,HPV18 HeLa细胞的生长活性和克隆形成能力均降低,细胞凋亡率升高(P均< 0.05),且高剂量组作用效果均比低剂量组明显(P均< 0.05)。与空白组相比,HPV18 HeLa细胞在低剂量或高剂量组MSC-CM的作用下,HPV18 HeLa细胞中p53、胱天蛋白酶-3(Caspase-3)、Caspase-9、Bax的mRNA表达量升高,而B淋巴细胞瘤-2(Bcl-2)的mRNA表达量降低(P均< 0.05),高剂量组比低剂量组的作用效果更明显(P < 0.05)。结论 MSC-CM能诱发HPV18 HeLa细胞凋亡,可能与p53、Caspase-3、Caspase-9、Bax以及Bcl-2等基因表达差异相关。
【关键词】人乳头瘤病毒18型;宫颈癌;HeLa细胞;间充质干细胞;细胞凋亡
Effect of umbilical cord-derived mesenchymal stem cell-conditioned medium on apoptosis of HPV18-infected HeLa cell lines Qiu Jiehong, Zhang Changlin, Li Tian. Department of Gynecology and Pelvic Floor Disorders Center, the Seven Affiliated Hospital of Sun Yat-sen University, Shenzhen 518107, China
Corresponding author, Li Tian, E-mail: sandylitian@ 126. com
【Abstract】Objective To evaluate the effect of umbilical cord-derived mesenchymal stem cell-conditioned medium (MSC-CM) on regulating the apoptosis-related genes and determine the impact upon the apoptosis of human papillomavirus type18-infected HeLa cell lines. Methods Primary cervical cancer HeLa cells were divided into the blank, low-dose and high-dose groups. HeLa cells were cultured and treated with 0%, 20% and 60% of MSC-CM in three groups, respectively. The cell viability and clone formation ability of HeLa cells were detected by CCK-8 assay and clone formation assay. The apoptosis of HeLa cells was detected by Annexin V-Fluorescein isothiocyanate/Propidium iodide (V-FITC/PI) staining and flow cytometry. The expression levels of p53, Bax, Caspase-3, Caspase-9 and Bcl-2 mRNA in HeLa cells were quantitatively measured by RT-PCR. Results In the low- and high-dose groups, the cell viability and clone formation ability were significantly decreased, whereas the apoptosis rate was significantly elevated compared with those in the blank group (all P < 0.05). The effects in the high-dose group were more evident than those in the low-dose group (all P < 0.05). The expression levels of p53, Bax, Caspase-3 and Caspase-9 mRNA in the low- and high-dose groups were significantly up-regulated, whereas that of Bcl-2 mRNA was significantly down-regulated compared with those in the blank group (all P < 0.05). The effects in the high-dose group were more pronounced than those in the low-dose group (all P < 0.05). Conclusions Under the effect of MSC-CM, the apoptosis of HPV18 cervical HeLa cells can be induced, probably associated with the differential expression patterns of p53, Bax, Bcl-2, Caspase-3 and Caspase-9 mRNA.
【Key words】Human papillomavirus type18;Cervical cancer;HeLa cell;Mesenchymal stem cells;
Apoptosis
人乳头瘤病毒(HPV)是一种闭合双链DNA病毒[1]。在HPV感染导致的众多上皮病变中,子宫颈癌與HPV的持续感染高度相关[2]。目前约90%的子宫颈癌由高危型HPV感染引起,其中69.1%的子宫颈癌是由HPV16和HPV18引起的,这对全球女性的健康造成了严重的不良影响[3]。目前大部分HPV疫苗以预防HPV感染为主,主要保护HPV阴性人群,且不能终身预防[4]。因此,探索一种靶向清除HPV阳性子宫颈癌细胞的治疗方案,成为了目前子宫颈癌防治的迫切需求。
人脐带间充质干细胞(MSC)是一种多能干细胞,因取材广泛、增殖迅速,在细胞治疗领域备受关注[5]。研究显示,MSC能增加血循环中未成熟CD4+ T淋巴细胞数目,逆转HIV-1持续感染的结局[6]。乙型肝炎终末期肝病患者输注MSC,能降低HBV的病毒复制水平[7]。同时,MSC的抗癌特性引起了研究人员的关注[8]。MSC能有效抑制胆管癌细胞系的生长并在动物模型中定向迁移抑制瘤体生长[9]。另外MSC能使卵巢肿瘤的细胞周期停滞并促进其凋亡进程[10]。可见,MSC在病毒感染和肿瘤中发挥着重要的作用。然而目前较少报道MSC在宫颈癌中的作用,本研究通过制备MSC条件培养基(MSC-CM)处理人子宫颈癌HeLa细胞,探索MSC对人HeLa细胞的影响及可能机制。
材料与方法
一、细胞来源及主要试剂
人脐带MSC购自博雅干细胞公司,HPV18型阳性人子宫颈癌HeLa细胞(HPV18 HeLa细胞)购自美国ATCC细胞库,细胞培养板、培养瓶购自美国 Corning 公司,DMEM培养基、DMEM/F12培养基、胎牛血清、 胰蛋白酶-乙二胺四乙酸(EDTA)溶液均购自美国 Gibco公司,MSC专用胎牛血清购自BI公司。CCK-8试剂盒购自北京四正柏生物科技有限公司。磷脂结合蛋白Ⅴ(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)双染法凋亡试剂盒购自北京索莱宝科技有限公司。Trizol RNA提取试剂盒、逆转录试剂盒、荧光实时定量(qRT)-PCR试剂盒均购自北京天根生物科技有限公司。
二、细胞培养
采用含10%胎牛血清的DMEM培养基(含100 U/ml 青霉素, 100 μg/ml链霉素)培养 HPV18 HeLa 细胞;本研究采用F3~F6代的MSC进行实验,使用含10%胎牛血清的低糖DMEM/F12 培养基进行培养,置于37℃含5% CO2、湿度为95%的环境中培养,2 ~ 3 d 传代1次。当细胞长至80% ~ 90%时,利用含0.25%胰酶进行常规传代。
三、MSC-CM对HPV18 HeLa细胞活性与增殖检测
1. MSC-CM的制备
将1×106的MSC(F3代)接种于培养瓶中,待12 h细胞贴壁后,采用无血清DMEM/F12饥饿培养72 h,并收集其培养上清,300×g、离心10 min后,将上清通过针筒式滤膜过滤器(0.22 μm,水系)过滤得到MSC培养上清,并用磷酸盐缓冲液(PBS)和DMEM培养液将MSC培养上清配制成浓度为0%、20%以及60%的MSC-CM。
2. CCK-8实验
将4×103个/孔的HPV18 HeLa细胞接种于96孔板中,设置空白组、低剂量组和高剂量组,每组设置5个重复实验孔,分别加入0%、20%和60% 的MSC-CM培养,48 h后通过CCK-8试剂盒对HeLa细胞的活力进行测定,对各组吸光度(OD)值进行统计学分析。实验采用至少3批不同批次的MSC,且每批次实验至少重复3次。
3. 细胞集落形成实验
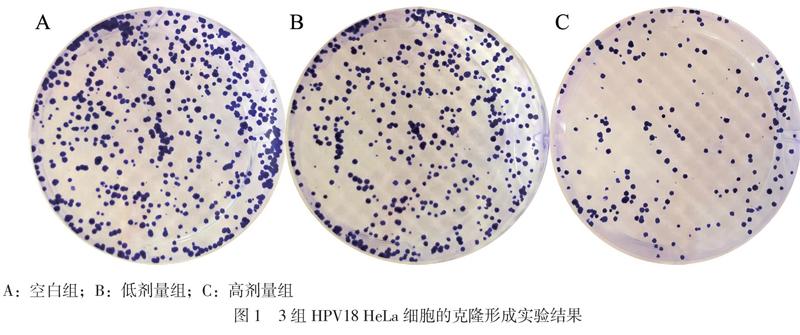
取对数生长期细胞HPV18 HeLa细胞,胰蛋白酶消化制备单细胞悬液,设置空白组、低剂量组和高剂量组,细胞以 800个/孔接种于6孔板中,待细胞培养12 h贴壁后,分别加入0%、20%和60%的 MSC-CM,每组细胞各设5个重复孔,以37℃、5% CO2培养7 ~ 9 d后,PBS 冲洗1次,用甲醇固定 20 min,结晶紫染色 15 min,拍照,并计数集落数,进行统计学分析。实验采用不同批次的MSC,且每批次实验至少重复 3 次。
4. 流式细胞术检测细胞凋亡
设置空白组、低剂量组和高剂量组,分别使用0%、20%和60%的MSC-CM处理HPV18 HeLa细胞,48 h后收集3组的细胞样品制备细胞悬液,然后各加入100 μl结合缓冲液重悬细胞,再向细胞悬液中加入FITC标记的Annexin V和PI各5 μl,混匀后避光孵育 30 min,1 h内上流式细胞仪检测细胞凋亡情况。实验采用不同批次的MSC,且每批次的实验至少重复3次,每组收集5份重复样本。
5. qRT-PCR探索MSC促进HeLa细胞凋亡的凋亡基因差异
按前述实验方案准备0%、20%和60% MSC-CM处理48 h的HPV18 HeLa细胞样品,即空白组、低剂量组和高剂量组的HPV18 HeLa细胞样品,依据天根生物科技公司提供的试剂盒说明书提取细胞总RNA,并利用qRT-PCR检测凋亡相关分子p53、胱天蛋白酶-3(Caspase-3)、Caspase-9、Bax、B淋巴细胞瘤-2(Bcl-2)的表达,并通过2-??Ct法进行相对定量分析,评价在不同浓度的MSC-CM下HPV18 HeLa细胞凋亡的比例。实验采用3批以上不同批次的MSC且每批次实验至少重复3次。实验中所涉及的基因对应的引物序列如表1所示。
四、统计学处理
采用 SPSS 25.0进行统计分析,使用GraphPad Prism 8.0.2进行作图。正态分布数据以进行描述,2组数据比较采用独立样本t检验;多组数据比较用单因素方差分析,两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
结果
一、MSC-CM对HPV18 HeLa细胞活力与增殖的影响
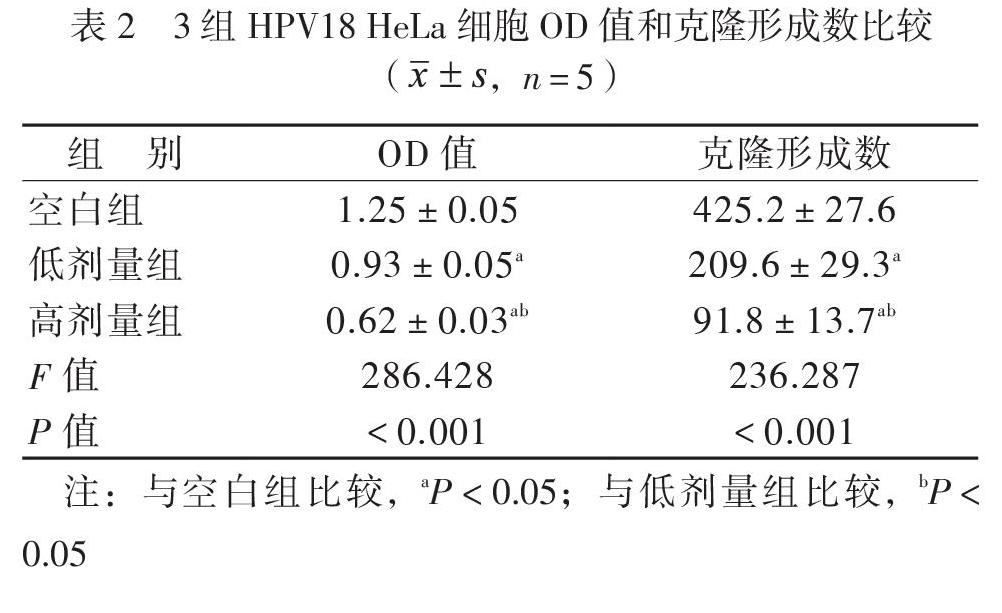
依次以0%、20%和60%的MSC-CM分别处理3组HPV18 HeLa细胞48 h后,高剂量组和低剂量组的HPV18 HeLa细胞的OD值均低于空白组(P均< 0.05),且高剂量组的OD值低于低剂量组(P < 0.05)。另外,高剂量组和低剂量组的HPV18 HeLa细胞的克隆形成能力明显比空白组降低(P均< 0.05),而且高剂量组的克隆形成数少于低剂量组(P < 0.05),见表2、图1。
二、MSC-CM对HPV18 HeLa细胞凋亡的影响。
低剂量组和高剂量组的HPV18 HeLa细胞的凋亡率分别为(8.41±3.52)%和(31.80±9.58)%,均高于空白组(0.19±0.01)%(P均< 0.05)。高剂量组的HPV18 HeLa细胞凋亡率高于低剂量组(P < 0.05),见表3、图2。
三、MSC通过调控凋亡相关基因mRNA表达促进HPV18 HeLa细胞的凋亡
低剂量组和高剂量组的HPV18 HeLa细胞中,p53、Caspase-3、Caspase-9以及Bax mRNA相对表达量均高于空白组(P均< 0.05),而Bcl-2的mRNA相对表达量均低于空白组(P均< 0.05),且高剂量组的作用效果比低剂量组更明显(P均< 0.05),见图3。
讨论
人脐带来源的MSC是典型的低分化多能干细胞之一,与骨髓MSC、脂肪MSC、人羊膜来源的MSC等相比,具有更低免疫原性,而且新生儿脐带来源丰富,人脐带来源的MSC在体外更容易扩增,更容易推广其临床应用[2]。MSC有定向归巢的特性,即定向迁移到机体发生损伤或炎症的组织,而人体内的肿瘤,被称为“过度愈合”的伤口。研究表明,MSC会被肿瘤微环境中肿瘤细胞分泌的细胞因子吸引到肿瘤基质[10]。所以MSC对肿瘤组织具有很强的定向迁移的能力,即MSC的肿瘤归巢性。这为MSC靶向治疗肿瘤或MSC作为药物载体治疗肿瘤,提供了广阔的应用前景。
MSC的抗肿瘤作用在肝癌、卵巢癌和乳腺癌等方面得到验证[11-13]。Qiao等(2004年)报道,人MSC的抗肿瘤發生作用是通过MSC的旁分泌作用实现的[14]。所以本研究提取MSC的培养上清,制备MSC-CM,初步探索MSC-CM对HPV18 HeLa细胞的影响,并揭示其中的分子机制。结果显示,在MSC-CM的作用下,HPV18 HeLa细胞的生长受到影响,这为人脐带MSC在HPV所致的子宫颈病变以及子宫颈癌的治疗提供了可靠的实验证据。同时,子宫颈癌的发生发展与持续数年的HPV慢性感染密切相关[14]。研究显示,HPV诱导子宫颈癌的中心环节就是E6与p53之间的相互作用,p53的失活是导致细胞恶性转化的主要原因[15]。Chen等(2014年)研究显示,HPV的遗传序列整合入子宫颈上皮细胞后,HPV 编码的E6蛋白,可与P53蛋白结合,从而导致染色体的不稳定性增加,阻碍细胞的自发性凋亡,最终导致细胞永生化[17]。除此之外,Bcl-2蛋白家族在细胞程序性死亡中起着非常重要的作用。Bcl-2蛋白家族主要通过改变线粒体外膜通透性从而诱导细胞发生凋亡。在Bcl-2家族中,Bax通过寡聚化在线粒体外膜形成孔道,改变线粒体的通透性,使线粒体内容物释放,引发细胞内Caspase级联反应,如细胞色素C从线粒体释放后,可与Caspase-9组成凋亡体,使Caspase-3的表达上调,从而诱导细胞凋亡,因此Caspase-3、Caspase-9和Bax基因也被称为促凋亡基因,然而Bcl-2则可阻断上述通路,抑制Bax的促凋亡进程,Bcl-2也因此被称为抗凋亡基因[16]。本研究通过qRT-PCR实验证实,MSC能有效上调p53、Caspase-3、Caspase-9和Bax等促凋亡基因的表达,而且有效抑制抗凋亡基因Bcl-2的表达,从而促进HPV18 HeLa细胞的凋亡。
综上所述,人脐带MSC通过旁分泌作用上调p53、Caspase-3、Caspase-9和Bax等促凋亡基因的表达,而且有效抑制抗凋亡基因Bcl-2的表达,从而促进HPV18 HeLa细胞的凋亡,为MSC治疗HPV感染相关的癌症病变提供新思路。然而MSC在其他类型HPV所导致的癌症病变中的作用,仍需进一步深入探讨,以期为MSC对HPV的防治应用提供更科学的依据。
参 考 文 献
[1] Schiffman M, Doorbar J, Wentzensen N, de Sanjosé S, Fakhry C, Monk BJ, Stanley MA, Franceschi S. Carcinogenic human papillomavirus infection. Nat Rev Dis Primers, 2016, 2:16086.
[2] Mangino G, Chiantore MV, Iuliano M, Fiorucci G, Romeo G. Inflammatory microenvironment and human papillomavirus-induced carcinogenesis. Cytokine Growth Factor Rev, 2016, 30:103-111.
[3] de Martel C, Georges D, Bray F, Ferlay J, Clifford GM. Global burden of cancer attributable to infections in 2018: a worldwide incidence analysis. Lancet Glob Health, 2020, 8(2):e180-e190.
[4] Qiao YL, Wu T, Li RC, Hu YM, Wei LH, Li CG, Chen W, Huang SJ, Zhao FH, Li MQ, Pan QJ, Zhang X, Li Q, Hong Y, Zhao C, Zhang WH, Li YP, Chu K, Li M, Jiang YF, Li J, Zhao H, Lin ZJ, Cui XL, Liu WY, Li CH, Guo DP, Ke LD, Wu X, Tang J, Gao GQ, Li BY, Zhao B, Zheng FX, Dai CH, Guo M, Zhao J, Su YY, Wang JZ, Zhu FC, Li SW, Pan HR, Li YM, Zhang J, Xia NS. Efficacy, safety, and immunogenicity of an escherichia coli-produced bivalent human papillomavirus vaccine: an interim analysis of a randomized clinical trial. J Natl Cancer Inst, 2020, 112(2):145-153.
[5] 廖文娟,李田,李小毛. 间充质干细胞在女性不孕症相关疾病中的基础研究进展. 新医学, 2017, 48(8):524-527.
[6] Chandra PK, Gerlach SL, Wu C, Khurana N, Swientoniewski LT, Abdel-Mageed AB, Li J, Braun SE, Mondal D. Mesenchymal stem cells are attracted to latent HIV-1-infected cells and enable virus reactivation via a non-canonical PI3K-NFκB signaling pathway. Sci Rep, 2018, 8(1):14702.
[7] Lin BL, Chen JF, Qiu WH, Wang KW, Xie DY, Chen XY, Liu QL, Peng L, Li JG, Mei YY, Weng WZ, Peng YW, Cao HJ, Xie JQ, Xie SB, Xiang AP, Gao ZL. Allogeneic bone marrow-derived mesenchymal stromal cells for hepatitis B virus-related acute-on-chronic liver failure: a randomized controlled trial. Hepatology, 2017, 66(1):209-219.
[8] 张艺凡, 胡方方, 秦方圆, 刘广芝. 人脐带间充质干细胞与肿瘤治疗研究进展. 中华实用诊断与治疗杂志, 2017, 31(4): 403-406.
[9] Liu J, Han G, Liu H, Qin C. Suppression of cholangiocarcinoma cell growth by human umbilical cord mesenchymal stem cells: a possible role of Wnt and Akt signaling. PLoS One, 2013, 8(4):e62844.
[10] Kalamegam G, Sait KHW, Ahmed F, Kadam R, Pushparaj PN, Anfinan N, Rasool M, Jamal MS, Abu-Elmagd M, Al-Qahtani M. Human Wharton's Jelly Stem Cell (hWJSC) extracts inhibit ovarian cancer cell Lines OVCAR3 and SKOV3 in vitro by inducing cell cycle arrest and apoptosis. Front Oncol, 2018, 8:592.
[11] Ullah M, Liu DD, Thakor AS. Mesenchymal stromal cell homing: mechanisms and strategies for improvement. iScience, 2019, 15:421-438.
[12] Yulyana Y, Ho IA, Sia KC, Newman JP, Toh XY, Endaya BB, Chan JK, Gnecchi M, Huynh H, Chung AY, Lim KH, Leong HS, Iyer NG, Hui KM, Lam PY. Paracrine factors of human fetal MSCs inhibit liver cancer growth through reduced activation of IGF-1R/PI3K/Akt signaling. Mol Ther, 2015, 23(4):746-756.
[13] He N, Kong Y, Lei X, Liu Y, Wang J, Xu C, Wang Y, Du L, Ji K, Wang Q, Li Z, Liu Q. MSCs inhibit tumor progression and enhance radiosensitivity of breast cancer cells by down-regulating Stat3 signaling pathway. Cell Death Dis, 2018, 9(10):1026.
[14] Brianti P, De Flammineis E, Mercuri SR. Review of HPV-related diseases and cancers. New Microbiol, 2017, 40(2):80-85.
[15] Hoppe-Seyler K, Bossler F, Braun JA, Herrmann AL, Hoppe-Seyler F. The HPV E6/E7 oncogenes: key factors for viral carcinogenesis and therapeutic targets. Trends Microbiol, 2018, 26(2):158-168.
[16] Delbridge AR, Grabow S, Strasser A, Vaux DL. Thirty years of BCL-2: translating cell death discoveries into novel cancer therapies. Nat Rev Cancer, 2016, 16(2):99-109.
(收稿日期:2020-11-05)
(本文編辑:林燕薇)

