拟南芥GLABROUS 1 两个新等位突变体的筛选和鉴定
郑叶子 王丹 潘咪 王艳玲 安丽君
(1. 西北农林科技大学旱区作物逆境生物学国家重点实验室,杨凌 712100;2. 西北农林科技大学生命科学学院,杨凌 712100)
细胞命运决定与植物器官发育与形态建成密切相关,因此了解其潜在的调控机制一直以来是植物发育生物学研究的热点。表皮毛是植物地上部组织表皮细胞向外突出形成的一种特殊结构,是研究植物细胞命运决定优良模型系统[1-3]。拟南芥叶片表皮毛是由特定的表皮细胞分化形成的单细胞结构,其在叶片上呈现规律的分布,相邻表皮毛之间通常间隔三个或四个表皮细胞,在野生型中很少出现表皮毛簇的现象[4-5]。目前的研究已经确定了许多遗传因子参与这一过程[3,6],其中GLABROUS 1(GL1)是一个关键组成[1,7-8]。GL1编码R2R3 MYB 类型的转录因子,正调控表皮毛发生,GL1功能缺失的植株几乎不能形成表皮毛[1,7,9]。然而,在野生型中过表达GL1会抑制表皮毛的形成[8,10],表明GL1转录本的相对剂量在表皮毛形成具有重要作用。此外,研究发现GL1在叶片所有的表皮细胞中都有表达,在成熟的表皮毛中没有表达,表明在表皮毛的发育过程中GL1的表达受到严格调控。之前的研究表明GL1的表达受细胞周期调控,在gl3-sst sim突变体中,GL1能够在成熟表皮毛中高表达,并且CYCD3;1的表达水平升高能够维持幼嫩叶片中GL1的表达[11],但是具体的调节机制仍然不明了。本研究中我们筛选和鉴定了GL1的两个新等位突变体f08-01(gl1-44)和vat002-07(gl1-45),并且证实位于GL13'非编码区的153 bp 序列对于GL1的表达至关重要,它可能充当反式作用因子对GL1进行转录和转录后调控的平台,旨对进一步解析GL1在植物表皮毛细胞命运决定中的作用奠定基础。
1 材料与方法
1.1 材料
本研究使用的拟南芥野生型为Columbia-0(Col-0)生态型,f08-01abs3-1D突变体是在拟南芥abs3-1DEMS 诱变库中筛选得到[12],而vat002-07 var2突变体是在以叶色突变体var2为背景的T-DNA activation tagging 突变体库中获得[13]。为了清除abs3-1D和var2遗传背景,分别得到f08-01和vat002-07的单突变体,将f08-01 abs3-1D和vat002-07 var2植株分别与Col-0 野生型植株连续杂交3 代,并对得到的f08-01和vat002-07单突变体的表皮毛表型进行鉴定。
所有的植物均生长在植物培养间中,温度为22± 1℃下,光照条件为24 h 持续光照,光强度约为100 μmol·m-2·s-1。
1.2 方法
1.2.1 表皮毛表型分析 在不同发育阶段中,使用SZ61 体视显微镜(Olympus)观察不同基因型的表皮毛在叶片和花序茎上的分布规律。为了统计莲座叶上的表皮毛数目,将不同基因型植物种子分别播种在营养土上,在培养间生长至4 周大时,将莲座叶按叶序(第3 片-第10 片)进行分离,然后首先在SZ61 体视显微镜(Olympus)下统计每片叶子上的表皮毛数目,其次将对应的叶片用Canoscan 9000F(Canon)扫描,计算叶面积;最后用叶片上表皮毛的总数量除以相应的叶面积得到单位面积表皮毛数,即表皮毛密度。对于主花序茎上表皮毛数量的统计,待在培养间生长的不同基因型植物主茎生长到约18 cm 高时,统计第一个节间从底部向上2 cm 处1 cm 长度中的表皮毛数量。每个基因型至少使用15 株独立的植物,所有实验至少重复2 次,数据以平均值±标准差表示,采用t检验评估野生型和突变体之间的差异,***:P<0.001。
1.2.2F08-01和VAT002-07基因的克隆 对于F08-01基因的分离采用图位克隆的方法,首先通过BSA法(Bulk segregation analysis),利用分布在拟南芥5条染色体上的已知的分子标记对突变基因进行粗定位,确定与突变基因连锁的染色体区间及其所在的染色体;其次查阅连锁区间内的基因注释,推测可能的突变基因;最后,以f08-01突变体基因组DNA为模板,扩增可能的突变基因序列进行测序,确定突变位点。由于vat002-07突变体来自T-DNA 插入突变库,所以我们首先通过抗除草剂(Basta)抗性处理,确定突变基因与T-DNA 连锁;其次利用TAIL-PCR 对突变基因进行分离,最后以vat002-07突变体基因组DNA 为模板,通过PCR 扩增靶基因的全基因组序列并进行测序,确定T-DNA 的插入位点。所用引物见表1。
1.2.3 遗传互补实验 为了确认克隆得到的突变基因是造成f08-01和vat002-07植物突变表型产生的原因,进行了遗传互补实验。首先分别构建了4 个植物二元表达载体PGL1∷GL1,PGL1:GL13'Δ(GL13'Δ表示包含有GL13'非编码区序列的DNA 片段)和P35S∷GL1以及PGL1:GL13'm(GL13'm表示GL13'非编码区中的153 bp 序列中的E2F 结合位点缺失),其次通过花序侵染法将这些表达载体分别转入到f08-01和vat002-07中,通过抗生素抗性筛选和基因组PCR 鉴定确定阳性转化植物,利用T3 代植株检测表皮毛发育模式及GL1基因的表达水平。每次转化至少观察20 个转基因株系,选择其中2 个株系用于详细分析。所用引物见表1。
1.2.4 放线菌酮(Cycloheximide,CHX)处理和mRNA 积累检测 CHX 处理实验参考文献[14]进行,具体步骤为首先将不同基因型植物种子分别播种在固体MS 培养基表面无菌培养12 d;然后将幼苗分别转移到液体MS 中适应生长2 d;最后将幼苗分别转移至新的含有100 μm CHX的液体MS中进行处理,2 h 后收集样本进行mRNA 水平检测。
利用实时荧光定量RT-PCR(Real-time qRTPCR)检测GL1mRNA 的表达水平。收集处理过的不同基因型背景的幼苗,Trizol 法提取叶片总RNA 并进行DNaseI 处理,然后利用Transcriptor First Strand cDNA Synthesis Kit(Roche)合成第一链互补cDNA作为模板进行real time qRT-PCR,以ACTIN2基因作为内参。

表1 所用引物序列表
2 结果
2.1 f08-01和vat002-07突变体的获得
为了发掘控制植物表皮毛形成的新遗传因子,我们采用非定向筛选的方法进行了大规模的正向遗传筛选,其中在以株型突变体abs3-1D为背景的EMS 诱变库中获得了一株几乎没有表皮毛形成植物,将其命名为f08-01abs3-1D;同时在以叶色突变体var2为背景的T-DNA activation tagging 突变体库中发现一株表皮毛数量明显减少的植物,将其命名为vat002-07var2。通过检测自交植物的表皮毛表型确认f08-01abs3-1D和vat002-07var2的表皮毛缺陷表型能稳定遗传后,将f08-01abs3-1D和vat002-07var2突变体分别与Col-0 进行杂交以去除abs3-1D和var2的遗传背景,获得f08-01和vat002-07突变体。通过表型鉴定发现f08-01和vat002-07突变体的表皮毛表型分别与f08-01 abs3-1D和vat02-07var2相似,与野生型相比,f08-01和vat002-07莲座叶的表皮毛数量显著减少(图1-A-C),与此一致的是,f08-01和vat002-07花序梗上的表皮毛数量也显著低于野生型(图1-D-F),这些结果表明,F08-01和VAT002-07突变基因可能是表皮毛形成的正调控因子。此外,定量统计分析显示,f08-01的表皮毛缺陷表型比vat002-07更严重,因为在f08-01的前5 片莲座叶中几乎没有表皮毛(图1-G),与在莲座叶中的表型相似,f08-01主花序茎上的表皮毛数量也显著少于vat002-07(图1-H)。
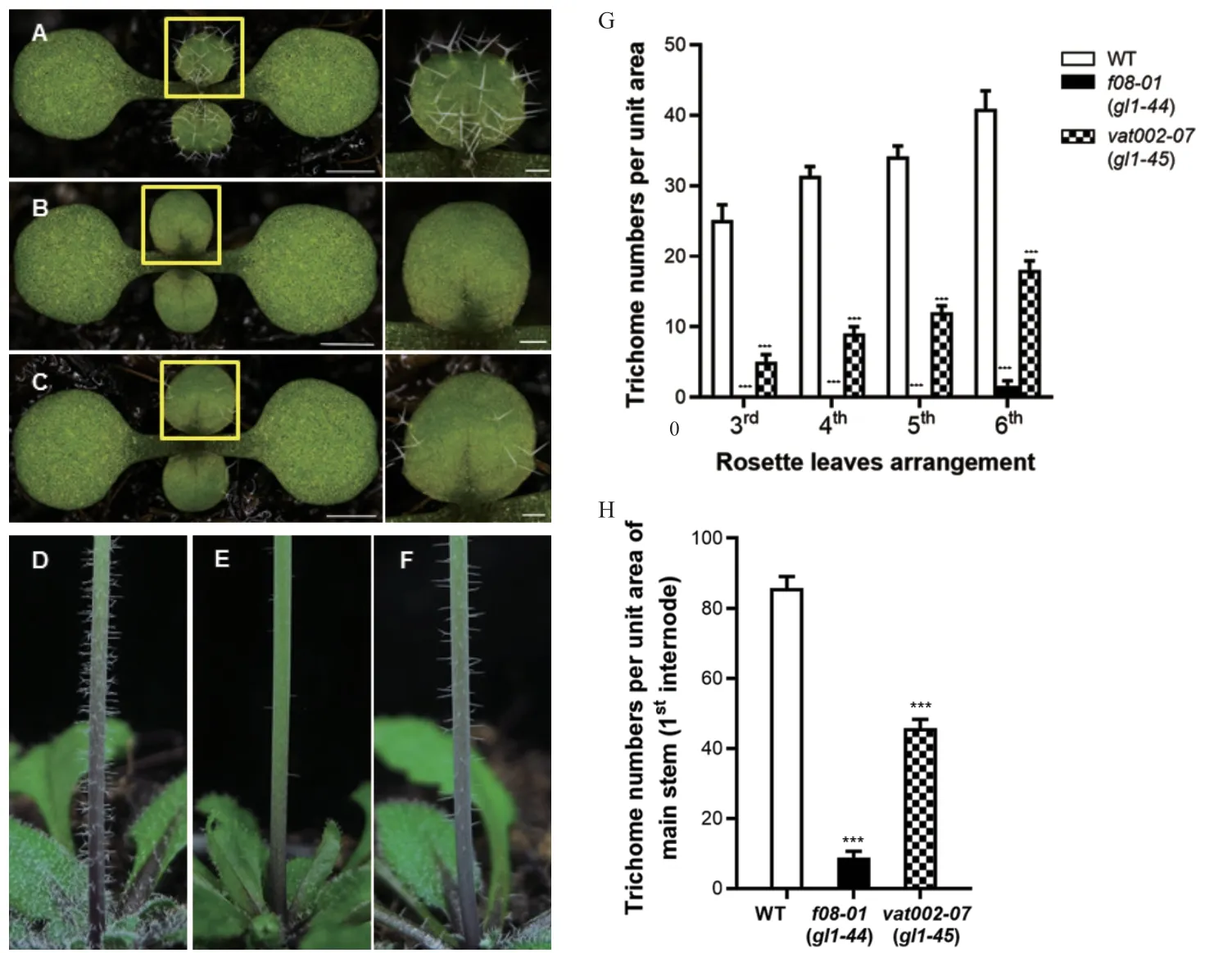
图1 f08-01 和vat002-07 突变体的表皮毛表型
2.2 f08-01和vat002-07是GL1的两个新等位突变体
由于f08-01和vat002-07的表皮毛发生缺陷十分明显,暗示F08-01和VAT002-07基因是调控表皮毛形成的重要调控因子,因此我们首先对F08-01和VAT002-07基因进行了克隆。对于F08-01基因的克隆采用图位克隆法进行。粗定位结果表明F08-01位点与III 号染色体上的分子标记MFE16#1 和T21C14#1 连锁,该染色体区间的长度为2 501 kb(图2-A)。通过在拟南芥数据库中筛查此区间中的基因,发现At3g27920基因在此区间内,该基因编码GL1蛋白。由于之前的研究显示GL1强的功能缺失突变体表现为无表皮毛形成[1,7,9],因此推测f08-01突变体的表皮毛缺陷表型可能是由GL1基因突变引起的。为了验证此种推测,对f08-01突变体中GL1基因的全序列进行了测序,结果表明f08-01中GL1基因第3 个外显子中发生了C 到T 的突变(图2-A),导致编码的氨基酸由谷氨酰胺(Gln)突变为终止密码子,致使GL1 蛋白合成提前终止(图2-A)。
采用TAIL-PCR 方法克隆VAT002-07突变基因。首先对vat002-07植株进行抗除草剂谷膦酸盐(Basta)处理,结果发现所有的植株在处理后仍然存活,表明突变位点与T-DNA 连锁,接着以vat002-07植株的基因组DNA 为模板进行TAIL-PCR,经过4 轮PCR 后,在凝胶上检测到11 条清晰条带(图2-B)。对这些片段分别进行测序并将测序结果提交NCBI 数据库进行同源性比对,发现一个序列与拟南芥GL1基因5'端非翻译区显著相似(图2-C 和2-D),这表明vat002-07的表皮毛表型可能是由于GL1基因的 T-DNA 插入导致。为了进一步验证之前的假设,从vat002-07BC2 群体中随机选择4 株植物,通过基因组PCR 对T-DNA 插入基因型进行分析。当使用引物GL1 R 和LB1 进行PCR 时出现清晰条带,表明该植物携带T-DNA(图2-E 和2-F)。对这些PCR 片段测序后,发现插入位点与TAIL-PCR 结果一致。
为了进一步证实f08-01和vat002-07中GL1基因的突变是表皮毛发生缺陷的原因,进行了遗传互补实验。结果表明转基因植株在莲座叶和主序茎上的表皮毛表型与野生型植株非常相似(图3-A),同时还检测了转基因植物中GL1的表达水平,发现f08-01和vat002-07中GL1基因的表达水平显著降低,而转基因植物中GL1的转录本明显升高(图3-B和3-C)。
综合上述结果,我们确认F08-01和VAT002-07就是GL1,f08-01和vat002-07是GL1的新等位突变体,因此将f08-01和vat002-07重命名为gl1-44和gl1-45。
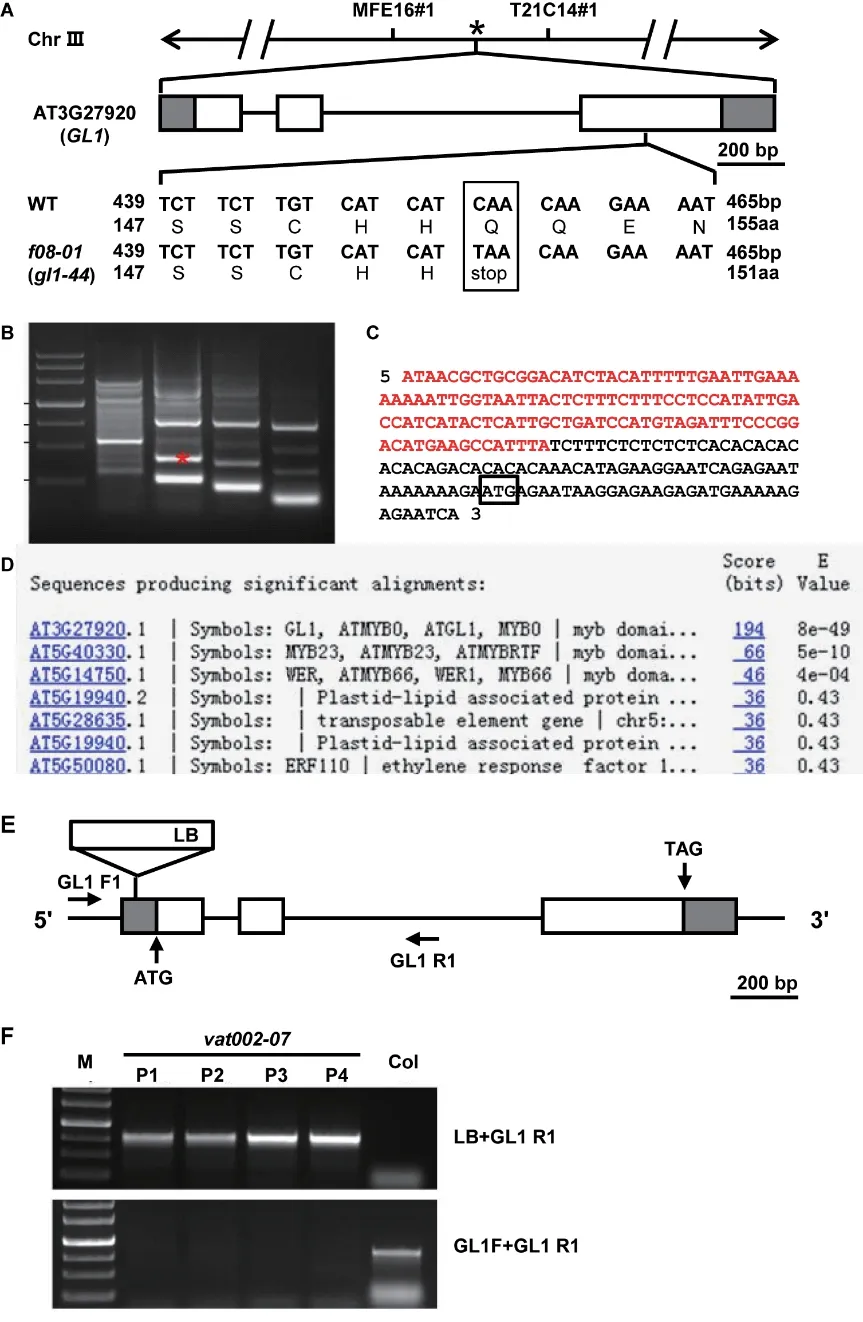
图2 F08-01 和VAT002-07 突变位点的克隆
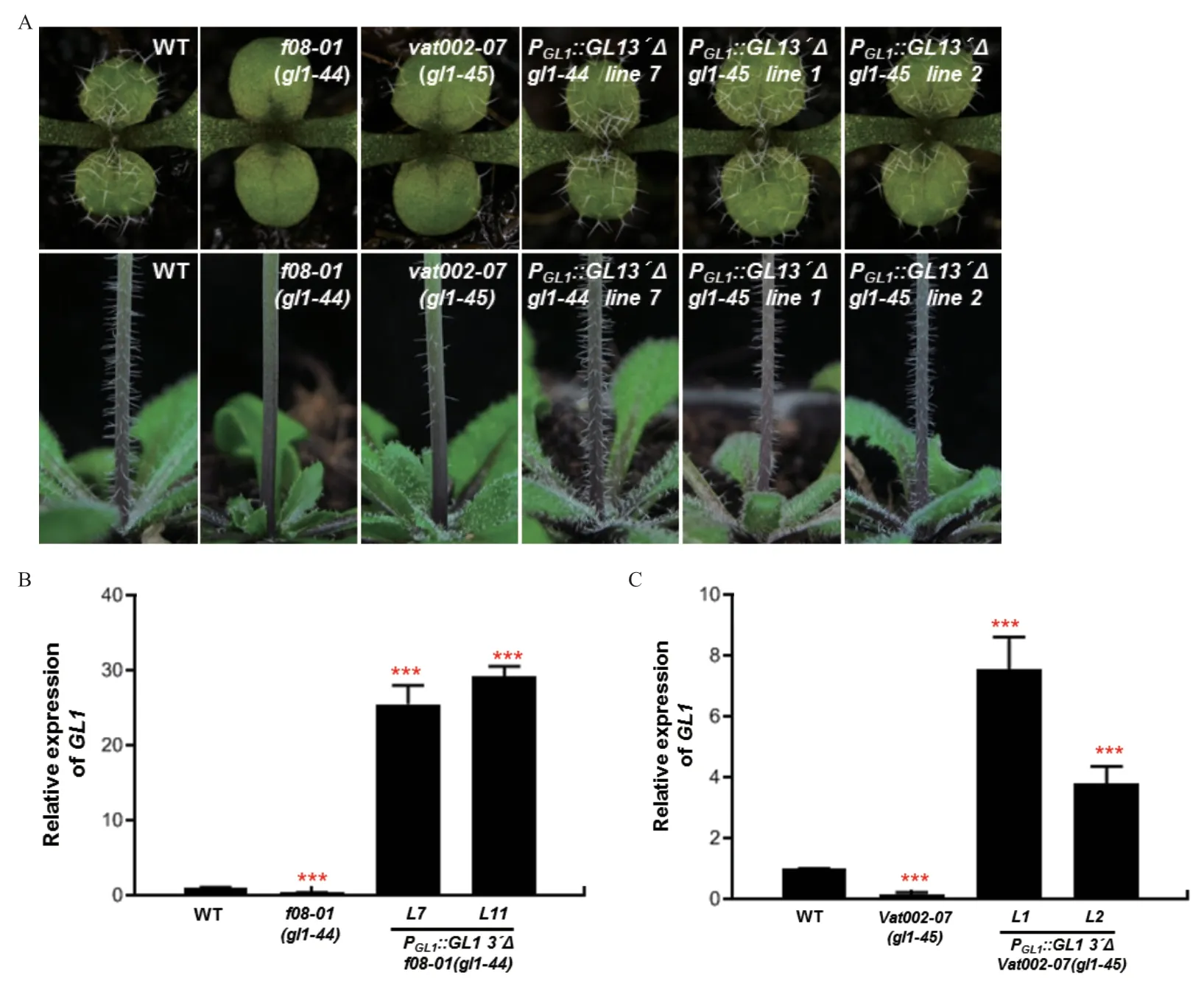
图3 f08-01 和vat002-07 突变体的遗传互补
2.3 GL1的3'非编码区介导GL1的转录和转录后调控
在遗传互补实验中我们发现GL1的3'非编码区对其生物学功能至关重要。当在gl1-45植物中表达由GL1自身启动子驱动的GL1完整开放阅读框(ORF)时,不能回复其表皮毛缺陷表型(图4-A),同时以CaMV 35S 启动子驱动GL1表达时,也不能回复gl1-45突变体的表型(图4-A),而当以GL1自身启动子驱动包含GL13'非编码区的153 bp(从终止密码子下游1 028 bp 开始)的GL1表达时能成功回复gl1-45的表皮毛缺陷(图3-A),这表明在表皮毛发育过程中,3'非编码区对GL1的功能至关重要。
Wenger 和Marks[11]提 出GL13' 非 编 码 区 的153 bp 片段末端存在两个反向重叠的潜在E2F 转录因子的结合位点,可是介导对于GL1的转录激活。因此,为了揭示GL13'非编码区的功能,特别是这153 bp 区间的生物学功能,我们将这153 bp中的E2F 结合位点∷进行了突变,构建了植物表达载体PGL1∷GL13'm,并将其转入了gl1-44植物中,结果发现E2F 结合位点缺失时仍然可以成功回复gl1-44突变体的表皮毛缺陷表型(图4-B),这提示153 bp 中E2F 结合位点可能与GL1的功能无关。大量的研究表明真核生物中基因的3'非编码区参与对基因表达的转录和转录后调控,介导mRNA 和蛋白的稳定性。为此,我们检测了P35S∷GL1gl1-45和PGL1∷GL1gl1-45转基因植物中GL1的表达水平。与野生型植株相比,P35S∷GL1gl1-45和PGL1∷GL1 gl1-45植株中GL1的表达水平明显降低(图4-C)。为进一步研究P35S∷GL1 gl1-45植株中GL1mRNA 水平下降是由于翻译依赖的 mRNA 降解还是转录激活失败导致,我们对P35S∷GL1 gl1-45和PGL1∷GL1 gl1-45植物进行了100 μmol/L CHX 处理,结果发现野生型植物处理2 h 后,GL1mRNA 显著累积(图4-C),而P35S∷GL1 gl1-45转基因植物中GL1mRNA积累量约为野生型中的4 倍(图4-C),这表明P35S∷GL1 gl1-45中GL1mRNA 的减少降解可能是由于翻译依赖的RNA 降解机制引起。相比较之下,PGL1∷GL1 gl1-45植物中GL1mRNA 积累量虽然能被检测到,但其GL1mRNA 水平仍处在一个低水平(图4-C),表明P35S∷GL1 gl1-45持续低水平的GL1表达可能是转录激活失败导致。综合以上研究结果,我们认为GL1的3'非编码区可能同时作为转录水平调控和转录后水平调控的平台,从而微调GL1的表达,实现其精确的生物学功能。
3 讨论
3.1 GL1的两个新等位基因突变体的筛选
对于多细胞生物来说,构成不同组织和器官的不同类型细胞其命运的正确决定对植物的发育至关重要,为了研究植物细胞命运决定的分子调控机制,实验室前期建立了以植物表皮毛为系统的研究体系。表皮毛是由表皮组织发育而来的特化结构,在不同的物种或同一物种的不同组织中的表皮毛会呈现出不同的形态特征[15]。在拟南芥中,表皮毛是单细胞发育形成的结构,主要分布在莲座叶的上表皮、下表皮,花序茎以及萼片上,是研究植物细胞命运决定的优良模式系统[4]。本研究中通过大规模的遗传筛选获得了两株具有明显表皮毛形成缺陷的突变体。通过基因克隆和遗传互补实验,确认本研究中筛选获得的这两株突变体是GL1基因的两个新等位突变体,因此分别将其命名为gl1-44和gl1-45。
GL1是控制植物表皮毛形成的核心基因。最开始发现的GL1功能缺失突变体gl1-1是由于GL1基因功能完全缺失导致的,其地上部所有组织都没有表皮毛产生[9]。GL1 蛋白包含两个与MYB 蛋白同源性的DNA 结合域的重复序列(从第14 到第117氨基酸残基)[9],表明GL1 的主要功能可能主要是结合和激活下游基因的表达,但是研究发现在MYB结构域之外的其他区域的突变也可以导致严重的表皮毛缺陷,如本研究中发现的gl1-44和gl1-45。gl1-44表皮毛缺陷是由于GL1中与MYB 结构域相邻的第3 个外显子发生了突变,gl1-45中是由于5'非编码区插入T-DNA,两种突变都导致了GL1转录本积累明显减少。这些数据表明GL1的整体表达水可能是最初表皮毛形成的关键,此外还可能需要其他顺式作用元件来精确调控GL1表达。
3.2 3'非编码区对GL1表达至关重要
在互补实验中,我们发现GL1的3'非编码区对于GL1的表达至关重要,暗示GL1的3'非编码区具有一定的生物学功能。本研究中使用CaMV 35S 启动子组成型表达GL1,也不能回复gl1-45的表皮毛发育缺陷表型,这表明GL13'非编码区可能对GL1表达的转录激活及其mRNA 的稳定性至关重要。Wenger 和Marks[11]指出,在GL1的3'非编码区的一个153 bp 区间中存在两个反向重叠的潜在的E2F 结合位点,但是我们的研究表明E2F 的结合位点可能不是GL1功能的关键;Oppenheimer 等[7]提出,托叶特异的转录因子能够激活GL1的转录,因此基于ChIP-seq 的数据,我们预测了GL1潜在的反式作用因子,结果发现有两个转录因子ABF2 和ABF4 能够与GL13' 非编码区的153 bp 片段结合。ABF2 和ABF4 属于b-ZIP 转录因子,最初被确定为ABA 响应元件(ABRE)结合因子(ABFs),用于调节包含ABRE 的基因的表达以响应ABA[16]。然而,最近的研究表明ABFs 也能够转录激活发育调节因子。ABF3 和ABF4 能够靶向结合抑制开花整合SUPPRESSOR OF OVEREXPRESSON OF CONSTANS1(SOC1)基因的表达,促进干旱条件下的开花[17]。此外,也有研究报道指出一类早期基因(IEGs)的翻译会依赖mRNA 的降解[18]。IEGs 表达的转录后调控能够确保短暂的蛋白质的产生,这可能对于保护机体免受一些不受细胞周期控制的事件的发生至关重要[19]。大量的研究表明,GL1 可能是一个IEG,因为在表皮毛的发育和响应不同信号的过程中,GL1 仅在特定范围表达[1,7,11],并且本研究发现P35S∷GL1 gl1-45 转基因植株中抑制翻译能够显著增强GL1 mRNA 的积累(图4-C),所以进一步深入研究ABF2 和ABF4 与GL1 的直接结合以及GL1 mRNA 的翻译依赖衰退机制,将有助于进一步剖析GL1 在表皮毛形成中的生物学功能。
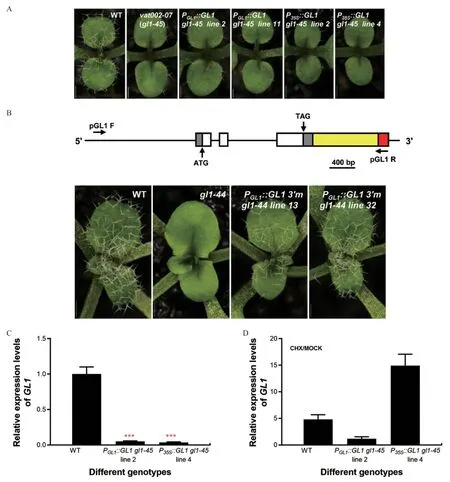
图4 GL1 的3'非编码区对其表达的影响
4 结论
本研究通过大规模的遗传筛选,获得了两个植物表皮毛形成的关键控制基因GL1的新等位突变体gl1-44和gl1-45,并且通过初步的药理学实验证明GL1 基因3'非编码区的153 bp 序列对于GL1的表达至关重要,它可能充当反式作用因子对GL1进行转录和转录后调控的平台,精确调控GL1的表达,从而实现其特定的生物学功能。

