基于毛细管电泳的7种猪源性疫病的多重PCR检测方法的建立
涂 藤,尹清清,张鹏飞,王 印,*,杨泽晓,姚学萍,罗 燕
(1.四川农业大学 动物医学院,四川 成都 611130; 2.动物疫病与人类健康四川省重点实验室,四川 成都 611130)
猪链球菌(Streptococcussuis,SS)、猪瘟病毒(classical swine fever virus,CSFV)、日本脑炎病毒(Japanese encephalitis virus, JEV)、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)、副猪嗜血杆菌(Haemophilusparasuis,HPS)、猪轮状病毒(porcine rotavirus, PoRV)、沙门氏菌(Salmonella,SE),是养猪业中常见的猪传染病,常常引起猪群之间的交叉感染以及多重病原的混合感染[1-2]。在实际的生猪饲养与生产中,猪群所面临病原微生物的威胁来源往往是多方面的,既有同类之间的交叉感染,也有来自人类生产生活中的人畜共患病,有的甚至能危害公共卫生安全。在集约化养殖的饲养模式中,疾病的传播往往是非常迅速的[3]。CSFV是一种以高热稽留、出血、呼吸和繁殖障碍及高死亡率为主要特征的高度接触性传染病[4];PRRSV是一种高致病性高传染性的疾病,引起母猪繁殖障碍也引起仔猪呼吸障碍,当患有PRRS的病猪继发感染呼吸道疾病,例如副猪嗜血杆菌病,也会导致更严重的肺脏病变,混合感染也导致死亡率明显升高[5];HPS为条件致病菌,感染之初首先在猪上呼吸道建立感染,当病猪PRRSV时,HPS会呈现继发感染并且加重临床病症[6];人类是JEV的终末宿主,因此该病毒对公共卫生健康和养殖业存在极大的威胁[7];PoRV引起的腹泻已经广泛的分布于五大洲,并且已经造成了严重的经济损失[8],成为仔猪腹泻类疾病中危害最大的疫病之一;SS是一种重要的人畜共患病,在部分亚洲国家SS感染人的死亡率高达26%[9];猪沙门氏菌即猪霍乱沙门氏菌,它不但能够引起猪的临床疾病,还是许多猪肉及其产品的感染源,阻碍人类的身体健康。从临床样品检测结果来看,上述几种人畜共患病常与各种猪病混合感染,因此在鉴别诊断猪病的同时,做好常见人兽共患病的检测工作,不仅对实验研究人员还是对社会公共卫生都有重大意义。
针对引起猪呼吸道疾病的相关病原的诊断,近年来以多重PCR技术为主的检测技术已有一定的发展[10-11],但大多只能检测2到5重疾病病原[12-14]。由于普通多重PCR技术依赖于琼脂糖凝胶电泳,在条带的区分度以及灵敏度上,该方法受到了很大的限制,也因此很难实现真正的高通量检测。毛细管电泳技术的检测方式是依赖激光诱导荧光技术(LIF)实现对样品的检测,根据Gassmann 等[15]的研究,LIF在毛细管电泳中的使用便很大程度地提高了该方法的检测限度和灵敏性。该技术是一种重要的分离小分子样品的分析技术,高度的灵敏性与极低的检测限度是其最重要的特点。为了鉴别诊断3种猪呼吸道疾病和4种猪源人畜共患病病原,将毛细管电泳技术与多重PCR技术相结合,克服传统电泳的瓶颈,建立一种能够同时鉴别检测7种猪源疫病的高通量检测方法。
1 材料与方法
1.1 主要试剂
大肠埃希菌DH5α由四川农业大学动物检验检实验室保存。DNA Master Mix、pMD19-T载体、DNA Marker DL 2000、反转录试剂盒以及RNA iso Plus均购自宝生物工程(大连)有限公司。病毒DNA提取试剂盒、病毒RNA提取试剂盒、细菌DNA提取试剂盒、DNA纯化回收试剂盒、质粒小提试剂盒均购自天根生化科技(北京)有限公司。QIAxcel DNA High Resolution Kit(100~500 bp),Intensity Calibration Marker,Alignment Marker,Size Marker,Wash Buffer(WP、WI),Separation Buffer,Mineral Oil,均购自凯杰生物技术(上海)有限公司。其余试剂均为国产分析纯。
1.2 主要仪器
样品处理系统MP Fastprep-24,购自美国MP Biomedicals公司;全自动实时毛细管电泳系统QIAxcel Advanced购自凯杰企业管理(上海)有限公司;生物安全柜购自美国Thermo Scientific公司;梯度PCR扩增仪 ABI Veriti购自美国Applied Biosystems公司;Ⅱ级生物安全柜AC2-4S1购自新加坡艺思高科技有限公司;其他常用仪器均为四川农业大学动检实验室提供使用。
1.3 所用病毒、细菌毒株
SS(血清2、7、9型)、CSFV(细胞源、脾淋源、石门株)、PRRSV(CH-1R、TJM-F92株)、HPS(血清4、5、12型)、PoRV(OSU株 和 Iowa株 )、SE(猪霍乱沙门氏菌、猪伤寒沙门氏菌株)、JEV(SA14-14-2、SH-80)、PCV(2型)、PEDV/TGEV二联苗(华毒株+CV777)、E.coli均由四川农业大学保存。参考GenBank中ASFV P72的标准参考序列,人工合成ASFV质粒模板,由四川农业大学保存。
1.4 引物设计
参考GenBank中SS、CSFV、SE、PRRSV、HPS、SS和JEV的标准参考株基因组序列,比对不同血清型的参考序列并选择保守基因,使用Snapgene 3.2软件设计并评价了7对特异性引物。在特异性引物的5′端加上通用引物标签序列,组成嵌合引物。引物信息详见表1。所有引物均由生工生物工程(上海)股份有限公司合成。
1.5 核酸提取和反转录
参照病毒DNA提取试剂盒,病毒RNA提取试剂盒,细菌DNA提取试剂盒说明书,抽提各毒株的DNA/RNA,并把RNA反转录成cDNA,将DNA/cDNA保存于-20 ℃。
1.6 毛细管电泳系统的准备、校正与样品分析
(1)环境准备:试验开始前确保室温在20~30 ℃。每次试验前开启氮气瓶阀门,保持输出口的压力为0.4 MPa。在缓冲液槽中分别加入对应的试剂。(2)Marker的准备:按照参考说明书制备Intensity Calibration Marker、Alignment Marker和Size Marker,确保这3种分装好的Marker管中没有气泡。
1.7 卡夹的校准

表1 毛细管电泳多重PCR所用引物
将准备好的Calibration Marker放入缓冲液槽M2位置,点击“Service”,在“Caliration”界面点击“Start Calibration”进行校准,校准通过后,接受校准结果。运行样本时,打开样品门,将样品放入96孔架中,横着摆放,Size Marker和样本一起放在96孔架中。
1.8 样品的分析
仪器操作流程遵循QIAxcel Advanced厂家说明书进行。结果分析时,根据Alignment Marker对齐各个毛细管泳道的绝对迁徙距离,配合系统中赋值得出样品条带的结果,所有结果的处理与分析都在QIAxcel ScreenGel软件中进行。
1.9 特异性嵌合引物单重PCR的验证与标准品制备
使用含有通用引物序列的7对特异性嵌合引物,对从阳性样品中提取的DNA/cDNA进行扩增。扩增体系:10×扩增缓冲液 2 μL,4种dNTP混合物各200 μmol·L-12 μL,引物各10 μmol·L-10.5 μL,模板DNA 0.2 μg,TaqDNA聚合酶0.2 μL,Mg2+1.5 mmol·L-11.5 μL,加ddH2O2至20 μL。扩增反应程序为一般PCR反应程序。扩增完成后,进行电泳验证。一部分样品进行重组质粒构建并测序。
1.10 毛细管电泳的单重PCR试验
扩增反应体系为25 μL:2 × PCR Master Mix 12.5 μL,上、下游特异性嵌合引物(1 μmol·L-1)各1μL、通用引物(10 μmol·L-1)2 μL,DNA/cDNA 模板2 μL,ddH2O 6.5 μL。以各病毒和细菌的DNA/cDNA为模板进行扩增。扩增完成后,取PCR样品进行毛细管电泳分析,每份样品体积不能少于10 μL。
1.11 毛细管电泳多重PCR退火温度的优化
调节各质粒的浓度至10 ng·μL-1,调整后的各质粒进行等体积混合,使得在质粒混合液中,各质粒组分的浓度约为1.3 ng·μL-1。固定模板浓度,设置特异性嵌合引物的退火温度梯度(50.7、52.0、53.9、56.3、58.3、59.4、60.0 ℃)进行优化。扩增完成后,取PCR样品进行毛细管电泳分析。
在引物浓度方面,当通用引物浓度为特异性嵌合引物浓度的10~20倍时,通用引物浓度的变化对于扩增结果并没有显著性影响,所以直接固定通用引物浓度为20 μmol·L-1。为使7重PCR反应中,各目的片段的扩增效率均一,还需设计正交试验以优化反应体系中各项特异性嵌合引物的浓度,优化方案见表2。试验完成后,依据扩增的结果图的效果选择最优的引物浓度配制方案。
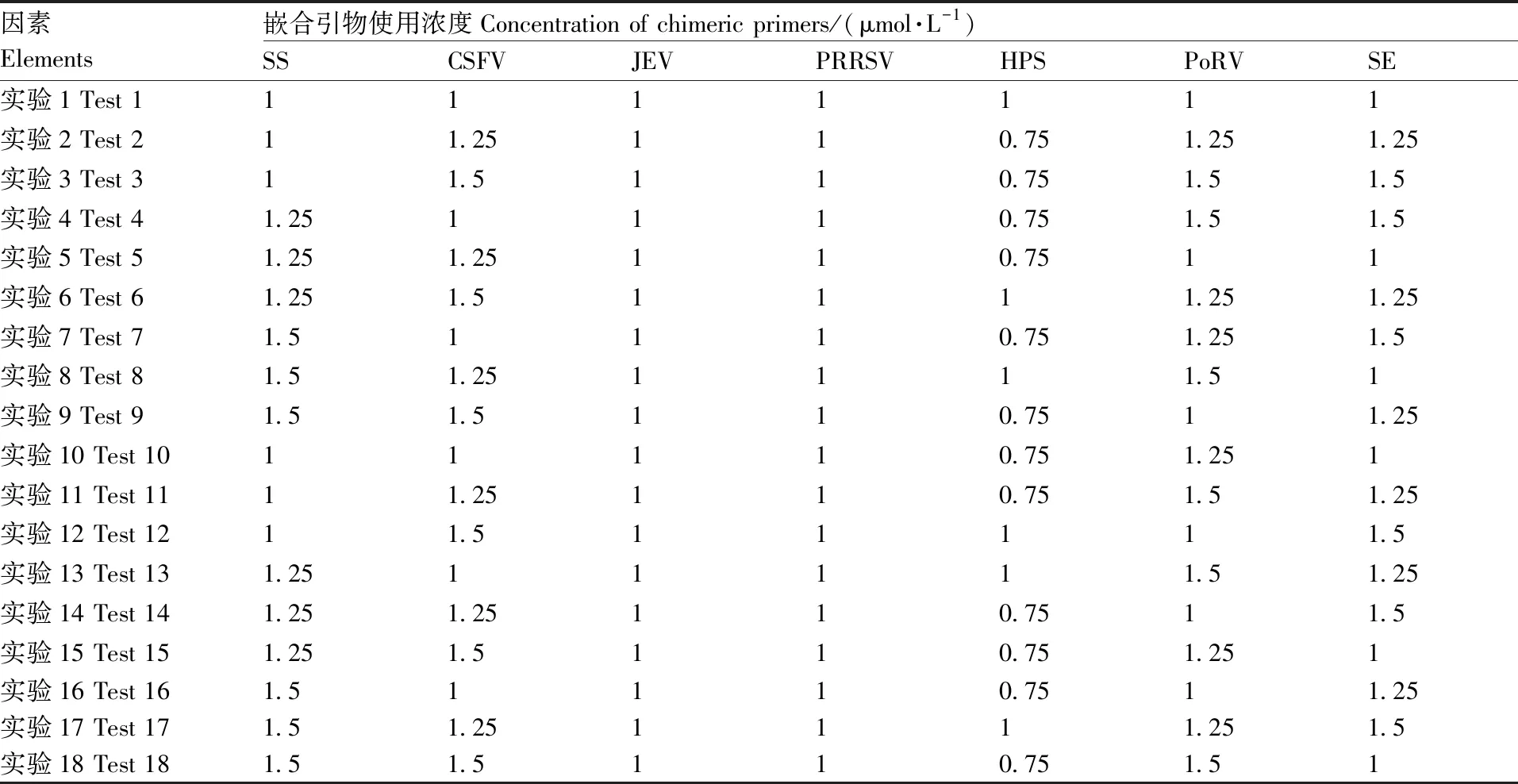
表2 嵌合引物浓度优化正交试验方案
1.12 毛细管电泳多重PCR灵敏性试验
将混合质粒模板进行梯度稀释,取107~10-1copies·μL-1浓度梯度的稀释产物进行灵敏性试验,每个稀释梯度做3次重复。扩增所用退火温度、体系、程序均使用已经由1.11节优化好的方法进行。扩增结束后,在毛细管电泳仪上样检测结果,计算最低的检测限度。
1.13 毛细管电泳多重PCR特异性试验
选取7种病原的基因组DNA或者反转录产物cDNA,进行随机分组,将其随机混合作为反应模板,使用已优化完成的7重检测方法进行扩增,检查不同的病原基因组背景核酸序列会不会对这7对特异性引物造成交叉反应,借此评价该方法的交叉反应性。
选取其他病原(猪流行性腹泻病毒、猪传染性胃肠炎病毒、大肠埃希菌、非洲猪瘟质粒)的DNA或cDNA作为对照,以相同的方法进行扩增,检查该方法是否会对其他的常见猪病病原有扩增反应。
1.14 毛细管电泳多重PCR重复性试验
使用经过梯度稀释的混合质粒模板,取稀释梯度在106~104copies·μL-1的样品作为重复性试验的模板。用已优化好的方法进行扩增,每个稀释度做3次重复,由此评价该方法的重复性。
1.15 毛细管电泳多重PCR临床样品的验证
采集来自四川各地不同猪场的病死组织和屠宰场的临床组织样本60份与3份健康猪的组织器官作为临床检测样品,且已根据国标或农业部标准进行鉴定[16-22],并将阳性组织器官保存,如表3。采用建立的基于毛细管电泳的多重PCR方法对这些样品进行检测,验证检测结果与原来鉴定结果是否相符。
2 结果与分析
2.1 特异性嵌合引物单重PCR的验证
用含有通用引物序列的7对特异性嵌合引物,对从阳性样品中提取的DNA/cDNA进行扩增。结果如图1,所有特异性嵌合引物均能扩增出清晰的目的片段,在2%琼脂糖凝胶电泳中可大致判断其大小是符合预期的。
2.2 毛细管电泳的单重PCR试验结果
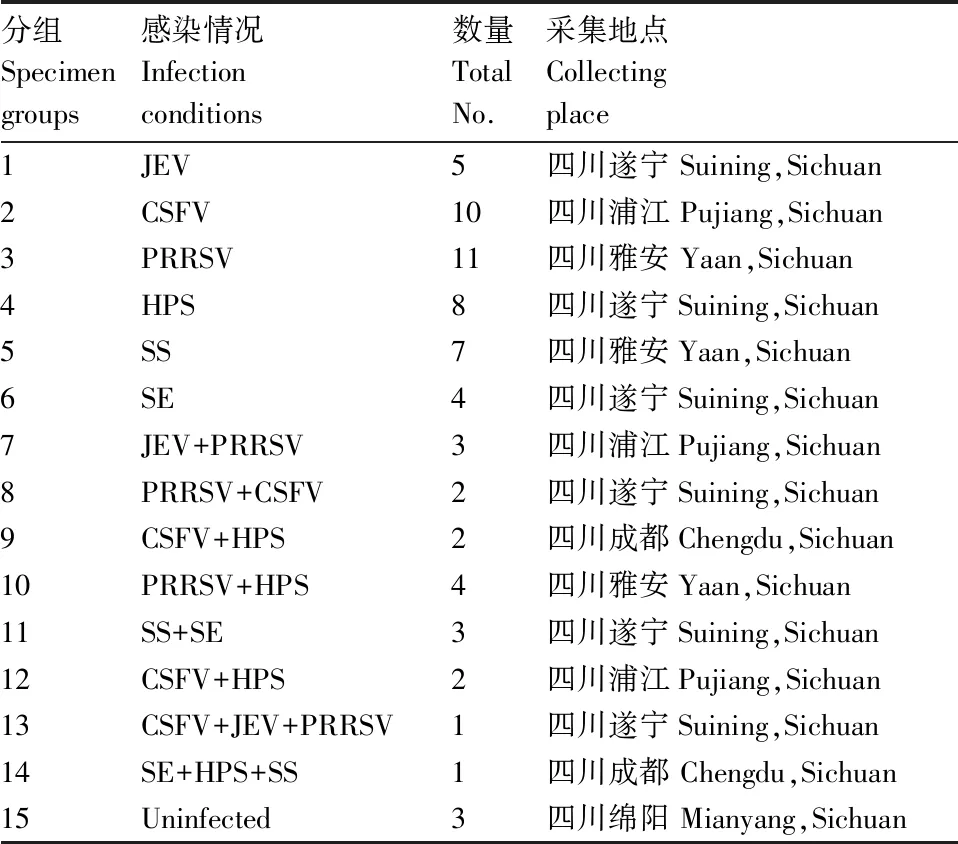
表3 临床样品说明

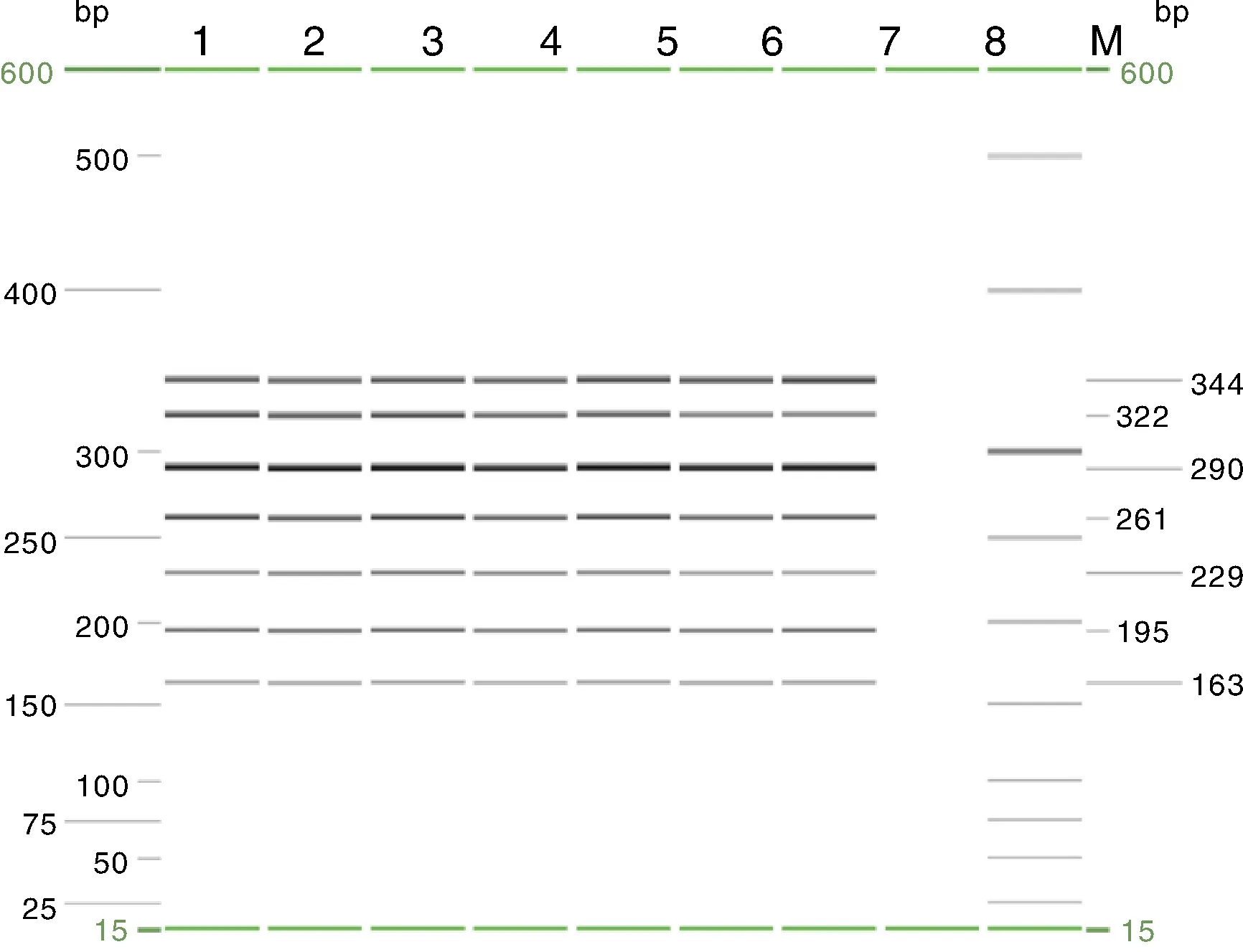
1,SS; 2,CSFV; 3,JEV; 4,PRRSV; 5,HPS; 6,PoRV; 7,SE; 8,ddH2O阴性对照; M,QIAxcel Size Marker(25~500 bp)。1, SS; 2, CSFV; 3, JEV; 4, PRRSV; 5, HPS; 6, PoRV; 7, SE; 8, ddH2O as negative control; M, QIAxcel Size Marker(25-500 bp).图2 毛细管电泳单重PCRFig.2 Results of capillary electrophoresis simplex PCR
在7种目的片段所对应的凝胶图与峰图中,目的条带都是清晰单一且特异的。在导出的实际Excel数据中,QIAxcel ScreenGel软件给出了具体的对应条带的实际bp数,分别为: SS 161 bp,CSFV 194 bp,JEV 236 bp,PRRSV 263 bp,HPS 294 bp,PoRV 325 bp,SE 349 bp (图2、图3、图4),结果与预计的扩增结果大小相同,该方法得出的检测片段长度符合卡夹所设置的正常误差(3~5 bp)范围内。在Size Marker的对照(图4)中,可以看出并无其他非特异性条带存在,对比正常Size Marker与各条带的峰图,可以看出Size Marker的相对荧光强度普遍比目的条带对应的相对荧光强度小数倍,并且Size Marker的核酸浓度已被预先调整为30 ng·μL-1,所以这几条目的条带的扩增均能判定为阳性。
2.3 毛细管电泳多重PCR的退火温度优化结果
调节各质粒的浓度至10 ng·μL-1,各质粒进行等体积混合,各质粒组分的浓度约为1.3 ng·μL-1。固定模板浓度,设置特异性嵌合引物的退火温度梯度进行优化,结果7重条带都能得到很好的扩增效果(图5)。针对每个泳道的所有条带收集其3个主要数据,包括相对荧光强度,bp数以及产物浓度设置变量,使用SPSS软件进行退火温度的评价,最终得出结论,当退火温度为58.3 ℃时(第5泳道)扩增的效果最佳,退火温度优化峰图见图6。
对引物浓度的优化依照表2中的正交试验设计的引物浓度的试验方案进行了优化,最终得出特异性嵌合引物最佳的引物浓度为1.25 μmol·L-1(SS)、1.5 μmol·L-1(CSFV)、1 μmol·L-1(JEV)、1 μmol·L-1(PRRSV)、0.75 μmol·L-1(HPS)、1.5 μmol·L-1(PoRV)、1.5 μmol·L-1(SE)。 在此前提下通用引物的使用浓度固定为20 μmol·L-1,特异性嵌合引物扩增10个循环,通用引物扩增25个循环为最佳的反应体系与反应程序。
2.4 灵敏性试验
将混合质粒模板进行梯度稀释,取107~10-1copies·μL-1浓度梯度的稀释产物进行灵敏性试验,每个稀释梯度做3次重复。在毛细管电泳仪上样检测结果,计算最低的检测限度。结果在7重条带同时出现的前提下,该方法能检测的最低限度为103copies·μL-1(图7),对SS、JEV、PRRSV、HPS的检测灵敏性较高,能达到10~100 copies·μL-1。
2.5 特异性及交叉性实验
选取7种病原的基因组DNA或者反转录产物cDNA,进行随机分组,将其随机混合作为反应模板,使用该方法进行扩增。结果不同的病原与不同的引物之间并不会发生交叉反应(图8、图9、图10),尽管有其他背景序列的干扰,试验所用的检测引物还是能很好地区分并扩增目的基因。选取其他病原的DNA或cDNA作为对照,以相同的方法进行扩增,结果也并未产生非特异性扩增(图8),说明该方法具有良好的特异性。
2.6 重复性实验
使用经过梯度稀释的混合质粒模板,取稀释梯度在106~104copies·μL-1的样品作为重复性试验的PCR模板。用已优化好的方法进行扩增,每个稀释度做3次重复。将以上3个稀释度总共9个样品的扩增峰图叠加到一起(图11),可以更为直观地显示该方法的重复性良好。
2.7 毛细管电泳多重PCR的临床样品验证结果
使用优化完成的毛细管多重PCR方法对63份临床样品进行检测。单一感染样品检出45份,多重感染样品检出15份,阴性样品检出3份,检测结果与国标或行业标准检测方法结果完全一致(表4),阳性率为95.2%,符合率为100%。
3 讨论
猪链球菌、猪瘟病毒、日本脑炎病毒、猪繁殖与呼吸综合征病毒、副猪嗜血杆菌、猪轮状病毒、沙门氏菌这几种疫病是养猪业常见的7种传染病病原,相关疾病感染率高,尤其在规模化猪场,如果未能及早检测预防,一旦流行开来,将造成巨大的经济损失。其中:猪链球菌、日本脑炎病毒、猪轮状病毒、沙门氏菌是4种常见的人畜共患病,准确及时地诊断监测不仅对经济还是人类公共卫生安全都具有重大意义;猪瘟病毒、猪繁殖与呼吸综合征病毒、副猪嗜血杆菌这3种病原引起的传染病都有明显的呼吸道症状,早期诊断十分重要。随着养殖行业的不断发展,集约化、规模化的养殖方式导致猪群之间的接触疾病几率明显增高,如未做好疾病的防控工作,各种不同的疾病能迅速地扩散,患病的猪群也时而呈现混合感染的现象[23]。
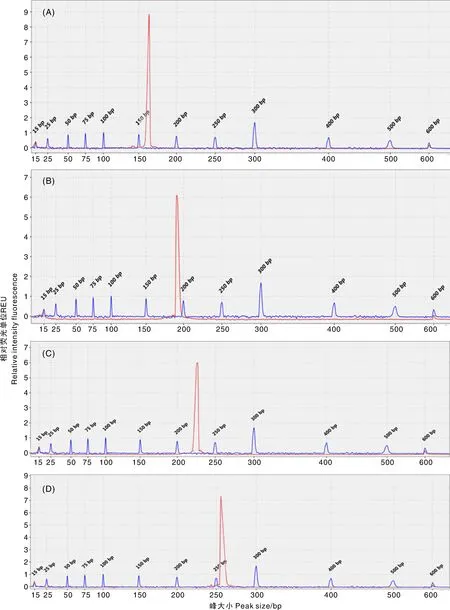
A~D分别为SS、CSFV、JEV、PRRSV的单重检测峰图。横坐标为bp数,纵坐标为相对荧光强度。A-D indicated detection peak figures of SS, CSFV, JEV, PRRSV. The abscissas represented the bp numbers and the ordinates represented the relative intensity of fluorescence.图3 单重毛细管电泳检测峰图结果Fig.3 Result of capillary electrophoresis simplex PCR

A~C分别为HPS、PoRV、SE的单重检测峰图;D,Size Marker对照。横坐标为bp数,纵坐标为相对荧光强度。A-C indicated detection peak figures of HPS, PoRV, SE. D indicated detection peak figures of Size Marker as control. The abscissas represented the bp numbers and the ordinates represented the relative intensity of fluorescence.图4 单重毛细管电泳检测峰图结果Fig.4 Result of capillary electrophoresis simplex PCR
1,50.7 ℃; 2,52.0 ℃; 3,53.9 ℃; 4,56.3 ℃; 5,58.3 ℃; 6,59.4 ℃; 7,60.0 ℃; 8,阴性对照; M,QIAxcel Size Marker (25~500 bp)。Lane 1, 50.7 ℃; Lane 2, 52.0 ℃; Lane 3, 53.9 ℃; Lane 4, 56.3 ℃; Lane 5, 58.3 ℃; Lane 6, 59.4 ℃; Lane 7, 60.0 ℃; Lane 8, Negative control; Lane M, QIAxcel Size Marker (25-500 bp).图5 毛细管电泳多重PCR退火温度优化凝胶图Fig.5 Gel figure of capillary electrophoresis multiplex PCR annealing temperature test
传统的凝胶电泳方法在核酸分离检测中使用非常广泛,在多数情况下,普通的琼脂糖凝胶电泳已经足以满足试验要求,比如进行一些定性的检测或鉴定等。然而在多重PCR技术中,由于检测项目往往需求较多,若同一次反应中需要扩增的目的条带较多并且其相互之间的大小区分程度较小,这时在普通琼脂糖凝胶电泳上进行区分的难度就会加大,纵然使用高浓度的琼脂糖凝胶去区分差别较小的条带,其区分度最多也不会低于30 bp。再者,琼脂糖凝胶电泳的试验过程中,电泳缓冲液的条件会很大程度地影响电泳效果。常见的负面影响包括对电泳电压和电流的影响,导致电泳速度变慢,使电泳时间过长进而使条带弥散并且使得核酸暴露时间过长导致核酸的降解,最终导致本来应该是阳性或者弱阳性的结果被判定为阴性。所以对于普通琼脂糖凝胶电泳的应用更多的还是用于试验结果的验证和精度要求比较低的定性判断当中。为克服这些问题,我们将毛细管电泳检测技术与多重PCR技术相结合,克服了传统琼脂糖电泳技术上的缺陷。首先,在电泳的准确性和区分度上,有了很大的进步。本试验使用了QIAxcel DNA High Resolution试剂盒,该试剂盒所带的毛细管电泳卡夹为高分辨率卡夹,最小能区分3~5 bp差别的条带,在本试验所用的7重PCR方法中,使用毛细管电泳能将7重条带明显地区分,然而普通电泳尽管使用了高浓度的凝胶,却并不能做到明显区分。

图6 毛细管电泳多重PCR退火温度优化峰图Fig.6 Result of capillary electrophoresis multiplex PCR annealing temperature test

M,QIAxcel Size Marker (25~500 bp); 1,107 copies·μL-1; 2,106 copies·μL-1; 3,105 copies·μL-1; 4,104 copies·μL-1; 5,103 copies·μL-1; 6,102 copies·μL-1; 7,101 copies·μL-1; 8,100 copies·μL-1; 9,10-1 copies·μL-1; 10,阴性对照。Lane M, QIAxcel Size Marker (25-500 bp); Lane 1, 107 copies·μL-1; Lane 2, 106 copies·μL-1; Lane 3, 105 copies·μL-1; Lane 4, 104 copies·μL-1; Lane 5, 103 copies·μL-1; Lane 6, 102 copies·μL-1; Lane 7, 101 copies·μL-1; Lane 8, 100 copies·μL-1; Lane 9, 10-1 copies·μL-1; Lane 10, Negative control.图7 毛细管电泳多重PCR灵敏性试验结果Fig.7 Results of capillary electrophoresis multiplex PCR sensitivity test
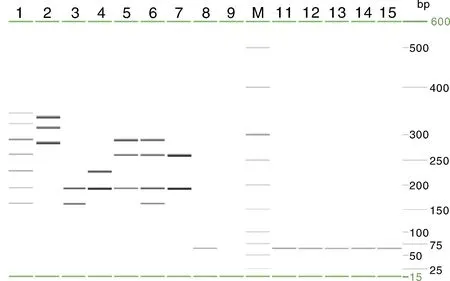
1,含有7种病原DNA/cDNA的混合液; 2,HPS、PoRV、SE; 3,SS、CSFV; 4,CSFV、JEV; 5,CSFV、PRRSV、HPS; 6,SS、CSFV、PRRSV、HPS; 7,CSFV、PRRSV; 8,阴性对照; M,QIAxcel Size Marker (25~500 bp); 11,E. coli; 12,PPV; 13,ASFV; 14,PEDV; 15,TGEV。Lane 1, Mixed template containing DNA/cDNA of 7 pathogens; Lane 2, HPS, PoRV and SE; Lane 3, SS and CSFV; Lane 4, CSFV and JEV; Lane 5, CSFV, PRRSV and HPS; Lane 6, SS, CSFV, PRRSV and HPS; Lane 7, CSFV and PRRSV; Lane 8, Negative control; Lane M, QIAxcel Size Marker (25- 500 bp); Lane 11, E. coli; Lane 12, PPV; Lane 13, ASFV; Lane 14, PEDV; Lane 15, TGEV.图8 毛细管电泳多重PCR特异性试验结果Fig.8 Results of capillary electrophoresis multiplex PCR specificity test
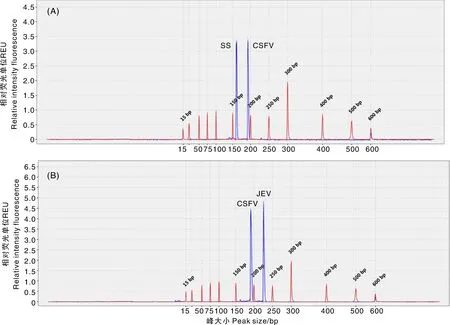

A~C分别为SS+CSFV、CSFV+JEV、CSFV+PRRSV的交叉反应性检测峰图。横坐标为bp数,纵坐标为相对荧光强度。A-C indicated cross reactivity peak figures of SS+CSFV, CSFV+JEV and CSFV+PRRSV. The abscissas represented the bp numbers and the ordinates represented the relative intensity of fluorescence.图9 毛细管电泳多重PCR交叉反应性试验结果Fig.9 Results of capillary electrophoresis multiplex PCR cross reactivity test
此外,在实验进行的过程中,在操作上我们也改进了不少细微操作来使本研究建立的方法更有优越性,同时为后人用相似方法提供一些参考。例如我们使用的Alignment Marker能够将各个泳道进行对齐。这避免了不同泳道之间电流或电压的细微差别导致的差异,在普通电泳中,当电流电压稍微大一些,其边缘现象即表现得非常明显,然而Alignment Marker的加入使得结果在QIAxcel ScreenGel软件中分析时,不同的泳道能够自动被对齐。由于该方法的电泳环境是在毛细管中进行,所以其每次电泳的样品体积需求非常小,往往只需要消耗小于1 μL以下的样品即可完成电泳和分析,这也为后续的核酸回收或者酶切连接等试验带来了更多的便利。

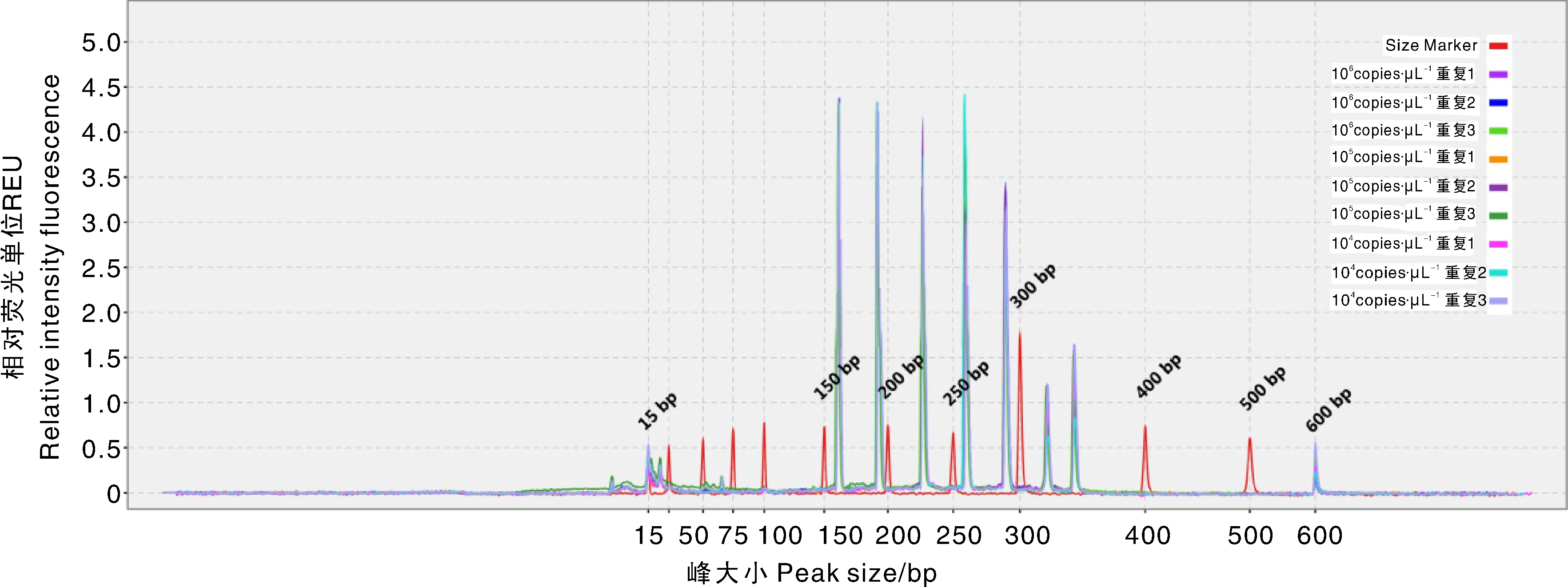
图11 重复性试验叠加峰图Fig.11 Overlaided peak figure of repeatability test
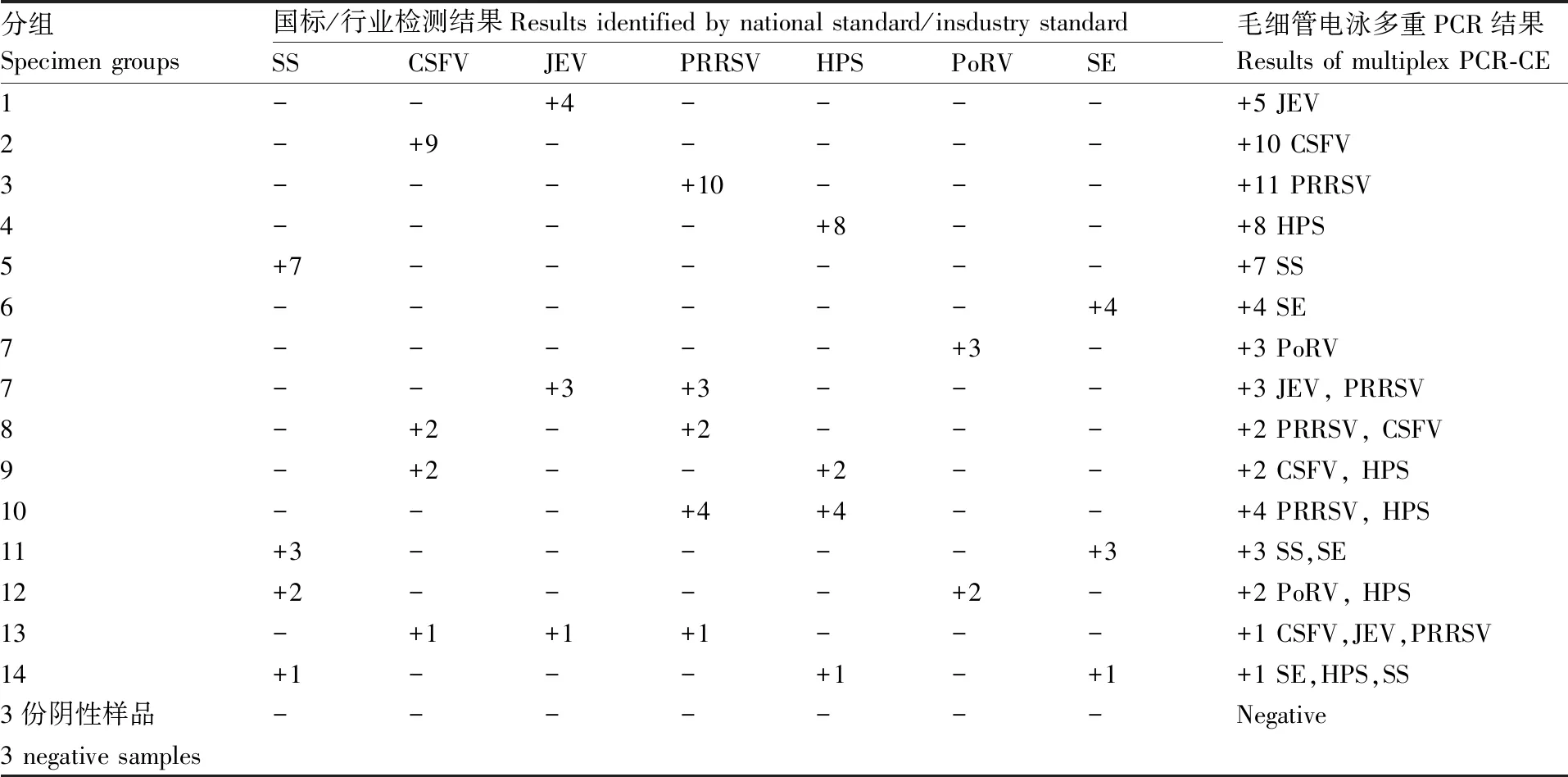
表4 毛细管电泳多重PCR临床样品检测结果
在本试验中,引物的设计引入了特异性嵌合引物与通用引物,二者的搭配在多重PCR扩增中能有效的使不同条带的扩增效率趋于一致[24],这避免了特异性引物在扩增时由于相互之间扩增效率的不同导致反应体系中DNA聚合酶或者dNTP被单一的消耗,进而避免了由之带来的误检或漏检[25]。
该方法具有良好的特异性和高通量特点,使用随机混合模板进行检测,结果并未出现交叉反应性,这说明该方法不仅仅只能用于7重病原的检测,还能用于这7种病原中随机单个或者多个病原的检测。使用优化完成的毛细管多重PCR方法对63份临床样品进行检测,测结果与国标或行业检测方法结果完全一致:检测结果的符合率为100%,阳性率为95.2%,体现了该方法在临床检测中应用的可靠性。

