高产纤维素酶菌株的筛选及产酶条件优化
傅科鹤 范莉莉 陈慧颖


摘要:纤维素是自然界中分布最广泛的一种生物质能源,筛选能够高效降解纤维素的菌株对于开发利用这类物质具有重要意义。从土壤中分离纯化获得一株高产纤维素酶的菌株TW063-3,通过形态学结合分子生物学鉴定得出,该菌株为草酸青霉。通过单因素优化试验寻找最佳培养条件,然后通过正交试验确定关键因子的最佳参数。筛选得出最佳培养条件:15 g/L羧甲基纤维素钠+2 g/L硝酸铵,pH值为3.0,200 r/min培养6 d。在最佳培养条件下,酶活性比优化前提高了34.1%,达到524.4 U/mL。研究结果可为生物降解纤维素酶提供一定的理论及应用价值。
关键词:纤维素酶;草酸青霉;培养基优化
纤维素酶能够将自然界中最丰富的生物质能源——纤维素类物质分解成可溶性单糖,从而为大批量生产生物燃料乙醇提供廉价原料[1]。经过50多年的研究发现,纤维素酶已经成为第四大工业酶种[2],在生物能开发、食品、畜牧业及工农业废弃物回收等多个领域都具有远大的应用前景[3]。
已有研究发现,自然界中能分解纤维素的生物类群主要是细菌与真菌[4]。丝状真菌是产纤维素酶非常重要的一大类群,能够产生多种胞外纤维素酶[5]。里氏木霉是研究得较为清楚的产纤维素酶菌株,但是其生长量相对较小,产酶量不能满足工业中转化纤维素的需求[6]。许多研究发现,青霉菌具有胞内分泌组分齐全、纤维素酶活性高、易培养和生长速度快的优势[7],而且青霉源纤维素酶能产生比木霉源纤维素酶较多的β-葡萄糖苷酶[8]。
本研究从海滩边土壤筛选获得一株高产纤维素酶的青霉菌株,通过优化培养条件,旨在提高该菌株的纤维素酶产量,研究成果可为今后工业化应用纤维素酶提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 刚果红筛选培养基 培养基配方为10 g/L羧甲基纤维素钠,0.2 g/L刚果红,2 g/L K2HPO4·3H2O,0.01 g/L FeSO4·7H2O,0.5 g/L MgSO4·7H2O,0.5 g/L KCl,14 g/L琼脂。
1.1.2 摇瓶发酵培养基 培养基配方为10 g/L羧甲基纤维素钠,3 g/L蛋白胨,0.5 g/L酵母粉,4 g/L (NH4)2SO4,2 g/L K2HPO4·3H2O,0.3 g/L CaCl2,0.5 g/L MgSO4·7H2O,2 g/L吐温-80。
1.2 方法
1.2.1 样品采集与处理 土壤样品从海洋和森林中采集,取5点采样,混合为1个样品。在样品中加入适量纯净水后,加玻璃珠打散,取上层液体,稀释后涂板筛选。
1.2.2 纤维素酶活性的测定 采用DNS(3,5-二硝基水杨酸)法测定纤维素酶活性。对照(CK)处理方法:取1 mL菌液,煮沸(100 ℃、5 min)灭活后用冷水冷却5 min,之后加入1 mL 1%羧甲基纤维素钠溶液和3 mL DNS,混合均匀后沸水(100 ℃、5 min)水浴,再用冷水冷却5 min,然后在波长(λ)为540 nm的紫外-可见分光光度计中测吸光度。
酶活性的测定:取1 mL菌液,加入1 mL 1%羧甲基纤维素钠溶液,混合均匀后在37 ℃水浴锅中水浴30 min,煮沸(100 ℃、5 min)灭活后用冷水冷却 5 min,再加入3 mL DNS溶液,混合均匀后沸水(100 ℃、5 min)水浴,再用冷水冷却5 min。每组测定吸光度前用其对应的CK清零后再测定540 nm处的吸光度,每瓶设3次重复。酶活性单位的定义:催化产生1 μg葡萄糖的酶量为1 U[9]。
酶活性(U/mL)=D540 nm×n×1 000/K。
式中:n为稀释倍数;K为标准曲线斜率。
1.2.3 高产纤维素酶菌株的筛选 将菌株活化后接种至刚果红初筛平板上,于28 ℃恒温培养箱中培养。待初筛获得的高产漆酶菌株活化产孢后,用3层擦镜纸过滤获得孢子,稀释至1×104 个/mL,在每瓶培养基(250 mL三角瓶装量50 mL)中接入1 mL孢子悬液,28 ℃、200 r/min培养5 d后测定酶活性。
1.2.4 发酵产酶条件的优化
1.2.4.1 碳源的优化 对经摇瓶复筛得到的最佳菌株进行培养基的优化,其中发酵培养基的碳源分别取10 g/L羧甲基纤维素钠、10%葡萄糖、10%淀粉、10%蔗糖进行筛选,其余条件不变,发酵5 d后测定酶活性,确定最佳碳源。
1.2.4.2 氮源的优化 将发酵培养基的碳源改为最适碳源,分别取2 g/L硝酸钠、硫酸铵、氯化铵、硝酸铵、蛋白胨进行初始发酵培养基最适氮源的筛选,其余条件不变,发酵5 d后,测定酶活性,确定最佳氮源。
1.2.4.3 pH值的优化 取最适碳源和氮源,pH值分别设为3.5、4.0、4.5、5.0、5.5,其余条件不变,发酵5 d后,测定酶活性,确定最佳pH值。
1.2.4.4 发酵培养时间的优化 选择优化后的最佳培养基进行发酵培养,从培养2 d开始,每天测定1次纖维素酶活性,确定最佳培养时间。
1.2.4.5 正交优化 依据单因素试验结果,选择碳源、氮源、pH值和生长时间,设计4因素4水平正交试验[10],采用 L16(44)正交表。
1.2.5 菌种的鉴定
1.2.5.1 形态学的鉴定 将菌种TW063-3活化后,接1小块菌饼到CYA平板上,于28 ℃培养3 d产孢后,挑取少量带孢子的菌丝置于载玻片上,显微观察并拍照。
1.2.5.2 分子生物学鉴定 DNA提取参照生工生物工程(上海)股份有限公司(Sangon Biotech)DneasyPlant Mini Kit(50)的试剂盒。采用真菌18S rDNA通用引物ITS1f(5′-TCCGTAGGTGAACCTGCGG-3′)、ITS4R(5′-TCCTCCGCTTATTGATATGC-3′)扩增ITS(内转录间隔区)序列,PCR扩增程序:94 ℃ 4 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,33个循环;72 ℃10 min。经生工生物工程(上海)股份有限公司测序后通过MEGA 7构建系统进化树。
2 结果与分析
2.1 高产纤维素酶菌株的筛选
本研究共分离纯化164株菌株,通过初筛获得6株纤维素酶活性最高的菌株(图1)。复筛结果表明,菌株TW063-3(P=8.73e-10<0.01)的纤维素酶活性最高,为268.2 U/mL。因此,选取TW063-3进行后续研究。
2.2 高产纤维素酶菌株的分类鉴定
2.2.1 形态学鉴定 菌株活化后接种于CYA培养基上培养3 d产孢后,挑取菌丝进行显微观察,结果见图2。观察发现,菌落呈灰绿色,边缘为白色,多分生孢分散形成许多小菌落(图2-A);分生孢子梗多次分枝后出现多簇对称或不对称的小梗,形如扫帚,具有隔膜且多个分支。分生孢子大多为球形和椭圆形,生长时为蓝绿色(图2-B~图2-D),因此初步鉴定TW063-3为青霉菌。
2.2.2 分子生物学鉴定 TW063-3序列通过NCBI
BLAST进行序列比对,通过MEGA 7的NJ法构建系统进化树。由图3可以看出,TW063-3与草酸青霉的同源性都为99%,可靠性为100%。综合形态学鉴定结果,确定TW063-3为草酸青霉(NCBI登录号:MT020385)。
2.3 产酶条件优化
2.3.1 最佳碳源 如图4所示,以羧甲基纤维素钠(CMC-Na)为碳源时,纤维素酶活性最高,为33015 U/mL(P=0.016 7<0.05)。而葡萄糖和淀粉2种碳源产酶活性差异不显著。因此选择羧甲基纤维素钠(CMC-Na)作为最佳碳源。
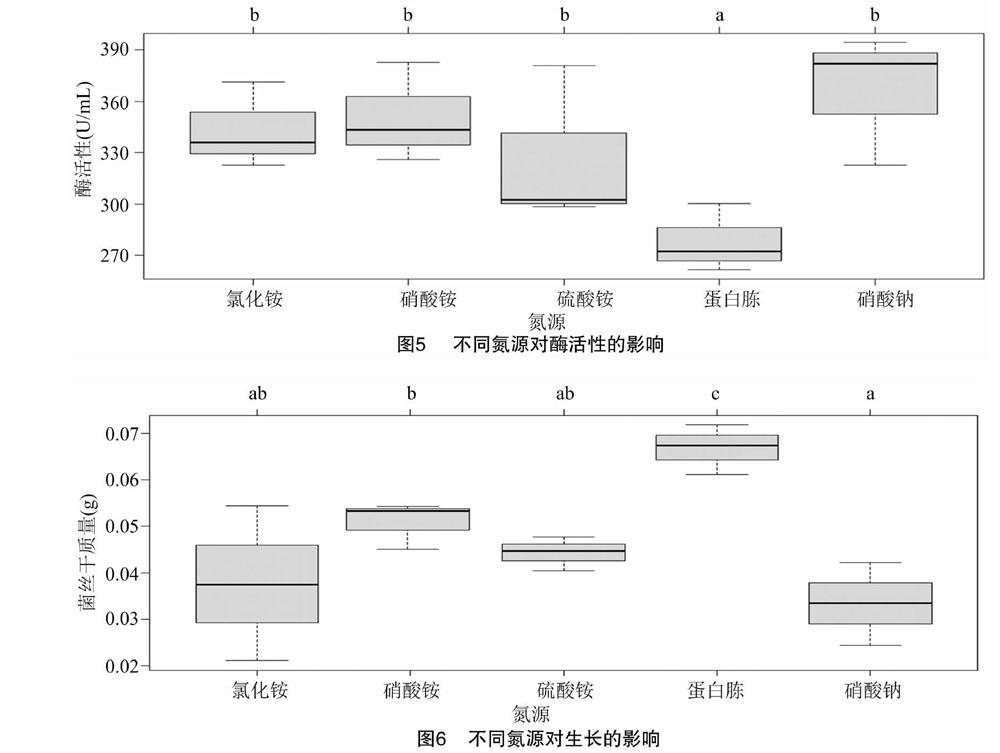
2.3.2 最佳氮源 如图5所示,以硝酸铵为氮源的酶活性与除蛋白胨外其他3种氮源的差异不显著,但是其生长量(P=0.004 24<0.01)比其他3种氮源高(图6)。因此,选择硝酸铵作为最佳氮源。
2.3.3 最适pH值 pH值为3.5时,酶活性显著低于其他4种pH值(P=0.000 154<0.01),pH值为4.0的酶活性与pH值4.5、5.0时差异显著,pH值为4.5、5.0、5.5的酶活性差异不显著,其中pH值为5.0时酶活性最高。因此,选则pH值5.0为产酶的最佳pH值,酶活性为300.9 U/mL(图7)。
2.3.4 最佳培养时间 确定该菌株最佳培养基后,从培养2 d开始,每天测定1次菌株所产纤维素酶活性,培养7 d结束。如图8所示,TW063-3菌株在培养4 d时酶活性最高,在培养5 d时酶活性下降,但是培养6 d又开始上升,在培养7 d开始小幅度下降。而培养4 d与培养6 d的酶活性差异不显著,培养6 d与培养3 d的酶活性差异不显著,培养 2 d 与培养7 d的酶活性差异不显著,培养4 d的酶活性为300.42 U/mL,高于培养6 d的酶活性。因此, 选择培养 4 d 作为 TW063-3 产纤维素酶的最
佳培养时间。
2.3.5 正交优化 依据单因素试验结果,选择羧甲基纤维素钠(A,设5、10、15、20 g/L 4个水平)、硝酸铵(B,设2、4、6、8 g/L 4个水平)、pH值(C,设3、4、5、6 4个水平)和培养时间(D,设3、4、5、6 4个水平)设计4因素4水平正交试验,采用 L16(44) 型正交设计。正交试验结果的极差分析表明,影响酶活性的4个因素排序为培养时间(D)>pH值(C)>碳源(A)>氮源(B),对于A因素,由于k3>k1>k4>k2,所以取A3,同理,B因素取B1,C因素取C1,D因素取D4,其最优组合为A3B1C1D4(表1),即产纤维素酶最佳培养基组合为15 g/L羧甲基纤维素钠+2 g/L硝酸铵,pH值为3.0,培养时间为6 d。
由于正交极差分析表中培养组合为A1B4C1D4的酶活性最高,因此選取A1B4C1D4、A3B1C1D4的培养条件进行验证试验。结果表明,组合A3B1C1D4的培养条件下培养的TW063-3产生的纤维素酶活性高达524.4 U/mL。由此,确定培养条件的最佳组合为A3B1C1D4。
3 结论
纤维素是自然界中分布最广、产量最大的多糖类物质,由于其多糖结合的高聚合性及复杂性,导致这类最丰富的资源一直无法得到充分开发利用。
近几十年来,相关研究热点一直集中于如何充分开发利用这类资源[11-12],而筛选1株高产纤维素酶的菌株是纤维素资源充分开发利用的基础工作,相关成果将为纤维素的利用奠定理论依据。目前已经发现,细菌、放线菌与真菌等多种生物都能够分泌丰富的纤维素复合酶体系为分解利用纤维素提供能量[13]。其中真菌纤维素酶由于种类全、活性高、作用底物广等特点被广泛开发成商业化的酶系[14]。
本研究从厦门海滩边土壤中分离出的1株能够高效分解纤维素的丝状真菌TW063-3,通过一系列形态学分析及分子生物学鉴定,确定该菌株为青霉属真菌。通过单因素优化结合正交试验设计,确定该菌株最佳产纤维素酶培养条件为15 g/L羧甲基纤维素钠+2 g/L硝酸铵,pH值为3.0,转速为200 r/min,培养时间为6 d。优化后的酶活性比优化前提高了34.1%,达到524.4 U/mL。研究成果为进一步研究纤维素酶降解机制及工业化发酵产酶提供一定的理论基础。
参考文献:
[1]Ulaganathan K,Goud B S,Reddy M M,et al. Proteins for breaking barriers in lignocellulosic bioethanol production[J]. Current Protein and Peptide Science,2015,16(2):100-134.
[2]赵国萍,李迎秋. 纤维素酶的研究进展及其在食品工业的应用[J]. 山东食品发酵,2015(2):37-40.
[3]孙 倩,林海鹏. 红树林环境产纤维素酶菌株的研究现状[J]. 广东化工,2015,42(18):119,134.
[4]Nehad E A,Yoness M F,Reem A A. Optimization and purification of cellulase produced by Penicillium decumbens and its application[J]. Egyptian Pharmaceutical Journal,2019,18(4):391-402.
[5]Saini A,Aggarwal N K,Yadav A. Cost-effective cellulase production using Parthenium hysterophorus biomass as an unconventional lignocellulosic substrate[J]. Biotech,2017(7):12.
[6]陈小玲,龙思宇,陈 英,等. 瑞氏木霉纤维素酶研究进展[J]. 广西科学院学报,2015,31(2):113-120.
[7]孙宪昀,曲音波,刘自勇. 青霉木质纤维素降解酶系研究进展[J]. 应用与环境生物学报,2007,13(5):736-740.
[8]Jorgensen H,Morkeberg A,Krogh K B R,et al. Production of cellulases and hemicellulases by three Penicillium species:effect of substrate and evaluation of cellulase adsorption by capillary electrophoresis[J]. Enzyme and Microbial Technology,2005,36(1):42-48.
[9]Prasanna H N,Ramanjaneyulu G,Rajasekhar Reddy B. Optimization of cellulase production by Penicillium sp.[J]. 3 Biotech,2016(6):162.
[10]Irfan M,Mushtaq Q,Tabssum F,et al. Carboxymethyl cellulase production optimization from newly isolated thermophilic Bacillus subtilis K-18 for saccharification using response surface methodology[J]. AMB Express,2017(7):29.
[11]Daud Q U,Hamid Z,Sadiq T,et al. Enhanced production of cellulase by Escherichia coli Engineered with UV-mutated cellulase gene from Aspergillus niger UVMT-I[J]. Bioresources,2019,14(4):9054-9063.
[12]王興吉,刘文龙,闫宜江. 纤维素酶水解小麦秸秆的酶解动力学[J]. 江苏农业科学,2019,47(2):309-311.
[13]吴孔阳,李婉婉,杨同香,等. 1株耐高温纤维素酶产生菌的分离与鉴定[J]. 江苏农业科学,2019,47(9):312-314.
[14]Bentil J A,Thygesen A,Mensah M,et al. Cellulase production by white-rot basidiomycetous fungi:solid-state versus submerged cultivation[J]. Applied Microbiology and Biotechnology,2018,102(14):5827-5839.徐思琪,吴志才. 生计资本与农村家庭旅游需求——基于CFPS中国家庭追踪调查数据[J]. 江苏农业科学,2021,49(3):219-224.

