RGO改性介孔TiO2薄膜光催化同步去除Ni2+和SDBS
李翠霞,孙会珍,金海泽,张幽幽,杨 轩,李文生
RGO改性介孔TiO2薄膜光催化同步去除Ni2+和SDBS
李翠霞,孙会珍,金海泽,张幽幽,杨 轩,李文生*
(兰州理工大学,省部共建有色金属先进加工与再利用国家重点实验室,甘肃 兰州 730050)
以钛酸四丁酯(TBT)、天然鳞片石墨为原料,聚乙烯吡咯烷酮(PVP)为介孔模板剂,通过浸渍-提拉法辅助热处理和紫外辐照还原制备介孔RGO-TiO2薄膜,利用XRD、SEM、BET、UV-Vis DRS、FT-IR等对其结构、形貌及性能进行表征.以Ni2+和十二烷基苯磺酸钠(SDBS)为目标污染物,考察了介孔RGO-TiO2薄膜光催化去除Ni2+和SDBS的反应性能,探讨了GO加入量及pH值对其催化性能的影响.在最佳条件下,进一步研究Ni2+/SDBS共存体系中Ni2+的光催化还原和SDBS的光催化氧化.结果表明:GO的加入量为1.0wt%时,介孔RGO-TiO2薄膜对单一体系Ni2+和SDBS的光催化效率最高,在此条件下,pH=7.5时Ni2+还原效率最高,pH=6时SDBS降解效率最高.综合以上实验条件,设定GO加入量为1.0wt%,pH≈6时,Ni2+/SDBS共存体系中Ni2+和SDBS去除效率均优于Ni2+和SDBS单一体系,此时,Ni2+还原率为87.9%,SDBS氧化率为95.5%.分析协同光催化机制,TiO2-SDBS表面复合物在紫外光激发下,SDBS被氧化同时,光生电子及SDBS氧化产物CO2•−自由基同步还原Ni2+.
介孔RGO-TiO2薄膜;浸渍-提拉法;光催化;协同作用;Ni2+;SDBS
纳米TiO2是一种氧化性强、化学稳定性良好、廉价、无毒、对环境友好的半导体光催化剂,被广泛应用于废水处理、空气净化、光解水制氢、光催化还原CO2等领域[1-4].但纳米TiO2禁带宽度较大,只能吸收占太阳光不到5%的紫外光,且电子空穴复合率高,导致其光催化性能较差,在实际应用中受限.为了提高TiO2光催化性能,众多学者采用贵金属沉积、离子掺杂、表面光敏化、半导体耦合、负载等手段对其进行改性[5];其中负载技术可有效抑制电子-空穴复合,进而改善纳米TiO2粉体的分散性,增大光催化剂与有机污染物的接触面积,促进TiO2光催化效率.Chandra等[6]采用原位掺入法合成的ZIF- 8@TiO2复合材料,由于金属有机骨架的存在对MB和RhB光催化效率高于纯TiO2.
石墨烯独特的单层sp2碳原子结构使其具有较大的比表面积、良好的导电性和较快的电子迁移速率[7-8],将其作为载体与TiO2复合可有效提高光催化性能[9].此外,介孔TiO2具有高孔容量和较大比表面积,有利于吸附污染物及提高光催化剂和产物的扩散[10],但TiO2固有的较高载流子复合率仍无法避免.近年来,采用溶胶凝胶法制备的介孔还原氧化石墨烯/TiO2(RGO/TiO2)复合材料能够有效克服上述问题,实现污水中有机染料的高效降解[11].但粉体光催化剂回收困难,不利于循环利用导致应用成本增加.本课题组采用浸渍-交替提拉法制备的介孔RGO/TiO2薄膜在120min时对甲基橙溶液的降解率达92.5%;循环利用5次后降解率仍达85%,证实RGO/TiO2薄膜是一种高效且易于回收的光催化剂[12].
通常工业废水体系中同时存在有毒重金属离子和难降解有机污染物,如何在低成本下实现二者的高效同步去除,提高污水净化效率是目前亟待解决的难题之一.光催化剂在太阳光辐照时产生分别具有还原性、氧化性的光生电子及空穴用以金属离子的还原和有机物的氧化降解,为解决此难题提供了有效途径.因此,研究光催化剂同时去除金属离子和有机污染物具有重要意义.本课题采用浸渍-交替提拉法,经热处理和紫外辐照还原合成介孔RGO- TiO2薄膜,并以有毒重金属离子Ni2+和难降解有机污染物-表面活性剂十二烷基苯磺酸钠(SDBS)为目标污染物,依次考察了GO加入量、初始溶液pH值两个因素对介孔RGO-TiO2薄膜去除Ni2+和SDBS光催化活性的影响,在最佳实验条件下进一步研究Ni2+/SDBS共存体系中Ni2+还原和SDBS氧化之间的协同机理,为半导体光催化技术在成分复杂的工业污水处理领域应用提供实验基础和理论指导.
1 材料与方法
1.1 样品制备
所用试剂为分析纯的鳞片石墨(225目)(上海胶体化工厂)、钛酸四丁酯(天津市北辰方正试剂厂)、柠檬酸(莱阳化工实验厂)、聚乙烯吡咯烷酮(天津市致远化学试剂有限公司)、盐酸(白银良友化学试剂有限公司)、无水乙醇(天津富宇精细化工有限公司),蒸馏水.
采用改进的Hummers法[13],将天然鳞片石墨制成GO分散液.将17.5g柠檬酸(CA)搅拌溶解于82mL无水乙醇,滴加25mL的钛酸丁酯搅拌反应30min,再缓慢滴加5mL蒸馏水继续搅拌30min后陈化,得到浅黄色TiO2前驱体溶胶.向此溶胶中加入占TiO2质量10%的模板剂聚乙烯吡咯烷酮(PVP);将不同量的GO(占TiO2质量0.1%,0.5%,1.0%,1.5%)加入上述TiO2(PVP)溶胶中并调节混合溶胶的粘度为4.5mPa/s得到GO/TiO2(PVP)前驱体溶胶.将载玻片分别用3%盐酸溶液和蒸馏水超声清洗,再用无水乙醇冲洗3~4次,经100℃烘干;设定拉膜机电压为16V,将清洗过的载玻片装于拉膜机上并分别浸入上述不同GO加入量(0.1%,0.5%,1.0%,1.5%)的GO/TiO2(PVP)前驱体溶胶中静置3min后匀速提拉上来,放入100℃的真空干燥箱中干燥25min;以上步骤重复10次即可制得不同GO加入量交替10层的前驱体薄膜;将前驱体薄膜放入马弗炉中400℃热处理3h,随炉冷却后取出置于无水乙醇中持续搅拌同时经高压汞灯照射6h,即得介孔RGO-TiO2薄膜.按照上述方法只是不加入GO制备介孔TiO2薄膜.
1.2 样品表征
利用D8/axs X射线衍射仪分析样品晶体结构,Cu K辐射,步长0.02°,扫描范围2为5°~70°. JSM-6701F冷场发射型扫描电子显微镜观察样品形貌.ASAP2020全自动比表面积及孔隙分析仪测定样品的比表面积及孔径分布.U-3900H紫外-可见分光光度计分析样品的光吸收和可见光响应能力.F97Pro荧光分光光度计检测样品的荧光发射光谱.vector22型FT-IR红外光谱仪测定样品的红外光谱.
1.3 光催化性能测试
室温下以含Ni2+的硫酸镍溶液和SDBS溶液为目标还原物和降解物,采用250W汞灯为光源(距液面15cm)在自行设计的光催化装置上测试不同污染物体系光催化降解效率.
Ni2+的分析测试方法:配制(Ni2+)=20.0mg/L的标准液;取10片薄膜放入100mL浓度为20mg/L的硫酸镍溶液中,暗吸附30min后打开高压汞灯,每隔20min取一次试样,离心取上清液于25mL容量瓶中加水至10mL,再依次加入2mL柠檬酸铵、1mL碘溶液、2mL丁二酮肟溶液、2mLEDTA-2Na溶液至标线;以蒸馏水为参比液,静置一段时间后于530nm波长处测量浓度.
SDBS的分析测试方法:配制(SDBS)= 20.0mg/L的标准液;取10片薄膜加入到100mL浓度为20mg/L的SDBS溶液(pH=7)中,暗吸附30min后向溶液中缓慢加入2mL过氧化氢溶液;打开高压汞灯,每隔20min取一次试样,离心取上清液移入125mL梨型分液漏斗中并加蒸馏水稀释到50mL,依次加入12.5mL亚甲蓝溶液、10mL氯仿、3mL异丙醇激烈振荡,再静置分层;氯仿相经脱脂棉洗水后放入10mL比色皿中于625nm波长下进行光度检测.
1.3.1 Ni2+体系(pH=7.5)和SDBS体系(pH=6)测试分别取10片薄膜加入100mL浓度为20mg/L的目标降解溶液中,暗吸附30min后打开光源,每隔20min取一次样,通过分别测定不同体系水溶液中Ni2+和SDBS残余质量浓度,不同的是,在SDBS体系测试中暗吸附后需向溶液中缓慢加入2mL过氧化氢溶液,开光源继续取样测定.光催化去除效率可根据公式(1)计算:

式中:0为初始浓度,mg/L;C为反应时间为时浓度,mg/L.
1.3.2 Ni2+/SDBS体系(pH≈6)测试 测试步骤同上,混合溶液为100mL浓度均为20mg/L的Ni2+与SDBS溶液组成.暗吸附结束后向混合溶液中缓慢加入2mL过氧化氢溶液,再打开光源每隔20min取样后经高速离心取上清夜并将所取试样分为2份,分别按照Ni2+和SDBS体系的测试方法分析Ni2+和SDBS两者浓度变化,光催化效率通过公式(1)计算.
2 结果与讨论
2.1 RGO-TiO2薄膜结构与性能分析
2.1.1 XRD分析 图1是GO、TiO2和不同GO加入量RGO-TiO2薄膜的XRD图谱.TiO2及RGO- TiO2薄膜均在2=25.3°、37.8°、48.2°、54.0°和62.8°处出现了衍射峰,分别对应于锐钛矿相TiO2(JCPDS No.89-4921)的(101)、(004)、(200)、(105)、(204)晶面,在2=27.5°处衍射峰则对应金红石相TiO2的(110)晶面,说明RGO-TiO2薄膜中TiO2晶型为锐钛矿相与金红石相的混合晶相.此外,不同GO加入量RGO-TiO2薄膜样品经紫外光辐照还原后在2= 12.8°处未检测到明显的GO特征峰,表明薄膜样品中大部分GO被还原,归因于RGO-TiO2薄膜在乙醇溶液中经紫外辐照产生光生电子-空穴对,空穴被乙醇消耗产生乙氧基自由基和氢离子,GO上一些含氧官能团与电子相互作用进而被还原[14].

图1 不同样品的XRD谱

图2 不同样品SEM图及1.0wt%RGO-TiO2薄膜EDS谱
2.1.2 SEM-EDS分析 GO的SEM图如图2(a)所示.GO呈现透明薄纱状,并由于引入含氧官能团破坏C=C双键使其表面有很多褶皱,而这种褶皱也保证了GO拥有良好的柔韧性,从而使其在热力学条件下更加稳定[15].图2(b、c)分别为纯TiO2、1.0wt%RGO-TiO2薄膜样品的SEM图,二者均表面平整,但1.0wt%RGO-TiO2薄膜附着均匀的白色微粒,这源于实验所用柠檬酸和钛酸四丁酯发生单齿配位反应后与溶胶中GO上的含氧官能团反应均匀负载于GO表面,形成具有位阻效应的复杂络合物[16],再经热处理及紫外辐照后在薄膜上生成均匀负载纳米TiO2粒子的RGO片.图(d)为1.0wt%RGO- TiO2薄膜样品的EDS能谱图.由图可知,RGO-TiO2薄膜中的主要元素为Ti、C、O 3种,经分析可得,Ti元素来源于钛酸四丁酯,O元素由TiO2薄膜和未被完全还原的GO提供,C元素则是RGO和残留的有机物提供.此外,还有一些微量元素Si、Ca、Na、部分O等来源于载玻片,Au元素则是样品喷金所致.
2.1.3 BET分析 如图3所示,N2吸附-脱附曲线为典型介孔材料的IV型曲线,具有H2型迟滞回线,表明薄膜样品中存在狭缝孔结构[17];这主要归因于模板剂PVP中羰基(C=O)与CA和钛酸四丁酯(TBT)形成钛络合物发生交叉配位环状分子链,该分子链与GO上含氧官能团发生反应,经400℃煅烧PVP消失,留下锐钛矿型TiO2的连续固体骨架均匀附着在GO片上,形成介孔结构,其形成过程如图4所示.BET法计算得到薄膜样品比表面积为34.57m2/g.由孔径分布曲线得孔径分范围主要集中于2.5~ 8.0nm之间,说明1.0wt%RGO-TiO2薄膜具有较窄的孔分布.有望获得孔径分布均匀、高比表面积的薄膜样品,为其吸附污染物提供更多的附着位点,进而提高其光催化性能.

图3 1.0wt%RGO-TiO2薄膜的氮气吸附-脱附等温线
2.1.4 UV-Vis DRS及FT-IR分析 由图5(a)可知, TiO2与1.0wt%RGO-TiO2薄膜的光吸收带边分别为410和470nm,表明引入GO使TiO2光吸收范围拓展至可见光区域.二者的带隙能(E)可通过以下公式:

式中:是普朗克常数,6.626×10-26JS;是光速,3× 108m/s.

图4 TiO2-PVP-GO作用机理
Fig.4 TiO2- PVP-GO action mechanism diagram
通过计算可得TiO2和1.0wt%RGO-TiO2薄膜的E分别为3.0和2.6eV,可见TiO2中引入RGO可使其带隙变小,其主要原因是RGO与TiO2复合后TiO2的O(2p)轨道与RGO的C(2p)轨道发生了轨道杂化,致使TiO2价带边缘上升从而减小其带隙[18-19].

图5 TiO2、1.0wt%RGO-TiO2薄膜UV-Vis DRS和不同样品的FT-IR图
GO、TiO2、1.0wt%GO-TiO2和1.0wt%RGO- TiO2薄膜样品的FT-IR图如图5(b)所示.在3386cm-1处较宽的吸收峰对应GO中羟基(-OH)的伸缩振动[20],在2954,1727,1600,1289,1056cm-1处出现CH2的反对称伸缩振动[21]、GO羧基中C=O的伸缩振动、水分子变形振动、GO表面C-O-C及醇的C-OH伸缩振动.表明GO主要含有-OH、-COOH、-C=O 3种含氧官能团.对比GO和GO-TiO2的FT-IR图, RGO-TiO2在3386和1727cm-1处吸收峰消失或减弱,表明GO部分被还原.同时,RGO-TiO2薄膜样品在1626cm-1处的吸收峰表明石墨烯片骨架的振动[22],位于1278cm-1处的吸收峰应源于PVP中C-N的伸缩振动[23],可能是由于400℃热处理后RGO-TiO2薄膜中残留少量的PVP所致.RGO-TiO2薄膜样品在低于1000cm-1处的吸收带属于TiO2中Ti-O-Ti键的振动,这可能是Ti-O-Ti和Ti-O-C键共同作用的结果[24].而Ti-O-C键的存在表明,GO上羧酸官基团和TiO2纳米颗粒表面的羟基发生强有力相互作用最终形成通过化学键结合的RGO-TiO2薄膜[25].
2.1.5 PL分析 光生电子和空穴的分离效率是影响光催化效率的重要因素.一般来说,较低的荧光强度表示光生电子-空穴对复合率较低,即光生载流子的寿命较长[26].如图6,相比于a(TiO2),各RGO-TiO2薄膜的荧光强度均有所降低,说明引入GO可有效抑制光生电子-空穴对的复合,延长载流子的寿命.其中GO添加量为1.5%的样品e电子-空穴分离效率相对最佳,说明其更有利于提高光催化剂的活性.

图6 TiO2及不同GO加入量RGO-TiO2薄膜的荧光光谱图
2.2 光催化性能
2.2.1 GO加入量对Ni2+还原率及SDBS氧化率的影响 从图7可以看出单纯引入H2O2的SDBS体系中,经过80min光催化反应后其降解率仅有1%,说明在缺少光催化剂的情况下H2O2对SDBS的去除效果很差.在上述体系以及Ni2+溶液中引入光催化剂后,在暗吸附阶段对SDBS的去除率均有大幅度提高,其中RGO-TiO2薄膜对SDBS和Ni2+的吸附率均高于TiO2薄膜.暗吸附30min时显示不同GO加入量RGO-TiO2薄膜对Ni2+和SDBS的吸附率均较TiO2高,由于RGO-TiO2薄膜中RGO表面大量的π电子及其独特的二维单原子层网络结构与Ni2+和SDBS相互作用,提高其吸附性能[27].光照80min后加入不同量GO的RGO-TiO2薄膜较纯TiO2有更好的光催化性能,并随着GO加入量的增加对Ni2+的光催化还原效率和SDBS的光催化氧化效率呈先上升后降低的趋势,在光照时间内,整体上GO加入量为1.0wt%时光催化效率最好.由图7(a)可知, 80min时1.0wt%与1.5wt%RGO-TiO2薄膜对Ni2+还原率接近且均达到67%左右;由图7(b)可知,80min时1.0wt%与1.5wt%的RGO-TiO2薄膜对SDBS的降解率接近且达到87.9%左右;归因于薄膜中RGO快速转移电子,降低光生电子、空穴复合率,同时薄膜中介孔结构为光催化反应提供更多附着位点,从而提高光催化性能.

2.2.2 初始溶液pH值对Ni2+还原率和SDBS氧化率的影响 基于以上研究,以1.0wt%RGO-TiO2薄膜为光催化剂,研究pH值对1.0wt%RGO-TiO2薄膜光催化还原Ni2+和光催化氧化SDBS效率影响.
由图8(a)可知,1.0wt%RGO-TiO2薄膜随着初始溶液pH值增大Ni2+光催化还原效率整体呈上升趋势,光照80min时初始溶液pH=7.5和9的还原率接近且为73%左右.总体来看,在一定催化时间内初始溶液pH=7.5的反应条件最佳,这源于此条件下薄膜对Ni2+的有效吸附.此外,TiO2等电点为6.8,当初始溶液pH>6.8时TiO2表面带负电易吸附Ni2+进而利于还原;反之,当pH<6.8时TiO2表面带正电,与Ni2+相斥,不利于Ni2+还原.当pH=9时,其还原效率增加不明显,可能是由于溶液中多余的OH-与Ni2+反应生成沉淀致使Ni2+还原效率受影响.
由图8(b)可知,随着pH值增大,1.0wt%RGO- TiO2薄膜对SDBS的氧化率呈先增大后降低的趋势,pH=6时SDBS氧化率最高,80min光催化效率达到83%.在强酸性条件下由于过量的H+消耗了OH使降解效率减小;而弱碱性条件使H2O2快速分解导致降解率减小.

2.2.3 Ni2+与SDBS协同光催化性能 近年来重金属离子和有机污染物协同去除方面已经取得了许多成果(表1).实现了Cr(VI)、Pb(II)、Ni(II)等重金属离子与有机污染物RhB、SDBS、MB、苯酚、MO的同时去除.本文制备的介孔RGO- TiO2薄膜比表面积大且由于RGO优良的导电性可有效提高电子空穴的分离效率,从而提高光催化效率.
基于以上分析,综合考虑Ni2+和SDBS酸碱环境,取10片1.0wt%RGO-TiO2薄膜作为光催化剂,加入初始浓度为40mg/L([Ni2+]=[SDBS]=20mg/L)Ni2+/ SDBS共存体系的混合溶液(pH≈6)中,研究二者的协同效应对光催化性能的影响.
如图9所示,由于较低pH值更有利于催化剂通过静电作用吸附金属阳离子[28].在Ni2+/SDBS共存体系中,SDBS阴离子的存在有助于减缓光催化剂表面吸附Ni2+而导致对其余Ni2+的排斥.SDBS阴离子可以作为一个桥接离子,通过静电作用将Ni2+拖近光催化剂表面最终形成了Ni2+-SDBS-Ni2+夹心络合物,进一步促使二者的去除率升高.由图可知在Ni2+/SDBS共存体系下,H2O2对SDBS的去除率同样很低;引入光催化剂后Ni2+的还原率和SDBS的氧化率较其单一体系均有所提高.光照80min时,Ni2+单一体系及Ni2+/SDBS共存体系中Ni2+还原率分别为67%和87.9%;SDBS在其单一体系及Ni2+/SDBS共存体系中其氧化率分别为86%和95.5%,表明Ni2+与SDBS在Ni2+/SDBS共存体系中光催化还原率和氧化率均高于单一体系,说明两者之间具有较强的协同作用.

表1 1.0wt%RGO-TiO2薄膜及其他光催化剂协同处理重金属离子与有机污染物光催化效率的对比

图9 SDBS氧化对Ni2+光催化还原效率的影响
插图为Ni2+还原对SDBS光催化氧化效率的影响
Ni2+与SDBS协同效应机理如图10所示.通常情况下在单一金属离子光催化还原体系中,离子还原主要依赖于对光催化剂所产生的光生电子的吸收.而在体系中引入能够自敏化的有机污染物后,经光源辐照有机污染物产生电子并将其注入半导体光催化剂的导带,还原吸附在光催化剂表面的金属离子,这个现象被称之为电荷转移络合[34].在Ni2+/ SDBS共存体系中,当RGO-TiO2薄膜受到紫外光照射时,RGO-TiO2-SDBS络合物通过光敏化以及激发光催化剂产生的电子进入TiO2导带后被表面吸附的Ni2+捕获以促进其还原.此外在本实验条件下, RGO-TiO2在光辐照作用下产生光生电子-空穴对后,空穴的消耗主要存在2个途径(氧化SDBS和光生电子-空穴对复合).而SDBS在光催化氧化过程中直接或间接消耗空穴可抑制光生电子-空穴对复合,提高光催化效率的重要因素[35].SDBS经自敏化提供一个电子后会转变为阳离子自由基(SDBS•+),并经过一系列的氧化反应而被转化分解[36].在SDBS的氧化过程中产生的CO2•−阴离子自由基具有较强的还原性可以被进一步应用于促进Ni2+的还原,从而实现了Ni2+与SDBS的高效协同催化降解.
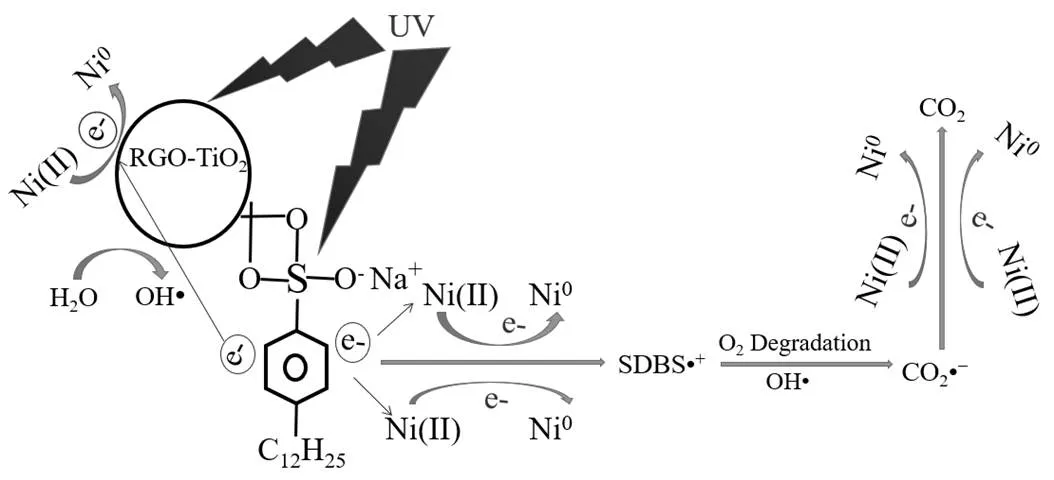
图10 Ni2+与SDBS在RGO-TiO2薄膜上的协同作用机理
3 结论
3.1 采用浸渍-交替提拉法成功合成介孔RGO- TiO2薄膜;薄膜SEM显示TiO2纳米粒子均匀分散在薄膜表面;薄膜BET测试表明RGO-TiO2复合材料具有介孔结构,且比表面积较大;UV-Vis DRS图谱显示介孔RGO-TiO2薄膜光吸收范围较TiO2发生了红移.
3.2 GO加入量为1.0wt%时RGO-TiO2薄膜在紫外光下对Ni2+和SDBS的降解效率最佳,且在此条件下,pH=7.5时有利于Ni2+还原,pH=6时有利于SDBS降解.
3.3 GO加入量为1.0wt%,pH≈6时,Ni2+/SDBS共存体系中Ni2+还原率和SDBS降解率均较其单一体系高,此时Ni2+还原率和SDBS降解率分别为87.9%和95.5%;归因于SDBS的氧化中间产物CO2•−可对Ni2+进一步还原,从而促进了Ni2+和SDBS同时的去除.
[1] 李翠霞,康伟超,任一波,等.P123对rGO/m-TiO2薄膜微观结构及光催化性能的影响 [J]. 中国环境科学, 2019,39(9):3754-3760. LI C X, KANG W C, REN Y B, et al. Effect of P123 on the microstructure and photocatalytic activity of rGO/mesoporous TiO2films [J]. China Environmental Science, 2019,39(9):3754-3760.
[2] 张志伟,徐 斌,张毅敏,等.GO/(CeO2-TiO2)改性复合膜紫外光催化去除氨氮、DOC [J]. 中国环境科学, 2020,40(3):1116-1122. Zhang Z W, Xu B, Zhang Y M, et al.Ultraviolet photocatalytic removal of ammonia nitrogen and DOC by GO/(CeO2-TiO2) modified composite membrane [J]. China Environmental Science, 2020,40(3): 1116-1122.
[3] Wang T T, Lin Y C, Lin M C, et al. Au-assisted methanol- hydrogenated titanium dioxide for photocatalytic evolution of hydrogen [J]. Catalysis Today, 2017,354:250-257.
[4] Do J Y, Chava R K, Mandari K K, et al. Selective methane production from visible-light-driven photocatalytic carbon dioxide reduction using the surface plasmon resonance effect of superfine silver nanoparticles anchored on lithium titanium dioxide nanocubes (Ag@ LixTiO2) [J]. Applied Catalysis B: Environmental, 2018,237:895-910.
[5] Rangarajan G, Panchamoorthy G K, Madhav N V, et al. Present applications of titanium dioxide for the photocatalytic removal of pollutants from water: A review [J]. Journal of Environmental Management, 2020,270(110906).
[6] Chandra R, Mukhopadhyay S, Nath M. TiO2@ZIF-8: A novel approach of modifying micro-environment for enhanced photo- catalytic dye degradation and high usability of TiO2nanoparticles [J]. Materials Letters, 2016,164:571-574.
[7] Zhu Y W, Shanthi M, Cai W W, et al. Graphene and graphene oxide: synthesis, properties, and applications [J]. Cheminform, 2010,22(46): 3906-3924
[8] Zhang Y, Tan Y W, Stormer H L, et al. Experimental observation of the quantum Hall effect and Berry's phase in graphene [J]. Nature, 2005, 438(7065):201-204.
[9] Prabhakarrao N, Chandra M R, Rao T S. Synthesis of Zr doped TiO2/reduced graphene oxide (RGO) nanocomposite material for efficient photocatalytic degradation of eosin blue dye under visible light irradiation [J]. Journal of Alloys and Compounds, 2017,694: 596-606
[10] Wang H L, Liu X H. Preparation of silver nanoparticle loaded mesoporous TiO2and its photocatalytic property [J]. Journal of Inorganic Materials, 2016,31(5):555-560.
[11] 李翠霞,金海泽,杨志忠,等.介孔RGO/TiO2复合光催化材料的制备及光催化性能[J]. 无机材料学报, 2017,32(4):357-364. Li C X, Jin H Z, Yang Z Z, et al. Preparation and photocatalytic properties of mesoporous RGO/TiO2composites [J]. Journal of Inorganic Materials, 2017,32(4):357-364.
[12] 吴强红.rGO-TiO2薄膜的制备及光催化性研究[D]. 兰州:兰州理工大学, 2016. Wu Q H. Study on the preparation and photocatalytic activity of rGO- TiO2thin films [D]. Lan Zhou: Lanzhou University of Technology, 2016.
[13] Hummers W S, Offeman R E. Preparation of graphitic oxide [J]. American Chemical Society, 1958,208:1334-1339.
[14] Williams G, Seger B, Kamat P V. TiO2-graphene nanocomposites. uv-assisted photocatalytic reduction of graphene oxide [J]. Acs Nano, 2008,2(7):1487-1491.
[15] Meyer J C, Geim A K, Katsnelson M I, et al. On the roughness of single- and bi-layer graphene membranes [J]. Solid State Communications, 2007,143(1/2):101-109.
[16] 李翠霞,金海泽,谭高伟,等. rGO/TiO2复合光催化剂的制备及光催化性能[J]. 中国环境科学, 2017,37(2):570-576. Li C X, Jin H Z, Tan G W, et al. The preparation and photocatalytic activity of rGO/TiO2composite photocatalyst [J]. China Environmental Science, 2017,37(2):570-576.
[17] Storck S, Bretinger H, Maier W F. Characterization of micro-and mesoporous solids by physisorption methods and pore-size analysis [J]. Applied Catalysis A: General, 1998,174(1/2):137-146.
[18] Burda C, Chen X. The electronic origin of the visible-light absorption properties of c-, n- and s-doped TiO2nanomaterials [J]. Journal of the American Chemical Society, 2008,130(15):5018-5019.
[19] Vasudevan P, Thomas S, Biju P R, et al. Synthesis and structural characterization of sol–gel derived titania/poly (vinyl pyrrolidone) nanocomposites [J]. Journal of Sol Gel Science & Technology, 2012, 62(1):41-46.
[20] 尹 竞,廖高祖,朱冬韵,等.G-C3N4/石墨烯复合材料的制备及光催化活性的研究 [J]. 中国环境科学, 2016,36(3):735-740. Yin J, Liao G Z, Zhu D Y, et al Preparation and photocatalytic activity of g-C3N4/rGO composite [J]. China Environmental Science, 2016, 36(3):735-740.
[21] 杨勇辉,孙红娟,彭同江,等.石墨烯薄膜的制备和结构表征 [J]. 物理化学学报, 2011,27(3):736-742. Yang Y H, Sun H J, Peng T J, et al. Synthesis and structural characterization of graphene-based membranes [J]. Acta Physico- Chimica Sinica, 2011,27(3):736-742.
[22] Nethravathi C, Rajamathi M. Chemically modified graphene sheets produced by the solvothermal reduction of colloidal dispersions of graphite oxide [J]. Carbon, 2008,46(14):1994-1998.
[23] 马婷芳,史铁钧.聚乙烯吡咯烷酮的性能,合成及应用 [J]. 应用化工, 2002,(3):16-19. Ma T F, Shi T J. Properties, synthesis and applications of PVP [J]. Applied Chemical Industry, 2002,(3):16-19.
[24] Sakthivel S, Kisch H. Daylight photocatalysis by carbon-modified titanium dioxide [J]. Angewandte Chemie International Edition, 2003, 42(40):4908-4911.
[25] Williams G, Seger B, Kamat P V. TiO2-graphene nanocomposites. UV-assisted photocatalytic reduction of graphene oxide [J]. ACS nano, 2008,2(7):1487-1491.
[26] 柴晴雯,吕 艳,张 周,等.Cu2O@ZnO复合光催化剂对难生物降解有机物的光降解 [J]. 中国环境科学, 2019,39(7):2822-2830. Chai Q W, Lv Y, Zhang Z, et al. Photodegradation of refractory organic compounds by Cu2O@ZnO composite photocatalyst [J]. China Environmental Science, 2019,39(7):2822-2830.
[27] Dreyer D R, Sungjinpark, Bielawski C W, et al. The chemistry of graphene oxide [J]. Chemical Society Reviews, 2009,39(1):228-240.
[28] Xie G, Wang H, Zhou Y Y, et al. Simultaneous remediation of methylene blue and Cr(VI) by mesoporous BiVO4photocatalyst under visible-light illumination [J]. Journal of the Taiwan Institute of Chemical Engineers, 2020,112:357-365.
[29] Chen F, Yu C, Wei L, et al. Fabrication and characterization of ZnTiO3/Zn2Ti3O8/ZnO ternary photocatalyst for synergetic removal of aqueous organic pollutants and Cr(VI) ions [J]. Science of the Total Environment, 2019,706:136026.
[30] Liu E, Du Y, Bai X, et al. Synergistic improvement of Cr (VI) reduction and RhB degradation using RP/g-C3N4photocatalyst under visible light irradiation [J]. Arabian Journal of Chemistry, 2020,13(2): 3836-3848.
[31] Shao N, Li S, Yan F, et al. An all-in-one strategy for the adsorption of heavy metal ions and photodegradation of organic pollutants using steel slag-derived calcium silicate hydrate [J]. Journal of Hazardous Materials, 2020,382:121120.
[32] Bano Z, Saeed R M Y, Zhu S, et al. Mesoporous CuS nanospheres decorated rGO aerogel for high photocatalytic activity towards Cr(VI) and organic pollutants [J]. Chemosphere, 2020,246:125846.
[33] Javad Saien, Amir Azizi. Simultaneous photocatalytic treatment of Cr(VI), Ni(II) and SDBS in aqueous solutions: Evaluation of removal efficiency and energy consumption [J]. Process Safety and Environmental Protection, 2015,95:114-125.
[34] Wang N, Zhu L, Huang Y, et al. Drastically enhanced visible-light photocatalytic degradation of colorless aromatic pollutants over TiO2via a charge-transfer-complex path: A correlation between chemical structure and degradation rate of the pollutants [J]. Journal of Catalysis, 2009,266(2):199-206.
[35] Dozzi M V, Saccomanni A, Selli E. Cr(VI) photocatalytic reduction: Effects of simultaneous organics oxidation and of gold nanoparticles photodeposition on TiO2[J]. Journal of Hazardous Materials, 2003,99: 188-195.
[36] Wang N, Zhu L, Deng K, et al. Visible light photocatalytic reduction of Cr(VI) on TiO2in situ modified with small molecular weight organic acids [J]. Applied Catalysis B: Environmental, 2010,95(3/4): 400-407.
Simultaneous removal of Ni2+and SDBS by RGO modified mesoporous TiO2thin films photocatalytic.
LI Cui-xia, SUN Hui-zhen, JIN Hai-ze, ZHANG You-you, YANG Xuan, LI Wen-sheng*
(Key Laboratory of Advanced Processing and Recycling of Non-ferrous Metals, Lanzhou University of Technology, Lanzhou 730050, China)., 2021,41(4):1663~1671
The mesoporous RGO-TiO2thin films were synthesized by dipping-coating assisted heat treatment and ultraviolet lamp irradiation reduction with tetrabutyl titanate (TBT), natural flake graphite as raw materials and polyvinylpyrrolidone (PVP) as mesoporous template. The structure, morphology and properties of samples were characterized by X-ray diffraction (XRD), scanning electron microscopy (SEM), specific surface area (BET), UV-Vis diffuse reflectance spectra (UV-Vis DRS) and Fourier transform infrared (FTIR). The reaction property of the removal of Ni2+and SDBS by photocatalysis of mesoporous RGO-TiO2thin films were evaluated with Ni2+and SDBS as target pollutants. The GO amount and the effects of pH on its catalytic performance were discussed. The photocatalytic reduction of Ni2+and photocatalytic oxidation of SDBS in Ni2+/SDBS co-existed system were further studied under the optimum condition. The results showed that the mesoporous RGO-TiO2thin film had the highest photocatalytic efficiency for single system Ni2+and SDBS with the content of 1.0wt% GO; The reduction efficiency of Ni2+and the degradation efficiency of SDBS were the highest when the pH values were 7.5 and 6, respectively. In summary, the removal efficiency of Ni2+and SDBS in the co-existed system was better than that of the single system under the additions that the amount of GO was 1.0wt% and pH≈6. The reduction rate of Ni2+was 87.9% and the oxidation rate of SDBS was 95.5%. In this present contribution, the mechanism of synergistic photocatalysis was further explored. It can be concluded that the Ni2+synchronous reduction occured by the photogenerated electrons and the oxidation producted CO2•−free radical when the TiO2-SDBS surface complex was oxidized under the excitation of ultraviolet light.
mesoporous RGO-TiO2thin films;dipping-coating;photocatalysis;synergy;Ni2+;SDBS
X703.5
A
1000-6923(2021)04-1663-09
李翠霞(1972-),女,河北卢龙人,副教授,博士,主要从事无机功能材料的制备及其在环境领域中的应用研究.发表论文30余篇.
2020-08-31
国家自然科学基金资助项目(51764039)
* 责任作者, 教授, liws@lut.edu.cn

