铜绿微囊藻对混凝除氟的促进作用及机理分析
象 豫,徐 慧,李 昆,王 希,3,吴昊澜,4,樊 华
铜绿微囊藻对混凝除氟的促进作用及机理分析
象 豫1,2,徐 慧2,李 昆1*,王 希2,3,吴昊澜2,4,樊 华1
(1.南昌大学资源环境与化工学院,江西 南昌 330031;2.中国科学院生态环境研究中心,环境水质学国家重点实验室,北京 100085;3.中国科学院大学,北京 100049;4.中国地质大学(北京)水资源与环境学院,北京 100083)
以铜绿微囊藻、氯化铝(AlCl3·6H2O)为研究对象,通过三维荧光、场发射扫描电镜等表征,探究了藻类对氟化物混凝去除机制的影响.结果表明,在pH值为7.0,8.0,9.0,Al投加量在20.0~80.0mg/L的条件下,铜绿微囊藻对混凝除氟有明显的促进作用,其促进作用主要在于藻絮体对氟的表面吸附.铜绿微囊藻与氯化铝水解产物通过吸附架桥和网捕卷扫作用,聚集成较大较多的絮体.絮体粒径越大,除氟率越高.pH值为7.0,Al投加量为40.0mg/L时,絮体粒径达到最大值500μm,此时氟去除率最高,为77.37%;当Al投加量为80.0mg/L时,藻细胞破损严重,有机物过多释放,对混凝除氟起阻碍作用.絮体破碎吸附实验结果表明,对絮体进行一定强度破碎可以增加吸附位点,从而提高氟的去除率;但破碎强度过大,絮体粒径过小,对氟的吸附效率亦会降低.
铜绿微囊藻;除氟;混凝;絮体;吸附
氟是人体所必需的微量元素,对骨骼和牙齿生长发育至关重要,但是长时期的过量摄入则会导致氟中毒[1].天然地质条件和以氟为原料的工业生产过程,如电镀,陶瓷生产,半导体制造以及砖和玻璃生产等,都会向水环境中转移氟离子[3].我国遭受氟超标饮用水威胁的人口分布范围较为广泛,主要分布区域是华东,西北,东北,华北等部分省市自治区.我国农村饮用氟离子浓度大于1.5mg/L的饮用水人口达到5000万人.
饮用水除氟主要采用混凝沉淀法,吸附法,离子交换法,电渗析,膜分离法等[4-9].相较于其他方法,混凝沉淀法工艺简单,处理成本低,水量大且后期维护少,即使在不发达的农村地区也具有很高的可操作性.混凝沉淀法主要是利用混凝剂产生的电性中和、吸附架桥及网捕卷扫等作用.在混凝过程中,铝盐水解形成氢氧化铝絮体,氟化物通过附着在絮体上而被除去.在此过程中涉及到Al-F络合,离子交换,电子吸引和物理吸附等多种作用[10].
我国北方某地区的地表水氟含量超标,同时又伴随着季节性水体富营养化问题.水体的富营养化会导致水体中藻类的大量生长繁殖,引起水华的爆发[11].水华爆发不仅会破坏水体的生态平衡,而且会严重地干扰水处理过程,藻类的形态多样、浓度分布不均、分泌的有机物量大且种类复杂,会对混凝效果产生较大的影响[12].一般说来,藻类在浓度较低时,对混凝过程有不同程度的促进作用,而在高浓度时,对混凝过程有不同程度的干扰[13].目前关于藻类对混凝除氟影响的研究鲜少,当系统中存在氟化物时,藻类细胞是否会对除氟效果产生影响还不清楚.本文以铜绿微囊藻为研究对象,探究藻类对氟化物的混凝去除机制的影响,以及混凝剂、藻类、氟化物三者之间的相互作用、相互影响机制,以期为水华爆发阶段水体中氟化物的混凝去除实际应用提供参考.
1 材料与方法
1.1 实验试剂及仪器
NaF,HCl,NaOH,AlCl3·6H2O,NaNO3,NaHCO3等均为分析纯试剂,购于国药化学试剂有限公司;实验用水为超纯水.
六联搅拌仪(MY3000.6G,梅宇,中国);浊度仪(2100N, HACH,美国);pH计(MP220, Mettler-Toledo,瑞士);紫外分光光度计(UH5300,Hitachi,日本);马尔文激光粒度仪(Mastersizer 2000,Malvern,英国);电感耦合等离子体发射光谱仪(ICPE-9820,岛津,日本);离子色谱仪(AQUION,Thermo Fisher Scientific,美国);总有机碳分析仪(TOC-L,岛津,日本);三维荧光光谱仪(F-7000,Hitachi,日本);傅立叶变换红外光谱仪(Nicolet 8700,Thermo Fisher Scientific,美国);场发射扫描电子显微镜(SU-8020,HITACHI,日本).
1.2 藻种培养及水样配置
本实验所用的铜绿微囊藻购置于中国科学院武汉水生生物研究所,编号为FACHB-315,采用BG11培养基进行培养.无菌条件下将藻种接种至玻璃锥形瓶中,放在光照培养箱中进行曝气培养,培养条件:温度(25±1)℃,光照强度2400lux,时间设置12h昼/12h夜.藻细胞对可见光能产生一定的吸收, 680nm处的光吸收主要是由于藻类细胞中的叶绿素a的存在.本实验配水中的叶绿素a仅由铜绿微囊藻贡献,因此用680nm处的吸光度(OD680)来间接表示藻细胞的浓度.
在实验中,将处于初始稳定期的铜绿微囊藻溶液稀释至680nm吸光度值为0.3,加入5.0mmol/L NaNO3和4.0mmol/L NaHCO3以调节离子强度和碱度.在稀释的藻液中加入NaF,使体系中的氟离子浓度为10.0mg/L.
1.3 实验方法
1.3.1 混凝实验 使用1mol/L HCl和0.5mol/L NaOH溶液将水样分别调节pH值为7.0,8.0,9.0,混凝剂为氯化铝,投加量(以Al计)分别设置为:1.0,2.0, 5.0,8.0,12.0,15.0,20.0,40.0,60.0,80.0,100.0,120.0mg/L,于六联搅拌机上进行混凝实验.混凝程序设置为: 250r/min转速快速搅拌30s使水质混合均匀,投加混凝剂并以200r/min转速快速搅拌90s,以40r/min转速慢速搅拌10min,沉淀30min.每个样品做2个平行实验,混凝结束后,于上清液下2.0cm处取样进行水质分析,取絮体冷冻干燥后进行表征.
1.3.2 吸附实验 在pH值为7.0,Al投加量为40.0mg/L的条件下,对无NaF的含藻水样(OD680为0.3)进行混凝实验,混凝程序设置为:250r/min转速快速搅拌30s使水质混合均匀,投加混凝剂并以200r/min转速快速搅拌90s,以40r/min转速慢速搅拌10min.再对已形成的絮体分别以3种搅拌强度(分别为:0,400,800r/min)破碎2min,使其破碎成不同粒径的絮体,随后将NaF储备液投加至破碎后的体系中,使体系的氟离子浓度为10.0mg/L(以F-计),放于摇床低速震荡2h,每20min取一次样进行水质分析,取絮体冷冻干燥后用于表征.
1.3.3 藻在含氟水体中的培养 将处于初始稳定期的铜绿微囊藻溶液稀释至680nm吸光度值为0.3,加入5.0mmol/L NaNO3和4.0mmol/L NaHCO3以调节离子强度和碱度.在稀释后的藻液中加入NaF,使体系中的氟离子浓度为10.0mg/L,放于摇床低速震荡2h,定时取样检测氟离子浓度.
1.4 水质分析
水质分析主要考察氟离子浓度,藻细胞浓度以及有机物种类和浓度.水样氟离子浓度用离子色谱法测定;藻细胞浓度以其悬浊液在680nm处的吸光度值来代表;有机物的浓度和种类分别用总有机碳分析仪和三维荧光光谱仪来表征.三维荧光测定条件设定为:激发波长(X)为220~400nm,发射波长(M)为220~ 550nm,狭缝宽度均为5nm;光谱的扫描速度为12000nm/min.将激发和发射波长所形成的荧光区域进行分区,分成代表5种不同类型的有机物,分别为:芳香蛋白类物质Ⅰ(APⅠ),芳香蛋白类物质Ⅱ(APⅡ),富里酸类物质(FA),溶解性微生物代谢产物(SMP)、腐殖酸类物质(HA),各部分分区范围如表1所示.通过荧光区域整合法(FRI),将特定荧光区域的积分体积进行加和,最后以单位浓度(mg/L)溶解有机碳(DOC)对其进行标准化,得出某一荧光区域的特定结构有机物的积分占总积分的比例(,),将样品的实测DOC浓度与(,)相乘,得出各组分浓度[14].

表1 三维荧光光谱5个积分区域
1.5 絮体的表征
采用马尔文激光粒度仪对絮体的粒径进行实时监测,场发射扫描电子显微镜对冷冻干燥后的絮体表面形貌及表面元素成分进行点线面观察和分析.
2 结果与分析
2.1 铜绿微囊藻对不同投加量混凝剂除氟的影响
2.1.1 除氟效果 如图1所示, 随着混凝剂投量的增加,有藻和无藻体系的氟去除率均呈现出先增加后减小的趋势.在3个pH值条件下,当Al投加量£20.0mg/L时,有无铜绿微囊藻对氟的去除没有明显的影响. Al投加量>20.0mg/L时,有藻体系显示出了更高的去除率.当pH=7.0时,铜绿微囊藻对混凝除氟的促进作用最大,无藻体系在Al投加量为20.0mg/L时达到最高氟去除率48.11%,这与有藻体系的氟去除率相差无几;但在Al投加量为40.0mg/L时,有藻体系达到最高氟去除率73.03%,而此时无藻体系的氟去除率仅为31.03%,铜绿微囊藻的存在提高了42.00%的氟去除率.
2.1.2 出水pH值 pH值不仅对铝盐的水解和絮凝反应速度影响显著,也会对絮凝体的沉降和除氟效果产生明显影响[15].当原水为中性或弱碱性时, Al3+聚合并形成Al2-Al4、Al5-Al12、Al13-Al16等聚合物.这些铝聚合物可以转化为无定形Al(OH)3或沉淀为不溶性Al-F-OH,两者都能进一步吸附氟化物,除氟效果能得到改善.当原水pH值过低时,铝盐的水解产物以水合铝离子为主要形态,对氟不能进行有效的络合、沉淀[16].

如图2所示,在不同的初始pH值条件下,随着Al投加量增加,两种体系的pH值变化情况无显著差异,均呈现缓慢降低的趋势.Al投加量从0增加到120.0mg/L,平衡pH值均持续下降到4.5左右,这是由于Al3+水解和OH-的消耗.当体系中有铜绿微囊藻存在,Al投加量大于20.0mg/L时,出水pH值的变化幅度明显较无藻体系小,可见铜绿微囊藻及其有机物起到了一定程度的缓冲作用[17].
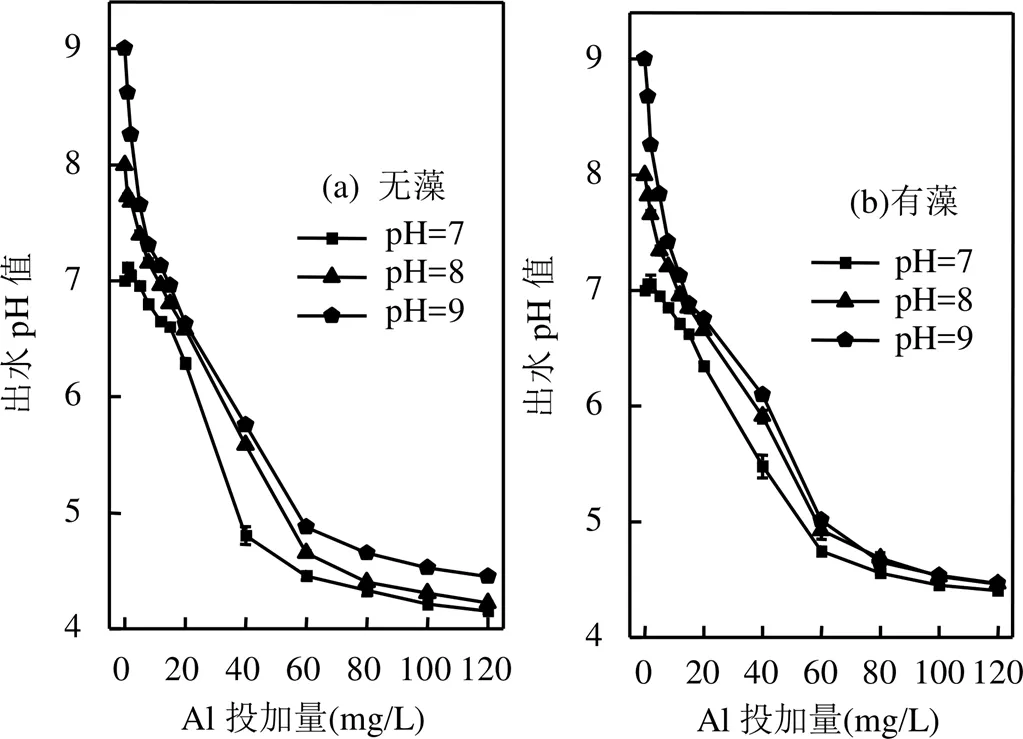
图2 两种体系的出水pH值
2.1.3 藻密度 如图3所示,在pH=7.0,不同Al投加量下混凝出水的浊度和OD680的变化趋势显示出了很高的一致性,均可表征藻的去除效果.Al投加量在0~20.0mg/L范围内,OD680快速下降,表明铜绿微囊藻在低的投加量下被大量去除,浊度的快速下降表明体系中已经形成了具有一定沉降性的藻絮体.Al投加量在20.0~40.0mg/L时,出水OD680和浊度以缓慢的速度继续下降,结合絮体更加快速生长的实验现象以及有藻体系具有高除氟率的实验结果,可见有藻体系显示出的更高的除氟率是由于铜绿微囊藻及其有机物与混凝剂形成的絮体的作用.蓝藻细胞的胞外聚合物(EPS)主要由糖类、脂质、蛋白质类等构成,含有羰基、羧基、羟基等丰富的官能团[18-20],是复杂的大分子有机物,可以提高絮体的初始形成速率,使吸附架桥和网捕卷扫作用增强,有助于形成较大粒径的絮体结构[21],对氟的吸附作用增强[22].Al>40.0mg/L时,剩余氟离子浓度升高,是由于藻细胞破损加重,胞内有机物释放,阻碍了混凝作用.

图3 Al投加量对铜绿微囊藻的影响
2.2 三维荧光分析
为探究实验过程中水样的有机物变化,测量了pH值分别为7.0、8.0、9.0,Al投加量分别为0(原水)、20.0、40.0、80.0mg/L条件下的出水三维荧光.如图4所示,不同pH值、不同Al投加量的水样的5种组分的荧光响应值和浓度均不同.Al=20.0和40.0mg/L时,各类组分的荧光响应值和浓度较原水样均有一定程度的降低.
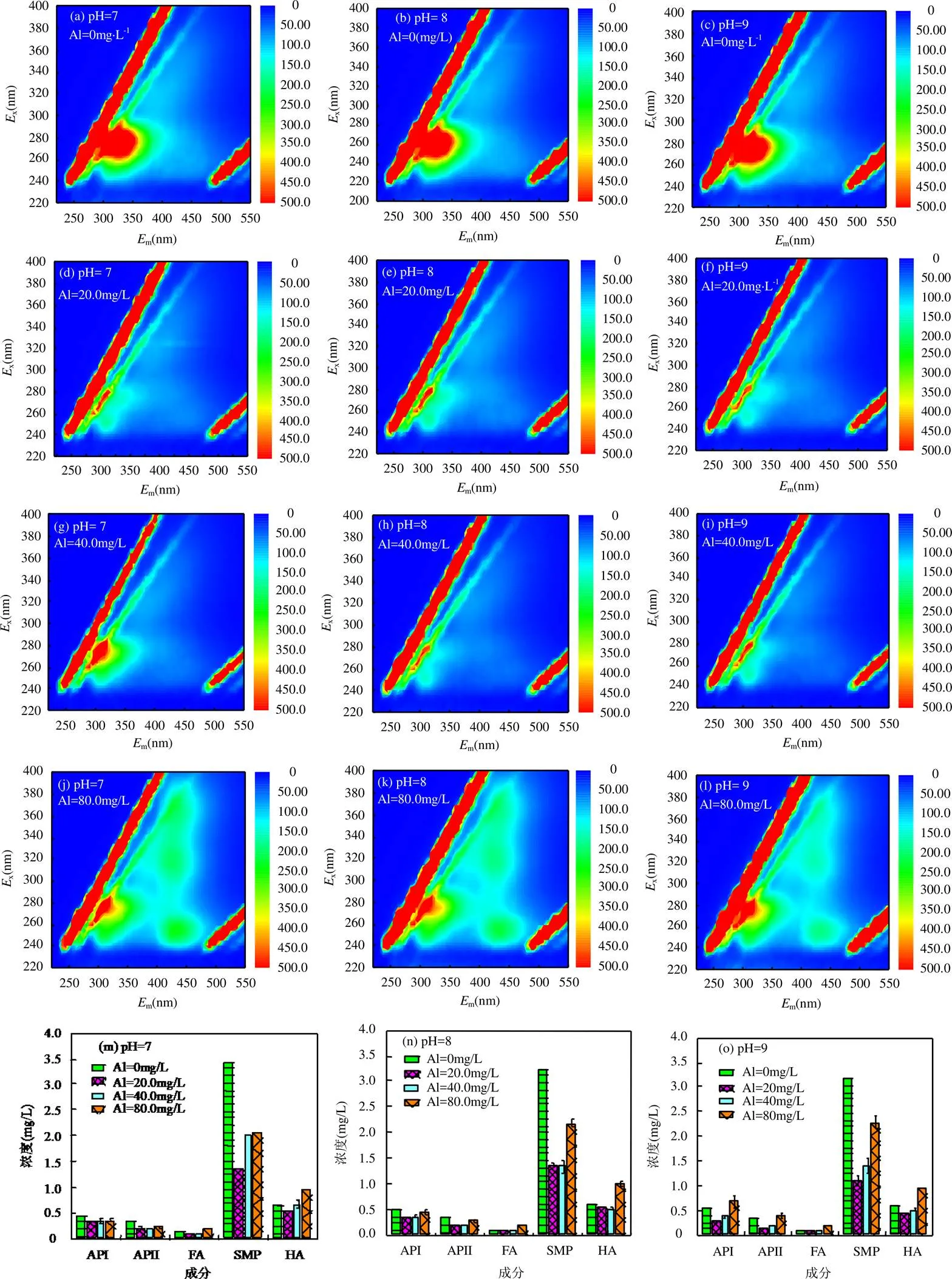
图4 不同条件下的三维荧光图及各组分浓度
Al投加量为40.0mg/L时,在pH为9.0时,各组分的荧光响应值和浓度较20.0mg/L的Al投加量都有上升.但在pH值为7.0和8.0时,芳香蛋白类物质和富里酸类物质没有上升.当Al投加量增加为80.0mg/L时,3个pH值条件下,各个组分的荧光响应值和浓度较20.0mg/L的Al投加量均上升.这是因为高浓度的金属离子会刺激藻细胞发生抗氧化反应而破坏膜系统,胞内有机物流出[23],尤其是腐殖酸的大量溶出,对混凝起到了干扰[24],从而降低了除氟效果.
2.3 藻絮体的表征
混凝剂投加到水体后,其水解产物与铜绿微囊藻及其EPS发生吸附架桥和网捕卷扫作用,聚集成较大絮体[25].为探究絮体的粒径变化,使用马尔文激光粒度仪对絮体的粒径进行了实时监测.在本文中,使用絮体的平均尺寸(50)来代表絮体的实际尺寸.结果如图5,pH值分别为7.0,8.0,9.0时,随着Al投加量由20.0mg/L增加到80.0mg/L,絮体平衡时的粒径呈现出先增大后减小的趋势,都在40.0mg/L的Al投加量达到最大平衡粒径,分别为500.0,350.0和200.0μm,趋势与氟去除率相吻合,可见藻类及其有机物与混凝剂形成的絮体性质对氟的去除起着重要的作用,氟去除率随絮体粒径的增大而升高[26].有研究[27]表明絮体的粒径和分型维数存在一定联系.絮体粒径越大,分形维数越小,结构愈松散.絮体粒径越小,分数维数越大,结构愈紧实.松散的絮体具有更大的表面积,更有利于吸附.用场发射扫描电子显微镜对絮体表层进行扫描,并利用X射线能谱仪,对絮体的表层的微区进行F和Al元素的扫描.如图6所示,可以清楚地看到这两种元素的面分布情况,F和Al结合在絮体表层,证明了藻絮体表面Al对氟的吸附作用.

图5 不同pH值条件下含藻絮体粒径随时间的变化

图6 pH=7时不同Al投加量下含藻絮体FE-SEM图
2.4 藻絮体破碎后对氟的吸附作用验证
为了更好的了解混凝过程含藻絮体与氟离子的作用机理,验证铜绿微囊藻和氯化铝形成的含藻絮体对氟的吸附作用,将混凝剂与铜绿微囊藻形成的絮体进行不同程度的破碎,用破碎后的絮体进行氟的吸附实验.破碎后絮体的粒径结果如图7(a)所示,絮体的粒径随破碎强度的增大而减小,平衡时絮体粒径分别为200和100μm.吸附后体系中氟的剩余浓度见图7(b),絮体表面Al与F的分布见图8,所示结果验证了含藻絮体对氟离子的吸附.随着破碎强度的增大,絮体的粒径逐渐减小.当破碎强度为0r/min时,絮体的粒径最大.当破碎强度为400r/min时,絮体显示出了更高的吸附效果,是因为絮体破碎程度增大,粒径减小,表面积增大,暴露出了更多的具有活性的吸附位点.破碎强度增加至800r/min时,虽然絮体的粒径减小,表面积更大,但吸附效果却下降,这是由于破碎强度太大,减少了具有活性的吸附位点[28],从而降低了氟的吸附效率.
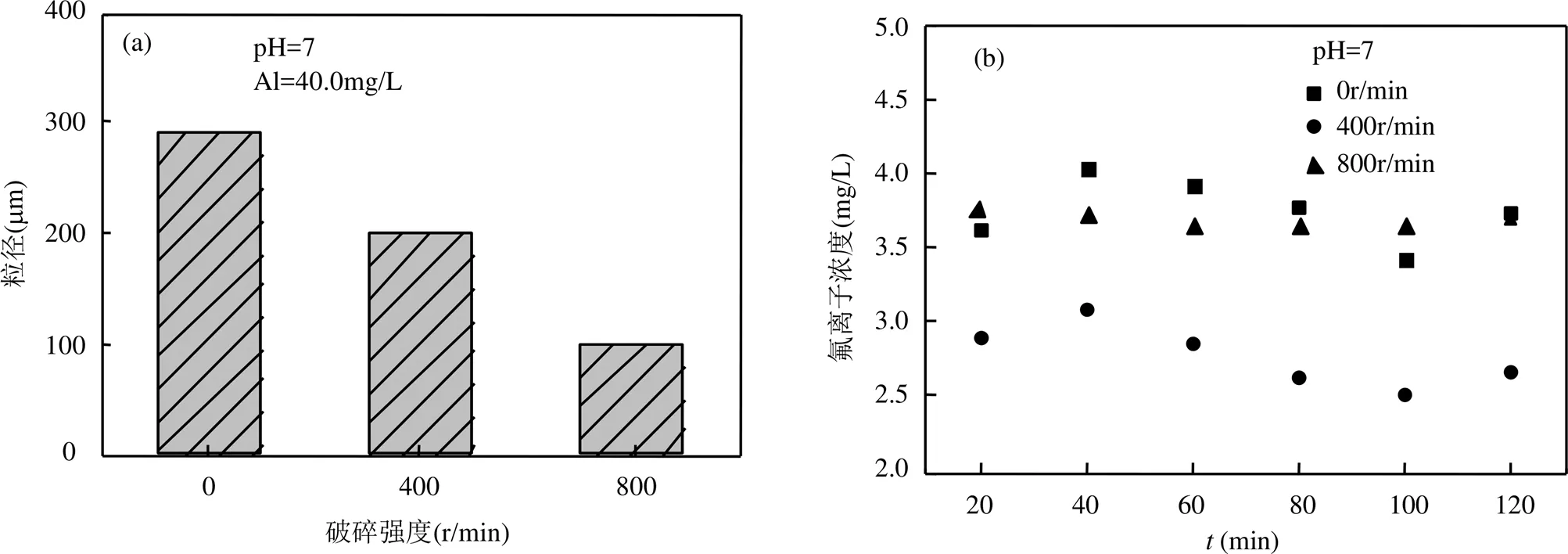
图7 藻絮体破碎后对氟的吸附

图8 pH=7时不同破碎强度下含藻絮体FE-SEM图
2.5 铜绿微囊藻对氟的同化吸收作用
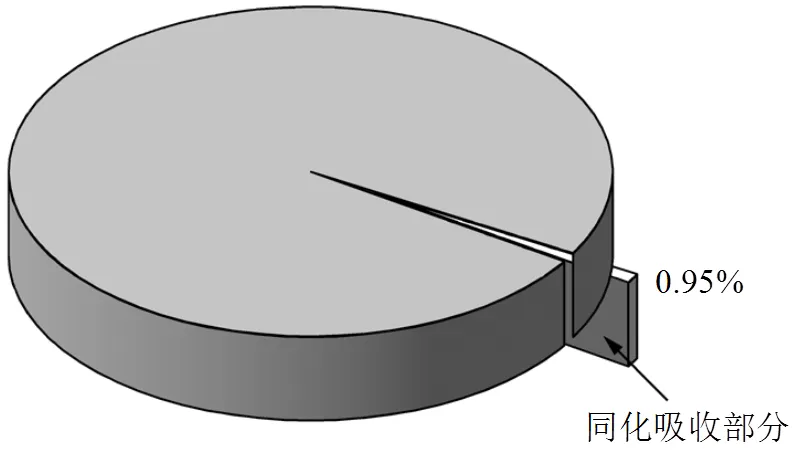
图9 铜绿微囊藻对氟离子的同化吸收作用
为了探究铜绿微囊藻对氟离子的同化吸收作用,将铜绿微囊藻在含氟水体中进行培养.定时取样检测体系中氟离子浓度,发现随着培养时间的增加,溶液中氟的浓度仅出现轻微下降.最终测得氟离子的去除率仅为0.95%,这表明铜绿微囊藻仅能吸收少量的氟,其同化吸收对氟的去除作用十分微小(图9).
2.6 促进作用机理
当体系中有铜绿微囊藻存在,pH值为7.0,8.0, 9.0时,Al投加量在20.0~80.0mg/L的条件下,铜绿微囊藻对混凝除氟有明显的促进作用,其促进作用机理如图10所示,铜绿微囊藻及其有机物与混凝剂水解产物通过吸附架桥和网捕卷扫作用,聚集成较大较多的絮体.絮体粒径越大,除氟率越高.当Al投加量过高时,藻细胞破损严重,有机物过多释放,对氟的去除起到了干扰作用.氟的去除作用在有藻体系中一共分为3个部分,一是非生物沉淀,F与Al转化为不溶性Al-F,Al-F-OH等物质[29];二是表面吸附,F吸附在含藻絮体表面;三是被铜绿微囊藻同化吸收.混凝除氟的促进作用机理主要在于含藻絮体的表面吸附,借助铜绿微囊藻增大絮体的粒径和表面积,通过表面吸附实现氟的有效去除.

图10 铜绿微囊藻对混凝除氟的促进作用机理
3 结论
3.1 无藻体系在pH=7.0,Al投加量为20.0mg/L条件下达到最高氟去除率48.11%,此时有藻体系的氟去除率为49.05%.有藻体系在pH=7.0,Al投加量达到40.0mg/L条件下达到最高氟去除率73.03%,此时无藻体系出水的氟去除率仅为31.03%.Al投加量在20.0~100.0mg/L范围内,有藻体系的氟去除率相较于无藻体系明显更高.
3.2 藻源有机物对混凝效果有一定的影响.在Al投加量为20.0和40.0mg/L时,混凝剂对有机物有一定的去除.当Al投加量为80.0mg/L时,藻细胞破损加重,胞内有机物释放,对混凝起到了干扰作用.
3.3 铜绿微囊藻的存在对混凝除氟的促进作用主要来自于含藻絮体对氟的表面吸附.铜绿微囊藻及其有机物与混凝剂水解产物通过吸附架桥和网捕卷扫作用,聚集成较大絮体,Al与F结合在絮体表面.对絮体进行一定强度破碎可以增加吸附位点,从而提高氟的吸附效率.
[1] Zhang L E, Huang D, Yang J, et al. Probabilistic risk assessment of Chinese residents' exposure to fluoride in improved drinking water in endemic fluorosis areas [J]. Environmental Pollution, 2017,222:118-125.
[2] Zhu J, Lin X, Wu P, et al. Fluoride removal from aqueous solution by Al(III)–Zr(IV) binary oxide adsorbent [J]. Applied Surface Science, 2015,357:91-100.
[3] Dreveton A. Overview of the Fluorochemicals Industrial Sectors [J]. Procedia Engineering, 2016,138:240-247.
[4] Ozairi N, Mousavi S A, Samadi M T, et al. Removal of fluoride from water using coagulation-flocculation process: a comparative study [J]. Desalination and Water Treatment, 2020,180:265-270.
[5] Bhatnagar A, Kumar E, Sillanp M. Fluoride removal from water by adsorption—Areview [J]. Chemical Engineering Journal, 2011,171(3): 811-840.
[6] Martyna G, Katarzyna M-N, Eftekhar A A. Removal of fluoride from multicomponent water solutions with the use of monovalent selective ion-exchange membranes [J]. Science of the Total Environment, 2020, 722:137681.
[7] Belkada F D, Kitous O, Drouiche N, et al. Electrodialysis for fluoride and nitrate removal from synthesized photovoltaic industry wastewater [J]. Separation and Purification Technology, 2018,204:108-115.
[8] Amor Z, Bariou B, Mameri N, et al. Fluoride removal from brackish water by electrodialysis [J]. Desalination, 2001,133(3):215-223.
[9] Miretzky P, Cirelli A F. Fluoride removal from water by chitosan derivatives and composites: A review [J]. Journal of Fluorine Chemistry, 2011,132(4):231-240.
[10] Wang X, Xu H, Wang D. Mechanism of fluoride removal by AlCl3and Al13: the role of aluminum speciation [J]. Journal of Hazardous Materials, 2020,398:122987.
[11] Landsberg, Jan H. The effects of harmful algal blooms on aquatic organisms [J]. Reviews in Fisheries Science, 2002,10(2):113-390.
[12] Henderson R K, Parsons S A, Jefferson B. The impact of differing cell and algogenic organic matter (AOM) characteristics on the coagulation and flotation of algae [J]. Water Research, 2010,44(12):3617-3624.
[13] Takaara T, Sano D, Konno H, et al. Affinity isolation of algal organic matters able to form complex with aluminium coagulant [J]. Water Science & Technology Water Supply, 2004,4(5/6):95-102.
[14] Chen W, Westerhoff P, Leenheer J A, et al. Fluorescence excitation- emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environmental science & Technology, 2015,37(24): 5701-5710.
[15] He Z, Lan H, Gong W, et al. Coagulation behaviors of aluminum salts towards fluoride: Significance of aluminum speciation and transformation [J]. Separation & Purification Technology, 2016,165:137-144.
[16] Gong W X, Qu J H, Liu R P, et al. Effect of aluminum fluoride complexation on fluoride removal by coagulation [J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2012,395(1): 88-93.
[17] 李影影,董黎明,李梦娅,等.固体浓度及上清液有机物对柠檬酸污泥pH缓冲容量的影响[J]. 环境化学, 2018,37(3):584-590. Yingying L I, Liming D, Mengya L I, et al. Effects of solid concentration and organic matter in supernatant on the pH buffering capacity of citric acid sludge [J]. Environmental Chemistry, 2018, 37(3):584-590.
[18] Deng H, Yu X. Fluoride sorption by metal ion-loaded fibrous protein [J]. Industrial & Engineering Chemistry Research, 2012,51(5): 2419–2427.
[19] Her N, Amy G, Park H R, et al. Characterizing algogenic organic matter (AOM) and evaluating associated NF membrane fouling [J]. Water Research, 2004,38(6):1427-1438.
[20] Li L, Gao N, Deng Y, et al. Characterization of intracellular & extracellular algae organic matters (AOM) of Microcystic aeruginosa and formation of AOM-associated disinfection byproducts and odor & taste compounds [J]. Water Research, 2012,46(4):1233-1240.
[21] Gonzalez-Torres A, Putnam J, Jefferson B, et al. Examination of the physical properties offlocs produced on coagulation with metal salts [J]. Water Research, 2014,60:197-209.
[22] Cloete T E, Oosthuizen D J. The role of extracellular exopolymers in the removal of phosphorus from activated sludge [J]. Water Research, 2001,35(15):3595-3598.
[23] Plekhanov S E, Chemeris Y K. Early toxic effects of zinc, cobalt, and cadmium on photosynthetic activity of the green alga chlorella pyrenoidosa chick S-39 [J]. Biology Bulletin of the Russian Academy of Sciences, 2003,30(5):506-511.
[24] Dhir B, Sharmila P, Saradhi P P, et al. Physiological and antioxidant responses of Salvinia natans exposed to chromium-rich wastewater [J]. Ecotoxicology & Environmental Safety, 2009,72(6):1790-1797.
[25] Pivokonsky M, Safarikova J, Baresova M, et al. A comparison of the character of algal extracellular versus cellular organic matter produced by cyanobacterium, diatom and green alga [J]. Water Research, 2014,51(15):37-46.
[26] Mittal Y, Srivastava P, Kumar N, et al. Remediation of fluoride contaminated water using encapsulated active growing algae [J]. Environmental Technology & Innovation, 2020,19:100855.
[27] 李振亮,张代钧,卢培利,等.活性污泥絮体粒径分布与分形维数的影响因素[J]. 环境科学, 2013,34(10):3975-3980. Li Z L, Zhang D J, Lu P L, et al. Influencing factors of floc size distribution and fractal dimension of activated sludge [J]. Environmental Science, 2013,34(10):3975-3980.
[28] Li R, Gao B, Huang X, et al. Compound bioflocculant and polyaluminum chloride in kaolin-humic acid coagulation: Factors influencing coagulation performance and floc characteristics [J]. Bioresource Technology, 2014,172:8-15.
[29] He Z, Liu R P, Xu J, et al. Defluoridation by Al-based coagulation and adsorption: Species transformation of aluminum and fluoride [J]. Separation and Purification Technology 2015,148(1):68-75.
Promotion effect ofon defluorination by coagulation and its mechanism analysis.
XIANG Yu1,2, XU Hui2, LI Kun1*, WANG Xi2,3, WU Hao-Lan2,4, FAN Hua1
(1.School of Resources Environment and Chemical Engineering, Nanchang University, Nanchang 330031, China;2.State Key Laboratory of Environmental Aquatic Chemistry, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China;3.University of Chinese Academy of Sciences, Beijing 100049, China;4.School of Water Resources and Environment Engineering, China University of Geosciences (Beijing), Beijing 100083, China)., 2021,41(4):1900~1908
and aluminum chloride (AlCl3·6H2O) were chosen to research the effect of algae on the coagulation removal mechanism of fluoride through 3D-EEM, FE-SEM. The results showed thathad an obvious promotion effect on defluorination under the conditions of pH 7.0, 8.0, 9.0 and Al dosage of 20.0~80.0mg/L, which was mainly due to the surface adsorption of fluoride by algal flocs.and the hydrolyzed products of coagulant aggregated into larger flocs by bridging and sweep flocculation. The larger the floc size was, the larger the fluoride removal rate was. When the pH value was 7.0 and the Al dosage was 40.0mg/L, the flocs reached the maximum particle size (500μm), and the fluoride removal rate was the largest (77.37%). When the Al dosage was 80mg/L, the algal cells were seriously damaged and the organic matter was released, which hindered the defluorination process. The results of floc breakage and adsorption experiments showed that certain strength breakage of algae floc could increase the adsorption site and thus improved the removal rate of fluoride. Excessive breakage led to too small particle size of algae flocs, resulting in the reduction of fluoride adsorption efficiency.
;defluorination;coagulation;floc;adsorption
X172
A
1000-6923(2021)04-1900-09
象 豫(1995-),女,河南长葛人,南昌大学硕士研究生,研究方向:水质,水环境与污染控制.发表论文3篇.
2020-08-25
国家科技重大专项(2017ZX07108-002,2017ZX07501-002);国家自然科学基金资助项目(51778604);宁夏回族自治区重大项目(2019BFG02032)
* 责任作者, 讲师, kunli@ncu.edu.cn

