FK506结合蛋白FKBP52对金龟子绿僵菌侵染东亚飞蝗的影响
田野 李贝贝 李霜 农向群 张泽华 刘廷辉 王广君

关键词东亚飞蝗;FK506结合蛋白;金龟子绿僵菌;保护酶
FK506结合蛋白(FK506 binding proteins,FK-BPs)是一类以胞内蛋白为主的蛋白质超家族,因其与FKS06(Prograf,普乐可复)的相互作用而得名,它具有肽基脯氨酰顺反异构酶(PPIases)活性,可催化多肽或蛋白质底物中的肽一脯氨酸顺反子的转换,从而影响其活性、磷酸化状态、蛋白质间相互作用、亚细胞定位及稳定性。FKBPs能够结合环孢素a(CsA)、FKS06或雷帕霉素,发挥免疫抑制效应。在免疫细胞中,FKBPs和FKS06的二元复合体共同作用,抑制钙调磷酸酶(CAN)的活性,进一步作用于磷酸化信号途径,使免疫细胞产生免疫抑制作用。此外,FKS06结合蛋白还有许多其他重要生理功能,如细胞周期调节、钙离子通道活性调节以及发育调节等作用。
金龟子绿僵菌Metarhizium anisopliae作为一类广谱性的昆虫病原真菌,对害虫生物防治具有重要作用。其侵染方式主要有体壁侵入和体内增殖两种。其中体壁侵染机制是金龟子绿僵菌孢子附着在寄主体表后,形成附着胞和侵染钉,在一系列胞外酶的作用下,穿透体壁进人体腔,形成虫菌体,大量繁殖,消耗寄主营养,并分泌多种毒素,最终造成寄主死亡。研究发现,采用金龟子绿僵菌制剂可以有效控制蝗虫为害,但与化学农药相比,存在致死效率低、致死时间长的弊端。其原因一方面是金龟子绿僵菌侵染所需时间较长,另一方面是东亚飞蝗具有较强的免疫防御反应。因此,我们推测可以通过改变蝗虫体内FKBPs的量,抑制东亚飞蝗免疫活性,促进金龟子绿僵菌侵染,达到加速蝗虫死亡的目的。
本试验通过定量PCR检测了FKBP52基因在东亚飞蝗不同组织中的表达情况,克隆了FKBP52基因,并获得了FKBP52蛋白,研究了其对金龟子绿僵菌侵染东亚飞蝗的影响,以及对东亚飞蝗体内免疫相关酶的诱导激活作用,为进一步明确FKBP的功能奠定了基础,同时对指导蝗虫防治具有一定的理论意义。
1材料与方法
1.1供试菌株、试虫与试剂
供试金龟子绿僵菌菌株IMl330189为国外引进在本实验室长期保藏。培养条件:将菌株接种到PDAY培养基(马铃薯200g,蔗糖20g,酵母粉5g,琼脂粉20g,补水定容至1000mL,121℃高压灭菌25min)平板上,25℃下培养5d。收集分生孢子粉,密封贮存于4℃冰箱,备用。
试验所用东亚飞蝗Locusta migratoria ma-nilensis为本实验室饲养纯化种群,在人工气候培养箱中于温度(30±2)℃,相对湿度(60±5)%,光周期L∥D=14h∥10h条件下孵化后,将同一时问孵化的蝗蝻转移到60cm×50cm×70cm规格的养虫笼中饲养,光周期L∥D=14h∥10h,温度为(30±2)℃。
试剂TRIzol、PrimeScriptTM RT Reagent Kitwith gDNA Eraser、LA-Taq酶、限制性内切酶EcoRⅠ和HindⅢ、SYBR Premix Ex TaqTMⅡ(TliRNaseH Plus)、无RNase纯水等均购于TaKaRa公司;感受态细胞BL21(DE3)、蛋白Marker和Ni-NTA亲和层析柱购自北京全式金生物有限公司;大肠杆菌Escherichia coli DH5a和载体pET-21b为本实验室保存;胶回收试剂盒、质粒提取试剂盒购自北京天漠科技开发有限公司;超氧化物歧化酶(SOD)、过氧化物酶(POD)检测试剂盒购自南京建成生物工程研究所;引物合成和测序由上海生工生物工程股份有限公司完成。
1.2东亚飞蝗总RNA提取和反转录
用TRIzol溶液提取東亚飞蝗成虫后足、体壁、脂肪体和血淋巴等不同组织、卵块、1龄蝗蝻虫体、2~5龄蝗蝻及雌雄成虫中肠的RNA,并用NanoPhotometer微量紫外分光光度计测定RNA浓度和纯度,按照PrimeScriptTM RT Reagent Kit with gD-NA Eraser说明书方法合成cDNA第1链,直接进行后续试验或者-20℃保存备用。
1.3 FKBP52基因在飞蝗成虫不同组织、不同发育阶段中肠中的表达
基于NCBI中已经公布的昆虫FKBP基因序列,结合本实验室前期测得东亚飞蝗转录组数据,获得FKBP52基因的DNA序列;利用DNAMAN6.0软件设计荧光定量PCR引物及基因克隆所需引物(表1),由上海生工生物工程股份有限公司合成。
1.4东亚飞蝗FKBP52基因克隆
以1.2中合成的成虫时期东亚飞蝗cDNA作为模板,FKBP52-F、FKBP52-R为引物,PCR扩增FKBP52基因。反应体系(25μL):10×PCRBuffer 2.5μL,dNTPs 2μL,Taq DNA聚合酶0.5μL,上下游引物(10 gmol/L)各1μL,cDNA1μL,双蒸水17μL。反应条件为:94℃预变性5min;94℃变性1min,58℃退火1min,72℃延伸90 s,共30个循环;72℃延伸10 min;4℃保存。PCR产物用1%的琼脂糖凝胶电泳检测,目的条带切胶回收。将纯化产物连接到pMD19-T载体。采用热激转化法,导人感受态细胞DH5a中;通过氨苄抗性筛选阳性克隆。将筛选到的阳性克隆进行PCR检测,正确的送公司测序。从筛选获得的目标菌株中提取质粒,-20℃保存备用。
1.5生物信息学分析
目的基因核酸序列的翻译以及编码蛋白质序列结构分析预测采用DNAMAN软件;蛋白质分子量预测采用https://web.expasy.org/cgi-bin/prot-param/protparam在线工具;利用SignalP在线软件信号肽。利用NCBI数据库中BlastP(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行氨基酸序列同源性分析,运用在线软件SMART(http://smart.emblheidelberg.de/smart/set)分析保守结构域。
1.6 FKBPS2蛋白表达与纯化
从测序正确的转化子中提取质粒,以该质粒为模板,用分别带有EcoR工和HindⅢ酶切位点的引物FKBP52-F/FKBP52-R进行PCR,扩增FKBP52全长基因。PCR产物经电泳检测无误后,使用琼脂糖凝胶回收试剂盒进行回收,用EcoRⅠ和HindⅢ进行双酶切。将酶切产物回收,与pET-21b载体进行连接,构建重组表达载体。采用热激法转化大肠杆菌感受态细胞BL21,涂板、挑单克隆检测。将阳性克隆在LB(Amp)液体培养基中37IC培养至为0.5~0.6时,加入IPTG,至终浓度为0.5 mmol/L,16℃进行诱导表达12h。离心收集菌体,超声波破碎(300w,超声持续5s,暂停5s,重复99个循环)后,4℃,9000r/min离心10min,取上清。用镍柱亲和层析进行蛋白纯化,用SDS-PAGE电泳检测所纯化蛋白浓度。
1.7金龟子绿僵菌与FKBPS2组合对东亚飞蝗生物活性测定
采用金龟子绿僵菌IMI330189孢子悬浮液单次背板点滴和FKBP52蛋白饲喂3龄东亚飞蝗的方法来测定FKBP52对金龟子绿僵菌的毒力影响,称取0.5g金龟子绿僵菌孢子粉于0.05%的吐温80溶液中,用涡旋仪使其混合均匀,随后用血球计数板进行计数,配制成终浓度为4.15×10个/mL的金龟子绿僵菌孢子悬浮液。FKBP52蛋白测定浓度后,配制成终浓度为1mg/mL的蛋白液。共设3个处理1个对照。
处理1:金龟子绿僵菌孢子悬浮液背板点滴,饵剂为1g含5%植物油的无菌麦麸;处理2:FKBP52蛋白饲喂,饵剂为1g含5%植物油的无菌麦麸+1mL的FKBP52蛋白;处理3:同时进行金龟子绿僵菌孢子悬浮液背板点滴和FKBP52蛋白饲喂,饵剂为1g含5%植物油的无菌麦麸+1mL的FKBP52蛋白;对照:同时进行0.05%的吐温80溶液背板点滴和大肠杆菌BL21(DE3)(含有pET-21b空载体)诱导表达的菌体饲喂,饵剂为1g含5%植物油的无菌麦麸+1mL终浓度为1mg/mL的空载体诱导表达的蛋白。不同处理中金龟子绿僵菌孢子用量和FKBP52蛋白浓度见表2。对照和所有处理均重复5次。
将预先饥饿处理12h的3龄东亚飞蝗蝗蝻按照30头/筐的标准放人无菌的塑料生测筐中(长×宽×高=30 cmX12 cmX9cm),用已消毒的玻璃板盖好。金龟子绿僵菌单独处理和金龟子绿僵菌+FKBP52共同处理中的蝗蝻全部以背板点滴的方式接种金龟子绿僵菌IMI330189孢子悬浮液(浓度为4.15×10个/mL),对照组中的蝗蝻全部以背板点滴的方式接种0.05%的吐温80溶液,每头蝗蝻接种量为2μL。对照、FKBP52、绿僵菌单独处理以及金龟子绿僵菌+FKBP52共同处理中分别加入相应的饵剂。根据试验设计,24h后将饵剂取出,以新鲜麦苗饲喂至试验结束,每日记录蝗虫的死亡数与存活数,连续统计10d。试验于温度30℃,相对湿度60%,光周期L//D=16h//8h生测室内进行。
1.8 FKBP52处理后东亚飞蝗保护酶酶活力测定
按照与1.7相同的方法处理蝗蝻,将3龄蝗蝻分装,每筐15头,每个处理重复3次。第2天开始,从每个处理的3个重复中各取1头蝗虫,解剖收集中肠,于液氮中研磨,加入预冷的20mmol/L Tris-HCl缓冲液,4℃、15000r/min离心20min,取上清作为酶提取液,以牛血清蛋白BSA为标准蛋白,参照Bradford方法测定每个提取液的蛋白浓度,然后测定酶液中过氧化物酶(POD)和超氧化物歧化酶(SOD)的活性,具體测定方法参照试剂盒使用说明书。每个样品重复测定3次。
1.9数据处理与分析
采用SPSS19软件进行单因素方差分析,并选用多重比较进行显著性差异分析,其中P<0.05表示样本问存在显著差异,P%0.01表示样本间存在极显著差异。
2结果与分析
2.1 FKBP52在飞蝗成虫不同组织中和不同发育时期中肠中的表达分析
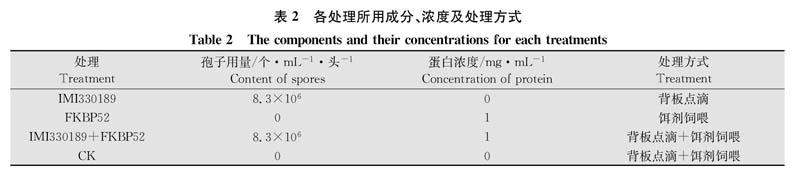
研究发现,FKBP52基因在雌、雄成虫的体壁、血淋巴、脂肪体、足、中肠、精巢和卵巢中都有表达,其中在雄成虫中肠内的表达量最高。以FKBP52基因在雄性成虫体壁中的表达量为标准参量,雄成虫中肠中FKBP52基因的表达量为体壁中表达量的4.13倍;其次为雌成虫中肠,相对表达量是雄成虫体壁中表达量的3.41倍;但雌、雄成虫中肠的相对表达量无显著性差异(P>0.05)。FKBP52基因在雌、雄成虫脂肪体中的相对表达量也较高,分别为雄成虫体壁表达量的2.79倍和2.71倍,二者之间也无显著性差异(P>0.05)。FKBP52基因在雌、雄成虫足中的表达量分别为雄成虫体壁表达量的1.38倍和1.60倍(P>0.05)。在雌虫体壁中的表达量与雄虫体壁之间无显著差异。但是在雄性精巢和雌性卵巢中的表达量略低于雄虫体壁。FKBP52基因在雌、雄成虫血淋巴中的表达量相对较少,分别为雄成虫体壁表达量的0.77倍和0.38倍(P>0.05)(图1)。
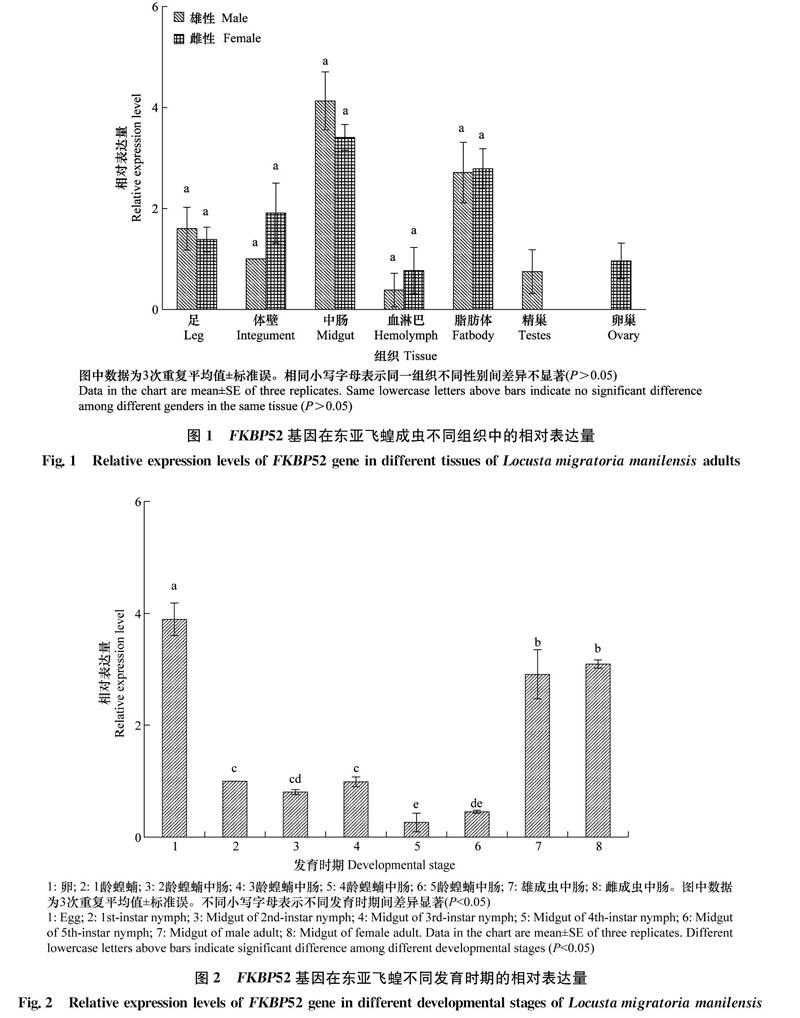
FKBP52基因在卵块、1龄蝗蝻虫体、2~5龄蝗蝻及雌、雄成虫中肠中都有表达,其中卵块中表达量最高。以FKBP52基因在1龄蝗蝻中的表达量为标准参量,卵块中FKBP52基因的表达量为1龄蝗蝻表达量的3.89倍,显著高于其他龄期(P<0.05)。其次为雌、雄成虫中肠,FKBP52基因的表达量为1龄蝗蝻表达量的3.09倍和2.91倍,二者之间无显著性差异(P>0.05);3龄蝗蝻中肠、2龄蝗蝻中肠、5龄蝗蝻中肠、4龄蝗蝻中肠的表达量依次递减,FKBP52基因的表达量分别为1龄蝗蝻表达量的0.99,0.81,0.46和0.26倍。可见,不同发育期的转录水平中,该基因主要在东亚飞蝗卵和雌雄成虫中肠中表达(图2)。
2.2东亚飞蝗FKBP52基因的克隆
通过PCR扩增得到FKBP全长基因。将其连接到pMD19-T克隆载体中,导人大肠杆菌DH5a中,经抗性筛选获得阳性克隆,进行测序。结果表明,该基因长度为1242bp(图3),编码413个氨基酸,通过NCBI序列比对,将其命名为FKBP52。利用SMART的序列工具分析FKBP52氨基酸序列,结果显示FK-BP52蛋白在第38-130位氨基酸、158-247位氨基酸之间存在2个FKBP_C超家族保守结构域,属于FKBP_C超家族成员之一(图4下划线所注)。
2.3 FKBP52蛋白表达与纯化
将FKBP52基因插入表达载体pET-21b中获得重组表达载体pET21b-FKBP52,将其导人大肠杆菌BL21后,经IPTG诱导表达,获得目的蛋白FKBP52。经过15%聚丙烯酰胺凝胶电泳检测分析,蛋白大小为46 kDa,与预期大小相符。大量提取蛋白,经镍柱亲和层析纯化,得到FKBP52纯蛋白(图5)。
2.4 FKBP52蛋白对金龟子绿僵菌侵染东亚飞蝗的影响
研究发现,使用只含FKBP52蛋白的饵剂处理东亚飞蝗,到第10天其累计平均死亡率为2.22%,与对照组(1.11%)无显著差异(P>0.05)。单独使用金龟子绿僵菌处理时,东亚飞蝗累计死亡率随处理天数增加不断上升,第10天达到60%,显著高于FKBP52蛋白单独处理组和对照组。使用金龟子绿僵菌与FKBP52蛋白同时处理东亚飞蝗时,在二者的共同作用下,东亚飞蝗的累计死亡率迅速上升,到第10天达到93.33%,显著高于金龟子绿僵菌单独处理组(P<0.05)(图6,表3)。上述结果表明FK-BP52蛋白与金龟子绿僵菌共同处理,可以显著提升对东亚飞蝗的致病力,提高杀虫效果。
2.5 FKBP52蛋白对东亚飞蝗过氧化物酶(POD)和超氧化物歧化酶(SOD)酶活力的影响
研究发现,FKBP52单独处理东亚飞蝗时,第1、4、5天POD酶活力与对照组之问无显著性差异(P>0.05),第2、3天时POD活力显著低于对照组(P<0.05)。金龟子绿僵菌单独处理时,在第3天和第5天东亚飞蝗的POD酶活力显著高于对照,尤其是第3天时,POD活力达到最高值11.609 u/mg;但在第2天POD的酶活力低于对照;在第1、4天其酶活力与对照无显著差异。FKBP52与金龟子绿僵菌共同处理时,除第1天外(第1天处理组的POD酶活力与其他处理无显著差异),第2、3、4、5天,处理组的POD活性都显著低于对照组(P<0.05),同时在第3-5天,FKBP52与金龟子绿僵菌共同处理组POD活性显著低于金龟子绿僵菌单独处理组(P<0.05)(图7)。
FKBP52单独处理东亚飞蝗时,第3、4、5天,处理组的SOD酶活力达到10.502、8.644、9.182 u/mg,显著高于对照组(分别为8.478、7.729、7.662 U/mg)(P<0.05),但在第1、2天时,与对照组之间都无显著性差异(P>0.05)。金龟子绿僵菌单独处理时,在第3天和第5天东亚飞蝗的SOD酶活力显著高于对照,尤其是第3天时,SOD酶活力达到最高值10.769u/mg;在第1天和第4天,SOD酶活力与对照无显著差异(P>0.05);但在第2天,处理组的酶活力显著低于对照组(P<0.05)。FKBP52与金龟子绿僵菌共同处理时,在第1天,处理组SOD酶活力与对照组之问无显著性差异;但第3、4、5天,处理组的SOD活性显著低于对照组和金龟子绿僵菌单独处理组(P<0.05),且从第1天开始呈现持续降低的趋势(图8)。
3讨论
昆虫在长期进化中形成了一套独特的免疫系统使其能够抵御逆境,扩大分布,并抵抗病原微生物的侵入。随着分子生物学的发展,关于昆虫免疫的主要过程及分子机理逐渐清晰,昆虫免疫机制的研究成果对于研究飞蝗免疫反应机制具有重要的参考意义。FKS06结合蛋白(FKBP)作为一种免疫调节蛋白,还参与了生物体内众多重要生理反应,如细胞周期的调节、钙离子通道活性的调节以及生长发育调节等。如朱佳证实了FKS06结合蛋白与棉铃虫Helicoverpa armigera滞育有关。Li等研究表明FK506结合蛋白在家蚕Bombyx mori每个发育阶段(卵、幼虫、蛹、成虫)都有表达,具有重要的调节作用。随着对FKS06结合蛋白研究的逐渐深入,其作用机制越来越清楚。刘国通等研究表明,FKS06单独并不能发挥免疫抑制作用,它需要先与FKBP12结合才能发挥作用,当FKS06与FK-BP12结合后,FK506特有的立体化学结构就会抑制FKBP12的肽基脯氨酰顺反异构酶活性,FKBP12在FK506的免疫抑制作用中发挥关键作用。本实验室前期验证了FKBP可抑制钙调磷酸酶活性,进一步诱导东亚飞蝗滞育。钙调磷酸酶可以与Toll途径下游Dorsal结合并使其去磷酸化,使转录因子Dif转移至细胞核,调节抗菌肽、防卫素、防御素等基因的表达。因此,我们推测FKBP作为钙调磷酸酶抑制剂会影响飞蝗体液免疫Toll途径级联反应,促进金龟子绿僵菌的侵染。
本试验克隆得到了长度为1242bp,含有完整FKBP_C结构域的一段FKBP序列,经过NCBI检索,确定克隆出的蛋白是FKBP_C超家族成员之一,与黑腹果蝇Drosophila melanogaster、家蚕中预测的结构相同;通过原核表达获得FKBP52蛋白,SDS-PAGE检测结果表明,该蛋白分子量46 kDa,与推测的分子量大小一致。通过对FKBP52基因在飞蝗不同发育时期和成虫不同组织中的相对表达量分析,发现FKBP52蛋白在中肠和脂肪体中的表达量相对较高。脂肪体是昆虫重要的免疫器官。因此,我们推测FKBP52蛋白对飞蝗免疫反应有着重要的作用。通过对FKBP52基因在蝗虫不同发育阶段中肠内的表达情况分析,发现其在蝗虫各发育阶段均有表达,但卵期与成虫期表达量明显高于幼虫期,在幼虫阶段的表达量基本相对稳定,这与柞蚕Antheraea pernyi中FKBP基因在不同发育阶段的表达谱相一致。
氧化还原反应是昆虫体内重要的化学反应之一,决定着昆虫的衰老与死亡,也会产生对虫体有害的活性氧,包括超氧阴离子、过氧化氢、羟基自由基等。活性氧的产生会对虫体造成伤害,引起体内脂质过氧化,DNA突变和酶失活等。在长期的发育进化过程中,昆虫形成了一套完整的保护系统,来清除各种活性氧。过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)作为昆虫体内氧化自由基的清除系统,能够协调体内氧自由基处于一种动态平衡状态,使机体免受伤害。王龙江等研究表明,红火蚁Solenopsis invicta被白僵菌Beau-veria bassiana侵染后体内CAT、SOD酶活力一直高于对照组,POD则表现出先上升后下降的趋势。张彦丰等研究发现,金龟子绿僵菌侵染能使蝗虫体内保护酶活力发生变化,呈现先升高后降低的趋势,蝗虫免疫降低,最终导致蝗虫死亡。本试验通过FKBP52与金龟子绿僵菌共同处理东亚飞蝗发现,二者共用可以使蝗虫的死亡率大大提高,且蝗虫體内的POD和SOD酶活力都显著降低,表明FKBP52蛋白能够有效抑制蝗虫免疫能力,能够作为正调控因子加强病菌的侵入,增强对寄主的致病力,提高死亡率。本研究为金龟子绿僵菌制剂的研制和蝗虫防治提供了新的思路与借鉴。

