不同肺转移潜能的大鼠肝癌细胞外泌体对巨噬细胞转录组的影响*
罗伟鑫,刘超群,许磊波,刘 超,吴文睿
肝癌易发生治疗后复发和远处肿瘤转移[1,2],其中肺部是最常见的肝外转移部位[3,4]。研究表明,肿瘤微环境是影响肿瘤转移的重要因素,其中巨噬细胞是肝癌肿瘤微环境中浸润数量最多的免疫细胞之一,在肿瘤的发生发展和转移过程中起重要作用[5,6]。外泌体(exosomes)是细胞分泌至胞外的、纳米级大小的囊泡状小体,其中含有蛋白质、脂质、非编码RNA等多种物质,在胞间的物质和信息交流中发挥重要作用[7]。近年来,体内外研究证据表明肝癌细胞来源的外泌体通过多种机制对原发肿瘤组织和转移灶内肿瘤微环境进行调控,促进肝癌细胞发生转移[8,9]。关于肝癌通过外泌体影响巨噬细胞功能促进肺转移的报道较少。本研究采用转录组测序方法(transcriptome sequencing)比较了大鼠骨髓来源的巨噬细胞在经两株不同肺转移潜能的肝癌细胞(WB-F344-Notch1high[10]和WB-F344-Bmi1high[11])来源外泌体处理后转录谱的差异,解析差异基因的功能,为探究肝癌通过外泌体驯化巨噬细胞促进肝癌肺转移的分子机制提供一定的依据。
1 材料与方法
1.1 细胞、动物、试剂与仪器 大鼠成体肝干细胞WB-F344购自中科院上海细胞库,WB-F344-Notch1high (WN1)和WB-F344-Bmi1high(WB1)细胞株由我们课题组前期通过慢病毒转染方式在WB-F344细胞中分别过表达Notch1和Bmi1,并参考Hooth MJ et al的选择性培养方法构建而成[12]。雄性F344大鼠,大于8周龄(成年大鼠),SPF级,购自北京维通利华实验动物技术有限公司。高糖DMEM(BI);胎牛血清(Gibco);青霉素/链霉素混合试剂(BI);PBS(BI);红细胞裂解液(白鲨易);大鼠M-CSF细胞因子(PeproTech);通用型RNA提取裂解液(TAKARA);蛋白酶抑制剂(康为世纪);磷酸酶抑制剂(康为世纪);RIPA(康为世纪);BCA法蛋白定量分析试剂盒(Invitrogen);上样缓冲液(loading buffer,弗德生物);ECL发光液(弗德生物);PKH26(Sigma);DAPI(索莱宝);抗CD9抗体(Abcam);抗CD81抗体(Santa Cruz);抗TSG101抗体(Abcam);抗Calnexin抗体(Affinity);辣根过氧化物酶标记的山羊抗兔Ig G(CST);辣根过氧化物酶标记的山羊抗鼠Ig G(CST);细胞培养箱(BINDER);台式离心机(湘仪L530);超高速离心机(Beckman Optima XE-100);激光共聚焦显微镜(Zeiss LSM 800);倒置荧光显微镜(Olympus);NanoSight NS300(Malvern Panalytical);透射电子显微镜(JEM-1400)。
1.2 细胞培养 取WB1和WN1两株细胞,用完全培养基(含有100 IU/m L青霉素G、100 mg/m L链霉素和10%胎牛血清的高糖DMEM)在5%CO2、37℃培养箱中培养,收集外泌体时,更换为无外泌体完全培养基培养。
1.3 大鼠骨髓来源的巨噬细胞的提取和培养 使用异氟烷将成年F344大鼠麻醉,用颈椎脱臼法处死,用75%酒精消毒全身毛发和皮肤,在无菌条件下取出股骨和胫骨。在安全柜中使用无菌器械剔除其表面软组织,剪断两端骨垢端,暴露骨髓腔,使用无菌PBS反复冲洗骨髓腔,收集冲洗液,500 g离心5 min。弃上清,使用红细胞裂解液常温裂解5 min,再次500 g离心5 min,弃上清,用含M-CSF(20 ng/mL)的完全培养基(含有100 IU/m L青霉素G,100 mg/m L链霉素和10%胎牛血清的高糖DMEM)重悬细胞、铺板,在5%CO2的37℃培养箱中培养,每2 d更换1次含M-CSF(20 ng/mL)的新鲜培养基,7 d后获得大鼠骨髓来源的巨噬细胞。
1.4 外泌体获取和实验分组 待WN1和WB1细胞在培养皿中长至约60%~70%密度后,更换去除外泌体的完全培养基继续培养48 h,分别收集WN1和WB1细胞培养上清,采用差速离心法从细胞上清中提取外泌体:全部离心步骤都在4℃条件下进行,首先2000 g离心20 min,去除细胞及其碎片。12000 g离心30 min,进一步去除细胞碎片。在超高速离心机上以110000 g离心70 min,保留沉淀并用适量PBS重悬,再次以110000 g离心70 min,最后得到的外泌体沉淀用PBS 100 μL重悬,并转移至EP管中备用。取等量的WB1和WN1细胞外泌体,分别处理大鼠骨髓来源的巨噬细胞48 h,使用RNA提取裂解液收集RNA样品送测序,其中WN1组为实验组,WB1组为对照组,实验重复3次,对每次结果进行配对分析。
1.5 WB1和WN1细胞及其外泌体蛋白检测 采用Western blot法,使用含蛋白酶抑制剂和磷酸酶抑制剂的RIPA溶液冰上裂解细胞或者外泌体15 min,收集裂解液,4℃,20000 g离心30 min,获取上清液,用BCA法测定蛋白浓度,加入loading buffer混匀,100℃金属浴加热10 min,冰上放置冷却、上样。蛋白电泳后转移至PVDF膜上,加封闭液室温下封闭1 h。加入一抗,置摇床上,4℃孵育过夜。用1×TBST洗涤3次,每次10 min。加入辣根过氧化物酶标记的二抗,室温下孵育1 h,1×TBST洗涤3次,每次10 min。ECL法显色, 使用MiniChemi化学发光快速拍摄系统获取图像。一抗的使用浓度分别为抗CD9(1: 1000)、抗CD81(1: 500)、抗TSG101(1: 2000)、抗Calnexin(1: 1000)。
1.6 外泌体粒径检测 获得外泌体悬液,调整外泌体至符合测量要求的浓度,使用NanoSight NS300检测外泌体粒径大小,同一样品重复检测3次。
1.7 外泌体鉴定 取外泌体悬液10μL,滴加到电镜铜网,室温静置沉淀5 min,用滤纸吸去液体。吸取醋酸铀10μL,滴加到铜网沉淀2 min,用滤纸吸去多余液体。室温静置、晾干后,使用JEM-1400透射电镜观察并拍摄。
1.8 外泌体体外摄取实验 使用PKH26对外泌体染色。将标记的外泌体加入巨噬细胞培养体系中继续培养12 h,固定,并用DAPI染细胞核,在激光共聚焦显微镜下对摄取外泌体的巨噬细胞进行拍摄。
1.9 转录组测序与数据分析 建立转录组文库和测序流程由上海欧易生物医学科技有限公司完成。以TRIzol法提取总RNA,使用NanoDrop 2000分光光度计测定RNA浓度和纯度,并使用Agilent 2100生物分析仪评估RNA完整性。确定样品符合要求后,使用TruSeq链式mRNA LT样品制备试剂盒构建文库并在Illumina HiSeq X Ten平台上进行测序。所得fastq格式的raw data先用Trimmomatic 处理,去除低质量的数据,获得clean data后,使用hisat2比对到大鼠的参考基因组,获得对应转录数据。最后,通过htseq-count软件获取各基因的reads数,使用DEseq2包[13](1.28.1版本)对实验组和对照组进行配对样本的差异表达分析, 将log2(差异倍数) ≥ 1且P<0.05的基因定义为具有显著统计学意义的差异基因。获得差异基因后,使用ggplot2包[14](3.3.2版本)和pheatmap包(1.0.12版本)绘制火山图和热图。
1.10 通路和功能的富集分析 使用Clusterprofiler包[15](3.16.0版本),采用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)数据库对差异表达基因进行信号通路注释和富集分析;采用基因本体论(gene ontology, GO)数据库对差异表达基因进行生物学过程(biological process, BP)、细胞组分)cellular component, CC)、分子功能 (molecular function, MF)方面的富集分析,校准P值(p.adjust)<0.05定义为统计学差异显著。
1.11 蛋白相互作用网络分析 利用相互作用基因检索搜寻工具(search tool for the retrieval of interacting genes, STRING)数据库分析差异基因中mRNA编码的蛋白之间的相互作用,并使用Cytoscape软件绘制蛋白相互作用网络(PPI),使用cytoHubba插件根据Degree分数大小筛选排位前10位的核心基因和使用MCODE插件筛选核心子网络,确定处于相互作用网络核心区域的差异基因。
2 结果
2.1 WB1和WN1来源的外泌体的鉴定 外泌体的标志性蛋白CD9、CD81和TSG101可以在WB1和WN1细胞及其来源的外泌体中被检测到。内质网相关蛋白Calnexin只能在细胞中被检测到,而在外泌体中没有表达。我们使用分步差速离心法所获得的外泌体的粒径大小较为均一,主要分布在50~150 nm范围内,两株细胞外泌体粒径大小分布差别不大(图1A、B)。进一步的电镜检测也证明了我们所获得的囊泡悬液为外泌体,其直径大小符合一般外泌体的定义(图1C)。

图1 外泌体鉴定
2.2 大鼠骨髓来源的巨噬细胞能够摄取外泌体并且在外泌体刺激后形态发生明显变化 通过PKH26对外泌体进行标记并在激光共聚焦显微镜下观察,结果显示在体外培养条件下,大鼠骨髓来源的巨噬细胞可以摄取加入培养体系的外泌体(图2A,红色颗粒物为外泌体)。光镜下观察显示,大鼠骨髓来源的巨噬细胞在接受外泌体刺激前形态多为长梭状,突触较长;接受外泌体刺激48 h后,大部分巨噬细胞形态变成煎蛋状(图2B)。

图2 巨噬细胞摄取外泌体及其形态变化

图3 WN1和WB1外泌体刺激的巨噬细胞转录组差异分析结果火山图和热图
2.3 WN1和WB1外泌体刺激的巨噬细胞转录组差异基因分析 对分别接受WB1或WN1来源的外泌体处理的大鼠骨髓巨噬细胞的转录组测序数据进行差异分析,构建火山图。以log2(差异倍数)≥1且P值<0.05为阈值进行筛选,共发现318个差异表达基因(图3A)。与WB1组比,WN1来源的外泌体处理的巨噬细胞上调的基因有296个(红色标注散点),下调的基因有22个(绿色标注散点)。我们以热图形式对差异基因进行了展示(图3B)。
2.4 WN1外泌体刺激的巨噬细胞上调差异基因的KEGG通路富集分析 对2.3中差异分析所得到的296个上调差异基因进行KEGG通路富集分析,结果共有19条通路被富集,对分析所得统计值显著性排名前10的通路进行了展示,分别是细胞因子-细胞因子受体的相互作用(cytokine-cytokine receptor interaction)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、Rap1 信号通路(Rap1 signaling pathway)、MAPK信号通路(MAPK signaling pathway)、IL-17信号通路(IL-17 signaling pathway)、黏着斑(focal adhesion)、钙离子信号通路(calcium signaling pathway)、TNF信号通路(TNF signaling pathway)、病毒蛋白与细胞因子和细胞因子受体的相互作用(viral protein interaction with cytokine and cytokine receptor)和类风湿关节炎(rheumatoid arthritis,图4A)。接着,我们对显著性排名前5的富集通路共有基因进行分析,发现Cxcl6、Il6、Cxcl2、Ccl12、Ccl20和Cxcl3等基因至少在3个富集通路中存在(图4B)。

图4 WN1外泌体刺激的巨噬细胞转录组上调差异基因KEGG分析结果
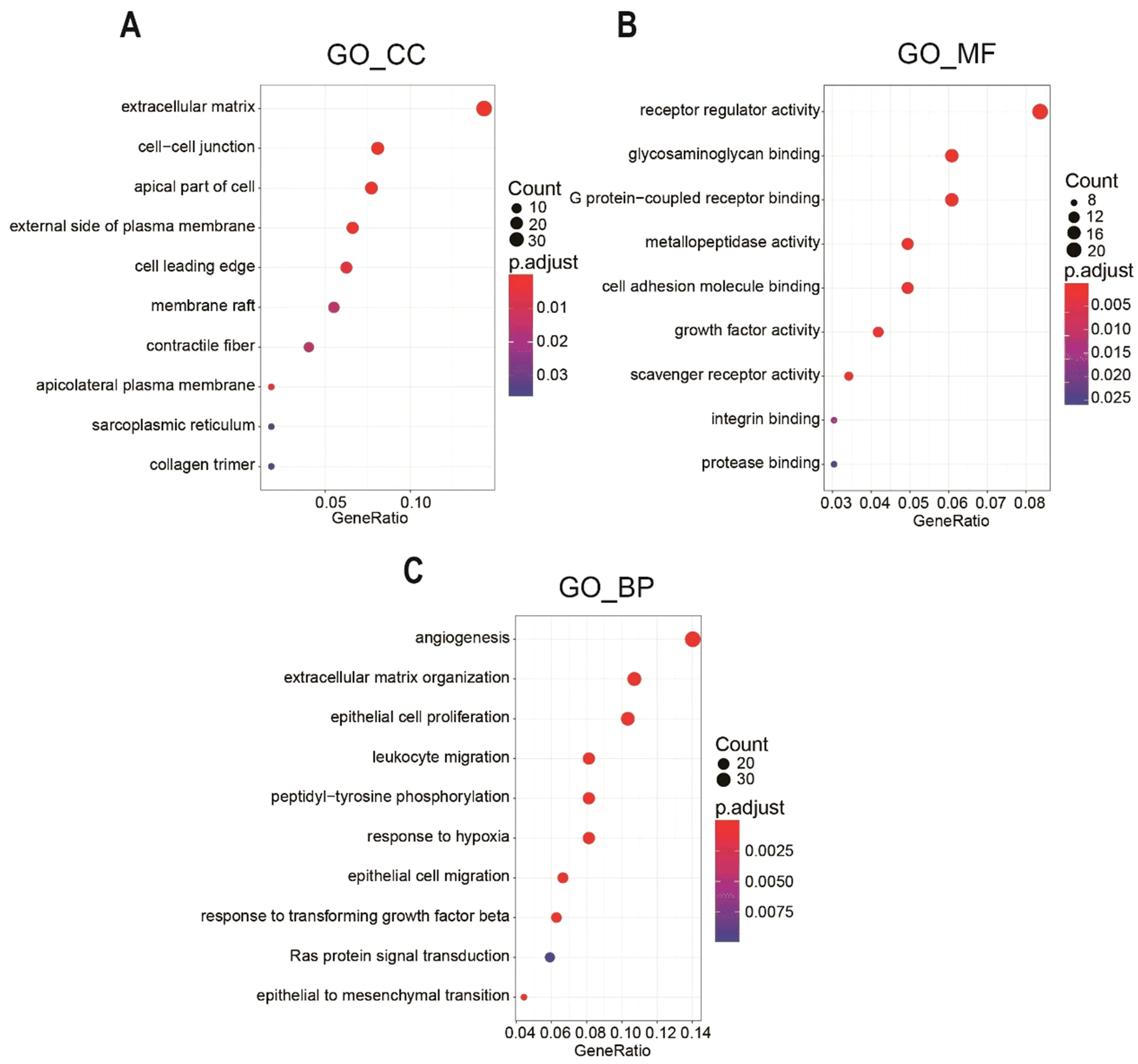
图5 WN1外泌体刺激的巨噬细胞转录组上调差异基因GO分析结果
2.5 WN1外泌体刺激的巨噬细胞上调差异基因的GO功能富集分析 由于GO条目存在冗余,在对2.3中差异分析所得296个上调差异基因进行GO功能富集分析后,我们挑选其中具有代表性的功能条目进行展示。结果显示在细胞组分(cellular component,CC)方面,差异基因主要集中分布在细胞外基质(extracellular matrix)、细胞顶端部分(apical part of cell)、细胞间连接(cell-cell junction)、收缩纤维(contractile fiber)等和细胞黏着和运动相关的条目中(图5A);在分子功能(molecular function, MF)方面,差异基因主要集中在受体调节器活动(receptor regulator activity)、G蛋白-偶联受体结合(G protein-coupled receptor binding)、生长因子活性(growth factor activity)、糖胺聚糖结合(glycosaminoglycan binding)、金属肽酶活动(metallopeptidase activity)等与细胞间信息交流和细胞外基质调控相关的条目中(图5B);在生物过程(biological process, BP)方面,差异基因主要集中在血管形成(angiogenesis)、上皮细胞增殖(epithelial cell proliferation)、上皮细胞迁移(epithelial cell migration)、上皮间质转化(epithelial to mesenchymal transition)等与肿瘤生长和转移相关的条目中(图5C)。

图6 WN1外泌体刺激的巨噬细胞转录组差异基因蛋白质相互作用网络分析结果
2.6 蛋白质相互作用网络分析筛选WN1外泌体刺激的巨噬细胞差异基因中的核心基因 在STRING数据库输入2.3中差异分析所得318个差异基因后,获得307个节点,655条边缘的PPI网络,为了简化PPI网络寻找核心基因,通过Cytoscape软件的cytoHubba插件得到Degree分数排名前10的基因(图6A),分别是Vegfa、Il6、Thbs1、Col1a2、Mmp3、Mmp2、Edn1、Postn、Bgn和Lpar1。另外,我们还通过MCODE插件对重要的核心网络进行筛选排名前2位的核心子网络(图6B),我们发现Vegfa、Il6、Edn1和Lpar1这4个基因在MCODE核心子网络中也占据有重要的地位。
3 讨论
肝癌肺转移是影响肝癌患者预后的重要因素,其发生机制值得深入探讨。既往研究证明肝癌可以通过分泌外泌体作用于肿瘤相关成纤维细胞[16]或内皮细胞[17],促进肝癌实现肺转移。内质网应激可促使肝癌细胞分泌富含miR-23a-3p的外泌体作用于巨噬细胞,增加巨噬细胞PD-L1的表达,实现肿瘤免疫逃逸[18]。本研究通过转录组测序技术和生物信息学分析,对不同肺转移潜能的大鼠肝癌细胞来源外泌体处理的骨髓来源巨噬细胞进行对比及KEGG和GO分析,进一步探讨了差异基因可能参与的信号通路和生物学过程。
肝癌微环境中的巨噬细胞在肿瘤的诱导下可以分泌多种细胞因子、趋化因子或生长因子作用于肿瘤细胞、肿瘤相关间质细胞或内皮细胞,促进肿瘤细胞EMT、诱导肿瘤内血管新生、淋巴管新生和免疫抑制等过程,进而促进肿瘤的发展和转移[19,20]。在多种肿瘤模型,Vegfa被报道具有通过促进血管生成和增加血管通透性促进肿瘤发展和转移的功能[21,22]。Il6作为重要的促炎因子,在多种肿瘤中被证实具有促进肿瘤细胞EMT,进而增强其向远处转移能力[23,24]。Mmp2和Mmp3等金属蛋白酶则是促进细胞外基质降解的重要参与者,可以帮助肿瘤细胞向外侵出原发灶,实现远处转移[25]。

