淡水淹水胁迫对桐花树幼苗生长及生理特征的影响
王冰清 丁岳炼 谭家得 陈杰 万利鑫 周建瑛 王惠芳
[佛山市林业科学研究所(佛山植物园) 广东佛山528222]
桐花树(Aegiceras corniculatum),又名蜡烛果,是紫金牛科、蜡烛果属灌木或小乔木,在中国主要分布于海南、广西、广东、福建、台湾及南海诸岛;印度、中南半岛至菲律宾以及澳大利亚南部等地也有分布,喜生长于海边潮水涨落的污泥滩上,适应性强,易形成单种的生物群落,是海岸红树林组成树种之一[1]。桐花树群植可构成红树林景观,在防风消浪、促淤保滩、固岸护堤、净化海水和空气方面发挥了重要的生态作用[2]。为扩大桐花树的生态应用价值,将桐花树引种种植于淡水湿地环境中,解决日益严峻的水土流失、水体污染、富营养化等问题,已成为目前研究的新方向。
关于桐花树的淡水应用目前已经有一定的基础,丁岳炼等[3]探究了桐花树淡水育苗技术,筛选出了淡水浇灌下桐花树幼苗生长的最佳基质;董雪等[4]就淡水驯化后的桐花树对人工污水的净化效果进行了探讨,为桐花树在淡水中的生态应用价值提供了理论支持。虽然目前有关桐花树在淡水中的应用有了一定的研究,但是关于桐花树在淡水中的适生水位以及水淹胁迫对桐花树生长发育、生理特征的影响,桐花树在河流、湖泊汛期环境中适应性等情况尚不清楚。为了扩大红树植物桐花树的应用范围,充分发挥其在淡水河流、湖泊中的生态效益,本研究通过模拟轻度、中度、重度淹水胁迫,探究桐花树的生长发育情况以及生理响应,拟了解桐花树的适生水位,为桐花树在淡水河流、湖泊中的应用提供理论基础。
1 材料与方法
1.1 材料
试验场地位于佛山市林业科学研究所苗圃内,试验材料为经淡水驯化的桐花树一年生实生苗。
1.2 方法
1.2.1 适生性培养
选取生长健壮、长势一致、高度相仿的一年生桐花树袋苗并将其分为4 组,每组30 株,于2019 年8 月15 日分别移入规格为160 cm×120 cm×50 cm 的4 个塑料储水箱中进行15 d 左右的适应性培养,加入苗木容器1/3位置的水,进行正常水肥管理,待供试苗生长稳定后开始淹水胁迫试验。
1.2.2 淹水胁迫试验
将4 个水箱中的桐花树分别设置为对照(CK)及轻度(A)、中度(B)、重度淹水(C)胁迫组,向水箱中注入自来水,对照组保持正常水肥管理水位,水位在苗木容器1/3位置处;轻度淹水胁迫组水位与苗木容器上口水平;中度淹水胁迫组水位至苗高1/3 处;重度淹水胁迫组水位至苗高2/3处。为防止水质恶化,每7 d换一次水。
1.2.3 试验测定
1.2.3.1 基础数据的测定
分别于淹水胁迫开始(第0天)及淹水胁迫结束(第60 天)测定各不同处理组桐花树苗高、地径及生物量,探究不同水位处理60 d 对桐花树长势的影响,并观察桐花树的形态变化。各处理组随机选取10 株进行测定,苗高、地径的测定采用直接读数法;分别选取根、茎、叶分别进行生物量测定,采用烘干法,干燥至恒重后称重。
1.2.3.2 生理指标的测定
分别于淹水胁迫第0、5、15、30 天,取对照组(CK)与重度淹水胁迫组(C 组)叶片,探究重度淹水胁迫下桐花树生理指标的变化。测定指标包括可溶性蛋白浓度,可溶性糖含量、MDA 含量,SOD、CAT、POD活性。取样时间统一在上午10点进行,采用完全随机取样,每个处理3株重复,分别采集植株顶端新叶下第3 或4 片健康叶,经液氮处理后存放入-80℃低温冰箱,待取样全部结束后统一进行测定。
(1)可溶性蛋白、MDA、SOD、CAT、POD 的测定方法:准确称取桐花树叶片0.2 g,加入9 倍体积的磷酸缓冲液,冰水浴条件下机械匀浆,制备成10%的植物组织匀浆,以2 500 r/min 低温离心10 min,取上清液待测。可溶性蛋白采用考马斯亮蓝法[5]测定,MDA 采用硫代巴比妥酸法[6]测定,SOD 采用邻苯三酚自氧化法[7]测定,CAT 采用过氧化氢法[8]测定,POD采用愈木酚法[9]测定。
(2)可溶性糖测定方法:准确称取桐花树叶片0.1 g,剪碎混匀,加入1 mL 蒸馏水,用匀浆研磨器研磨成匀浆液,倒入有盖离心管中,盖紧,管盖上扎一小孔,沸水浴10 min;待冷却后,以4 000r/min常温离心10 min,取上清液用蒸馏水稀释10 倍,摇匀备用。可溶性糖采用蒽酮比色法[10]测定。
2 结果与分析
2.1 淹水胁迫对桐花树生长发育的影响
2.1.1 形态特征的变化
不同水位淹水胁迫处理60 d 后,所有桐花树均能成活,并对淹水胁迫产生了一系列形态学适应反应,其中最主要的特征是茎基部形成膨大皮孔。图1分别为正常(CK)、轻度(A)、中度(B)、重度(C)淹水胁迫下,桐花树茎基部周围膨大皮孔的分布情况。正常水位下,桐花树由于未受到水淹胁迫,茎周未形成膨大皮孔;轻度淹水胁迫下,淹水水位附近茎基部上出现了膨大皮孔,并且随着淹水胁迫程度的加深,相同茎秆长度下膨大皮孔的数量增多,并随着水位的升高向茎顶端方向延伸。

图1 各处理组淹水60 d后茎形态变化
2.1.2 苗高地径的变化
不同水位淹水胁迫60 d 后桐花树的苗高、地径的变化量如图2 所示。由图2 可以看出,正常、轻度、中度、重度淹水胁迫处理60 d 后,桐花树的苗高、地径均有一定程度的增长;随着淹水程度的加重,桐花树苗高的增长量呈现先增加后减少的趋势,各处理组苗高增长量与对照组无显著性差异;不同水位淹水胁迫处理对地径的影响较小,随着淹水胁迫程度的加重,桐花树地径的增长量先趋于稳定后开始减少,各处理组地径的增长量与对照无显著性差异。
2.1.3 生物量的变化
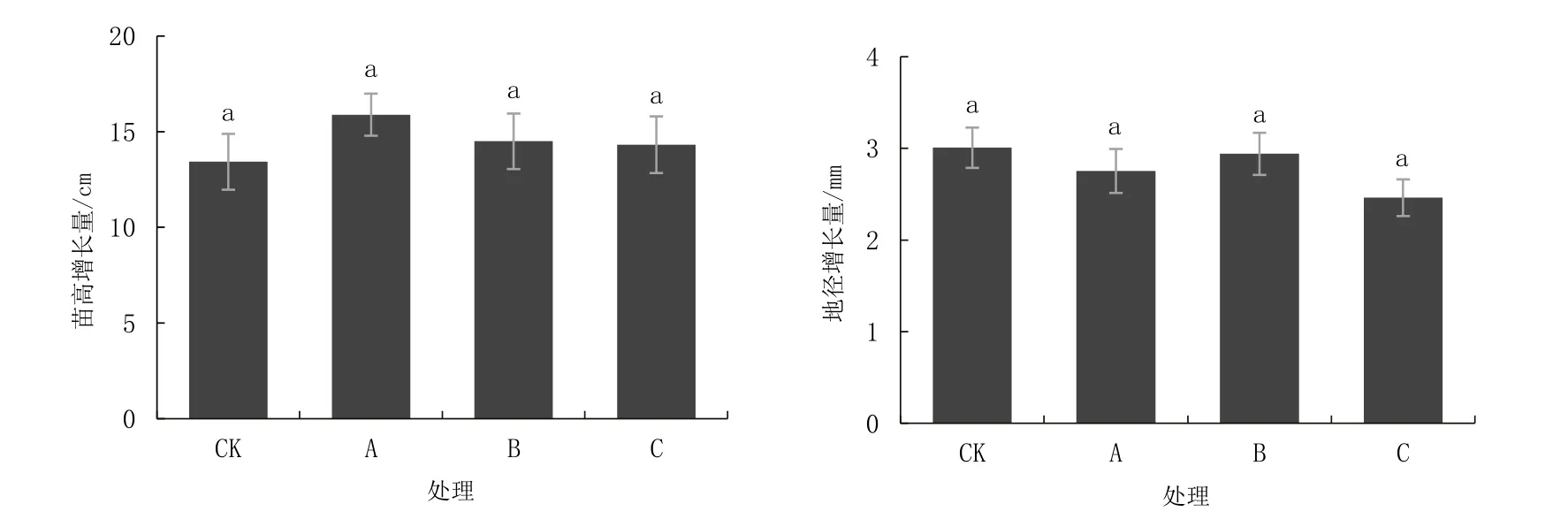
图2 淹水后桐花树苗高、地径变化
不同水位淹水胁迫60 d 后,桐花树生物量的增长量在根、茎、叶中的分配如图3 所示。由图3可知,不同处理组桐花树生物量的积累在根、茎、叶中的分配不均匀,其中对照组在根中的分配比较多,淹水胁迫组在茎的分配比较多。随淹水胁迫程度的加重,根生物量的积累呈递减的趋势,其中重度淹水胁迫组根生物量的积累显著小于对照组;随淹水胁迫程度的加重,茎、叶生物量的积累大体呈现递增的趋势,但各组之间茎、叶的增长量无显著性差异。
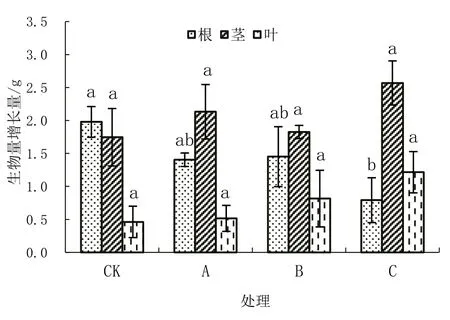
图3 不同处理下桐花树幼苗生物量的变化量
2.2 淹水胁迫对桐花树叶片生理指标的影响
2.2.1 淹水胁迫对桐花树可溶性蛋白含量的影响
对照组和重度淹水胁迫组桐花树叶片可溶性蛋白含量随淹水时间的变化如图4 所示。由图4 可知,对照组桐花树叶片可溶性蛋白含量随淹水时间的延长呈逐步上升趋势,处理30 d 后可溶性蛋白由0.24 mgprot/mL 逐步上升到0.40 mgprot/mL。随淹水时间的延长,重度淹水胁迫组可溶性蛋白含量呈现先降低后升高再趋于平缓的趋势;淹水处理0~5 d,可溶性蛋白含量由0.25 mgprot/mL下降至0.20 mgprot/mL;淹水处理5 d 后,随着淹水时间的延长,可溶性蛋白含量迅速上升,至15 d升时升为0.32 mgprot/mL;淹水15 d后,随着淹水时间的延长,可溶性蛋白含量趋于平缓。
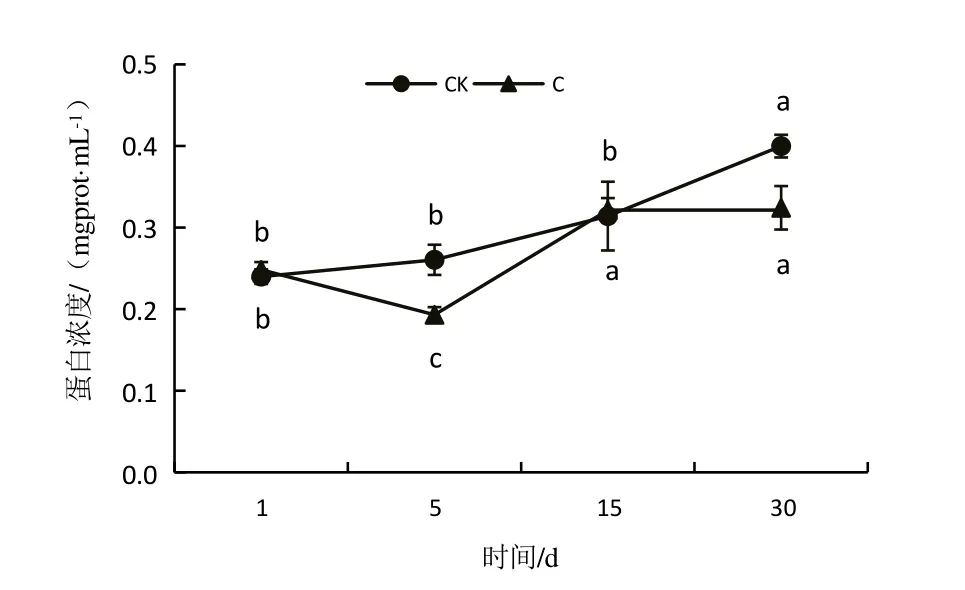
图4 叶片可溶性蛋白含量变化
2.2.2 淹水胁迫对可溶性糖含量的影响
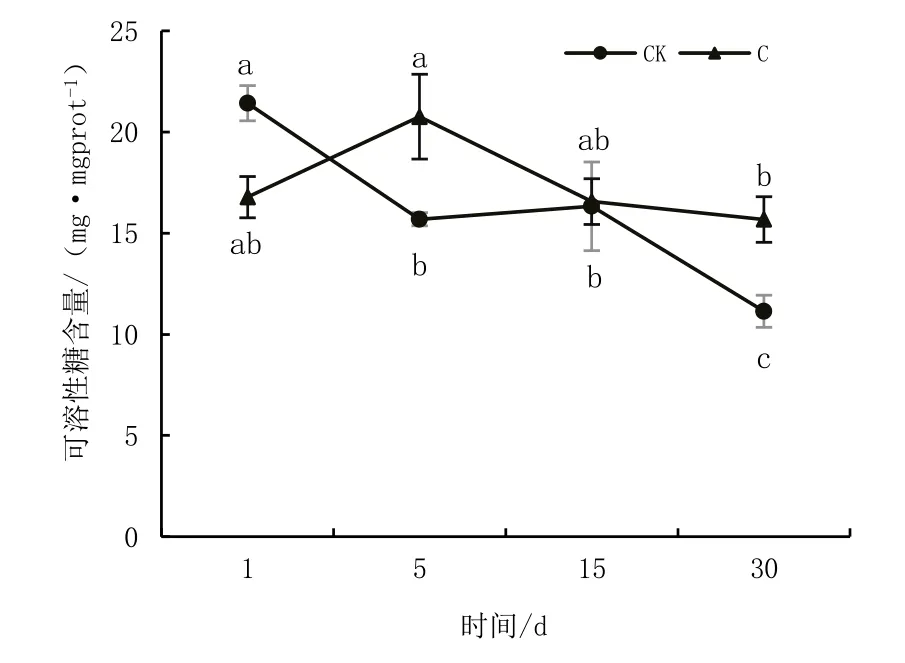
图5 叶片中可溶性糖含量变化
对照组和重度淹水胁迫组桐花树叶片可溶性糖含量随淹水时间的变化如图5 所示。由图5 可知,随淹水时间的延长,对照组可溶性糖含量呈现逐步下降的趋势,重度淹水胁迫组呈先上升后下降最后趋于平缓的趋势。对照组处理30 d,可溶性糖由21.43 mg/mgprot 下降至11.14 mg/mgprot。重度淹水胁迫组淹水处理前5 d,随淹水时间的延长,可溶性糖含量由16.78 mg/mgprot 升高至20.76 mg/mgprot;淹水5 d 后,随淹水时间的延长,可溶性糖含量降低至16.56 mg/mgprot;淹水处理15 d 后,随着淹水时间的延长,可溶性糖含量缓慢降低并逐步趋于平缓。
2.2.3 淹水胁迫对桐花树保护酶活性的影响
对照组和重度淹水胁迫组桐花树叶片MDA含量以及SOD、CAT、POD等保护酶活性随淹水时间的变化如图6 所示。由图6 可知,随淹水时间的延长,对照组MDA含量呈现先降低后缓慢升高的趋势,重度淹水胁迫组呈现先缓慢升高后逐渐降低并趋于平缓的趋势;对照组SOD活性逐渐降低,重度淹水胁迫组SOD活性呈先升高后降低最后趋于平缓的趋势;对照组CAT 活性逐渐降低,重度淹水胁迫组CAT 活性先升高后迅速降低最后缓慢降低;对照组POD 活性逐渐降低,重度淹水胁迫组POD 活性呈现先升高后迅速降低最后趋于平缓的趋势。
3 讨论与结论
3.1 讨论
3.1.1 淹水胁迫对桐花树生长发育的影响
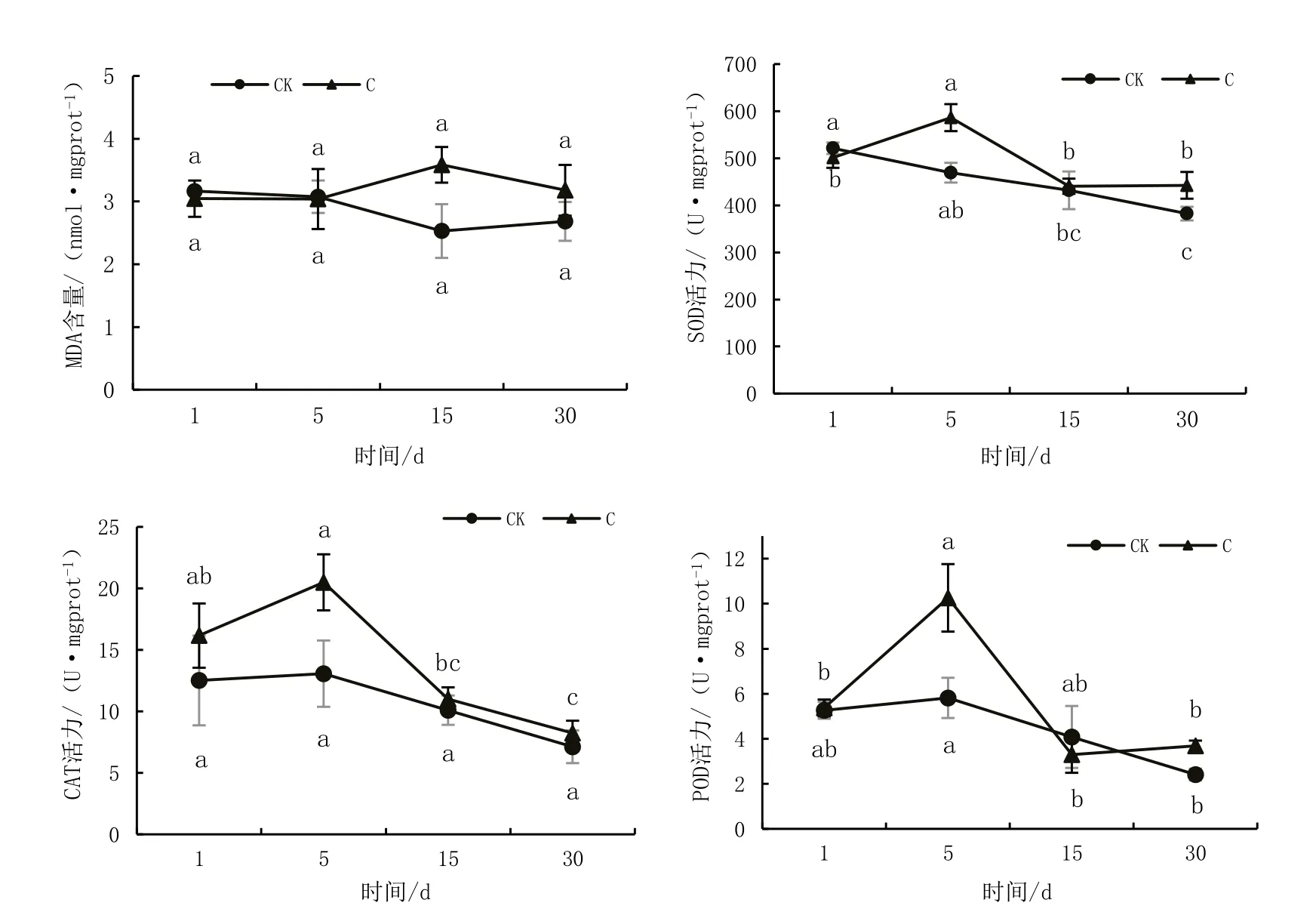
图6 叶片中MDA含量及SOD、CAT、POD活性变化
与对照组相比,淹水胁迫组根际产生膨大皮孔是桐花树对淹水胁迫的一种适应性表现。当对桐花树给予一定的淹水胁迫后,桐花树根系处在一种缺氧的环境中,通过茎周皮孔膨大增大了植物对氧气的吸收和氧气向根的疏导能力,使植物能够获取充足的氧气来维持正常新陈代谢活动[11],这是桐花树耐涝的一种典型特征。不同水位淹水胁迫下,桐花树苗高、地径的变化无显著性差异,这可能是由于桐花树本身是一种生长于海岸潮汐带的红树植物,能够对水淹环境有一个很好的适应,在不同水位水淹胁迫处理下均能正常生长。不同水位淹水处理下,从桐花树生物量的增长在根、茎、叶中的分配可以看出,淹水胁迫对桐花树根的影响比较大,随着淹水水位的上升,根系氧浓度降低,根系的生长越受限制,但植物为适应淹水环境,往往通过膨大皮孔、加速伸长茎和叶柄及增厚叶片角质层来获取充足的氧气[12-13],因此,随着淹水水位的上升,桐花树生物量的分配主要集中在茎、叶,根的分配较少,这与何斌源等[14]关于桐花树在原生环境不同海水高程淹水中生物量的分配主要在叶和根上、茎的分配较少的研究结果稍有不同,这可能是二者间的试验环境不同所导致;本研究是以淡水淹水,并且水位是静态恒定的,何斌源等[14]的试验是在海岸线上,受海水盐度和潮汐的影响,根部有时可以露出水面进行呼吸,因此在一定高程的淹水下,其根部已长期适应了潮汐的环境,从而可正常进行生长,分配的生物量较本试验多。
3.1.2 淹水胁迫对桐花树叶片生理指标的影响
在逆境胁迫下,植物体内会发生一定程度的渗透调节,通过生理生化的代谢途径产生脯氨酸、可溶性糖、可溶性蛋白等渗透调节物质和特定蛋白,以控制离子、水流和去除有毒基团[15-16];渗透调节的同时,植物体内的保护酶系统也开始工作,通过调节SOD、POD、CAT 等抗氧化酶的活性,加速其对氧自由基的清除,可降低逆境胁迫对植物的危害,提高植物的抗性[17],这些都是植物在逆境胁迫下的生理特征及适应性表现。本试验研究发现,桐花树可溶性糖含量、抗氧化酶活性随着淹水时间的延长大体上呈先升高后降低最后趋于稳定的趋势,这是由于淹水胁迫打破了植物细胞内保持的氧自由基的平衡,因此,植物通过提高抗氧化酶的活性加速对氧自由基的清除。随着胁迫时间的延长,酶活性降低,这可能是由于自由基过量积累,酶结构和功能受到一定程度破坏[18-19],最后随时间的延长,桐花树为应对淹水环境发生了不同程度的形态学结构改变,随淹水胁迫程度降低,酶活性变化逐渐趋于平缓。这与吴静[18]和梁芳[20]关于鸡爪槭、红花玉蕊的研究结果(呈先升高后降低的变化趋势)稍不一致,这可能是由于桐花树与鸡爪槭、红花玉蕊相比,对淹水环境具有更好的适应性。
MDA 是植物在淹水胁迫下膜脂过氧化作用的产物,MDA 的含量与植物体受氧自由基攻击程度有关[21],MDA 的含量同时受抗氧化酶活力的反向调节[22-23],抗氧化酶活性的升高可以加速氧自由基的清除,因此能降低丙二醛的积累。本试验淹水胁迫前5 d,MDA 含量比较稳定,这是由于植物刚开始受到淹水胁迫时,保护酶系统即开始工作,植物体内SOD、POD、CAT等抗氧化酶的活性显著提升,植物受到淹水胁迫产生氧自由基的同时,抗氧化酶也在加速清除氧自由基,因此,MDA 的含量未有较大变化;淹水胁迫5 d 后,植物应对淹水胁迫慢慢产生一系列形态结构上的适应性变化;随水淹胁迫程度降低,植物体内抗氧化酶活性开始下降,此时受抗氧化酶活性的影响,MDA 含量开始缓慢的提升;淹水胁迫15 d 后,植物完全适应了水淹环境,抗氧化酶活性开始趋于稳定;淹水胁迫解除,MDA含量缓慢回落至初始浓度。
3.2 结论
红树植物桐花树在淡水环境中也比较耐水淹,在不同淹水水位梯度下都能正常生长。在较高水位环境中,通过膨大皮孔、加速伸长茎等形态改变,以及体内渗透调节、抗氧化酶作用等生理响应来应对淹水胁迫。本研究结果为桐花树从海岸潮汐带引种种植于河流、湖泊中提供参考依据,同时为了解其适应短期的河流汛期环境提供有价值的信息。

