银杏果外种皮总黄酮提取工艺和抗氧化活性
李超峰 吴雯雯 王靖雯
摘要:以银杏果肉质外种皮为原料、总黄酮含量为指标,采用冷凝回流法和超声波法提取,分别以料液比、乙醇浓度、提取温度和超声波功率、工作时长、超声时长为试验单因素,确定影响提取效果的因素及其水平,通过正交法优化,确定最佳提取工艺。采用还原力与清除羟自由基、超氧阴离子自由基、1,1-二苯基-2-三硝基苯肼(DPPH)自由基能力对总黄酮进行抗氧化活性的评价。结果表明,当超声波功率为75 W、液料比为6 mL ∶ 1 g、乙醇浓度为70%、提取温度为60 ℃、工作总时长为1 080 s、工作时长为3s/次和间隙时长为10 s/次时,银杏外种皮的总黄酮提取率最高,为221%。研究还发现,银杏果外种皮总黄酮具有良好的抗氧化活性。
关键词:银杏;外种皮;总黄酮;抗氧化活性;提取工艺
银杏(Ginkgo biloba L.)为银杏科银杏属仅有的植物,素有植物“活化石”之称,在民间常用作中草药。银杏果实、叶片和树皮均有很高的药食价值,主要含有黄酮类、内酯类、有机酚酸类、聚戊烯醇类、多糖类等生物活性物质,其中黄酮类和内酯类是主要药用成分[1-4]。目前,银杏的药用成分在临床上主要用于治疗心脑血管疾病、抗氧化、抗肿瘤、抗衰老、抗炎、降低血液黏度、降血脂、提高机体免疫力等方面[4-8],因而受到广泛关注,具有广阔的市场前景。银杏果外种皮是银杏种子(白果)硬壳外的肉质部分,俗称白果衣胞。我国在生产银杏种核时,每年约产生4.8万t外种皮,且常常被作为废弃物丢弃于环境中,既浪费了资源,又造成了严重的环境污染。近年来的研究发现,银杏外种皮含有多糖、酚酸、黄酮、萜内酯等多种化合物,具有较高的药用价值[9],因此,加大对银杏外种皮的开发利用,可以节约有限的生物资源,减轻环境污染。
本研究采用冷凝回流提取法和超声波法提取银杏果外种皮总黄酮,以提取率为评价指标,在单因素试验的基础上采用正交试验优化提取工艺,并明确该总黄酮的抗氧化活性。
1 材料与仪器
1.1 试验材料
银杏果于2019年10月采自鹽城师范学院校园内,去核后于-80 ℃冰箱中冻存备用。
1.2 试验试剂
主要试剂:芸香苷标准品,购自上海佳和生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、亚硝酸钠(NaNO2)、硝酸铝(AlNO3)、氢氧化钠(NaOH)、1,10-菲咯啉、亚硫酸铁(FeSO4)、H2O2、氯化硝基四氮唑蓝(NBT)、L-蛋氨酸(L-Met)、乙二氨四乙酸二钠(EDTA-Na2)、核黄素(VB2)、铁氰化钾(K3[Fe(CN)6])、三氯乙酸、三氯化铁(FeCl3)、磷酸氢二钾(K2HPO4)、磷酸二氢钾(KH2PO4)、甲醇、乙醇、石油醚等其他试剂均为分析纯,均购自国药集团化学试剂有限公司。
1.3 试验仪器
电子天平,购自ME204E 瑞士梅特勒公司;匀浆机[AD145S-P(8G/10G)],购自上海昂尼公司;索氏抽提器(SXT-06型),购自上海洪纪仪器有限公司;超声波破碎仪(VCX150PB),购自美国SONICS公司;旋转蒸发仪(R-210型),购自瑞士Buchi公司;真空冷冻干燥机(Labconco立式18),购自美国Labconco公司;紫外可见分光光度计(UV-2100型),购自尤尼可上海仪器有限公司。
1.4 试验方法
1.4.1 银杏果外种皮的预处理 摘取银杏果,去除果蒂后,清洗、自然风干表皮水分,剔除果核并匀浆,再用2倍量石油醚混合,用50 ℃回流法去除脂溶性物质,剩余滤渣备用。
1.4.2 银杏果外种皮总黄酮的提取
1.4.2.1 冷凝回流法 将10 g银杏果外种皮经过匀浆和脱脂后,加入不同浓度和体积的乙醇溶液,并将冷凝回流提取器于不同温度提取3 h后取出,冷却,4 ℃、5 000 r/min离心10 min,弃沉淀,取上清,用旋转蒸发仪减压浓缩至无醇味,定容至 100 mL,4 ℃保存,用于总黄酮含量的测定。根据上述单因素试验结果,用正交试验法对其工艺参数进行进一步优化,以明确该提取方法的最佳技术参数。
1.4.2.2 超声波法 将10 g银杏果外种皮经匀浆和脱脂后,按1 g ∶ 5 mL的料液比与70%乙醇溶液混合,经不同功率超声波作用不同时间后取出,于 4 ℃、5 000 r/min离心10 min,弃沉淀,取上清,用旋转蒸发仪减压浓缩至无醇味,定容至100 mL,于 4 ℃ 保存,用于总黄酮含量的测定。根据上述单因素试验结果,采用正交试验法对其工艺参数进行进一步优化,以明确该提取方法的最佳技术参数。
1.4.3 总黄酮的测定 称取芸香苷标准品 5.00 mg,加水溶解后定容于50 mL容量瓶内,得100 mg/L芸香苷标准溶液。分别移取2.00、4.00、6.00、8.00、10.00 mL芸香苷标准溶液于25.00 mL容量瓶内,定容得浓度梯度标准液的稀释液。取 1 mL 梯度稀释液和4.00 mL 30%乙醇溶液混合,再加入0.40 mL 5% NaNO2,摇匀静置6 min,加入040 mL 10% AlNO3显色剂,摇匀静置10 min,再加入4% NaOH,摇匀静置15 min,以不添加芸香苷的标准溶液作为空白对照,于波长510 nm处测定吸光度。以标准溶液浓度为横坐标、以吸光度为纵坐标建立回归方程。按上述方法测定银杏果外种皮提取液的吸光度,根据回归方程计算总黄酮含量。
1.4.4 银杏果外种皮总黄酮的抗氧化活性
1.4.4.1 还原力 按照Oyaizu的方法测定还原力[10]。取不同浓度的0.25 mL样品,依次加pH值为6.6的0.2 mol/L磷酸缓冲盐溶液(PBS)和1% K3[Fe(CN)6]各2.5 mL,充分混匀后于50 ℃恒温水浴20 min,取出后再加入2.5 mL 10%三氯乙酸混匀,10 000 r/min离心10 min。取5.0 mL上清液,依次加入5.0 mL H2O、1.0 mL 0.1% FeCl3,于 700 nm 处测定吸光度。
1.4.4.2 清除羟自由基 采用邻二氮菲-Fe2+氧化法测定清除羟自由基的能力,具体步骤参照Jin等的方法[11],并略有改动。(1)依次取1 mL 0.75 mol/L 邻二氮菲、2 mL 0.2 mmol/L pH值为74的PBS和1 mL ddH2O,充分混匀,再加1 mL 075 mmol/L FeSO4,混匀后加入1 mL 0.01% H2O2,于37 ℃恒温水浴60 min,在波长536 nm处测定吸光度(Df)。步骤(2)与步骤(1)相同,仅H2O代替H2O2,吸光度记作D0。步骤(3)与步骤(1)相同,仅样品代替ddH2O,吸光度记作Dx。步骤(4)与步骤(1)相同,仅样品代替H2O2,吸光度记作Ds。清除羟自由基活性计算方法为:
1.4.4.3 清除超氧阴离子自由基 采用氯化硝基四氮唑蓝光还原法测定清除超氧阴离子自由基的能力,具体步骤见Duan等的方法[12],并略有改动。取5 mL含有15.6 mmol/L L-Met、0.112 5 mmol/L NBT、0.3 mmol/L EDTA-Na2和pH值为7.8的005 mol/L PBS反应混合液,对照组加入0.5 mL ddH2O,样品本底吸收校正组和试验组各加0.5 mL不同浓度的总黄酮提取液,3种试验组再加1 mL VB2后,将调零组和校正组立即置于暗处,试验组于25 ℃照光15 min后,立即遮光,在波长560 nm处测定吸光度。清除超氧阴离子活性按下式计算:
1.4.4.4 清除DPPH自由基 具体参照Manivasagan等的方法并略有改动[13]。将0.2 mL不同浓度的样品与5 mL 0.1 mmol/L DPPH甲醇溶液混合,在室温下遮光反应30 min,于波长517 nm处测定吸光度(D);以0.2 mL ddH2O代替样品作为空白对照(D′),以甲醇代替含有DPPH的甲醇溶液作为样品本底吸收校正(Dj)。清除二苯代苦味酰基自由基活性按下式计算:
2 结果与分析
2.1 冷凝回流法提取率的影响因素及其水平的確定
2.1.1 液料比对提取率的影响 由图1可知,在乙醇浓度为70%、提取温度为60 ℃、提取时间为3 h和液料比为1~5 mL ∶ 1 g的条件下,随着液料比的增加,银杏外种皮总黄酮提取率逐渐提高;当液料比从1 mL ∶ 1 g增加到2 mL ∶ 1 g时,提取率线性提高;当液料比从4 mL ∶ 1 g增加到 5 mL ∶ 1 g 时,提取率从1.22%提高到1.45%,变化平缓,仅增加023百分点。因此,综合提取效率,选择4 mL ∶ 1 g、 5 mL ∶ 1 g和6 mL ∶ 1 g等3个液料比水平进行正交试验。
2.1.2 温度对提取率的影响 如图2所示,在提取时长为3 h、液料比为5 mL ∶ 1 g、乙醇浓度为70%、温度为30~70 ℃的条件下,随着提取温度逐渐提高,总黄酮提取率呈先升高后降低的趋势;当提取温度为60 ℃时,总黄酮提取率最高,为1.49%。因此,选择50、60、70 ℃这3个温度水平进一步进行正交试验。
2.1.3 乙醇浓度对提取率的影响 如图3所示,在提取温度为60 ℃、提取时间为3 h、液料比为 5 mL ∶ 1 g 和乙醇浓度为60%~100%的条件下,随着乙醇浓度的提高,总黄酮提取率呈先升高后降低的趋势。当乙醇浓度为80%时,总黄酮提取率最高,为1.73%。因此,选择70%、80%、90% 3个水平的乙醇浓度进一步进行正交试验。
2.1.4 正交优化 冷凝回流法正交试验因素与水平设计见表1,正交试验结果见表2。由极差大小可知,3个因素对提取率的影响程度依次为液料比(C)>乙醇浓度(A)>温度(B)。均值代表了每个因素的最佳水平条件,对同一因素的3个水平进行比较可知:A1>A3>A2,B2>B3>B1,C3>C2>C1,因此,在该冷凝回流试验中,A1B2C3组成了最优水平,即在冷凝回流提取中,乙醇浓度为70%,提取温度为60 ℃,液料比为6 mL ∶ 1 g。
2.2 超声波法提取率的影响因素及其水平的确定
2.2.1 工作总时长对提取率的影响 由图4可知,在超声波功率为150 W、工作时长为3 s/次、间隙时长为10 s/次、乙醇浓度为70%和液料比为5 mL ∶ 1 g的条件下,随着工作总时长的增加,银杏外种皮总黄酮提取率基本呈升高趋势。当超声波工作总时长为 900 s 时,总黄酮提取率最高,为 1.47%。因此,选择720、900、1 080 s 3个水平的超声波工作总时长进行正交试验。
2.2.2 工作时长对提取率的影响 由图5可知,在工作总时长为360 s、功率为150 W、间隙时长为 10 s/次、乙醇浓度为70%和液料比为5 mL ∶ 1 g的条件下,随着超声波工作时长的延长,银杏外种皮的总黄酮提取率呈“S”形趋势。当超声波工作时长为4 s/次时,总黄酮提取率最高,为0.78%。因此,选择3、4、5 s/次3个水平的超声波工作时长进行正交试验。
2.2.3 功率对提取率的影响 由图6可知,在工作总时长为360 s、超声波工作时长为3 s/次、间隙时长为10 s/次、乙醇浓度为70%和液料比为5 mL ∶ 1 g的条件下,随着超声波功率的提高,银杏外种皮的总黄酮提取率呈先升高后降低的趋势。当超声波功率为60 W时,总黄酮提取率最高,为1.40%。因此,选择45、60、75 W 3个水平的超声波功率进行正交试验。
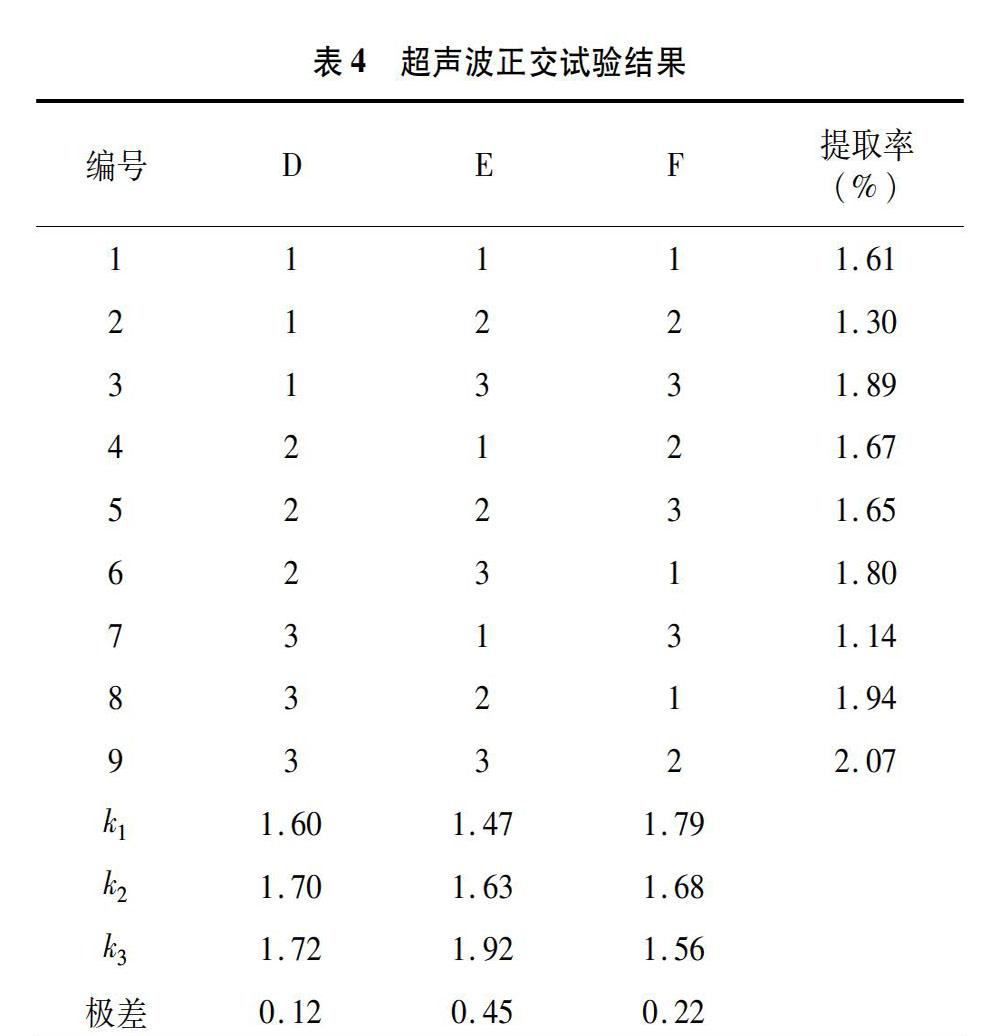
2.2.4 正交优化 超声波正交试验因素与水平设计见表3,正交试验结果见表4。由极差大小可知,3个因素对提取率的影响程度依次为超声波功率(E)>工作时长(F)>总时长(D)。均值代表了每个因素的最佳水平条件,对同一因素的3个水平进行比较可知:D3>D2>D1,E3>E2>E1,F1>F2>F3。因此,在该冷凝回流试验中,D3E3F1组成了各因素最优水平,即在超声波提取过程中,工作总时长为 1 080 s,功率为75 W,工作时长为3 s/次。
将优化后的提取条件相结合,在液料比为 6 mL ∶ 1 g、乙醇浓度为70%、提取温度为60 ℃、超声波功率为75 W、工作总时长为1 080 s、工作时长为3 s/次和间隙时长为10 s/次的条件下,外种皮总黄酮的提取率为2.21%。因此可见,与单一提取法相比,2种方法结合的效果较好,既可以提高银杏外种皮总黄酮的提取率,又可以缩短提取时间,提高效率,更有利于工业化生产。
2.3 总黄酮的抗氧化活性
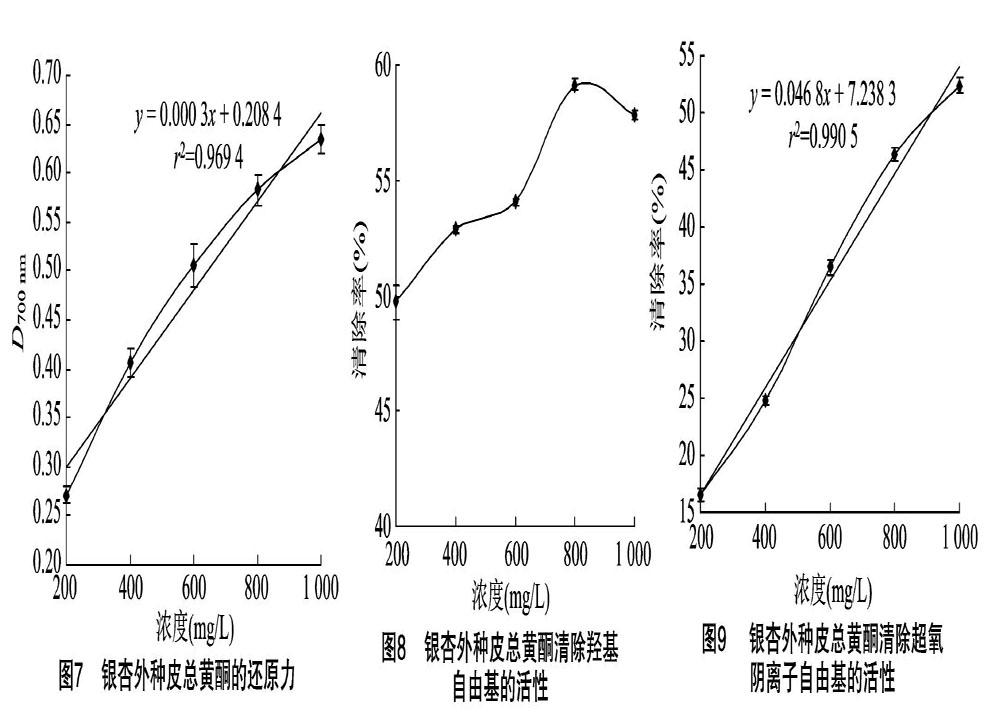
2.3.1 还原力 物质的还原能力是潜在抗氧化性能的重要体现[14]。如图7所示, 随着浓度的提高,银杏果外种皮总黄酮的还原力逐渐增强,且在试验浓度范围内,二者呈线性正相关,相关系数为0969 4,回归方程为y=0.000 3x+0.208 4。
2.3.2 清除羟自由基活性 羟自由基是已知活性最强、危害最大的活性氧,对脂类、蛋白和核酸等生物大分子具有强烈的氧化胁迫作用,使其正常生理功能难以进行,进而产生畸变,甚至可累积致死[15]。由图8可以看出,在浓度为0.2~0.8 g/L的范围内,银杏果外种皮总黄酮清除羟自由基的活性逐渐升高,清除率最高达59.13%;而当浓度为1.0 g/L时,其活性略有降低,清除率为57.85%。
2.3.3 清除超氧阴离子自由基活性 超氧阴离子活性相对较低,但却是生物体内羟自由基、过氧化氢等其他自由基形成的基础,它们均由超氧阴离子自由基衍生而来[16]。同时,超氧阴离子自由基可以使DNA损伤,进而引发突变,也可以使过氧化氢谷胱甘肽过氧化物酶、肌酸激酶失活,从而对生物产生毒害作用[17]。由图9可知,随着浓度的提高,银杏果外种皮总黄酮清除超氧阴离子的活性逐渐增强,且在0.2~1.0 g/L范围内二者呈线性正相关,相关系数为0.990 5,回归方程为y=0.046 8x+7238 3。
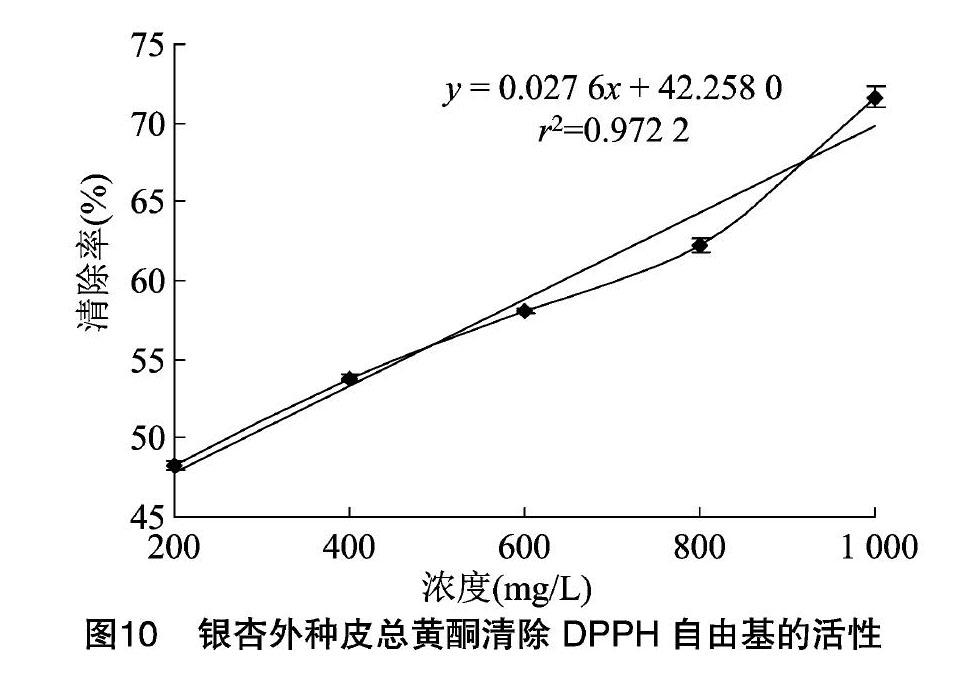
2.3.4 清除DPPH自由基活性 自由基与衰老、心血管疾病、癌症、糖尿病、帕金森综合症等多种疾病发生有着潜在联系[18]。DPPH自由基结构简单、性质稳定、反应易于控制,是抗氧化剂自由基清除活性筛选的首选试剂[19]。由图10可知,银杏外种皮总黄酮具有清除DPPH自由基的能力,且在试验条件下,清除DPPH自由基的活性与浓度呈线性正相关,相关系数为0.972 2,回归方程为y=0.027 6x+42.258 0。
3 结论
在上述单因素研究的基础上,结合正交试验分析,确定了相应的工艺条件。在超声波功率为 75 W、液料比为6 mL ∶ 1 g、乙醇浓度为70%、提取温度为60 ℃、工作总时长为1 080 s、工作时长为 3 s/次、间隙时长为10 s/次的条件下,银杏果外种皮的总黄酮提取率为2.21%。此外,银杏果外种皮总黄酮具有较强的抗氧化活性,对羟自由基、超氧阴离子自由基和DPPH自由基都具有显著的清除活性。研究结果为新一代安全抗氧化等产品的开发及银杏加工废弃物的高值化利用提供了有益参考,具有重要的經济和理论意义。
参考文献:
[1]Ding Z. Studies on extraction and isolation of flavonoids from ginkgo leaves[J]. Journal of Food Quality,2007,22(6):693-700.
[2]徐艳芬,张丽娟,宋新波. 银杏叶提取物的研究进展[J]. 药物评价研究,2010,33(6):452-456.
[3]闫高颖,张必荣,张 敏,等. 水浸法提取银杏叶总黄酮工艺的研究[J]. 西北药学杂志,2016,31(6):560-562.
[4]刘宝亮,吴一帆,穰小东,等. 响应面法优化离子液体双水相提取银杏黄酮的工艺研究[J]. 中国食品添加剂,2018(12):108-115.
[5]蔡锦源,王萌璇,韦坤华,等. 银杏黄酮的提取及纯化方法研究进展[J]. 应用化工,2017,46(5):982-985.
[6]Formica J V,Regelson W. Review of the biology of quercetin and related bioflavonoids[J]. Food and Chemical Toxicology,1995,33(12):1061-1080.
[7]Feng R Z,Wang Q,Tong W Z,et al. Extraction and antioxidant activity of flavonoids of Morus nigra[J]. International Journal of Clinical and Experimental Medicine,2015,8(12):22328-22336.
[8]Kawaguchi K,Kikuchi S I,Hasunuma R,et al. Supresion of infection induced endotox inshockin mice by a citrus flavanone naringin[J]. Planta Medica,2014,70(1):176-182.
[9]赵浩晨,王婉婷,雷佳美,等. 银杏果外种皮多糖的脱色工艺及抗氧化活性研究[J]. 江苏农业科学,2020,48(10):228-231.
[10]Oyaizu M. Studies on products of browning reaction:antioxidative activities of products of browning reaction prepared from glucose amine[J]. Japanese Journal of Nutrition,1986,44:307-315.
[11]Jin M,Cai Y X,Li J R,et al. 1,10-phenanthroline-Fe2+oxidative assay of hydroxy radical produced by H2O2/Fe2+[J]. Progress Biochemistry & Biophysics, 1996,23(6):553-555.
[12]Duan X W,Jiang Y M,Su X G,et al. Antioxidant properties of anthocyanins extracted from litchi (Litchi chinenesis Sonn.) fruit pericarp tissues in relation to their role in the pericarp browning[J]. Food Chemistry,2007,101(4):1365-1371.
[13]Manivasagan P,Venkatesan J,Senthilkumar K,et al. Isolation and characterization of biologically active melanin from Actinoalloteichus sp. MA-32[J]. International Journal of Biological Macromolecules,2013,58:263-274.
[14]周巾英,欧阳玲花,王 丽,等. 白藜芦醇清除DPPH自由基反应的动力學[J]. 食品工业,2020,41(6):222-226.
[15]余 佳,王 生,许文琦,等. 葛仙米藻胆蛋白粗提物、藻蓝蛋白和藻红蛋白的体外抗氧化活性比较研究[J]. 食品研究与开发,2019,40(23):104-108.
[16]Liu F,Ng T B. Antioxidative and free radical scavenging activities of selected medicinal herbs[J]. Life Science,2000,66(8):725-735.
[17]刘占才,牛俊英. 超氧阴离子自由基对生物体的作用机理研究[J]. 焦作教育学院学报(综合版),2002,18(4):48-51.
[18]Li J W,Liu Y F,Fan L P,et al. Antioxidant activities of polysaccharides from the fruiting bodies of Zizyphus jujuba cv. Jinsixiaozao[J]. Carbohydrate Polymers,2011,84(1):390-394.
[19]熊双丽,卢 飞,史敏娟,等. DPPH自由基清除活性评价方法在抗氧化剂筛选中的研究进展[J]. 食品工业科技,2012,33(8):380-383.卢 飞,郑尊涛,张江兆,等. 菊花中啶虫脒的残留降解规律[J]. 江苏农业科学,2021,49(6):155-159.

