4,4′-二羧酸-2,2′-联吡啶基配合物结构及性能研究进展
钟宝琦,李 爽,王冰倩,高 琳,蒋雯西,刘国成,2
(1.渤海大学 化学与材料工程学院,辽宁 锦州 121013;2.北京理工大学 化学与化工学院,北京 10081)
近年来,金属-有机配合物的合成和性能研究已经从无机化学逐步渗透到了分析化学、物理化学、有机化学等学科,实现了多学科的交叉融合[1-5]。在众多的金属-有机配合物中,混合金属基配合物是目前配位化学的研究热点之一[5-6]。不同的金属离子具有不同的配位特性、磁学特性以及光电特性,也使该类配合物展现出丰富的性能和应用[7-8]。然而,成功地将不同配位特性的金属引入同一个配合物中难度很大,选用具有不同配位倾向的有机配体是解决该类问题行之有效的方法[9]。N,O-混合型有机配体具有N和O两种类型的配位原子,其不同的核外电子排布使其对金属离子的配位具有一定的选择性[10]。在众多的N,O-混合型配体中,4,4′-二羧酸-2,2′-联吡啶(H2dcbpy)含有一对螯合N原子和两个羧基的四个O原子,因此具有丰富多变的配位模式[7-10],可以将3s、3d、4d、4f等不同周期金属离子进行单一或混合组装[7-13]。由其构筑的配合物展现出了一维、二维甚至三维的结构类型[7-13]。本文在综述了H2dcbpy的合成方法、配位模式的基础上,重点介绍了不同类型金属构筑的dcbpy基配合物的结构及其光催化性能、磁性、可视化金属离子检测以及光电压效应,为后续构建结构新颖、性能优良的多功能配合物材料提供参考。
1 H2dcbpy的合成和配位模式
1.1 H2dcbpy的合成
H2dcbpy的合成主要通过两种途径,如图1所示。其一是将4,4'-二甲基-2,2'-联吡啶中的甲基通过强氧化剂一步氧化成羧基:将4,4'-二甲基-2,2'-联吡啶(2.7 g,15 mmol)溶于浓硫酸(70 mL)中,在0℃冰浴环境下加入重铬酸钾(17.6 g,60 mmol),将反应混合液加热至50℃并恒温1 h,将绿色溶液倒入300 mL冰水中,产生的沉淀过滤、水洗至滤液变为无色。将淡黄绿色固体置于70 mL硝酸(50%)中回流4 h,倒入300 mL冰水中,过滤后用水和丙酮交替洗涤,得到白色固体产物,真空中干燥,产量为3.16 g[14]。该方法的优点在于产率较高,缺点在于反应中使用大量具有一定危险性的重铬酸钾和硝酸等强氧化剂,和丙酮、硝酸等易制毒或易制爆化学品。
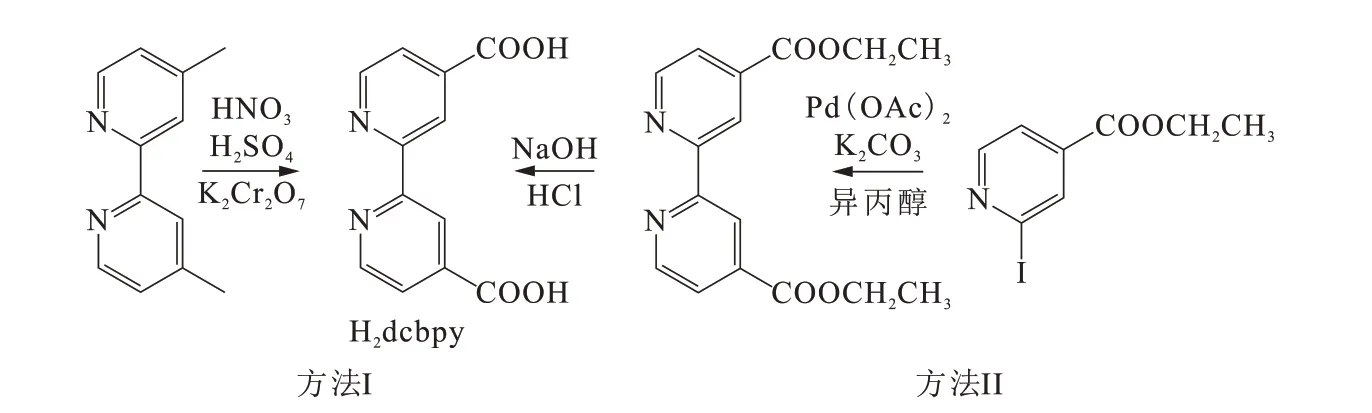
图1 H2dcbpy的合成途径Fig.1 Synthesis routes of H2dcbpy
H2dcbpy合成的另一种方法是首先制备4,4′-二羧酸乙酯-2,2′-联吡啶,然后通过水解的方法制备H2dcbpy:将2-碘 异 烟 酸 乙 酯(1.00 g,3.61 mmol),K2CO3(748 mg,5.41 mmol),异 丙 醇(0.556 mL,7.22 mmol),Pd(OAc)2(40.5 mg,0.180 mmol)和DMF 10 mL混合反应5 h。将得到固体粗产物用热的乙醇重结晶得到4,4′-二羧酸乙酯-2,2′-联吡啶(477 mg)。在1 mol/L KOH中回流2 h,用3 mol/L盐酸调pH至2,过滤得到最终产物H2dcbpy(200 mg)。该方法反应条件较温和,但产率较低[15]。
1.2 dcbpy的配位模式
dcbpy是一种N、O混合型有机配体。其吡啶N原子具有较强的螯合配位能力,与过渡金属、主族金属以及稀土金属离子均可形成配位键,配位模式相对固定。其羧基O原子可在中性及弱碱性环境下发生部分或者完全去质子现象,能与金属离子产生配位作用,并能起到平衡电荷的作用。由于两个羧基的四个氧原子可以发生单配位和双配位,所以,整个dcbpy展现出了丰富的配位模式,如图2所示[16]。

图2 dcbpy的配位模式Fig.2 Coordination modesof dcbpy
2 dcbpy基配合物的结构
dcbpy的两个吡啶N原子和四个羧基O原子不仅展现出了强的配位能力、多变的配位模式,而且展现出丰富的构象。两个吡啶环中间的C-C单键可以根据配位需要发生不同程度的扭转,使两个吡啶N原子和两个羧基可以呈现顺式和反式的存在形式。这些结构特点使配体在与金属离子配位时表现出了极佳的适应性,不仅可以和过渡金属、稀土金属以及主族金属发生单一配位,而且通过N、O配位原子的配位倾向性的调控,可以实现混合金属共同参与配位的现象。这进一步丰富了dcbpy基配合物的结构类型。
2.1 单一金属基配合物
dcbpy中的羧基具有电荷平衡能力和较好的配位能力,可以与过渡金属和稀土离子配位。N原子为中性位点,与过渡金属具有较好的配位能力。由于两个N原子处于螯合位置,所以在一定条件下也可以与稀土离子配位。dcbpy基单金属配合物的结构相对简单,性质相对单一。根据金属所在周期,分别以3d、4d、4f单金属基配合物进行论述。

图3 配合物1的结构Fig.3 Structureof complex 1
2.1.1 3d型单一金属基配合物 在第四周期中,具有3d电子的过渡金属离子具有良好的配位能力。其中,基于Mn2+、Fe2+、Co2+、Ni2+、Cu2+、Zn2+的金属-有机配合物居多,而关于钪、钛、钒、铬基配合物的报道较为少见。这主要是因为后者容易与O形成金属氧簇,阻碍了其与有机配合物的直接键合。dcbpy中的N和O与大多3d金属具有键合能力,可以形成单一金属基配合物。3d金属离子具有较为单一的配位模式,这导致dcbpy与该类金属离子形成的配合物具有比较单一的结构。
Lu等[17]选择dcbpy和Co(OAc)2通过水热反应合成了一例三维配合物[Co(bpbc)(H2O)2]n(1),如图3所示。dcbpy采用桥连单齿配位模式,与Co2+形成左手和右手螺旋链,两种螺旋链以3:2的比例存在,并最终形成三维结构。由于dcbpy具有较好的空间拓展能力,整个结构发生了二重互穿。结构中存在两种一维孔道:一种主要是以H为孔道内壁的疏水孔道;另一种是以O为孔道内壁的亲水孔道。
2.1.2 4d型单一金属基配合物 在第五周期中,具有4d电子的过渡金属离子也具有良好的配位能力,并且表现出了不同的特性。其中,Y3+易于含O配体配位,锆、铌、钼、锝具有丰富的变价,容易形成金属氧簇阴离子,Ru2+、Rh2+、Pd2+、Ag+、Cd2+容易以单离子形式与有机配体配位。4d型金属离子的原子半径比3d金属稍大一些,大多展现出经典的6配位模式,其中Ag+能够展现出2至6配位形式,而Cd2+可以展现出5至8配位模式。配位模式的多变性导致该类金属离子与dcbpy形成的配合物的结构也较为丰富。
Liu等[18]通过镉盐与dcbpy配体利用水热反应生成一例三维配合物Cd(dcbpy)·H2O(2),如图4所示。结构中包含一个Cd(II)离子、一个dcbpy配体和一个客体水分子。由于4d过渡金属的特有原子尺寸和电子构型,镉离子在与羧酸配体进行配位时展现了7种配位模式。羧基将镉离子连接成一维金属-羧基链状结构单元,该结构单元通过dcbpy进一步拓展成三维金属-有机框架。结构中存在的沿着a轴延展的一维亲水孔道被结晶水分子占据,溶剂可填充体积占单胞体积的9%。
2.1.3 4f型单一金属基配合物 在第六周期中,有一类性质较为相似的金属离子,包括镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)、镥(Lu)。由于其4f电子特性,也称4f型金属或镧系金属。与3d和4d金属相比,4f型金属具有更大的配位半径,这为更高的配位数提供了基础,通常配位数都在8以上。该类金属具有典型的正三价的电荷属性,其较高的电荷为不同价态的阴离子的引入以及复杂结构的产生提供了前提。稀土离子对O原子具有高于N原子的配位倾向性,因此容易和羧酸配体配位,而dcbpy中的螯合N结构特性弥补了N与稀土离子配位能力的不足。因此,dcbpy和该类金属离子容易获得高质量和高产率的配合物单晶材料。
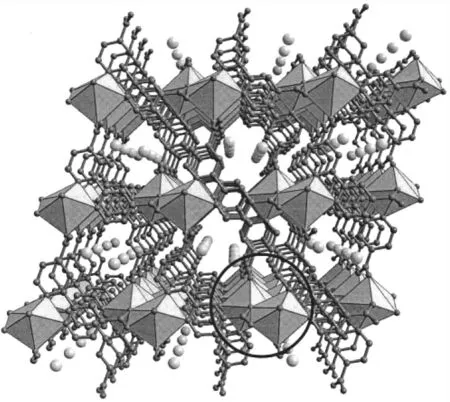
图4 配合物2的结构Fig.4 Structureof complex 2
Wang等[19]利用水热条件,将La3+和dcbpy进行组装,得到了一例三维配合物[La2(dcbpy)3(H2O)4]·2H2O(3),如图5所示。结构中,La3+与两个螯合N原子、两个配位水分子以及7个羧基O原子形成11配位模式。dcbpy两个N和四个O原子全部参与配位,将La3+拓展成三维金属-有机框架。
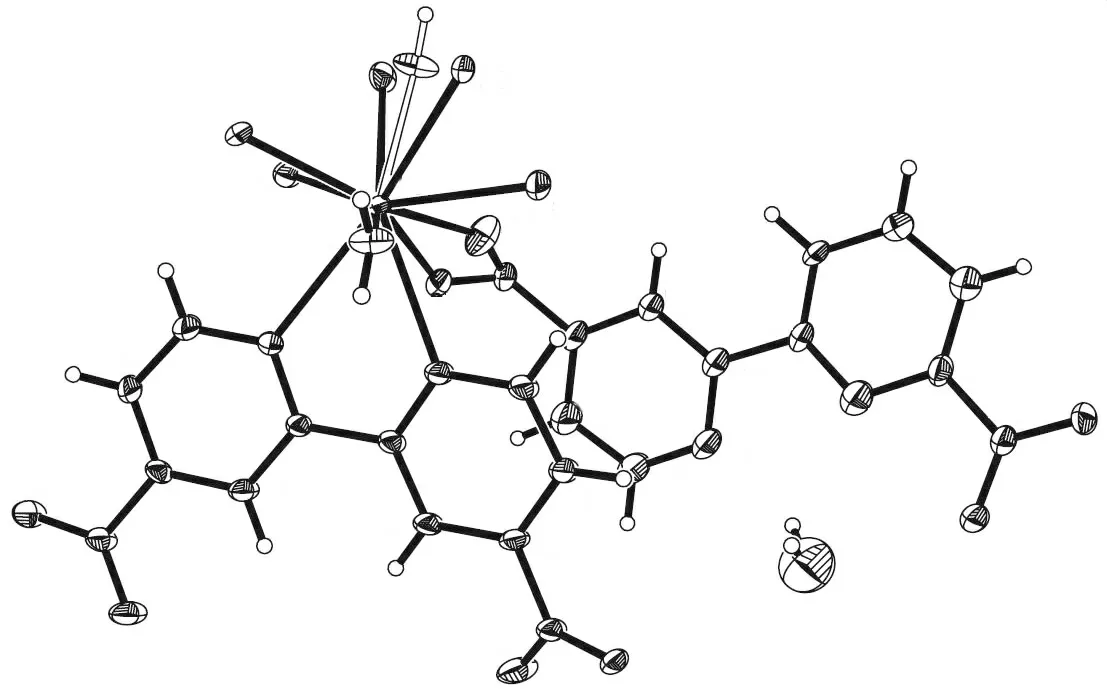
图5 配合物3的结构Fig.5 Structureof complex 3
2.2 混合金属基配合物
dcbpy具有两个螯合N原子,对过渡金属具有较好的配位能力。dcbpy还有两个羧基,羧基中的O原子与稀土金属离子具有较好的键合能力。此外,dcbpy的两个吡啶N原子为电中性,而两个羧基可以通过调节pH的方法来调控其去质子的时机。因此,dcbpy上的配位点在不同环境中具有不同的配位特性。这为多种金属与dcbpy的共同配位提供了有利条件。第三周期、第四周期、第五周期、第六周期的部分金属离子可实现同周期或跨周期混合配位,形成结构丰富的配合物。
2.2.1 3s-4d混合金属基配合物 具有配位能力的第三周期金属离子包括Na+、Mg2+、Al3+。其3s电子特性导致其配位能力较弱。然而,在弱碱性条件下,上述离子可以与带有负电荷的羧酸根离子配位,这主要是羧酸根的阴离子属性和羧基中的O原子与金属阳离子的协同作用产生的配位效果。上述3s金属离子与中性的N原子配位能力较差,这反而为3s-4d混合金属基配合物的制备提供了一个机遇。在dcbpy中,其羧基可有效的与3s金属离子键合,而中性的螯合N原子倾向于与4d金属配位,最终形成混合组装效果。3s金属中的镁离子具有一定的配位能力,可以在弱碱性条件下与羧基形成六配位模式。第四周期的钌离子也具有六配位模式。这两种金属离子均为正二价,在一定条件下可以形成混合配位模式。
Kobayashi等[20]利用分步合成法,首先将Ru2+与H2dcbpy反应得到Ru(Hdcbpy)3-前驱体,再于碱性条件下与镁离子进行组装得到红色配合物[Mg(H2O)6]{[Mg(H2O)3][Ru(dcbpy)3]·4H2O}(4),每个Ru2+与六个dcbpy配位,如图6所示。镁离子有两种存在形式,其中一种通过三个dcbpy连接三个Ru2+,形成二维网络;另一种镁离子以六水合镁离子形式存在于二维网络的孔道中。每个单胞中的溶剂可填充体积为0.809 nm3,占单胞体积的11.4%。

图6 配合物4的结构Fig.6 Structureof complex 4
2.2.2 3s-4f混合金属基配合物 尽管3s金属与4f金属的周期和离子半径相差较大,但也可以参考3s-4d混合金属基配合物的分步反应实现金属离子的混合配位。Zhao等[21]利用Ir2+与2,2-联吡啶(bpy)先合成出配合物前驱体,再利用碱性环境合成Ir(ppy)2(Hdcbpy)-前驱体,再在水热条件下与镁离子进行组装,制备了3s-4f混合金属基配合物{Mg[Ir(ppy)2(dcbpy)]2(H2O)2}·3.5H2O(5),如图7所示。结构中,每个Ir2+与两个bpy配位,dcbpy利用两个羧基将Mg2+和Ir2+连接成一维混合金属-有机带,[Ir(ppy)2]2+修饰在一维带的两侧。
2.2.3 3d-4f混合金属基配合物
3d-4f混合金属基配合物是一类经典的混合金属配合物,3d金属对中性的N原子具有较好的配位能力,其中3d金属可以是Zn2+、Ni2+、Cu2+等过渡金属,4f金属对具有负电性的羧基O原子具有较好的键合特性,4f金属主要为稀土金属离子。这导致几乎所有的4f镧系金属离子均可以与3d金属实现混合配位。dcbpy恰好满足3d-4f混合金属基配合物的配位需要,其螯合N原子和羧基O原子能有效连接3d和4f金属离子,实现混合配位。
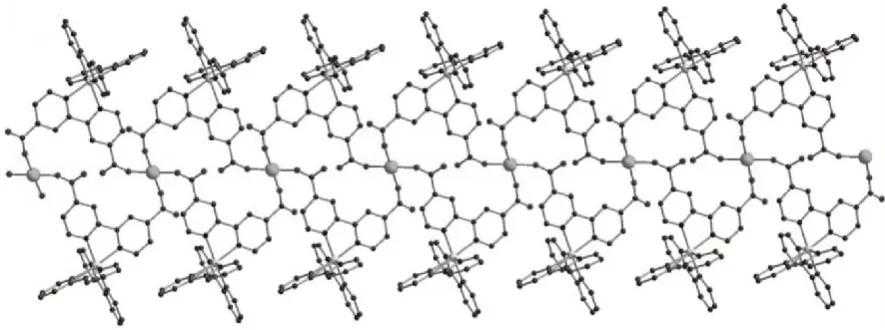
图7 配合物5的结构Fig.7 Structureof complex 5
Kobayashi等[22]利用Co3+和La3+进行组装,获得 了 一 例 三 维 配 合 物{LaIII[CoIII(dcbpy)3]3nH2O}(6),如图8所示。结构中,Co3+采用经典的六配位,每个La3+采用10配位模式。每个Co3+与三个dcbpy配位连接进而连接六个单金属节点的La3+,形成经典的NaCl型推拓扑结构。配合物沿着a轴具有一维开放孔道,溶剂可填充体积高达55%,具有出色的水吸附能力。
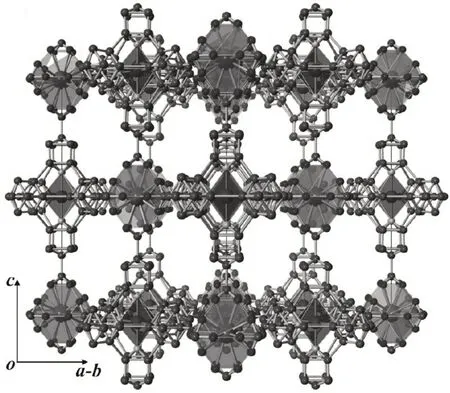
图8 配合物6的结构Fig.8 Structureof complex 6
2.2.4 4d-4d混合金属基配合物 金属离子的混合配位不仅可以发生在不同周期之间,也可以发生在相同周期内部。这对金属离子的配位特性提出了更高的要求,主要是因为相同周期的金属离子的半径相对接近,这为配体的选择性配位增加了难度。在过渡金属离子中,第VIII副族的金属离子与第I和第II副族的金属离子的配位属性表现出了一定的差异性。其中第VIII副族的金属离子具有较强的配位能力,所以可以与中性的N原子配位,而第II副族的金属离子配位能力相对较弱,因此可以和具有负电性的羧基O原子配位,这为同周期混合金属的组装提供了前提。4d型金属半径相近,其中Ru2+和Cd2+具有相同的电荷和不同的配位能力,容易进行组装形成混合金属基配合物。
Luo等[23]利用dcbpy成功将上述两种金属离子进行连接,构筑了一例三维配合物{Cd2[Ru(dcbpy)3]·12H2O}n(7),如图9所示。结构中,每个Ru与三个dcbpy配位进而连接六个双核镉簇,通过四个羧基连接的双核镉簇与六个dcbpy配位连接,进而连接六个Ru2+单元,这两种节点相互连接最终形成典型的pcu型拓扑网络。孔道结构特性以及钌的催化活性为二氧化碳的光催化还原提供条件。

图9 配合物7的结构Fig.9 Structureof complex 7
3 配合物的性能研究
dcbpy基配合物结构和组分的多样性导致了其性能的多样性。具有自选单电子的锰、钴、镍基配合物具有磁学特性;具有d10电子的锌、镉基配合物以及部分镧系金属基配合物具有荧光特性;钛、锆、钌等金属基配合物具有光催化活性。上述特性使该类配合物在金属离子检测、光催化染料降解、光电压效应、磁性能等方面也具有很好的性能与应用前景。
3.1 配合物的光催化染料降解性能
钌-多吡啶配合物在可见光区具有宽的吸收带以及较长的衰减寿命,通过dcbpy的连接,有望制备性能良好的可见光催化剂以用于染料的光催化降解。Luo等[24]利用dcbpy将钌和铟进行混合组装,得到了一例三维金属-有机框架[InRu(dcbpy)3][(CH3)2NH2]·6H2O(9)。当采用500 W氙灯(滤光片将420 nm以下的紫外光滤掉)照射10 mg/L甲基橙染料溶液时,经过120 min,甲基橙降解了大约80%,如图10所示。通常,在可见光条件下,甲基橙较难降解。该催化剂良好的催化效果主要归因于配合物在多次的氧化还原过程中产生了大量的羟基自由基。催化剂的回收率可达到89%,表明催化剂具有良好的稳定性。
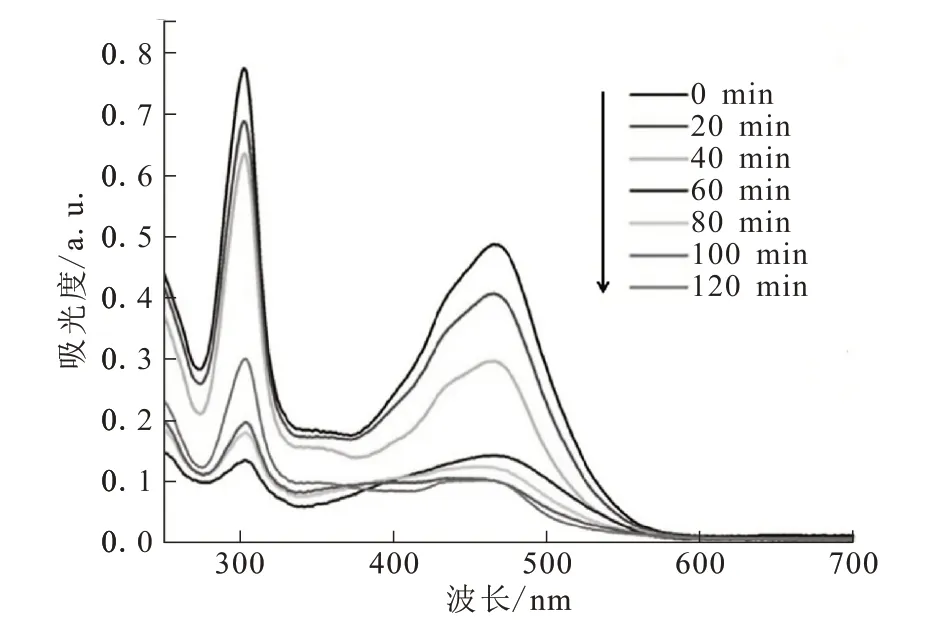
图10 甲基橙溶液随时间变化的UV-vis吸收光谱Fig.10 UV-visabsorption spectra of methyl orangesolution at different time
3.2 配合物的光电压效应
dcbpy连接的钴基配合物在可见光区具有宽的吸收带,大约具有3~5 eV能量,说明该类配合物材料具有半导体性质,可通过表面光电压谱(SPS)来研究其半导体性能。Niu等[25]利用dcbpy与钴离子获得了一例一维配位聚合物{[Co2(Hdcbp)4(H2O)2]n·7n(H2O)(10),表面光电压谱如图11所示。在300~600 nm范围内,配合物10出现了4个光响应带,最大发射峰波长分别为338 nm、367 nm、417 nm、442 nm。出现在338 nm和367 nm的较强光响应可归因于配体到金属的电荷转移。出现在417 nm和442 nm的光响应可归因于钴离子内部的d→d*的电荷转移。上述结果表明配合物10可作为一种光电转换材料。
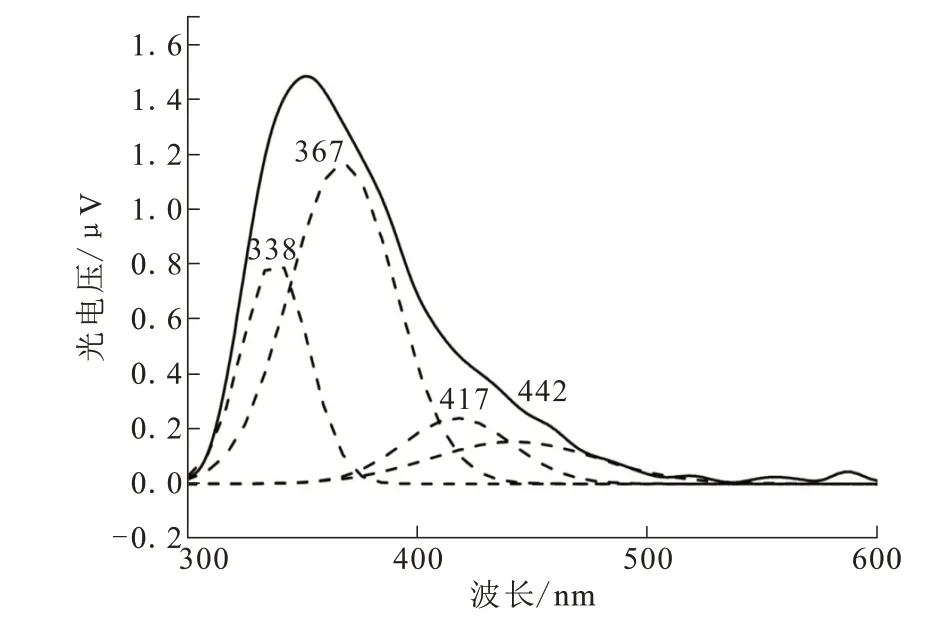
图11 配合物10的表面光电压谱Fig.11 Surfacephotovoltagespectroscopy of complex 10
3.3 配合物的磁性能
利用羧基的桥连作用,dcbpy可以将具有d电子的过渡金属离子拓展成次级结构单元,而金属与金属的距离可以保持在三个原子以内,这样可以有效传递金属离子之间的磁性作用。Kruger等[26]利用锰离子与dcbpy进行组装,获得了一例三维配合物{[Mn(dcbpy)]·2H2O}(11)。结构中的锰离子通过羧基连接成一维金属-有机链,使配合物具有磁性。配合物11的磁性能如图12所示。在300~80 K,配合物11的有效磁导率μeff从5.75μB降到5.50μB,变化很小,摩尔磁化率χm的变化也是很小。随着温度的继续降低,当温度达到4.2 K时,μeff迅速降至最低值1.95μB,同时χm迅速升高,在5 K时达到峰值0.215 cm3/mol。当对数据进行拟合后耦合常数J值为-0.26 cm-1,朗德因子g值为1.95,体现出弱的反铁磁性。
3.4 配合物的可视化传感性能
dcbpy具有一定的共轭体积,与金属离子配位后,可以进一步巩固其刚性平面结构,有利于可视化传感性能的研究。Palomares等[27]利用钌、dcbpy以及硫氰根得到了一例零维配合物[Ru(dcbpy)2(NCS)2(12)。通过乙腈和叔丁醇的分散作用,将其修饰到4μm厚的介孔TiO2膜上,膜为肉眼可见的绿色。当滴加汞离子之后,该膜逐渐变成明显的红色。UV-vis光谱如图13所示,当逐渐滴加汞离子时,出现在530 nm的吸收峰逐渐降低,而在480 nm处的吸收峰逐渐的增强,定量极限可达20 μg/L。表明该材料可作为一种理想的汞离子检测剂。
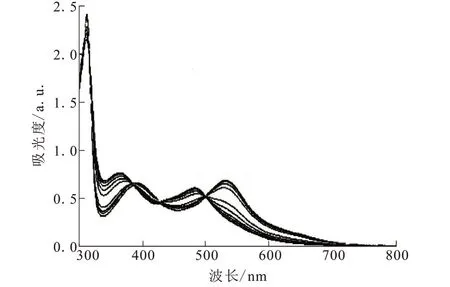
图13 配合物12溶液的吸收光谱Fig.13 UV-visabsorption spectraof complex 12 solution
4 结论
配合物的组分和结构对材料的性能影响很大,总结和探索有机配体的结构、配位点的属性以及配体的电荷情况对新型配合物的定向合成具有重要意义。本文在系统查阅关于4,4′-二羧酸-2,2′-联吡啶基配合物的报道,总结了该配体的合成、配位特性以及单一金属和混合金属基配合物的结构,并进一步介绍了该类配合物的光催化染料降解、磁性、光电压效应以及可视化重金属检测性能。对研究该类材料结构和性能之间的关系,以及产业化应用具有一定的参考价值。该类材料将可能在药物传输、病毒细胞筛分以及空气净化等领域具有一定的应用前景。

