黑嘴病病原菌人工感染对中间球海胆吞噬作用相关免疫指标的影响
王中,张伟杰,刘雷,冷晓飞,高洪涛,江会杰,常亚青*
(1.大连海洋大学 农业农村部北方海水增养殖重点实验室,辽宁 大连 116023; 2.大连海宝渔业有限公司,辽宁 大连 116045)
中间球海胆Strongylocentrotusintermedius又称虾夷马粪海胆,原产于日本北方和俄罗斯远东沿海[1],其生长速度快、生殖腺颜色好、味道甜,是国内外公认的优质海胆种类之一[2]。1989年中国从日本引入该种,随后开展了其生物学、生态学、人工育苗及遗传育种研究[1-2]。目前,该种已成为中国最主要的养殖海胆种类,其生殖腺年产量超过200 t[1]。近年来,中间球海胆养殖过程中不断暴发黑嘴病、红斑病和病变综合征等各种细菌性疾病[3-7],且有日益严重的趋势。细菌性疾病已成为威胁海胆养殖效益和养殖产业发展的主要因素,而如何有效防控疾病则成为中间球海胆养殖业最迫切需要解决的问题。
解析海胆对病原的免疫机理是开展其疾病防控的基础。研究表明,无脊椎动物对于疾病的免疫反应较为原始,缺乏真正意义上的免疫抗体,只能依靠先天性的非特异性免疫系统来抵御外来病原体的侵染[8]。吞噬细胞构成其免疫系统抵御外来病原体的第一道防线,其依靠吞噬作用对入侵的外源物质进行吞入和破坏[9]。吞噬作用在无脊椎水产动物抗菌免疫中发挥重要作用,如虾类血细胞在其免疫防御中通过识别、吞噬、包裹、结节形成排除异物[10]。贝类血细胞可以活跃地趋化到炎症和损伤部位进行吞噬,成为贝类免疫防御的主要细胞[11]。在海胆中,Yui等[12]研究发现,紫球海胆S.purpuratus在6 h内即可清除90%~99%进入体腔液的细菌,同时体腔细胞数量下降90%以上;Ito等[13]研究发现,光棘球海胆Mesocentrotusnudus的吞噬细胞可以有效识别并吞噬异种细胞,且体腔液中存在可增强吞噬功能的调理素;张颖[14]、李霞等[15]研究了温度对健康中间球海胆吞噬能力影响,发现在25~30 ℃时吞噬细胞对酵母细胞的吞噬率最高;张颖等[16]发现,裙带菜凝集素可提高中间球海胆吞噬细胞的吞噬能力。上述均是对健康海胆吞噬细胞的吞噬能力进行的研究。Zhang等[17-18]通过研究患红斑病中间球海胆免疫基因的转录表达,发现海胆患病后吞噬作用相关免疫通路基因表达呈现下降的趋势。从病菌入侵开始至海胆出现病症期间,吞噬作用机制迄今尚未见报道,对此期间吞噬作用相关的免疫指标进行检测,有助于揭示海胆在病菌感染下的免疫或患病机理。
本研究中,用黑嘴病病原菌对中间球海胆进行人工感染,并通过测量吞噬细胞及吞噬作用相关免疫因子随感染时间的变化,解析中间球海胆对黑嘴病病原菌感染的免疫机理,以期为海胆疾病防控提供理论依据。
1 材料与方法
1.1 材料
试验用中间球海胆(壳径约2 cm)108只随机选自农业农村部北方海水增养殖重点实验室人工繁育群体。黑嘴病病原菌为本实验室分离纯化并成功回感的菌种(待发表)。
1.2 方法
1.2.1 试验设计 将108只试验海胆平分放入6个10 L灭菌水槽中,每个水槽18只,暂养1 d后开始正式试验。试验开始时,使用1 mL无菌注射器针头从海胆围口膜处刺入海胆体腔内,对海胆进行损伤,之后向水槽中加入浓度为108CFU/mL的黑嘴病病原菌液10 μL,得到浸泡胁迫浓度为102CFU/mL(预试验结果表明,使用该浓度感染,海胆在48 h后开始出现病症)。分别在胁迫前(0 h)和胁迫后1、6、12、24、48 h取样,取样方法为:从6个水槽中各随机取1只海胆,解剖后等量吸取体腔液1 mL,混匀后取100 μL用于体腔细胞分类计数,另取900 μL用于细胞凋亡和细胞坏死检测,剩余体腔液分装至6个1.5 mL离心管中,4 ℃下以3 000g离心15 min,吸取上清液至1.5 mL离心管中并于-80 ℃保存,用于体腔液上清液中各免疫参数的测定,同时收集沉淀于-80 ℃下保存,用于体腔细胞中各免疫参数的测定。每个时间点按同样的方法取样3次作为3个重复。
1.2.2 体腔细胞分类计数 用血球计数板常规细胞计数方法,参考Smith等[19]的分类方法对体腔细胞进行分类计数。
1.2.3 吞噬相关免疫参数测定 体腔细胞及体腔液上清液中酸性磷酸酶(ACP)活力、活性氧(ROS)含量、总抗氧化能力(T-AOC),以及细胞凋亡、细胞坏死等免疫参数均采用碧云天生物技术(上海)有限公司相关试剂盒测定,所有检测步骤均按照试剂盒说明书操作。
1.2.4 体腔细胞总RNA提取及cDNA合成 采用Trizol法提取体腔细胞总RNA,用10 g/L琼脂糖凝胶电泳检测RNA质量,采用BiochromSimpliNano超微量分光光度计(英国Biochrom公司)检测样品RNA的纯度和浓度,采用PrimeScriptTMRT Reagent Kit(Perfect Real Time)(宝生物工程(大连)有限公司)合成cDNA第一链。反应体系(10 μL):5×PrimeScript Buffer(for Real Time)2 μL,PrimeScript RT Enzyme Mix I 0.5 μL,Oligo dT Primer(50 μmol/L)0.5 μL,Random 6 mers(100 μmol/L)0.5 μL, Total RNA+RNase Free ddH2O 6.5 μL。样品混匀后在 PCR 仪上进行反转录, 条件为37 ℃下反应15 min,85 ℃下反应5 s, 4 ℃下保存备用。
1.2.5 引物设计及RT-PCR 根据实验室前期转录组数据[18],筛选获得中间球海胆补体C3前体(C3-pre)、含半胱氨酸的天冬氨酸蛋白水解酶基因8(Caspase-8)和C型凝集素域家族成员4g(Clec4g)基因核心序列,采用Primer premier 5.0软件对各基因设计RT-PCR引物(表1),引物于生工生物工程(上海)有限公司合成。
RT-PCR在LightCycler®96扩增仪(Roche, 上海)上进行,使用FastStart Essential DNA Green Master试剂盒(Roche,上海)进行实时定量PCR扩增反应。PCR反应体系(20 μL):FastStart Essential DNA Green Master(2×conc)10 μL,上、下游引物各0.8 μL,cDNA模板2 μL,ddH2O 6.4 μL。PCR反应程序:95 ℃下预变性10 min;94 ℃下循环变性15 s,60 ℃下退火复性60 s,共进行40个循环。用2-ΔΔCt法[20]分析各基因定量表达结果。
1.2.6 细胞的凋亡率和坏死率计算 以荧光显微镜下每个视野内(每个样品取3个视野)单种细胞的凋亡细胞数除以该种细胞的总数计算得到该种细胞的凋亡率,单种细胞的坏死细胞数除以该种细胞的总数计算得到该种细胞的坏死率,并计算:
各免疫参数单细胞平均贡献值=各免疫参数测量值/(吞噬细胞数-坏死细胞数)。
1.3 数据处理
试验采用SPSS 20.0软件处理相关数据,采用单因素方差分析法分析黑嘴病病原菌胁迫对体腔细胞密度及各免疫参数的影响,采用LSD多重比较法分析不同时间点上各类细胞密度、各免疫参数平均值相对于0 h变化的差异性,显著性水平设为0.05,极显著水平设为0.01。
2 结果与分析
2.1 病原菌胁迫对体腔细胞密度的影响
从表2可见:中间球海胆体腔液中变形吞噬细胞密度在胁迫前(0 h)为99.17×104cells/mL,在胁迫后1 h出现极显著下降(P<0.01),且达到最低值23.89×104cells/mL,胁迫后6 h开始逐渐恢复,至胁迫后24 h恢复至胁迫前水平(P>0.05),之后在48 h又出现极显著性下降(P<0.01);无色桑椹细胞密度在胁迫前为12.50×104cells/mL,胁迫1 h后极显著上升(P<0.01),6 h时达到最高值25.22×104cells/mL,之后开始逐渐下降,至48 h下降至胁迫前水平(P>0.05);胁迫后各时间点上纤毛游走细胞和红色桑椹细胞的密度与胁迫前均无显著性差异(P>0.05)。

表2 中间球海胆体腔细胞密度随胁迫时间的变化
2.2 病原菌胁迫对吞噬细胞凋亡与坏死的影响
病原菌胁迫后吞噬细胞凋亡与坏死的显微镜观察如图1所示。从表3可见:中间球海胆体腔变形吞噬细胞凋亡率在病原菌胁迫后1 h呈极显著上升(P<0.01),胁迫后6 h时,凋亡率下降至与胁迫前无显著性差异水平(P>0.05),并保持至48 h;变形吞噬细胞坏死率在病原菌胁迫后1 h出现轻微下降,随后开始上升,胁迫后12 h时极显著升高(P<0.01),24 h时达到最高,之后开始下降,但48 h时仍极显著高于胁迫前水平(P<0.01)。

A—纤毛游走细胞;B—红色桑椹细胞;C—无色桑椹细胞;D—变形吞噬细胞;E—凋亡细胞;F—坏死细胞;G—正常细胞。A—vibratile cell; B—red spherule cell; C—colorless spherule cell; D—phagocytic amoebocyte; E—apoptotic cell; F—necrotic cell; G—normal cell.图1 病原菌胁迫后吞噬细胞凋亡与坏死的荧光显微镜观察Fig.1 Fluorescence microscope observation of apoptosis and necrosis of phagocytes in sea urchin exposed to pathogen stress

表3 吞噬细胞凋亡率与坏死率随胁迫时间的变化
2.3 病原菌胁迫对吞噬作用相关生理参数的影响
从表4可见:体腔细胞ACP酶活性在病原菌胁迫前0 h为114.99 U/L,在胁迫后总体上呈现下降趋势,胁迫后24 h时下降约80%,达到最低值25.29 U/L,极显著低于胁迫前(P<0.01),胁迫后48 h有所回升;体腔细胞内活性氧含量在病原菌胁迫后6 h时达到最低值9.32×106,48 h时达到最高值12.40×106,但均与胁迫前无显著性差异(P>0.05);体腔细胞总抗氧化能力在胁迫前为2.78 U/mg,胁迫后1 h时达到最高值3.49 U/mg,且极显著高于胁迫前(P<0.01),6 h后逐渐下降至与胁迫前无显著性差异水平(P>0.05)。
从表4还可见:换算为单细胞平均贡献值后,吞噬细胞ACP活性的单细胞贡献值在病原菌胁迫前0 h为1.53×10-4U/L,胁迫后呈现先上升后下降的趋势,1 h时约上升至0 h时的3倍,达到最高值4.69×10-4U/L,极显著高于胁迫前(P<0.01),12 h后逐渐下降至与胁迫前无显著性差异水平(P>0.05);活性氧含量单细胞贡献值在病原菌胁迫后1 h时约上升至0 h时的6倍,达到最高值为76.77,24 h后下降至与胁迫前无显著性差异水平(P>0.05),48 h后又上升至与胁迫前有显著性差异水平(P<0.05);总抗氧化能力单细胞贡献值在病原菌胁迫前为0.37×10-5U/mg,胁迫后1 h时约上升至0 h时的7倍,达到最高值2.52×10-5U/mg,且极显著高于胁迫前(P<0.01),12 h后虽有下降,但仍显著高于胁迫前(P<0.05)。

表4 吞噬细胞中吞噬作用相关生理参数随胁迫时间的变化Tab.4 Changes in phagocytosis related parameters in phagocytes with challenge time
从表5可见:体腔液上清液中ACP活性在病原菌胁迫前为0.80 U/L,胁迫后呈先上升后下降的趋势,在1 h时达到最高值,为1.08 U/L,24 h时降到最低,但各时间点变化未达到显著性水平(P>0.05);血清内总抗氧化能力随胁迫时间的变化呈先下降后上升的趋势,在6 h时达到最低值,12 h后逐渐上升至与胁迫前相近水平,但各时间点的变化均未达到显著性水平(P>0.05)。
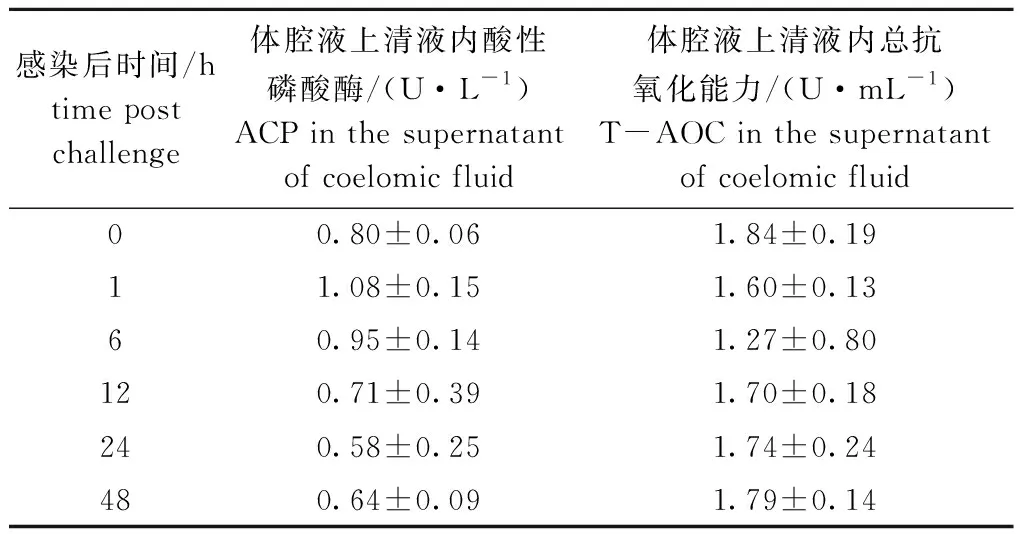
表5 血清中吞噬作用相关生理参数随胁迫时间的变化
2.4 病原菌胁迫对吞噬相关免疫基因表达的影响
以β-actin为内参基因,用RT-PCR法检测中间球海胆吞噬细胞中C3-pre、Caspase-8和Clec4g基因的相对表达量。从表6可见:总细胞中C3-pre基因相对表达量在胁迫后1 h时约上调至0 h时的4倍,且极显著高于0 h(P<0.01),在之后的各个时间点上出现下调,但仍极显著高于0 h(P<0.01);总细胞中Caspase-8基因相对表达量出现上调,在48 h时达到最高,约上调至0 h时的2倍,且极显著高于0 h(P<0.01);总细胞中Clec4g基因相对表达量在胁迫后1 h时约上调至0 h时的7倍,且极显著高于胁迫前(P<0.01),48 h时约上调至0 h时的4倍,其余各时间点均与0 h无显著性差异(P>0.05)。

表6 吞噬细胞中吞噬作用相关基因相对表达量随胁迫时间的变化
3 讨论
3.1 黑嘴病病原菌胁迫下吞噬细胞免疫应答机制
海胆免疫系统的主要功能之一是吞噬作用,其介导免疫应答的主要细胞是吞噬细胞,吞噬细胞可对外源粒子进行搜索、捕捉和破坏[8]。本试验中发现,在黑嘴病病原菌感染初期(1 h),吞噬细胞密度大幅下降,降幅达到80%,这说明当外源病原菌入侵机体时,机体通过吞噬细胞的吞噬作用进行防御,吞噬细胞杀死病原菌的同时自身消亡[17],这一结果与Yui等[12]观察到紫球海胆在细菌注射1 h内吞噬细胞密度下降80%的结果一致,不同之处是,紫球海胆其他3种体腔细胞也出现大幅下降,而本研究中其他3种体腔细胞未出现显著下降,且无色桑椹细胞反而出现显著升高,其原因尚待进一步研究。吞噬细胞密度在后期(24 h)又基本恢复正常水平,说明机体重新生成了新的吞噬细胞以应对剩余病原菌,赵新亚等[21]、Holm等[22]分别在中间球海胆和海星Asteriasrubens中检测到LPS刺激后吞噬细胞密度的增加。在病原菌感染早期,细胞发生大量凋亡,细胞凋亡是细胞为了维持内环境稳定而发生的一种主动消亡过程[23],说明在这一阶段海胆利用细胞凋亡进行主动防御,在感染后期,细胞坏死率大幅上升,细胞坏死是细胞在致病因素作用下而发生的死亡[23],这说明海胆免疫系统吞噬作用的免疫能力面临崩溃。
本研究中,从吞噬细胞密度、凋亡和坏死结果可推测出海胆在病原菌侵入后迅速利用吞噬细胞进行吞噬,并通过细胞凋亡进行主动防御,在6 h时虽然有新的吞噬细胞出现并参与防御,但是细胞凋亡率降低,细胞坏死率逐渐上升,说明机体免疫能力已下降,24 h时细胞坏死率达到最高,免疫系统逐渐崩溃导致海胆患病。
3.2 黑嘴病病原菌胁迫下吞噬作用相关生理参数的免疫应答
由于吞噬细胞发生大规模的凋亡和坏死,本研究中测量体腔细胞酶活等参数后,将其计算为单个正常吞噬细胞的平均贡献值,这一指标剔除了坏死细胞的干扰,更能准确反映海胆的免疫状态。对比结果显示,体腔细胞中ACP、ROS和T-AOC呈现出不同的变化趋势,而计算为单个吞噬细胞贡献平均值后,这些指标均一致呈现先升高后下降趋势,这证明了单细胞贡献平均值能更好地揭示海胆吞噬作用相关免疫反应的规律。在病原菌胁迫后早期,单细胞ACP较胁迫前上升,这说明在吞噬作用中,细胞释放了大量的ACP[24],用于杀灭病菌,这在早期免疫应答中可能起到重要作用,这与细菌感染后的栉孔扇贝[25]、刺参[26]等ACP活性变化相一致。本研究中,单细胞ROS和T-AOC在病原菌感染后分别上升了约6倍和7倍,这种变化趋势与受到胁迫后的栉孔扇贝[27]和长牡蛎[11]相一致,这说明海胆在感染后通过伴随吞噬作用的呼吸暴发产生大量活性氧自由基,杀死吞入的病菌[28],同时机体受到活性氧自由基的损伤后,抗氧化能力加强,对多余的活性氧自由基加以清除,以维持机体正常[29]。在本试验中细胞中ACP活性是血清中的约62倍,T-AOC也较血清中高,这说明吞噬后的杀菌作用相关免疫活动主要发生于体腔细胞中,而与血清关系不大。
3.3 黑嘴病病原菌胁迫下吞噬相关免疫基因的免疫应答
C3是补体激活级联反应的中心成分,在病原体吞噬和杀灭中起着调理素的作用[8,19]。在紫球海胆中,C3通过物理标记目标细胞促进吞噬作用[30]。C型凝集素具有调理素的功能,能够促进无脊椎动物体腔细胞的吞噬作用[31-32]。本试验中,海胆受到黑嘴病病原菌胁迫后,吞噬细胞内C3-pre和Clec4g基因相对表达量呈极显著上调,这与中间球海胆受到红斑病病原菌胁迫后C3-pre和Clec4g相对表达量的变化相类似[18],说明C3-pre和Clec4g基因在吞噬作用中起促进作用。Caspase-8是死亡受体介导的凋亡途径中关键的启动子[33],本试验中,Caspase-8相对表达量在48 h时约上调至0 h的2倍,极显著高于0 h,这与草鱼肝细胞受到胁迫后表达相类似[34],吞噬细胞凋亡是海胆应对病原菌入侵的一项重要免疫措施。
3.4 海胆免疫能力指标的筛选及其在疾病防控中的应用
近年来,海胆养殖过程中几乎每年都会发生黑嘴病,由黑嘴病导致的大规模死亡现象也时有发生[4,6-7]。为有效开展疾病防控,目前亟须找到能代表海胆免疫能力或抗病能力的指标,从而对疾病的发生开展预测或筛选抗病能力强的亲本。本研究中发现,在黑嘴病病原菌胁迫后一定时间内,细胞凋亡率、单个吞噬细胞内ACP、ROS和T-AOC,以及C3-pre、Caspase-8和Clec4g基因相对表达量均极显著高于胁迫前,因此,这些参数均可作为海胆免疫能力或抗病能力的候选指标。这些指标只需抽取海胆体腔液就可以进行测定,具有低损伤、快速、经济、准确的优势,有望应用到中间球海胆疾病防控研究和生产实践中。关于指标高低与抗病力的相关性,以及指标的准确性今后需进一步研究。
4 结论
1) 病原菌入侵初期,中间球海胆迅速发挥吞噬作用,主要表现为单个有效吞噬细胞内ACP和活性氧含量分别上升约3倍和6倍,抗氧化能力上升约7倍,细胞内C3-pre和Clec4g基因相对表达量分别上调约4倍和7倍,吞噬细胞密度迅速下降;在感染后期,吞噬细胞坏死率大幅上升,上述吞噬指标均逐渐减弱。
2) 体腔细胞中ACP、ROS和T-AOC酶活性计算为单个吞噬细胞平均贡献值后,以及C3-pre和Clec4g等基因的相对表达量能较好地反映海胆的免疫状态。因此,这些参数可以作为海胆免疫能力或抗病能力的候选指标。

