通关藤苷G通过ATM-CHK2-p53信号通路抑制结直肠癌细胞增殖
王恺纯,徐勤芬,刘 微,胡道德*
1上海交通大学附属第一人民医院临床药学科;2南京医科大学附属上海一院临床医学院临床药学科,上海200080
结直肠癌(colorectal cancer,CRC)作为常见的恶性肿瘤之一,其发病率位居全球第三,死亡率位居全球第二[1]。虽然诊断与治疗的进步延长了部分患者的生命,但是,患者5年生存率仍只有64%[2],这一数据与10年前相比无明显变化。目前,结直肠癌的主要治疗手段为手术结合放化疗,其严重的副作用使患者生活质量明显下降。近年来,相关研究发现,天然药物在抑制结直肠癌增殖、减轻放化疗毒副作用方面具有一定优势,是结直肠癌治疗的重要手段之一[3,4]。
通关藤药材(Marsdeniatenacissima(Roxb.) Wight et Arn)是萝藦科植物通关藤的藤茎,主要产自云南、贵州等省份。研究发现,通关藤药理作用较为广泛,具有抗癌、平喘、免疫调节、降压、止痛、利尿以及缓解放化疗导致的肿瘤患者白细胞下降等作用[5]。此外,临床上亦将其用于治疗胃癌、肺癌、肝癌、白血病等多种肿瘤,疗效较为显著。有研究证明,通关藤总皂苷具有抗肝癌细胞增殖作用[6],是其主要抗癌活性成分。通关藤苷G(tenacissoside G,TG)化学结构式如图1所示,是通关藤总皂苷中成分之一。有研究报道,TG可能为通关藤中治疗非小细胞肺癌的主要活性成分,通过PI3K/Akt等多条信号通路发挥抗肺癌作用[7]。但目前关于TG抗结直肠癌的作用和机制尚未见报道。本实验以人结直肠癌细胞RKO和LoVo为研究对象,观察TG对结直肠癌细胞增殖活性的影响,并对其可能的作用机制进行探究。
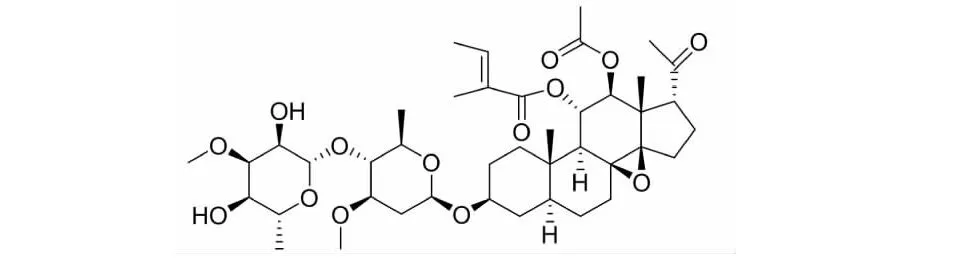
图1 通关藤苷G的化学结构式
1 材料与仪器
1.1 试验药物
通关藤苷G(纯度 ≥ 98%,批号HT177497),购自宝鸡市辰光生物科技有限公司。
1.2 试剂与仪器
DMEM高糖培养基、F12k培养基、胰蛋白酶、青霉素-链霉素溶液、胎牛血清(Gibco公司);CCK-8试剂(MCE公司);细胞裂解液、BCA蛋白定量试剂盒、上样缓冲液(苏州新赛美公司);细胞周期检测试剂盒(美国BD公司);CDK2、CDK4、CDK6、Cyclin D1、Cyclin E1、p21、cleaved Caspase 3、cleaved PARP、ATM、p-ATM、CHK2、p-CHK2、p53、p-p53、GAPDH抗体(美国CST公司);HRP-conjugated Affinipure Goat Anti-Mouse IgG(H+L)、HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)、CoraLite488-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)(Proteintech公司);AL104电子分析天平(梅特勒-托利多仪器有限公司);二氧化碳培养箱(SANYO公司);酶标仪(Bio-Tek公司);ECLIPSETi-5型荧光倒置显微镜(日本Nikon公司);BD Accuri C6流式细胞仪(美国BD公司);Tanon-5500型化学发光凝胶成像仪器(中国天能科技有限公司);Power PacTMBasic型电泳仪(美国Bio-Rad公司)。
2 实验方法
2.1 细胞培养液的配制
将10%胎牛血清(V/V)、1%青霉素-链霉素双抗溶液分别和DMEM高糖培养基或F12k培养基混匀,在4 ℃条件下储存,备用。
2.2 细胞培养
人结直肠癌细胞RKO(货号:TCHu116)和LoVo(货号:TCHu 82)均购自中国科学院典型培养物保藏委员会细胞库。复苏RKO和LoVo细胞,置于细胞培养皿中,加入细胞培养液,置于37 ℃、5% CO2的细胞培养箱中培养。1~2天更换一次培养液。取对数生长期的细胞用于实验,细胞融合度约90%时用胰蛋白酶消化传代以用于后续实验。
2.3 细胞增殖活性检测
取对数生长期的RKO和LoVo细胞,用新鲜培养基重悬,调整细胞浓度为8×104个/mL,按每孔100 μL接种于96孔板,每孔设置6复孔。贴壁后,设置空白组(只加培养液)、对照组(不加药组)、实验组(TG浓度为25、50、100、200和400 μM),每孔均设6复孔,分别处理24 h和48 h,结束前吸去药液,每孔加入10 μL CCK-8试剂和90 μL培养液。培养箱避光培养2 h,置酶标仪上450 nm波长处检测吸光度A。细胞活性=(A实验组-A空白组)/(A对照组-A空白组)×100%,实验重复3次。
2.4 平板克隆检测不同浓度通关藤苷G对细胞生长增殖的影响
取对数生长期的RKO和LoVo,调整细胞浓度为5×103个/mL,按每孔100 μL接种于6孔板。贴壁后,弃培养液,加入50 μM和100 μM TG,放入培养箱中继续培养14天。取出6孔板,吸弃培养液,磷酸缓冲盐溶液(phosphate buffer saline,PBS)润洗3次,加入多聚甲醛室温固定30 min后PBS洗3次,每孔加入1 mL结晶紫溶液,室温染色30 min后PBS清洗3次至肉眼可见紫色细胞集落。记录集落数,计算试验组和对照组集落数比值。实验重复3次。
2.5 流式细胞术检测细胞周期
取对数生长期的RKO和LoVo,调整细胞浓度为1×106个/mL,按每孔1 mL接种于6孔板。贴壁后弃培养基,设置对照组(不加药组)、实验组(TG浓度为50、100和200 μM),继续培养48 h,弃去药液,胰酶消化,离心收集细胞,75%预冷的乙醇重悬,4 ℃放置过夜。PBS清洗两遍,加入500 μL含RNase的碘化丙啶(propidium iodide,PI)染色液,4 ℃避光孵育30 min,过筛,上机检测,记录激发波长488 nm处红色荧光。实验重复3次。
2.6 彗星实验检测细胞DNA损伤程度
取对数生长期的RKO和LoVo,调整细胞浓度为1×106个/mL,按每孔1 mL接种于6孔板。贴壁后弃培养基,设置对照组(不加药组)和实验组(药物组)。给药后继续培养48 h,弃去药液,胰酶消化,离心收集细胞,PBS重悬。将低熔点琼脂糖凝胶液化,加入稀释后的细胞悬液,混合均匀后铺在彗星载玻片透明孔上,保持水平,避光4 ℃放置15 min。将玻片置于裂解缓冲液中避光4 ℃放置30 min,吸去裂解液,PBS清洗后加入预冷的碱性电泳液避光4 ℃放置30 min,20 V,300 mA电泳30 min。将玻片转移至干净容器中,去离子H2O清洗3遍,预冷的70%乙醇固定5 min。室温风干玻片,每个样品加入100 μL稀释好的Vista Green DNA染料,室温孵育15 min。实验重复3次。
2.7 免疫荧光检测γ-H2AX水平变化
取对数生长期的RKO和LoVo,以每孔1×104个细胞接种于24孔板中。贴壁后弃培养基,设置对照组(不加药组)和实验组(药物组)。给药后继续培养48 h。PBS清洗3遍,预冷的甲醇-20 ℃固定20 min。PBS清洗3遍后,加入0.1%的Triton X-100,室温孵育15 min。PBS清洗3遍后,加入牛血清白蛋白(bovine serum albumin,BSA)室温封闭1 h。吸弃BSA后,加入一抗,4 ℃孵育过夜。含吐温的Tris-HCl缓冲盐溶液(Tris buffered saline with Tween 20,TBST)清洗4遍后加入二抗,避光室温孵育2 h。用TBST清洗4遍,再加入4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI),避光室温孵育30 min。TBST清洗3遍,荧光倒置显微镜观察并拍照。实验重复3次。
2.8 Western blot检测DNA损伤及凋亡相关蛋白表达水平变化
取对数生长期的RKO和LoVo,调整细胞浓度为1×106个/mL,按每孔1 mL接种于6孔板。贴壁后弃培养基,设置对照组(不加药组)和实验组(药物组)。给药后培养48 h。弃培养液,PBS洗3遍,每孔加入200 μL含苯甲基磺酰氟(phenylmethylsulfonyl fluoride, PMSF)和磷酸酶抑制剂的RIPA细胞裂解液,冰上裂解30 min,收集至1.5 mL离心管中,离心(4 ℃,15 000 g,10 min)取上清。用BCA比色测定法对细胞裂解液中蛋白含量进行定量后,加入上样缓冲液,100 ℃金属浴中变性10 min。用10%~15%聚丙烯酰胺SDS凝胶电泳蛋白样品,湿转法转至PVDF膜上,10%脱脂牛奶室温封闭1 h。一抗4 ℃孵育过夜,TBST洗4次,每次10 min。二抗室温孵育1 h,TBST洗4次,每次10 min。增强化学发光法(ECL)进行显影,ImageJ对条带进行灰度分析。实验重复3次。
2.9 统计分析处理

3 结果
3.1 TG抑制结直肠癌细胞增殖
利用CCK-8法检测TG对结直肠癌细胞株RKO和LoVo细胞生长抑制作用,结果如图2所示。不同浓度TG分别作用细胞24、48和72 h后,RKO和LoVo细胞活性受到明显抑制,且抑制效果呈时间和浓度依赖性。平板克隆实验结果同样证明TG对细胞的增殖抑制作用,见图3。根据抑制率结果计算得到,TG作用于RKO细胞24、48、72 h的IC50分别为334.68 μM(24 h)、91.71 μM(48 h)和57.42 μM(72 h);作用于LoVo细胞24、48、72 h的IC50分别为257.72 μM(24 h)、88.34 μM(48 h)和63.69 μM(72 h)。
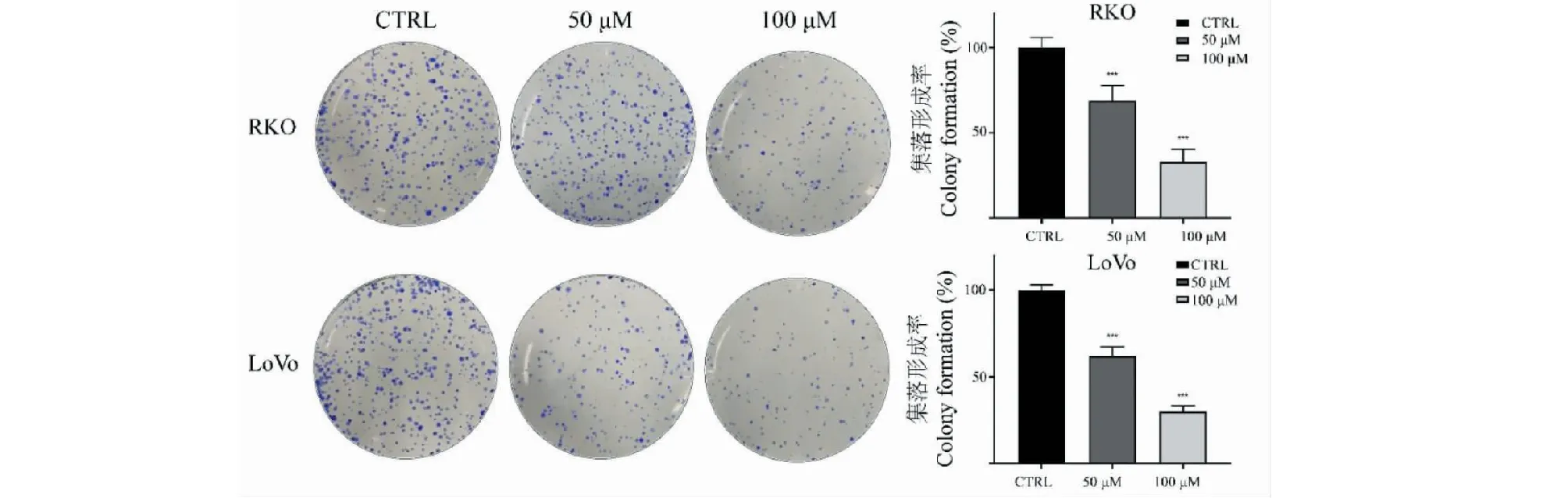
图3 不同浓度TG对结直肠癌细胞集落形成的影响(n=3)
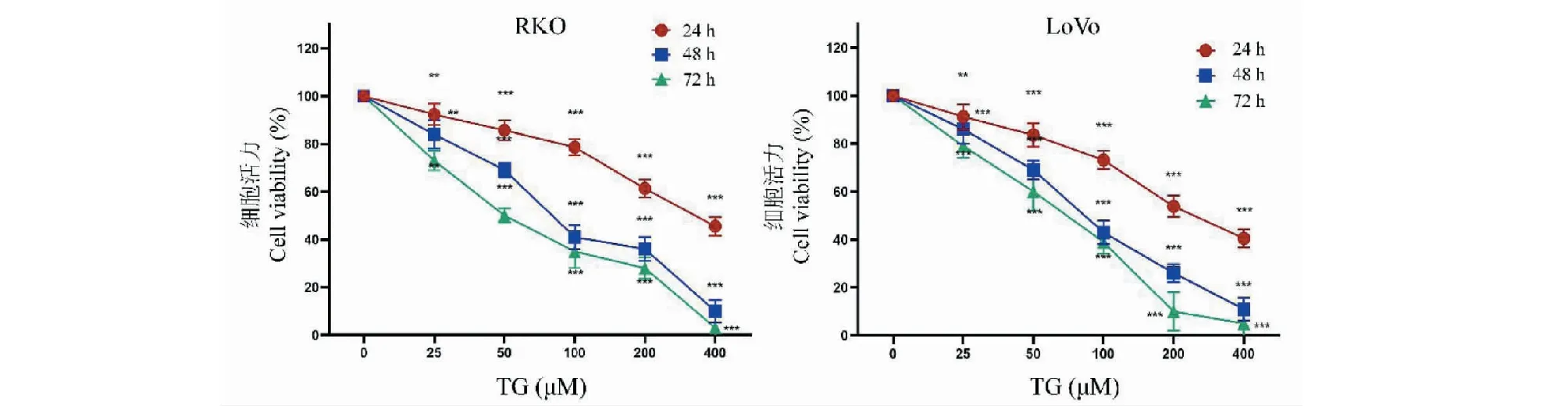
图2 不同浓度TG对结直肠癌细胞增殖的影响(n=6)
3.2 TG对结直肠癌细胞周期的影响
将RKO和LoVo细胞进行药物处理,设置TG浓度为50、100和200 μM,利用流式细胞术检测细胞周期比例变化,结果见图4和表1。与空白对照组相比较,给药后RKO细胞G0/G1期细胞由39.01%增至79.89%,LoVo细胞G0/G1期细胞由40.19%增至81.71%,且呈浓度依赖性升高(P< 0.05)。S期细胞比例显著递减,而G2/M期细胞比例无明显变化(P> 0.05)。上述结果提示TG可抑制细胞G1期向S期的转化,诱导G0/G1期阻滞。
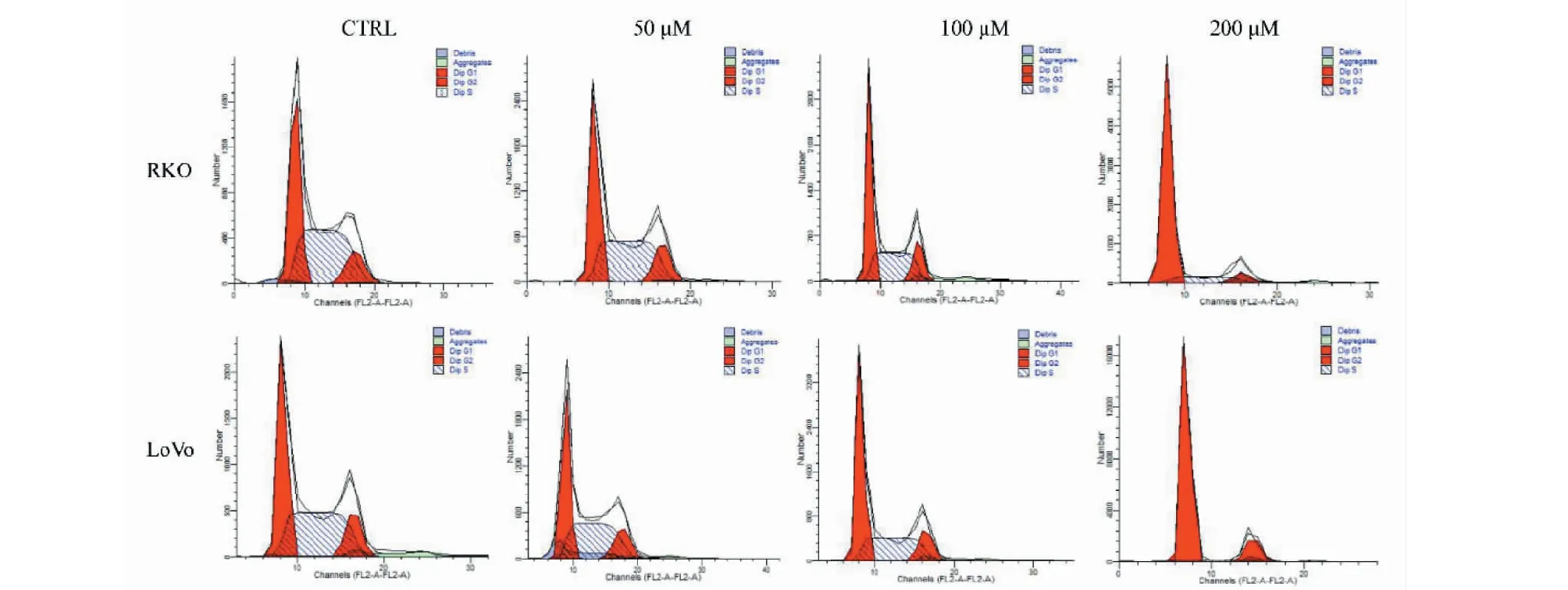
图4 TG对结直肠癌细胞周期的影响
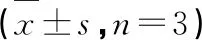
表1 各组人结直肠癌细胞RKO和LoVo周期比较
利用不同浓度TG处理结直肠癌细胞48 h后,Western blot实验结果(图5)显示,与对照组相比,给药后细胞内CDK2、CDK4和CDK6、Cyclin D1和Cyclin E蛋白表达水平均显著下降且细胞周期抑制剂p21的表达水平明显上升(P< 0.01)。表明TG可通过调控周期相关蛋白表达水平,诱导结直肠癌细胞G0/G1期阻滞作用。
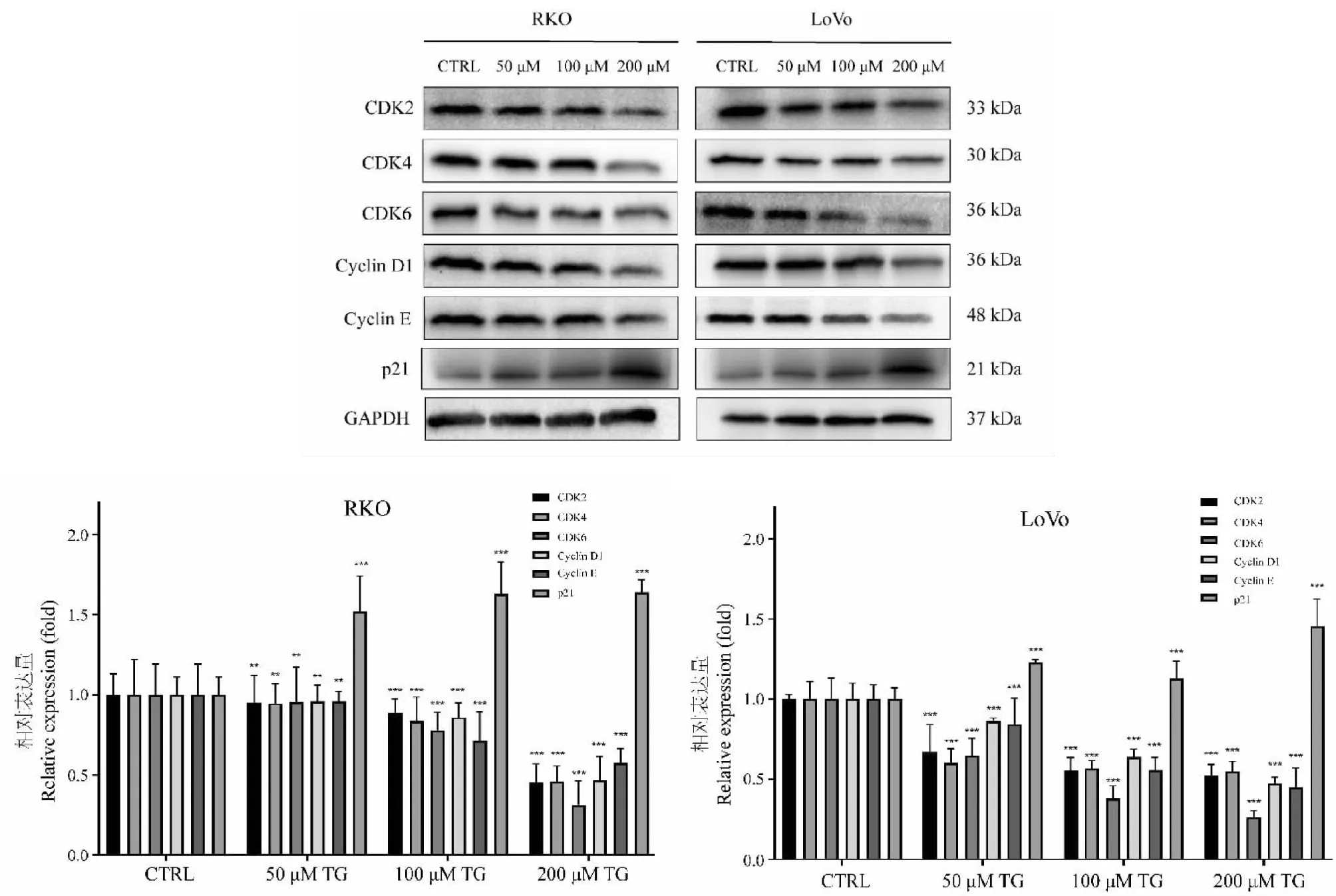
图5 TG对结直肠癌细胞内周期相关蛋白表达水平的影响(n=3)
3.3 TG诱导结直肠癌细胞DNA损伤
碱性彗星实验(图6)显示,TG可显著诱导结直肠癌细胞DNA损伤。不同浓度(50、100和200 μM)TG处理48 h后,RKO和LoVo细胞的彗星拖尾显著增加,且尾部DNA含量由低浓度组的45.76%(RKO)和43.82%(LoVo)上升至高浓度组的90.16%(RKO)和91.21%(LoVo)。与对照组0.01%(RKO)和0.00%(LoVo)的DNA含量相比显著升高(P< 0.01),表明给药后细胞DNA单、双链断裂明显增多,DNA损伤水平显著升高。
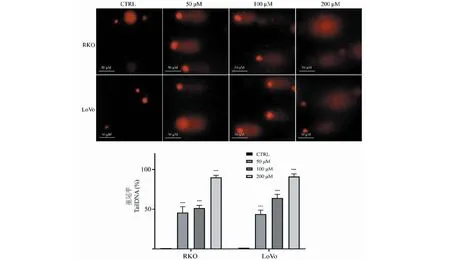
图6 彗星实验结果图及TG对细胞tailDNA含量的影响(n=3)
3.4 TG促进DNA双链断裂标记蛋白的表达
利用免疫荧光染色观察给药48 h后RKO和LoVo细胞内γ-H2AX的分布情况。实验结果如图7,与对照组相比,给药组细胞内γ-H2AX阳性灶点数显著增加,差异具有统计学意义(P< 0.01),表明TG诱导结直肠癌细胞RKO和LoVo发生DNA双链断裂。
图7 免疫荧光染色检测TG对细胞内γ-H2AX表达水平的影响(n=3)
3.5 TG调控ATM-CHK2-p53信号通路诱导结直肠癌细胞凋亡
Western blot实验(图8)结果显示,与对照组相比,给药48 h后内凋亡标志蛋白cleaved PARP和cleaved Caspase 3表达水平显著上升(P< 0.001),且呈浓度依赖性。为了进一步阐明TG引起凋亡的分子机制,本研究对DNA损伤应答中的关键蛋白ATM表达水平进行检测。结果(图8)显示,药物处理组细胞内ATM磷酸化水平显著升高(P< 0.01)。进一步检测ATM-CHK2-p53信号通路相关蛋白的表达水平后发现,与对照组相比,p-ATM/ATM,p-CHK2/CHK2和p-p53/p53比值均显著升高,表明TG可能通过激活ATM-CHK2-p53信号通路诱导细胞凋亡。

图8 TG对结直肠癌细胞内DNA损伤及凋亡相关蛋白表达水平的影响(n=3)
4 讨论
通关藤作为一种传统中药,临床上具有抗癌的功效。相关研究报道,通关藤提取所得的消癌平制剂对肿瘤细胞增殖有显著的抑制作用,其总皂苷提取物可诱导细胞凋亡发挥其抗癌活性作用[8]。因此,我们对通关藤的主要有效成分通关藤苷G抗结直肠癌药理作用及分子机制进行研究。实验结果显示,通关藤苷G能显著抑制结直肠癌细胞增殖,并通过诱导细胞DNA损伤、激活ATM-CHK2-p53通路,引起p53介导的周期阻滞和细胞凋亡。
维持基因组DNA的完整性对细胞的生长增殖具有至关重要的意义,然而细胞可能由于内、外部诸多物理或化学因素导致不同程度的DNA损伤。其中,DNA双链断裂是最严重的一种DNA损伤[9]。当DNA发生双链断裂时,细胞的DNA损伤应答机制使该DNA周边的H2AX组蛋白发生磷酸化,形成γ-H2AX[10]。γ-H2AX可在数分钟内在损伤处簇集形成γ-H2AX焦点,且焦点数量与DNA双链断裂水平呈正向对应关系,因此被公认为是DNA双链断裂的敏感性分子标记物之一。我们首先利用彗星实验对TG给药后细胞内DNA损伤情况进行检测后发现,药物处理组细胞尾部DNA含量显著升高,证明TG诱导结直肠癌细胞DNA损伤的发生。此外,免疫荧光染色法结果显示,与对照组相比,药物处理组细胞内γ-H2AX阳性灶数量显著升高,γ-H2AX表达水平显著上升,进一步证明了TG通过诱导DNA双链断裂引起DNA损伤。
DNA损伤应答,是生物体收到刺激而引起DNA损伤时,机体为保护细胞免受伤害而启动的DNA修饰;主要包括周期检查点的激活、DNA损伤修复以及DNA损伤诱导的细胞凋亡[11]。细胞中用于修复DNA损伤的通路复杂多样。当DNA双链断裂时,损伤感受器立即进行损伤识别,采取同源重组修复和非同源末端连接的重组修复[12]。其中,ATM蛋白是参与细胞损伤识别和修复的关键点之一[13],其通过上述两种途径参与DNA损伤应答。当ATM蛋白活化后,下游靶点CHK2发生磷酸化并激活p53[14],引起细胞周期阻滞并诱导细胞凋亡[15]。其中,G1/S周期进程阻滞主要由p53诱导的细胞周期蛋白依靠性激酶抑制剂p21水平升高所造成[16]。流式细胞术及Western blot结果均表明,TG可通过上调p21水平并抑制周期相关蛋白CDK2、CDK4、CDK6、Cyclin D1和Cyclin E的表达,诱导细胞G0/G1期阻滞。
研究证明,ATM-CHK2-p53信号通路在DNA损伤诱导的细胞凋亡中发挥重要作用[17]。结合其DNA损伤诱导作用,我们就TG对ATM-CHK2-p53信号通路的调控作用进行分子机制研究。Western blot实验结果表明,TG给药48 h后,细胞内ATM和CHK2磷酸化水平显著升高,且p53蛋白表达及其磷酸化水平也显著上调。同时,我们对细胞内凋亡标志蛋白cleaved PARP及cleaved Caspase 3进行检测后发现,两者细胞内表达水平随给药浓度增大而显著升高,证明TG对结直肠癌细胞具有凋亡诱导作用。由此可以推测,TG处理后细胞内活化的ATM可能通过诱导其下游蛋白CHK2磷酸化,并进一步激活p53,引起p53介导的细胞凋亡。
细胞周期抑制在抗结直肠癌细胞增殖中发挥重要作用[18]。细胞周期蛋白(Cyclin)和细胞周期蛋白依赖性激酶(CDK)在细胞周期进程中通过形成CDK-Cyclin复合物,磷酰化目标蛋白实现细胞周期的调控[19]。其中,CDK2-Cyclin E和CDK4/6-Cyclin D1对于细胞由G1期转入S期具有重要作用,而p21对于这一周期转化进程具有抑制作用[20]。由于TG可通过ATM-CHK2-p53信号通路上调p53活性,活化后的p53可能通过激活p21从而启动G1/S期监测点,诱导 G0/G1期细胞周期阻滞。
综上所述,本研究发现,TG对结直肠癌细胞具有增殖抑制作用且诱导细胞G0/G1期阻滞与凋亡。此外,TG可引起细胞DNA损伤,激活ATM-CHK2-p53信号通路。因此提示TG可能通过调控ATM-CHK2-p53信号通路,诱导p53介导的周期阻滞与细胞凋亡,抑制结直肠癌细胞增殖。本研究为通关藤苷G治疗结直肠癌提供了一定理论基础,其他相关作用机制有待进一步的研究。

