重组人血管内皮抑制素在晚期非小细胞肺癌化疗患者中的应用效果
马怡,郑爽,赫丽杰
辽宁省人民医院肿瘤科,沈阳 110016
临床上所有恶性肿瘤中,肺癌最为常见,其发病率和病死率居高不下。肺癌包含很多类型,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)的比例较高,达76%~80%,NSCLC包括腺癌、鳞状细胞癌、大细胞癌以及小细胞癌以外的肺癌[1]。在NSCLC患者中,以中老年男性居多,其发展速度快,恶性程度较高[2]。早期NSCLC症状不显著,临床不易诊断,而确诊时大部分患者已发展至中晚期,存在转移或扩散现象,此时进行手术效果不佳,且具有较高的复发率[3]。临床上对于晚期NSCLC患者的治疗以放化疗为主,但获得的疗效有限,且易引发不良反应,降低患者的生活质量。随着医疗水平的提高,多种新型抗肿瘤药物得到了发展。重组人血管内皮抑制素是一种人工合成的内源性药物,具有抑制血管生成的作用,能够减缓或阻断组织内皮细胞的迁移,防止肿瘤新生血管形成,在NSCLC患者中能够发挥较好的疗效[4]。本研究探讨了重组人血管内皮抑制素在晚期NSCLC化疗患者中的应用效果,旨在为晚期NSCLC患者治疗方案的选择提供一定的理论依据,现报道如下。
1 对象与方法
1.1 研究对象
选取2018年5月至2020年5月辽宁省人民医院收治的120例晚期NSCLC患者。纳入标准:①符合临床上关于NSCLC的诊断标准[5];②经病理检查确诊为NSCLC;③TNM分期为ⅢB~Ⅳ期;④未接受过其他治疗;⑤对本研究所用药物无过敏史。排除标准:①合并其他肿瘤;②合并心、肾等其他器官功能异常;③依从性低;④具有认知功能障碍。依据随机数字表法将患者分为观察组和对照组,每组60例。观察组中,男35例,女25例;年龄44~68岁,平均(56.24±4.37)岁;临床分期:ⅢB期21例,Ⅳ期39例;病理类型:腺癌28例,鳞状细胞癌19例,其他13例。对照组中,男37例,女23例;年龄45~69岁,平均(57.51±5.12)岁;临床分期:ⅢB期20例,Ⅳ期40例;病理类型:腺癌30例,鳞状细胞癌18例,其他12例。两组患者的性别、年龄、临床分期及病理类型比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核通过,所有患者及家属均对本研究知情并签署知情同意书。
1.2 治疗方法
两组患者均进行抗过敏、调养胃功能等常规护理,同时进行放疗,放射剂量为每次1.6~2.0 Gy,照射部位包括病灶、同侧纵隔以及肺门,每周5次,中位放射剂量为60 Gy。
对照组患者予以顺铂注射液治疗,静脉滴注30 mg/m2,第1~3天,21天为1个周期。
观察组患者在对照组的基础上联合重组人血管内皮抑制素注射液治疗,静脉滴注7.5 mg/m2,第1~14天,中途停药1周,21天为1个周期。
1.3 观察指标
①肿瘤标志物水平。分别于治疗前后采集两组患者的空腹静脉血5 ml,采取电化学方法检测细胞角质蛋白19片段抗原21-1(cyto-keratin 19 fragment antigen 21-1,CYFRA21-1)水平,采用放射免疫法检测癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原50(carbohydrate antigen 50,CA50)水平。②肺功能指标。采用Plantinum Elite DL型肺功能仪检测治疗前后两组患者的用力肺活量占预计值百分比(forced vital capacity as percentage of predicted value,FVC%)、第一秒用力呼气量(forced expiratory volume in first second,FEV1)以及最大通气量(maximal voluntary ventilation,MVV)。③外周血血管内皮生长因子(vascular endothelial growth factor,VEGF)和低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)水平。采用酶联免疫吸附试验检测治疗前后两组患者的外周血VEGF和HIF-1α水平。④生活质量。采用癌症患者生存质量量表评估治疗前后两组患者的生活质量,该量表主要包括功能情况、情感情况、社会/家庭情况、生理状态4个维度,各维度满分依次为28、24、28、28分,评分与生活质量呈反比[6]。⑤免疫功能指标。采用BD FACSCalibur流式细胞分析仪检测治疗前后两组患者的CD3+、CD4+、CD8+水平,并计算CD4+/CD8+。⑥不良反应发生情况。比较两组患者的不良反应,包括发热、乏力、白细胞减少、血小板减少等。
1.4 统计学分析
采用SPSS 20.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤标志物水平的比较
治疗前,两组患者的CYFRA21-1、CEA、CA50水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者的CYFRA21-1、CEA、CA50水平均低于本组治疗前,且观察组患者的CYFRA21-1、CEA、CA50水平均低于对照组,差异均有统计学意义(P<0.05)。(表1)
表1 治疗前后两组患者肿瘤标志物水平的比较(±s)

表1 治疗前后两组患者肿瘤标志物水平的比较(±s)
注:a与本组治疗前比较,P<0.05;b与对照组治疗后比较,P<0.05
指标CYFRA21-1(ng/ml)CEA(ng/ml)CA50(U/ml)时间治疗前治疗后治疗前治疗后治疗前治疗后观察组(n=60)6.34±1.25 3.27±0.56a b 25.61±4.31 11.05±2.36a b 26.47±4.90 15.35±3.71a b对照组(n=60)6.13±1.42 4.11±0.45a 26.13±4.71 15.30±2.61a 26.14±4.82 21.30±3.31a
2.2 肺功能指标的比较
治疗前,两组患者的FVC%、FEV1、MVV比较,差异均无统计学意义(P>0.05)。治疗后,两组患者的FVC%、FEV1、MVV均高于本组治疗前,且观察组患者的FVC%、FEV1、MVV均高于对照组,差异均有统计学意义(P<0.05)。(表2)
表2 治疗前后两组患者肺功能指标的比较(±s)

表2 治疗前后两组患者肺功能指标的比较(±s)
注:a与本组治疗前比较,P<0.05;b与对照组治疗后比较,P<0.05
指标FVC%FEV1(L)MVV(L/min)时间治疗前治疗后治疗前治疗后治疗前治疗后观察组(n=60)68.45±4.26 85.41±5.85a b 2.05±0.45 2.90±0.38a b 62.41±5.95 68.43±4.82a b对照组(n=60)69.69±4.75 81.36±5.57a 2.13±0.74 2.48±0.65a 61.55±5.21 64.84±4.67a
2.3 外周血VEGF和HIF-1 α水平的比较
治疗前,两组患者的外周血VEGF和HIF-1α水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者的外周血VEGF和HIF-1α水平均低于本组治疗前,且观察组患者的外周血VEGF和HIF-1α水平均低于对照组,差异均有统计学意义(P<0.05)。(表3)
表3 治疗前后两组患者外周血VEGF和HIF-1 α水平的比较(±s)

表3 治疗前后两组患者外周血VEGF和HIF-1 α水平的比较(±s)
注:a与本组治疗前比较,P<0.05;b与对照组治疗后比较,P<0.05
指标VEGF(pg/ml)HIF-1α(ng/L)时间治疗前治疗后治疗前治疗后观察组(n=60)512.30±102.85 342.67±94.21a b 65.39±6.54 35.41±3.47a b对照组(n=60)513.37±105.64 425.34±95.16a 64.56±7.12 40.53±3.39a
2.4 生活质量的比较
治疗前,两组患者的功能情况、情感情况、社会/家庭情况、生理状态评分比较,差异均无统计学意义(P>0.05)。治疗后,两组患者的功能情况、情感情况、社会/家庭情况、生理状态评分均低于本组治疗前,且观察组患者的功能情况、情感情况、社会/家庭情况、生理状态评分均低于对照组,差异均有统计学意义(P<0.05)。(表4)
表4 治疗前后两组患者生活质量评分的比较(±s)
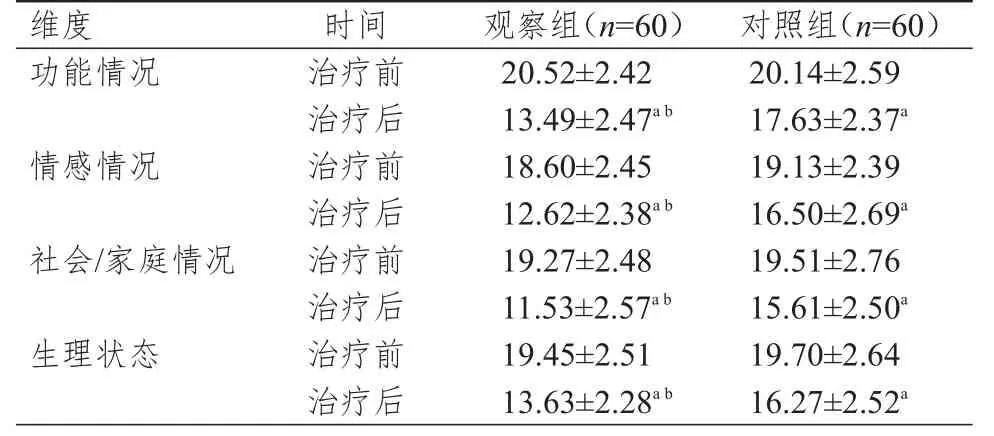
表4 治疗前后两组患者生活质量评分的比较(±s)
注:a与本组治疗前比较,P<0.05;b与对照组治疗后比较,P<0.05
维度功能情况情感情况社会/家庭情况生理状态时间治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后观察组(n=60)20.52±2.42 13.49±2.47a b 18.60±2.45 12.62±2.38a b 19.27±2.48 11.53±2.57a b 19.45±2.51 13.63±2.28a b对照组(n=60)20.14±2.59 17.63±2.37a 19.13±2.39 16.50±2.69a 19.51±2.76 15.61±2.50a 19.70±2.64 16.27±2.52a
2.5 免疫功能指标的比较
治疗前,两组患者的 CD3+、CD4+、CD8+水平及CD4+/CD8+比较,差异均无统计学意义(P>0.05)。治疗后,两组患者的CD3+、CD4+水平及CD4+/CD8+均高于本组治疗前,CD8+水平低于本组治疗前,且观察组患者的CD3+、CD4+水平及CD4+/CD8+均高于对照组,CD8+水平低于对照组,差异均有统计学意义(P<0.05)。(表5)
表5 治疗前后两组患者免疫功能指标的比较(±s)

表5 治疗前后两组患者免疫功能指标的比较(±s)
注:a与本组治疗前比较,P<0.05;b与对照组治疗后比较,P<0.05
指标CD3+(%)CD4+(%)CD8+(%)CD4+/CD8+时间治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后观察组(n=60)57.24±8.35 71.51±7.24a b 33.20±4.29 42.47±5.24a b 33.28±4.15 26.40±3.31a b 1.15±0.53 1.86±0.54a b对照组(n=60)56.28±7.62 58.13±8.42a 32.35±4.37 35.26±4.39a 32.43±4.08 29.21±3.34a 1.12±0.36 1.43±0.60a
2.6 不良反应发生情况的比较
治疗后,观察组患者的不良反应总发生率为5.00%(3/60),低于对照组的16.67%(10/60),差异有统计学意义(χ2=4.236,P=0.040)。(表6)

表6 两组患者的不良反应发生情况[n(%)]
3 讨论
NSCLC患者以男性居多,早期临床表现并不明显,且患者的生存时间较短,生存率也较低。晚期NSCLC患者极易发生转移或扩散,采用手术治疗的效果不佳,往往结合放化疗,但也存在一定的不良反应[7]。此外,临床上常采用药物治疗晚期NSCLC患者,其中应用较多的药物包括吉西他滨、紫杉醇及顺铂类等,疗效确切,但药效时间较短,无法进行根治[8]。近年来,抑制血管生成成为了治疗肿瘤的新趋势,在抑制肿瘤扩散方面发挥重要作用。相关研究表明,抗血管生成药物对肿瘤旁血液的生成具有抑制作用,能够与其他药物相互作用产生效应[9]。重组人血管内皮抑制素是一种常见的血管内皮抑制素,能够减少血管内皮细胞的增殖,抑制肿瘤的快速增长,能够直接作用于VEGF,阻断其信号转导,降低蛋白水解酶的活跃度,进而加速内皮细胞的凋零。此外,重组人血管内皮抑制素可减少新生血管形成,切断肿瘤细胞的营养供应,提高化疗药物的疗效,防止肿瘤细胞转移或扩散[10]。相关文献报道,重组人血管内皮抑制素在NSCLC患者中的安全性良好,能够使药物直接作用于部分细胞,应用于原发灶及继发病灶时,效果较佳[11]。
在恶性肿瘤发生以及恶化的过程中,患者的血清学指标也会发生相应的变化,而这些指标的升降通常可反映肿瘤的严重程度,临床上将其称为肿瘤标志物,其中,CYFRA21-1、CEA及CA50是常见的3种肿瘤标志物[12]。CYFRA21-1与肺癌息息相关,当恶性肿瘤发生后,CYFRA21-1会转移到血液中,其水平升高表明肿瘤已发生。CEA是一类酸性糖蛋白,存在于胚胎组织中,具有较高的抗原特异性,其水平与肿瘤的治疗效果具有直接关联。CA50是糖类抗原之一,在晚期恶性肿瘤患者中的表达水平较高[13]。本研究中,治疗后观察组患者的CYFRA21-1、CEA、CA50水平均低于对照组,差异均有统计学意义(P<0.05)。说明重组人血管内皮抑制素能够降低晚期NSCLC化疗患者的肿瘤标志物水平,与宋延海等[14]研究结果类似。NSCLC在中老年人群中的发生率较高,受自身体质和长期放化疗的影响,NSCLC患者的相关功能会出现一定程度的下降,其会对免疫系统造成较大影响,导致肺功能降低,进而延误治疗。因此,提高NSCLC患者的肺功能有利于提高临床疗效[15]。本研究中,治疗后观察组患者的FVC%、FEV1、MVV均高于对照组(P<0.05)。说明将重组人血管内皮抑制素应用于晚期NSCLC化疗患者时,能够改善其肺功能,与孙晓等[16]的研究结果基本一致。
相关研究表明,VEGF和HIF-1α在肿瘤血管生成中的作用不可忽视[17]。VEGF是一种对血管生成具有促进作用的因子,其水平的高低反映了NSCLC的恶性程度、转移及预后情况,其水平越高,表明NSCLC的恶性程度越高[18]。HIF-1α能够促进肿瘤组织周围的血管生成,同时会干扰其他因子,造成其他因子的表达水平发生变化,此外HIF-1α在肿瘤生长过程中具有较大作用,其水平升高意味着恶性程度加重[19]。本研究发现,治疗后观察组患者的外周血VEGF和HIF-1α水平均低于对照组(P<0.05)。说明重组人血管内皮抑制素有利于改善晚期NSCLC化疗患者的恶性程度及预后,与贾桂英[20]的研究结果具有一定的相似性。此外,治疗后观察组患者的功能情况、情感情况、社会/家庭情况、生理状态评分均低于对照组(P<0.05)。说明重组人血管内皮抑制素有利于提高晚期NSCLC化疗患者的生活质量。本研究还发现,治疗后观察组患者的CD3+、CD4+水平及CD4+/CD8+均高于对照组,CD8+水平低于对照组,差异均有统计学意义(P<0.05)。说明重组人血管内皮抑制素有利于增强晚期NSCLC化疗患者的免疫功能。观察组患者的不良反应总发生率为5.00%,低于对照组的16.67%(P<0.05),说明重组人血管内皮抑制素有利于降低晚期NSCLC化疗患者的不良反应发生率。
综上所述,对晚期NSCLC化疗患者应用重组人血管内皮抑制素治疗可降低其肿瘤标志物水平及外周血VEGF和HIF-1α水平,改善肺功能,提高生活质量,增强免疫功能,降低不良反应发生率。然而本研究纳入的病例数有限,后续需要扩大病例数进行验证。

