氮磷共掺杂碳量子点“关-开”型荧光探针检测氨苄青霉素的研究
李满秀, 宋志英, 任光明, 赵三虎, 李海平
(忻州师范学院化学系,山西忻州 034000)
碳量子点(CQDs)由尺寸在10 nm以下分散的类球状碳颗粒组成,具有良好的生物相容性、耐光漂白、低毒性及合成原料廉价易得等特点[1 -3 ]。但是无杂元素掺杂、无表面钝化剂修饰的CQDs表现出选择性较差、活性位点少和较低的荧光发射,而掺杂其他元素的CQDs[4 - 7],其反应活性、荧光产率明显提高,具有更稳定的光学性质和优良的催化性能。
氨苄青霉素(Ampicillin)又称氨苄西林,是半合成的青霉素,因其价格低廉、使用便捷、且抗菌作用强等优点而成为最常用的抗生素之一。而由于其大量使用,给许多动物源性食品带来了极大的安全隐患,因此对痕量氨苄青霉素定量检测显得尤为重要。目前测定氨苄青霉素的方法有受体识别分析法[8]、生物传感器检测法[9,10]、高效液相色谱法[11]、高效毛细管电泳法[12]和荧光法[13 - 15]等。与其他测定方法相比,荧光法具有检测快速、操作简单和低成本等优势,因而得到人们更多的青睐。本文以柠檬酸三钠、11-氨基十一烷酸、NaH2PO4和聚乙二醇为原料,采用微波法制备了一种稳定的、高荧光量子产率的氮磷共掺杂碳量子点(NPCQDs)并对其进行了表征。研究表明在NPCQDs中加入黄芩苷能使其荧光猝灭,再向体系中加入氨苄青霉素,导致体系的荧光恢复,基于此构建“关-开”型荧光探针可提供一种检测氨苄青霉素的新方法。方法操作简单、灵敏度高、耗时短、成本低,可用于药品、奶类中氨苄青霉素的测定。
1 实验部分
1.1 主要仪器与试剂
F-4600型荧光分光光度计(日本,日立公司);傅里叶红外光谱仪(日本,岛津公司);Enlution-220型紫外-可见分光光度计(上海莱瑞科学仪器有限公司);pHS-3CT型酸度计(上海大普仪器有限公司);AL204型电子分析天平(梅特勒-托利多有限公司);KQ-400KDE型高功率数控超声波清洗器(昆山市超声仪器有限公司);真空冷冻干燥机(北京博医康实验仪器有限公司);透析袋1 000(美国)。
黄芩苷(都莱公司)标准储备液(1.0×10-3mol·L-1):准确称取44.63 mg黄芩苷,用N-N二甲基甲酰胺溶解,并定容到100 mL容量瓶中备用。氨苄青霉素标准储备液(1.0×10-3mol·L-1):准确称取20.15 mg氨苄青霉素,用超纯水溶解,并定容到50 mL容量瓶中备用。pH=8.6的Tris-HCl缓冲溶液:50 mL 0.1 mol·L-1Tris溶液与12.4 mL 0.1 mol·L-1HCl混合均匀后,加超纯水稀释至100 mL。柠檬酸三钠、NaH2PO4、硫酸奎宁(国药集团化学试剂有限公司);11-氨基十一烷酸(阿拉丁公司);聚乙二醇(天津福晨化学试剂厂);N-N二甲基甲酰胺(天津永大化学试剂有限责任公司);试剂级别为分析纯,实验用水均为超纯水。
1.2 实验方法
1.2.1 CQDs和NPCQDs的制备CQDs的制备:称取0.5 g柠檬酸三钠于100 mL烧杯中,加入8.0 mL超纯水和10 mL聚乙二醇,在室温下搅拌均匀后放入微波反应仪中,设置反应时间为240 s,功率为455 W进行反应,反应结束后得到粘稠状淡黄色液体,自然冷却,过滤,用超纯水定容到50 mL 的容量瓶中,得到均一的CQDs溶液。NPCQDs的制备:称取0.5 g NaH2PO4于100 mL烧杯中,加入8 mL超纯水,用玻璃棒搅拌使其溶解,再加入0.5 g柠檬酸三钠,0.1 g 11-氨基十一烷酸和10 mL聚乙二醇,在室温下搅拌均匀后放入微波反应仪中,设置反应时间为240 s,功率为455 W进行反应,反应结束后得到粘稠状橘黄色液体,自然冷却,过滤,用超纯水定容到50 mL的容量瓶中,得到均一的NPCQDs溶液。
将制得的CQDs与NPCQDs在预处理过的透析袋中透析24 h,同时在冷冻干燥机中冷冻干燥,得到CQDs与NPCQDs的固体。
1.2.2 荧光测定取0.14 mL 3.4×10-2mol·L-1的NPCQDs于10 mL的比色管中,再依次加入1 mL pH=8.6的Tris-HCl缓冲溶液和不同浓度梯度的黄芩苷溶液,用超纯水定容,振荡并摇匀,在激发/发射波长为355/440 nm 条件下测定其荧光强度。取0.14 mL 3.4×10-2mol·L-1的NPCQDs于10 mL的比色管中,再依次加入1 mL pH=8.6的Tris-HCl缓冲溶液,1 mL 1.0×10-3mol·L-1的黄芩苷溶液,不同浓度梯度的氨苄青霉素标准溶液,用超纯水定容,振荡并摇匀,在激发/发射波长为355/440 nm条件下测定其荧光强度(测定中激发和发射狭缝宽度均为10 nm)。
1.2.3 样品处理头孢氨苄胶囊:取0.022 g药品用超纯水溶解,定容于25 mL的比色管中,用于氨苄青霉素的测定。牛奶:取5 mL的牛奶样品,加入3 mL 19%的三氯乙酸(TCA)在超声振荡仪中振荡60 s,选择4 000 r·min-1离心15 min,过滤之后取3 mL的上清液,于上清液中加入2 mL正己烷进行脱脂,混匀,并静置1 min处理后,再次选择4 000 r·min-1离心15 min,弃去正己烷层,最终得到待测样品溶液。
1.2.4 标准曲线的绘制黄芩苷-NPCQDs的荧光猝灭标准曲线:配制0.1~1.3(×10-4)mol·L-1的黄芩苷系列标准溶液,依照实验方法“1.2.2”测定其荧光强度,然后以黄芩苷浓度为横坐标,体系的荧光强度为纵坐标绘制标准曲线。氨苄青霉素对体系荧光恢复标准曲线:配制0.1~7.0(×10-5)mol·L-1的氨苄青霉素系列标准溶液,依照实验方法“1.2.2”测定其荧光强度,然后以氨苄青霉素浓度为横坐标,体系的荧光强度为纵坐标绘制标准曲线。
2 结果与讨论
2.1 氮磷共掺杂碳量子点合成条件的优化
为了得到性能优良的NPCQDs,在不同微波时间(120 s、180 s、210 s、240 s、270 s)和不同微波功率(260 W、325 W、390 W、455 W、520 W、585 W)下制备NPCQDs(图1和图2)。结果表明,当微波时间为240 s,微波功率为455 W时,得到的NPCQDs的荧光强度较大且稳定。
2.2 光谱特征
2.2.1 红外光谱红外光谱如图3所示:1 107 cm-1处为C-O-C不对称和对称伸缩振动;1 325 cm-1处为P=O伸缩振动峰;1 476 cm-1处为C=N伸缩振动吸收峰;位于1 661 cm-1处的峰为C=O的伸缩振动吸收峰;2 908 cm-1处为C-H的伸缩振动峰;3 310~3 494 cm-1处的宽峰为-OH、N-H的伸缩振动吸收峰。数据可以说明两种材料表面可能存在较多的羟基与羧基,而NPCQDs在3 310~3 494 cm-1峰比CQDs峰宽,且在1 325 cm-1、1 476 cm-1处NPCQDs比CQDs相比吸收增强,表明成功掺杂了N、P元素[16]。

图2 功率对制备NPCQDs的影响Fig 2 Influence of power on preparation of NPCQDs

图3 CQDs和NPCQDs的红外光谱Fig.3 Infrared spectra of CQDs and NPCQDs1.CQDs;2.NPCQDs.
2.2.2 荧光表征对NPCQDs和CQDs进行荧光表征可知,NPCQDs在355 nm激发下,在440 nm处有最大发射,CQDs在340 nm激发下,在438 nm处有最大发射。从图4可以看到,NPCQDs的荧光强度明显高于CQDs,且发射波长略有红移,初步认为N、P的掺杂可能改变了CQDs表面的化学环境,引入更多的表面缺陷,导致发光性质改变;或者是杂原子的孤对sp2杂化态会在CQDs表面形成共轭集群,从而改善CQDs表面的电子密度和透光性,对其内在属性进行调整[17]。
2.2.3 紫外表征如图5所示:NPCQDs紫外吸收光谱的吸收峰为315 nm,而CQDs的紫外吸收光谱的吸收峰为323 nm,掺杂N、P的CQDs发生蓝移。
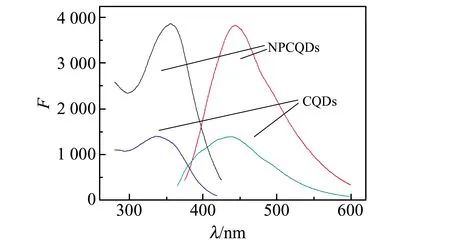
图4 CQDs与NPCQDs的荧光光谱图Fig.4 Fluorescence spectra of NPCQDs and CQDs
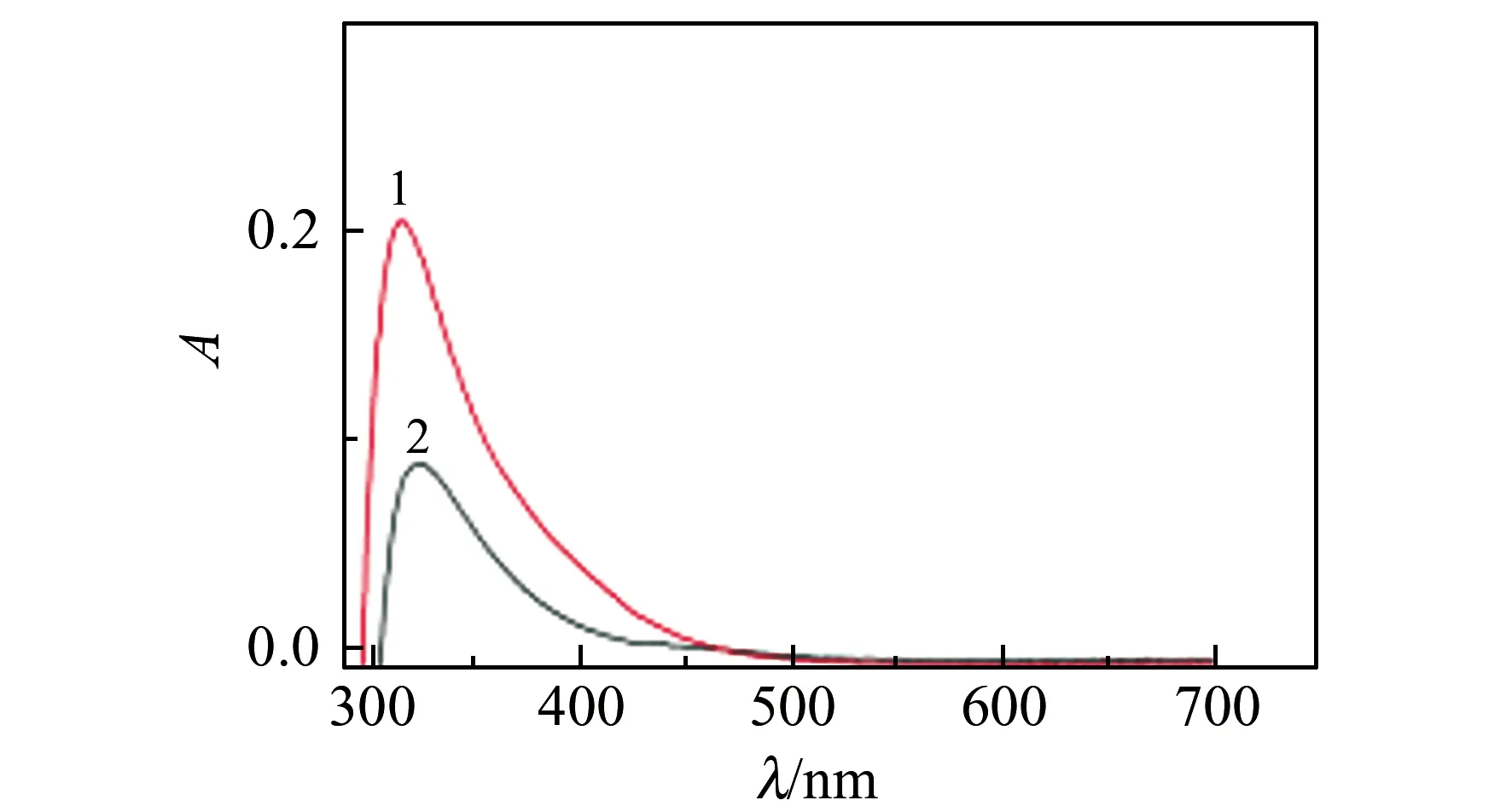
图5 CQDs和NPCQDs的紫外光谱图Fig.5 UV spectra of NPCQDs and CQDs1:NPCQDs;2:CQDs.
2.3 荧光量子产率的测定
本实验采用硫酸奎宁作参比物质,测定NPCQDs的荧光量子产率,当激发波长为360 nm时,NPCQDs的荧光量子产率达到12%。可以看出,以柠檬酸三钠等为原料制备得到的NPCQDs的荧光性能很好。
2.4 分析条件的优化

图6 pH值对体系荧光强度的影响Fig.6 Effect of pH value on fluorescence intensity of the system1.NPCQDs+Skullcap glycosides;2.NPCQDs+Skullcap glycosides+Ampicillin.
2.4.1 体系缓冲溶液的选择分别考察了三酸缓冲溶液、Tris-HCl缓冲溶液、磷酸盐缓冲溶液对体系荧光强度的影响。其中Tris-HCl缓冲溶液对NPCQDs的作用最佳,所以本实验选择Tris-HCl作为缓冲溶液。进一步考察了不同pH值Tris-HCl缓冲溶液对体系荧光强度的影响,配制不同pH的Tris-HCl缓冲溶液,按实验方法加入不同的pH缓冲溶液,测定其荧光强度,探究了黄芩苷对NPCDQs的荧光猝灭率(F′0-F′)/F′0的影响,以及氨苄青霉素对NPCDQs荧光恢复率(F-F0)/F0的影响(图6)。综合考虑,本实验选择在pH=8.6的Tris-HCl缓冲溶液中测定荧光强度。
2.4.2 反应时间对体系荧光强度的影响考察了反应时间分别为10、20、30、40、50、60、90、120 min时黄芩苷对NPCQDs荧光猝灭率,以及氨苄青霉素对NPCQDs的荧光恢复率的影响。根据图7可知,当放置时间为10 min时猝灭、恢复率较好,故实验选择在10 min进行测量。
2.4.3 温度对体系荧光强度的影响考察了反应温度分别为15、25、35、45、55 ℃时黄芩苷对NPCQDs的荧光猝灭率,以及氨苄青霉素对NPCQDs的荧光恢复率的影响。由图8可知:温度越低,荧光猝灭率越好,温度在15 ℃时,荧光恢复最好,另外,NPCQDs的荧光强度随着温度的升高在不断减弱。综合来看,温度在15 ℃时实验效果最好,所以实验选择在室温下进行测量。

图7 反应时间对体系荧光强度的影响Fig.7 Effect of time on fluorescence intensity of the system1.NPCQDs+Skullcap glycosides+Ampicillin;2.NPCQDs+Skullcap glycosides.

图8 温度对体系荧光强度的影响Fig.8 Effect of temperature on fluorescence intensity of the system1.NPCQDs+ Skullcap glycosides+Ampicillin;2.NPCQDs+Skullcap glycosides.
2.5 黄芩苷对氮磷掺杂碳量子点的荧光猝灭作用
研究表明,NPCQDs与黄芩苷作用后,其发射波长440 nm处的荧光强度明显减弱,且随黄芩苷浓度的增加不断减弱(图9)。NPCQDs荧光强度减弱程度与黄芩苷的浓度在0.1~1.3(×10-4) mol·L-1呈良好线性关系,回归方程为:F=-295.97c+695.29(10-4mol·L-1),相关系数R2=0.9900。荧光猝灭原因可能是黄芩苷表面富含的羟基取代基与NPCQDs表面的羧基反应结合形成无荧光的复合物[18]从而减弱了NPCQDs的荧光发射。考虑黄芩苷浓度会影响到NPCQDs荧光恢复程度和线性范围,选择浓度为1.0×10-4mol·L-1的黄芩苷溶液作为NPCQDs猝灭剂对氨苄青霉素进行检测。
2.6 “关-开”型荧光探针的构建及对氨苄青霉素的测定
在优化的条件下,考察了猝灭后的NPCQDs荧光恢复程度与氨苄青霉素浓度之间的关系,发现氨苄青霉素浓度在1~70 μmol·L-1内与黄芩苷-NPCQDs荧光恢复呈线性关系。在室温下,扫描NPCQDs在激发波长355 nm下的荧光光谱图,其最大发射波长位于440 nm。在该波长下黄芩苷、氨苄青霉素以及二者反应的产物均无明显荧光,故对实验结果不会造成影响。由图9可知,黄芩苷的加入可以猝灭NPCQDs的荧光,荧光信号“关闭”;加入氨苄青霉素后,其表面所含氨基与黄芩苷表面的羟基之间形成分子间氢键,使得NPCQDs得到释放,从而使荧光得到恢复(图10),体系的荧光信号处于“打开”状态,通过荧光探针的“关-开”模式实现了对氨苄青霉素进行选择性识别。
2.7 猝灭体系对氨苄青霉素的选择性
在优化的实验条件下,考察了常见的糖类,无机盐,氨基酸等可能的共存物质对恢复体系的影响,结果表明:在相对误差为±5%的范围内,各种共存物质的允许量如表1所示。糖类对体系的影响较小,Fe3+、色氨酸对体系干扰较大,但不影响实际样品的测定。
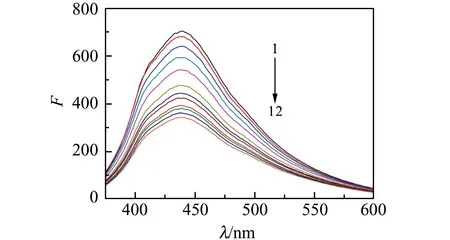
图9 黄芩苷对NPCQDs的荧光猝灭Fig.9 Fluorescence quenching of NPCQDs by Skullcap glycosides1→12 (cskullcap glycosides):0,0.1,0.2,0.3,0.5,0.7,0.8,0.9,1.0,1.1,1.2,1.3(×10-4)mol·L-1.
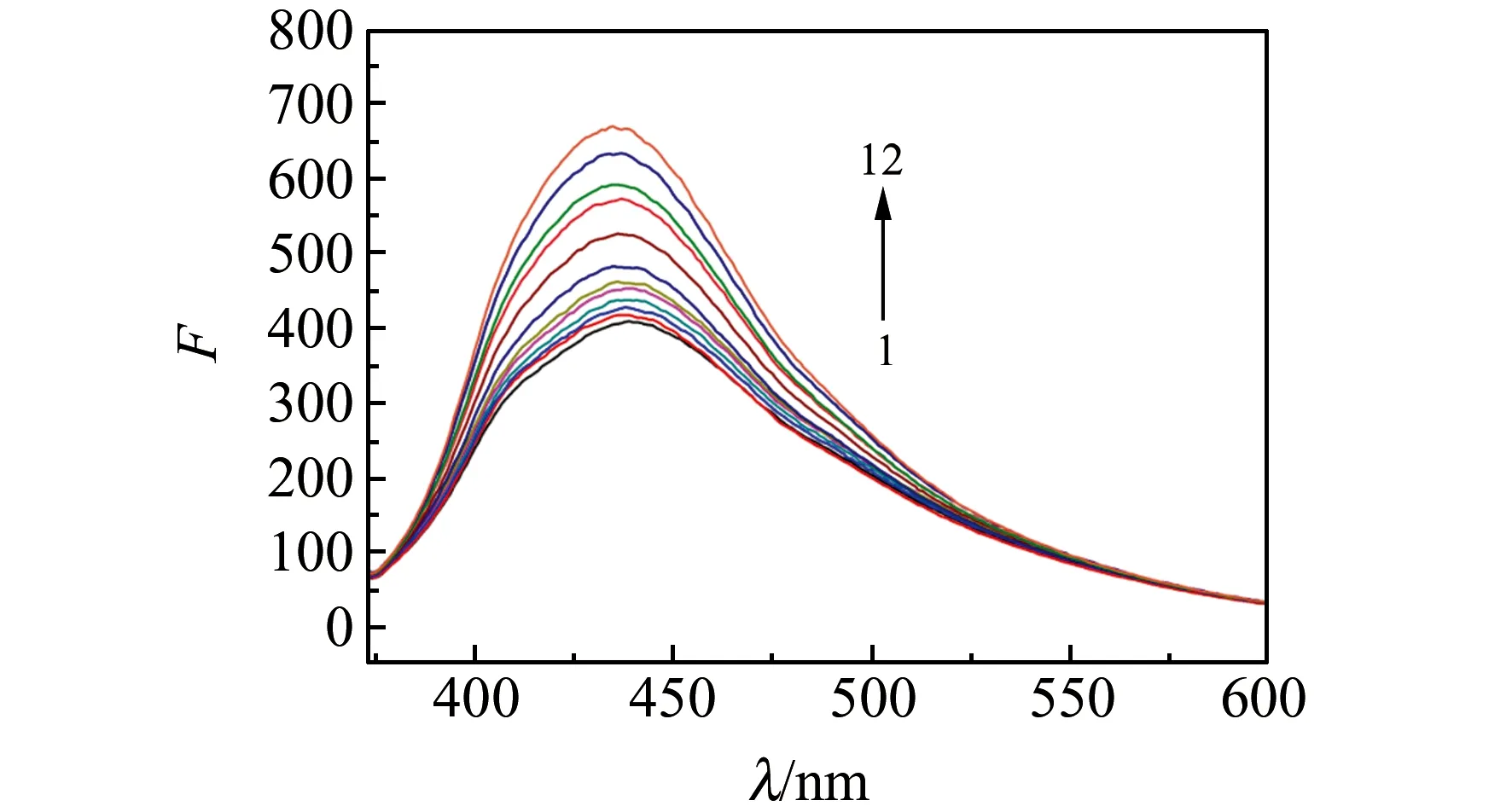
图10 氨苄青霉素对猝灭体系的响应Fig.10 Response of ampicillin to quenching system1→12 (campicillin):0.1,0.2,0.3,0.6,0.9,2.0,3.0,4.0,5.0,6.0,7.0(×10-5)mol·L-1.
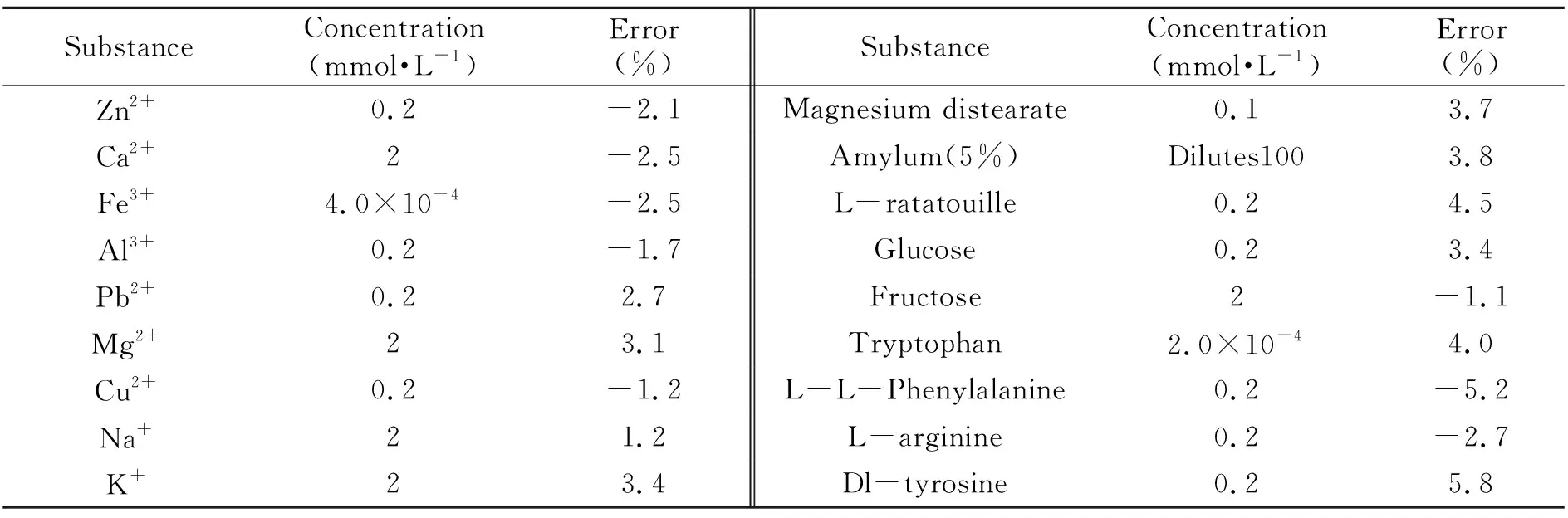
表1 干扰物质的影响
2.8 工作曲线,检出限和精密度
在优化的实验条件下,黄芩苷-NPCQDs体系的荧光强度与氨苄青霉素的浓度在1~70 μmol·L-1内呈良好的线性关系,回归方程为:F=35.451c+421.67(10-5mol·L-1),相关系数R2=0.9926。对3.5×10-5mol·L-1氨苄青霉素的10次平行测定结果的相对标准偏差(RSD)为0.17%,以3倍标准偏差计算本法的检出限为7.9×10-7mol·L-1。
2.9 样品分析
分别取经处理并稀释过的样品溶液按实验方法测定了氨苄胶囊和牛奶中氨苄青霉素的含量,每个样品平行测定5次。为了进一步验证该方法的准确性,测定了样品的加标回收率,结果见表2。

表2 头孢氨苄胶囊和牛奶样品测定及回收率(n=5)
3 结论
本研究制备了一种高稳定性、高荧光量子产率的水溶性NPCQDs,利用黄芩苷与NPCQDs结合引起荧光猝灭的现象,建立了“关-开”型荧光探针测定氨苄青霉素的新方法。该“关-开”型NPCQDs荧光探针具有操作简单,灵敏度高,选择性好等优点,适用于药品及牛奶中氨苄青霉素的检测,拓展了碳量子点在分析测试方面的应用。

