山慈菇酯提物对4T1乳腺癌免疫微环境的影响
张 楠, 曹晓东, 刘 颖, 张子英*
(1.内蒙古医科大学公共卫生学院, 呼和浩特 010110; 2.内蒙古医科大学GLP中心, 呼和浩特 010110;3.内蒙古医科大学基础医学院, 呼和浩特 010110)
乳腺癌是全球第2大高发癌,是女性最常见的恶性肿瘤之一,死亡率在全球排第5[1]。三阴性乳腺癌(triple-negative breast cancer,TNBC)(即雌激素受体、孕激素受体和人类表皮生长因子受体2)在诊断初期就合并远处器官转移,患者的存活率仅为23%[2]。TNBC化疗虽有一定的疗效,但并未延长患者的总生存期和无进展生存期[3]。目前TNBC患者的预后差,且没有合适的内分泌治疗和靶向治疗手段[4]。机体可以通过调节免疫功能产生抗肿瘤作用,而肿瘤细胞也可以产生免疫逃逸,通过形成特殊的免疫抑制微环境逃避机体免疫系统的识别和攻击,产生免疫逃逸[5]。文献[6]报道免疫调节治疗TNBC具有相对较好的预后。因此,免疫治疗应用于TNBC已成为国际乳腺癌研究领域的新热点[7]。
肿瘤免疫微环境主要由免疫细胞和免疫细胞因子构成。T淋巴细胞是机体调节免疫反应中最主要的效应细胞,主要包括表达CD4+的辅助性T细胞(helper T cell, Th)及表达CD8+的细胞毒T细胞(cytotoxic T Cell,CTL);Th按功能主要分为Th1和Th2,其中Th1主要分泌IL-2(interleukin-2)、TNF-α(tumor necrosis factor-α)、IFN-γ(interferon-γ)等细胞因子介导细胞免疫应答,而Th2则主要分泌IL-10(interleukin-10)等介导体液免疫应答。在正常机体中,Th1促进组织破坏,为CTL细胞的肿瘤排斥提供帮助;而Th2促进B细胞产生抗体,抑制细胞介导的抗肿瘤反应。Th1和Th2一旦失衡,Th1向Th2型发生漂移,就会导致免疫功能紊乱发生肿瘤[8-9]。研究表明,在乳腺癌患者的体内,Th1通常处于低表达,而Th2型处于高表达状态[8]。因此,需要研究上述免疫细胞及免疫因子在TNBC中的作用,为开发抗TNBC的免疫调节药物提供药理学依据。
山慈菇主要以兰科植物杜鹃兰(Cremastraappendiculata)、独蒜兰(Pleionebulbocodioides)以及云南独蒜兰(PleioneyunnanensisRolfe)的干燥假鳞茎作为基源植物[10]。它们的乙酸乙酯提取物共同的成分主要为:菲及二氢菲类和联苄类化合物[11-12]具有抗肿瘤、抗菌活性、抗病毒活性、抗氧化活性及细胞毒活性等多种生物活性[13]。研究发现山慈菇提取物具有调控巨噬细胞分泌TNF-α的作用[14]。检索TcmSP database发现山慈菇酯提物(cremastra appendiculata,CrAp)成分β-谷甾醇(β-sitosterol)、4-甲氧基菲-2,7-二醇(flavanthrinin)均有抗乳腺癌的作用,原儿茶酸(protocatechuic acid)[15]参与免疫调节反应。现研究CrAp对4T1乳腺癌的作用,4T1源于小鼠TNBC,而人类与小鼠调控乳腺癌的部分基因核苷酸序列具有高度同源性[16]。
1 试验材料与仪器
1.1 试剂及材料
4T1乳腺癌细胞株(中国科学院细胞库);DMEM(Dulbecco’s modified eagle medium)培养基(批号:S118024,Gibco公司);0.25% Trypsin-EDTA(批号:2046777,Gibco公司);FBS(胎牛血清,批号:11G313,ExCell Bio公司);Penicillin-Streptomycin双抗(批号:51H351,ExCell Bio公司);DMSO(二甲基亚砜,批号:1213C0314;北京索莱宝科技有限公司);PBS(磷酸缓冲盐溶液,批号:AC10260538,Hyclone公司);盐酸阿霉素(批号:3181024,北京索莱宝科技有限公司);山慈菇(批号:17122501,内蒙古暮昕药业);ELISA试剂盒:白介素-2(IL-2)(批号:B265707),肿瘤坏死因子-α(TNF-α)(批号:B288663),白介素-10(IL-10)(批号:B299453),干扰素-γ(IFN-γ)(批号:B298549),以上均购自Biolengend公司;ELISA终止液(批号:20170830,北京索莱宝科技有限公司);生理盐水(山东科伦药业有限公司);二甲苯(天津市北联精细化学品开发有限公司);甲醛(天津市风船化学试剂科技有限公司);无水乙醇(天津市永大化学试剂有限公司);乙酸乙酯等均为国产分析纯。
1.2 主要仪器
Leica DM200荧光显微镜(Leica公司);Leica RM2235切片机(Leica公司);Leica EG115021组织包埋机(Leica公司);Leica Auto Stainer XL染色机(Leica公司);Leica ASP200s组织脱水仪(Leica公司);CO2细胞培养箱(Nuair公司);低温高速离心机(Eppendorf公司);恒温水箱(江苏国胜实验仪器厂);倒置显微镜(Olympus公司);涡旋仪(海门其林贝尔仪器制造有限公司);电子数显游标卡尺(银龙岛五金工具有限公司);4 ℃冰箱(海尔);-20 ℃冰箱(中科美菱);EnSpire Multimode Plate Reader酶标仪(PerkinElmer公司)。
1.3 实验动物
BALB/c小鼠,雌性,6~8周龄,体质量(18±2) g,购自北京斯贝福生物技术有限公司,许可证号:SCXK(京)2016-0002。饲养于内蒙古医科大学动物实验中心,SPF级鼠房,饲养温度 18~22 ℃,相对湿度60.0%±10.0%。
1.4 药品及试剂的制备
1.4.1 山慈菇酯提物(CrAp)制备
将4 kg山慈菇以4倍量的无水乙醇回流提取3次,浓缩液1 000 mL。加水,加热挥去乙醇,形成不溶于水的胶体,过滤分离沉淀,用石油醚、乙酸乙酯以及正丁醇萃取3次,取乙酸乙酯萃取部分,冷藏,抽滤,得提取物,将提取物低温烘干,待用[17]。
1.4.2 CrAp 溶液
取125 mg CrAp,加0.1 mL DMSO溶解,加培养基至10 mL,配制成12.5 mg/mL 的母液,过滤,分装,4 ℃保存备用,用于细胞。取960 mg CrAp,加入0.5 mL无水乙醇同时加入0.05 mL 吐温-80助溶,加入适量生理盐水,超声30 min,溶解完全后加入生理盐水定容至10 mL,配制成96 mg/mL 的母液,过滤,用前稀释,4 ℃保存备用(小鼠所用的剂量均为96 mg/kg),用于小鼠。
1.4.3 阿霉素(ADM)溶液
取100 μg ADM标准品,加入1 mL 培养基溶解,配制成100 μg/mL 的母液,过滤,分装,4 ℃保存备用,用于细胞。取2 mg ADM标准品,加入10 mL 生理盐水溶解,配制成0.2 mg/mL 的母液,4 ℃保存备用(小鼠所用剂量均为2 mg/kg)。
2 实验方法
2.1 细胞生长曲线
细胞覆盖率达到培养瓶的80%左右,细胞用0.25%胰酶消化,调整细胞密度1×104个/mL,接种于24孔板中,每孔1 mL,24 h后开始计数,以后每隔24 h计数一次,每次取4孔细胞分别计数,计数结果取4孔平均值,连续计数6 d,绘制细胞生长曲线。
2.2 MTT法检测不同浓度的CrAp在不同时间对4T1乳腺癌细胞的抑制作用
4T1乳腺癌细胞用0.25%胰酶消化,加入培养基制成单细胞悬液,以每孔1×104个4T1细胞接种于96孔板上,每孔100 μL, ADM阳性药组(10 μg/mL)、空白对照组(加入含有细胞的培养基),同时每组设5个复孔。置入37 ℃、5% CO2培养箱中培养24~48 h,细胞贴壁后,吸除原培养液,实验组分别加入终浓度(12 500、1 250、125、12.5、1.25、0.125 μg/mL)的CrAp,阳性药组加入ADM,空白对照组加入100 μL不含药物的培养基。同时使用3块96孔板进行上述步骤,放入37 ℃,5% CO2的恒温细胞培养箱中,分别培养24、48、72 h。每孔加入5 mg/mL MTT溶液10 μL,避光,孵育4 h,小心地吸出每个孔内所有液体,加入150 μL DMSO,继续避光,将96孔板放到振荡摇床上低速震荡10 min,上机检测,在OD490测量各孔的吸光值,抑制率=(对照组OD值-药物组OD值)/对照组OD值×100%,进行计算。
2.3 动物分组和造模
2.3.1 具体步骤
BALB/c小鼠适应性喂养7 d后,进行植瘤。BALB/c小鼠接种肿瘤前用1%戊巴比妥钠生理盐水溶液进行麻醉后,将小鼠采取仰卧置于操作台上,用酒精棉球擦拭,右腋乳腺处皮肤皮下注射1×106个4T1细胞。5~7 d后,待小鼠肿瘤长到2~5 mm后,触摸有不规则的硬块,即代表植瘤成功。
2.3.2 动物分组
植瘤成功的BALB/c小鼠,随机分成5组:空白对照组、模型组、ADM阳性对照组、CrAp组以及CrAp+ADM组,每组各15只。空白对照组及模型组腹腔注射生理盐水,每日一次,CrAp组以96 mg/kg腹腔注射给药,每日一次,阳性对照组以2 mg/kg ADM腹腔注射给药,隔日一次,CrAp+ADM组腹腔注射给予相同剂量的CrAp和ADM,连续给药21 d。
2.4 CrAp体内抗4T1荷瘤小鼠数据的处理
2.4.1 小鼠一般行为观察
观察小鼠活动、毛发及饮食等基本变化。
2.4.2 绘制小鼠体重生长曲线
小鼠体重生长曲线:小鼠适应性喂养7 d,植瘤成功后测量小鼠体重,随机分组后进行给药,每隔7 d测量一次体重,共4次,绘制体重生长曲线。
2.4.3 小鼠在体抑瘤指标,绘制肿瘤生长曲线
小鼠肿瘤生长曲线:造模成功后的小鼠,每隔3 d,用游标卡尺测量瘤体的长径(a)和短径(b),计算肿瘤体积(V),其表达式为V=ab2/2,共7次,绘制肿瘤生长曲线。
2.4.4 小鼠离体抑瘤指标,计算药物抑瘤率
小鼠称重,剥离小鼠肿瘤进行称重,计算抑瘤率。抑瘤率=(模型组平均瘤重-给药组平均瘤重)/模型组平均瘤重×100%。
2.4.5 HE染色观察小鼠癌组织病理学变化
取癌组织于4%多聚甲醛浸泡24 h 固定后,将组织梯度乙醇脱水、二甲苯透明、石蜡包埋、切片、HE染色、中性树胶封片。最后光学显微镜观察癌组织结构的改变并拍照。
2.4.6 ELISA法检测癌组织中相关细胞因子的蛋白表达
取小鼠癌组织,加入预冷的PBS,制成10%组织匀浆,离心3 000 r/min,20 min,取上清液,保存于-20 ℃,按照试剂盒说明书检测组织中 IL-2、TNF-α、IFN-γ及IL-10的蛋白表达水平。在96孔板上加100 μL 稀释过后的一抗,放置在2~8 ℃中过夜。所有实验试剂于室温中放置30 min,稀释标准品,设置不同浓度的标准品孔,并且所有样品设置3个复孔。取出包被后的96孔板,弃掉一抗,洗板4次,每次用300 μL的清洗液,浸泡30 s,吸干,擦干,以下洗板步骤同上。为了减少特异性结合,每孔加入1×样品稀释液,室温孵育1 h。洗板4次,每孔加入100 μL 标准品或样品,适当摇晃,充分混匀,密封,室温孵育2 h。洗板4次,每孔加入100 μL 酶标抗体,密封,室温孵育1 h。洗板4次,每孔加入100 μL稀释后的亲和素-HRP,密封,室温孵育30 min。洗板5次,最后一次清洗时,清洗缓冲液浸泡1 min,可有助于减少背景。加100 μL 配制好的显色剂,避光孵育30 min,板内颜色变为蓝色。每孔加入100 μL终止液,板内溶液由蓝变为黄色。5 min内在酶标仪的450 nm读数测定OD值,根据绘制的标准曲线和样品OD值,计算样品含量。
2.5 TMT蛋白质组学方法检测CrAp对4T1癌组织免疫相关差异蛋白的影响
提取蛋白后,利用蛋白浓度测定试剂盒进行蛋白浓度测定。蛋白溶液中使用二硫苏糖醇、碘代乙酰胺处理后,胰酶酶解,酶解的肽段根据TMT试剂盒操作说明标记肽段。肽段用高pH反向高效液相色谱(high performance liquid chromatography,HPLC)分级,色谱柱为Agilent 300Extend C18(5 μm粒径,4.6 mm 内径,250 mm长)。肽段分级梯度为8%~32%乙腈、pH 9,60 min分离60个组分,随后肽段合并为18个组分,合并后的组分经真空冷冻干燥。肽段用液相色谱流动相A相[0.1% (v/v) 甲酸水溶液]溶解后使用EASY-nLC 1000超高效液相系统进行分离。流动相B为含0.1%甲酸的乙腈溶液,流速维持在500 nL/min。肽段经由超高效液相系统分离后被注入离子源中进行电离后,经Orbitrap Fusion Lumos质谱分析。二级质谱数据使用Maxquant (v1.5.2.8)进行检索。检索参数设置:数据库为Mus_musculus_10090_SP_20191115(17 032条序列),添加了反库以消除计算随机匹配造成的假阳性率(FDR),并且在数据库中加入了常见的污染库,用于消除鉴定结果中污染蛋白的影响;酶切方式设置为Trypsin/P。质谱鉴定到的肽段长度的分布符合质控要求后,分析质谱数据解析,使用MoMo分析Motif;使用Inter ProScan注释GO、Domain;使用Wolfpsort,CELLO亚细胞定位;使用Perl module富集分析。
3 数据处理
4 结果
4.1 不同浓度的CrAp在不同时间对4T1乳腺癌细胞的抑制作用
细胞生长曲线结果显示:0~1 d时,细胞经过短暂的悬浮开始贴壁,细胞出现增殖;1~3 d时,细胞进入指数生长期,细胞开始迅速增殖;在3~4 d时,细胞继续增殖,但增殖趋势已经缓慢;4 d时,细胞到达平顶期,细胞不再增殖;4~6 d时,细胞开始出现凋亡,如图1(a)所示。MTT结果显示,24、48、72 h时,不同浓度的CrAp均有不同程度的抑制率;CrAp抑制率范围为13.48%~74.47%,其中CrAp(125 μg/mL)在72 h抑制作用最强,抑制率为74.47%;与ADM组相比,24、48、72 h时,CrAp(125 μg/mL)抑制率无统计学意义(P>0.05),其余CrAp抑制率明显下降(P<0.01);随着时间增加,CrAp(125、12.5 μg/mL)组抑制作用明显,抑制率无剂量依赖性,如图1(b)所示。

**表示与阿霉素组相比P<0.01
4.2 小鼠一般行为观察
空白组小鼠,毛发发亮,偶见撕咬斗争,采取单独饲养,避免撕咬,进食规律,精神正常,喜爱活动;模型组小鼠,随着天数增加,活动减少,精神状态欠佳,进食进水量明显减少,不喜梳理毛发,毛发欠光泽,并存在掉毛现象;ADM组小鼠,活动欠佳,进食进水量下降,随着天数增加,毛发稀疏干枯,体形消瘦;CrAp组小鼠,活动以及进食进水量正常,随着天数增加,偶见掉毛,但毛发颜色无明显变化;CrAp+ADM组小鼠,进食进水略有减少,较ADM组有所改善,毛发暗淡,偶见梳理毛发。
4.3 小鼠体重变化曲线
小鼠体重结果显示,在给药21 d时,与空白组相比,模型组体重明显降低(P<0.01);与模型组相比,ADM组和CrAp+ADM组小鼠体重均明显降低(P<0.01),但CrAp组小鼠体重明显增加(P<0.01);同时与ADM组相比,CrAp组和CrAp+ADM组小鼠体重均明显增加(P<0.01),如图2所示。
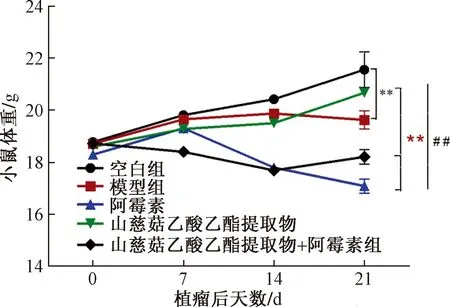
**表示与空白组相比P<0.01;##表示与模型组相比P<0.01;**表示与阿霉素组相比P<0.01
4.4 小鼠肿瘤增长曲线
小鼠肿瘤增长曲线结果显示,在给药21 d时,与模型组相比,各药物组肿瘤体积均明显减小(P<0.01);与ADM组相比,CrAp+ADM组肿瘤体积减小,但CrAp+ADM和CrAp组均无统计学意义(P>0.05),如图3所示。

##表示与模型组相比P<0.01
4.5 小鼠抑瘤率
小鼠抑瘤率结果显示,各药物组对荷瘤小鼠肿瘤均有不同程度的抑制作用,CrAp+ADM组抑瘤作用最强,为53.67%。肿瘤重量结果显示,与模型组相比,各药物组肿瘤重量均明显降低(P<0.01);与ADM组相比,CrAp组和CrAp+ADM组差异均无统计学意义(P>0.05),如图4所示。
4.6 癌组织病理学结果
模型组肿瘤细胞呈椭圆形,细胞核大,细胞形态完好,肿瘤细胞数目较多,坏死区域少见;与模型组比较,ADM组肿瘤细胞数量减少,边缘处有少量未坏死的肿瘤细胞,大部分肿瘤细胞破裂、胞核溶解,坏死区域较大,CrAp组肿瘤细胞数目略有减少,肿瘤细胞密度降低以及存在部分坏死区域,但不及ADM组,CrAp+ADM组肿瘤细胞数目明显减少,肿瘤细胞形态不完全且胞核溶解比例较大,并伴随着较大程度的坏死区域,且各给药组出现明显的免疫细胞浸润(图5)。

图4 小鼠肿瘤大小(体外)和抑瘤率

各组别倍数均为(×200);黑色箭头所指区域为肿瘤细胞坏死区域
4.7 小鼠癌组织中IL-2、TNF-α、IFN-γ和IL-10水平的变化
癌组织结果显示,与模型组相比,各药物组IL-2含量均明显升高(P<0.01),而TNF-α的含量均明显降低(P<0.01),CrAp组和CrAp+ADM组IFN-γ含量明显升高(P<0.01),而IL-10含量明显下降(P<0.01),ADM组IL-10含量下降(P<0.05);同时与ADM组相比,CrAp组IL-2和TNF-α含量明显降低(P<0.01),CrAp+ADM组TNF-α含量明显升高(P<0.01),以及CrAp组和CrAp+ADM组IFN-γ含量明显升高(P<0.01),其余均无统计学意义(P>0.05),如图6所示。

#表示与模型组相比P<0.05;##表示与模型组相比P<0.01;ΔΔ表示与阿霉素组相比P<0.01
4.8 小鼠癌组织中免疫调节相关蛋白的变化
CrAp/CON利用MaxQuant软件在IPI(ipternational protein index)数据库中检索,质谱鉴定有15个上调蛋白,胸腺素β-4一个下调蛋白,其中以1.5倍为差异筛选出与乳腺癌免疫调节功能相关的蛋白质(表1)。Gene Ontology(GO)分析:差异蛋白Ighm、H2bc4、S100a8、S100a9参与免疫系统过程,这些蛋白在细胞内外分布较广;Hist1h3b、S100a8、S100a9参与细胞黏附,Protein S100与免疫调节和凋亡密切相关。上调Histone、Protein S100参与Toll 4受体结合,参与蛋白质-DNA复合物组装、白细胞聚集、白细胞与细胞的黏附、大分子甲基化、染色质组织、肽分泌的调节、细胞大分子复合物组装等生物进程。
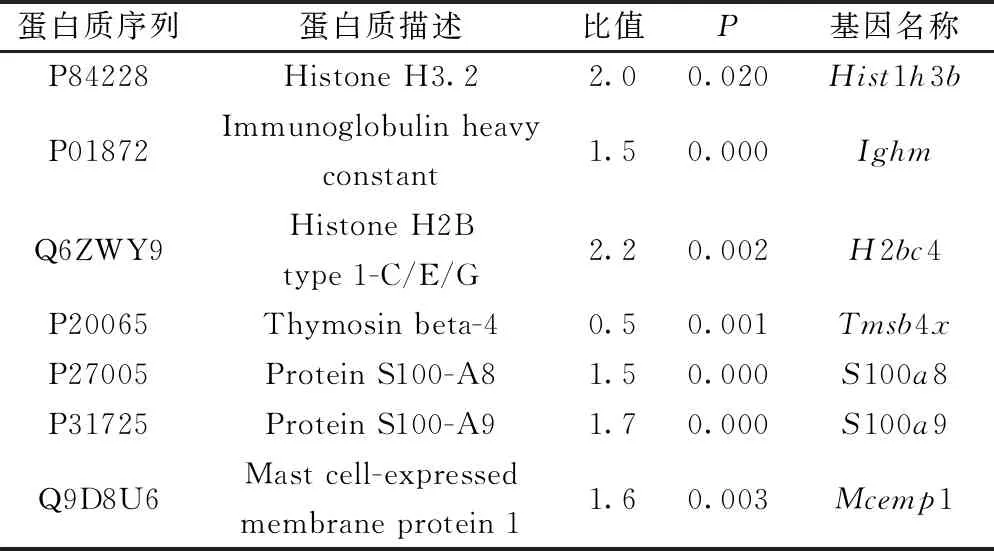
表1 CrAp/CON在4T1乳腺癌中与免疫调节功能相关的差异表达蛋白
5 讨论
ADM作为临床治疗乳腺癌最有效的药物之一,抗菌谱广,应用广泛,参照文献相关给药用量[17-18],结合前期的实验研究,将2 mg/kg的ADM作为实验所用剂量。本课题组也曾将4T1细胞接种于具有完全免疫功能的昆明小鼠,但未成功造模,因此认为免疫功能与4T1乳腺癌的发生发展密切相关。
山慈菇作为传统的中蒙医抗癌药,目前对于山慈菇抗乳腺癌的研究逐渐增多。刘银花等[19]发现不同浓度的山慈菇水提液对鼠源的TNBC细胞4T1增殖均有明显抑制作用。研究表明,山慈菇明显抑制人源TNBC细胞MDA-MB-231以及ER+人乳腺导管癌细胞T-47D的增殖[20-21]。同时不同浓度山慈菇水煎剂均可明显抑制乳腺癌T-47D、MDA-MB-231细胞的迁移[20-21]。杨雪威等[22]进一步证明山慈菇明显降低乳腺癌大鼠血清以及乳腺癌大鼠肿瘤组织血管内皮生长因子(vascular endothelial growth factor, VEGF),细胞基质金属蛋白酶(matrix metalloproteinase-9, MMP-9)的水平,干扰乳腺癌细胞的侵袭及迁移[23]。但是目前对于乳腺癌方面的研究大多以山慈菇水煎剂为主,并且主要停留在体外实验阶段。分析文献还未发现系统研究山慈菇酯提取物抗TNBC的免疫调节作用机制,因而,有必要运用现代药理学研究方法对CrAp进行深入研究,探索其抗4T1乳腺癌的分子机制。
5.1 CrAp体内抗4T1乳腺癌作用
5.1.1 CrAp对4T1乳腺癌细胞的影响
采用四甲基偶氮唑盐微量酶反应比色法(MTT法)检测CrAp对4T1 细胞的增殖毒性的影响,需要在细胞的对数生长期给药才能更准确地反映CrAp的细胞毒作用。生长曲线是测定细胞生长数目以及细胞活力的主要方法,可以有效观察细胞的生长趋势。生长曲线为MTT法加入的细胞浓度提供更好的依据,选择适当的接种浓度可避免浓度太低出现迟缓期,浓度太高过早到达衰退期,研究发现,4T1乳腺癌细胞在24~72 h,进入对数生长期,因此在MTT实验中,选择细胞接种24 h后开始进入实验。MTT法是检测细胞存活和生长最常用的方法之一,利用MTT法研究发现,不同浓度的CrAp在不同时间对4T1乳腺癌细胞的增殖均有不同程度的抑制作用,抑制率范围为13.48%~74.47%。在24、48、72 h时,不同浓度的CrAp均具有抑制4T1乳腺癌细胞增殖的作用,125 μg/mL CrAp的抑制作用最强。
5.1.2 CrAp对4T1乳腺癌荷瘤小鼠的影响
在建立4T1乳腺癌小鼠模型的研究中,小鼠一般行为、体重变化、肿瘤增长、抑瘤率是探讨荷瘤小鼠肿瘤状态最常用的评价方法。研究发现, CrAp在抗乳腺癌的同时,一定程度上改善了荷瘤小鼠的生存状态;CrAp可以改善小鼠的一般行为,进而说明化疗药在杀伤乳腺癌细胞的同时也会损害正常细胞,减弱了免疫系统对肿瘤细胞的识别杀伤能力,导致机体免疫功能下降,而CrAp可以改善上述症状,因而考虑可以中西药联合应用以提高癌症患者机体的免疫力。在绘制肿瘤曲线时,研究发现CrAp可以有效抑制肿瘤的增长。并且CrAp+ADM组抑瘤率比单独应用ADM以及CrAp抑瘤率更高,说明二者联合可以协同抗乳腺癌作用,同时可以有效改善ADM引起的不良反应。
5.1.3 CrAp对4T1乳腺癌荷瘤小鼠癌组织的影响
HE染色是最常用的染色法之一,苏木精染液为碱性,主要使细胞核内的染色质与胞质内的核酸着紫蓝色,伊红为酸性染料,主要使细胞质和细胞外基质中的成分着红色,通过HE染色可以有效观察癌组织形态以及病理学的改变。实验发现CrAp不仅可以抑制4T1乳腺癌细胞的增殖,还可以抑制4T1乳腺癌小鼠肿瘤的增长,增加荷瘤小鼠的体重。
5.2 CrAp对4T1乳腺癌荷瘤小鼠癌组织中免疫因子蛋白水平的影响
IL-2可以刺激T细胞生长、诱导NK细胞,激活淋巴细胞杀伤肿瘤细胞的活性,还可以激活B细胞,协同其他细胞因子(TNF-α、IFN-γ)发挥抗肿瘤作用[24-25]。结果表明,癌组织中,CrAp可以升高IL-2的表达,各药物组均可降低TNF-α的含量。TNF-α主要由单核巨噬细胞和内皮细胞产生,在机体内正常情况下TNF-α具有诱导细胞凋亡、坏死及激活淋巴细胞因子等多种抗肿瘤和抗感染的作用[26]。研究发现,乳腺癌癌旁组织及正常组织中TNF-α表达水平均高于正常人群的乳腺组织,患有肿瘤的患者,肿瘤组织中的淋巴细胞或巨噬细胞被肿瘤激活而高分泌TNF-α,使整个肿瘤高表达TNF-α[27]。激活免疫细胞释放过量的TNF-α可以引发癌组织的局部免疫应激反应,引起患者的免疫系统损伤,同时导致机体免疫调节机制发生紊乱[28-29]。而在乳腺癌微环境中,激活体内的免疫细胞释放TNF-α,引起癌组织局部TNF-α水平上升。考虑在癌组织中,CrAp通过降低肿瘤微环境中TNF-α的表达,参与调控乳腺癌免疫微环境。IFN-γ具有较强的抗病毒、抗肿瘤和免疫调节作用,主要由活化的T细胞和NK细胞产生[30]。研究发现模型组IFN-γ含量较低,这与相关文献提及的4T1乳腺癌造模组的IL-2、IFN-γ的含量较正常组低结果一致[31]。在癌组织CrAp明显升高IFN-γ含量,且在癌组织中CrAp协同ADM增加IFN-γ的表达。说明CrAp可以通过增强IFN-γ的表达产生抗4T1乳腺癌的免疫调节作用。某些诱因使肿瘤浸润淋巴细胞发生Th2失衡后,可产生大量的IL-4,进而促进肿瘤组织产生IL-10[32-33]。IL-10结果显示,CrAp明显降低癌组织中IL-10的含量。提示CrAp通过降低IL-10的含量增强了抗4T1荷瘤小鼠的免疫调节功能。
有研究表明,在乳腺癌动物模型以及人乳腺癌中,乳腺癌的Th2表达升高,Th1表达降低[34-35]。考虑升高Th1含量与降低Th2含量可以增强机体抗乳腺癌的免疫调节功能。而上述这些结果均表明,在癌组织中通过提高IL-2、IFN-γ而降低TNF-α、IL-10免疫因子的表达,发挥了肿瘤微环境中局部免疫调节作用,同时CrAp+ADM组调控上述免疫因子作用比单独应用CrAp和ADM更显著。
5.3 CrAp对4T1乳腺癌免疫微环境中与免疫相关的差异蛋白水平的影响
研究发现CrAp可以降低胸腺素β-4(thymosin β4,Tβ-4),而Tβ-4调节缺氧/复氧经历的癌细胞迁移和转移[36];且Tβ-4通过下调层黏连蛋白-5的表达量调控细胞迁移[37]。Tβ-4可能通过诱导肿瘤血管生成,从而促进肿瘤转移。Tβ4和Tβ10均能促进小鼠乳腺癌细胞的迁移,体内促进小鼠乳腺癌的转移,其促进乳腺癌转移的作用可能与上调MMP2,MMP9,Sdf1(stromal cell-derived factor 1) 和Stat3(signal transducer and activator of transcription 3)mRNA 水平有关[38]。肥大细胞表达膜蛋白1(mast cell-expressed membrane protein 1,MCEMP1)沉默导致VEGF的上调,caspase-3的下调,并增加缺血性卒中大鼠的微血管密度(microvessel density,MVD),说明MCEMP1降低VEGF含量,使caspase-3含量增加[39]。由此可见Tβ-4的下调和MCEMP1的上调可能是CrAp产生抗4T1乳腺癌的机制。S100-A8蛋白与ER表达水平和组织学类型有关,并与乳腺癌淋巴结转移相关[40]。S100A9表达水平在乳腺癌血清和组织中明显升高,在乳腺癌组织中表达明显高于癌旁正常组织,提示CrAp可能促使细胞内钙含量增加。S100A8 和S100A9 均为S100 钙结合蛋白(S100, a member of calcium binding proteins, S100/CaBP)家族成员,研究显示S100A8 和S100A9 在多种肿瘤中高表达[41],在多种肿瘤细胞中,S100A8/A9通过双重机制诱导细胞凋亡[41-42],由此可见S100A8 和S100A9的上调可能是CrAp促进4T1乳腺癌凋亡和产生免疫调节的主要机制。
6 结论
(1)在体外,CrAp能有效抑制4T1乳腺癌细胞的增殖;在体内,CrAp可以抑制4T1荷瘤小鼠癌组织的增长,并且增加荷瘤小鼠的体重。同时CrAp和ADM联合用药可以改善应用ADM的小鼠生存状态,提高小鼠体重以及抑瘤率。
(2)CrAp提高癌组织中IL-2、IFN-γ而降低TNF-α、IL-10免疫因子的表达,发挥了肿瘤微环境中局部免疫调节作用。CrAp作用于癌组织中的差异蛋白功能多与免疫调节过程相关。

