电压门控钠通道的表达与结直肠癌淋巴结转移的关系
吕杨波,邱丹,龚江,徐天生,林水泉
(温州医科大学附属衢州医院/浙江省衢州市人民医院 肛肠外科,浙江 衢州 324000)
结直肠癌(colorectal cancer,CRC)是全球发病率排名第三、病死率排名第二的恶性肿瘤[1]。淋巴结转移是CRC最常见的侵袭方式[2],也是预测和决定患者预后的关键因素[3]。然而,CRC淋巴结转移的关键分子通路尚不明确,这制约了CRC侵袭机制的研究,也限制了针对性的临床治疗。以往的研究证实,淋巴结转移过程复杂,多种离子通道及膜受体蛋白参与其中[4]。
电压门控钠通道(volt age-gated sodium channels,VGSC,Nav)是镶嵌于细胞膜上的大分子蛋白复合物。Nav亚基已被证实在多种癌细胞中异常高表达,并促进癌细胞的迁移和侵袭。如Nav1.7α亚基通过MACC1介导的NHE1上调促进胃癌进展[5]。Nav1.5α亚基的表达与乳腺癌[6]、非小细胞肺癌[7]、卵巢癌[8]、前列腺癌[9]等癌症的侵袭性密切相关,它还通过调节Wnt信号传导、类固醇代谢进程和细胞周期控制蛋白的表达,来促进CRC的转移[10-11]。然而迄今为止,Nav与CRC淋巴结转移的关系尚不明确。本研究对Nav与CRC的淋巴结转移的相关性进行初步探讨,为今后深入研究CRC淋巴结转移机制提供借鉴。
1 材料与方法
1.1 组织标本收集
临床评估无远处转移的首发CRC患者经腹腔镜肠癌根治术后,标本离体第一时间取样,切取肿瘤病灶约0.5 cm×0.5 cm作为肿瘤组织;在距肿瘤边缘5 cm以上肠壁组织(黏膜及黏膜下层)切取0.5 cm×0.5 cm作为癌旁组织进行对照[2],在 2 min内放置入-80 ℃冰箱冷冻。肿瘤根治标本经病理确诊为CRC后,其病例资料录入数据库。所有入组患者均签署样本采集及使用知情同意书,该研究经医院伦理委员会批准,伦理批准号:2019(001)。
1.2 qRT-PCR 检测各Nav 亚型表达水平
标本的qRT-PCR检测方案参考王磊等[12]的工作进行改进。按照说明书中的方法,使用TRIzol试剂(Invitrogen)对100例CRC患者的肿瘤组织和癌旁组织的总RNA进行制备。然后,采用Maxima First Strand cDNA Synthesis Kit(Fermentas,美国)将RNA(1 μg)反转录为cDNA。使用2×Maxima SYBR Green/ROX qPCR Master Mix kit(Fermentas,美国)在ABI 7500荧光定量PCR仪上进行qRT-PCR。所得数据使用2-ΔΔCt相对定量法进行分析。以患者癌旁组织中表达量为参考,分析各Nav亚型表达水平。引物要求:用NCBI primer blast设计,产物长度:100~200 bp,退火温度57~60 ℃。引物序列和相应的基因见表1。

表1 引物序列Table 1 Primer sequences
1.3 HE 染色的免疫组织化学分析
为了确保本研究所切取的肿瘤组织和癌旁组织对照准确无误,在大体病理标本确诊的情况下,课题组随机挑选了3例患者的直肠癌组织和对应的癌旁组织进行HE染色。方案参考唐伟森等[13]的工作进行,肿瘤大体标本经3.7%中性甲醛固定,常规脱水,石蜡包埋,4 μm厚度切片行HE染色。免疫组化步骤如下:石蜡切片脱蜡、水化后PBS冲洗,EDTA高压加热进行抗原修复,HRP阻断剂封闭内源过氧化酶活性。一抗37 ℃孵育1 h,加HRP标记的二抗37 ℃孵育30 min后,清洗3遍。DAB显色液显色约5 min,苏木素复染,脱水,封片,镜检,拍照。
1.4 分组与分析
统计各入组患者的临床病理因素。将CRC肿瘤组织与癌旁组织内各Nav的表达进行对比,以肿瘤组织中表达量与癌旁组织中表达量的比值进行描述,比值2以上为高表达,描述其高表达患者所占比例。根据所有患者肿瘤根治标本中的淋巴结病理结果,按是否存在淋巴结转移分为淋巴结阳性组和淋巴结阴性组,统计两组间各Nav表达的差异,筛选出存在差异的Nav,进行分析。分析Nav的表达与脉管内癌栓及神经累犯的相关性。
1.5 统计学处理
应用SPSS 19.0软件中的t检验及相关性分析中双因素相关的Spearman检验对数据进行分析,P<0.05为差异有统计学差异。
2 结 果
2.1 患者临床病理因素统计
对入组100例患者的临床病理信息进行了统计,患者平均年龄(59.3±11.6)岁;结肠癌67例,直肠癌33例;淋巴结检出数为(21.1±6.4)枚, 淋巴结阳性者占37.0%,患者的阳性淋巴结总数平均为(1.0±1.7)枚。患者其他资料见表2。

表2 CRC 患者的临床病理资料[n(%)]Table 2 The clinicopathologic data of the CRC patients [n (%)]
2.2 CRC 标本的HE 染色分析
对3例患者的直肠癌组织和对应的癌旁组织进行HE染色后可见肿瘤组织内见大量肿瘤细胞及散在坏死灶,癌旁组织内可见排列较规则的腺体细胞及组织(图1)。

图1 HE 染色分析(×100) A-C:肿瘤组织;D-F:癌旁组织Figure 1 HE staining analysis (×100) A–C: Tumor tissue; D–F: Adjacent tissue
2.3 不同Nav 亚型在CRC 临床标本中表达分析
Nav1.1、Nav1.2、Nav1.4、Nav1.5、Nav1.6、Nav1.8、Nav1.9在CRC组织中均高表达(图2A)。特别是Nav1.1、Nav1.5、Nav1.6、Nav1.8的表达量相对于自身的癌旁组织提高了近 8倍(图2A)。并且对Nav高表达的患者进行统计发现,Nav1.4、Nav1.6、Nav1.8高表达患者占患者总数的30%以上(图2B)。

图2 Nav 各亚型mRNA 表达 A:Nav 各亚型mRNA 在癌组织中的相对于癌旁组织的表达量;B:Nav 各亚型高表达患者占比Figure 2 The mRNA expressions of Nav subtypes A: The expression level of each Nav subtype in tumor tissue relative to that in adjacent tissue; B: Proportion of patients with high expression of each Nav subtype
2.4 Nav 表达与CRC 的淋巴结转移及其他侵袭性的关系
分析淋巴结阳性与阴性组中Nav的表达发现,淋巴结阳性组的CRC组织中Nav1.1、Nav1.6表达高于淋巴结阴性组(均P<0.05),而其他的亚型表达差异无统计学意义(均P>0.05)(表3)。脉管侵润和神经累犯与CRC的侵袭性相关,故分析了CRC标本中脉管侵润与各Nav亚型表达之间的关系,统计结果提示,脉管累犯患者的肿瘤组织中Nav1.6高表达(P=0.001),而Nav1.1与其他的亚型表达差异均无统计学意义(均P>0.05)(表4)。
表3 淋巴结阳性与阴性患者的肿瘤组织中各Nav 的表达(±s)Table 3 Expressions of Nav subtypes in tumors tissues of patients with positive and negative lymph nodes (±s)
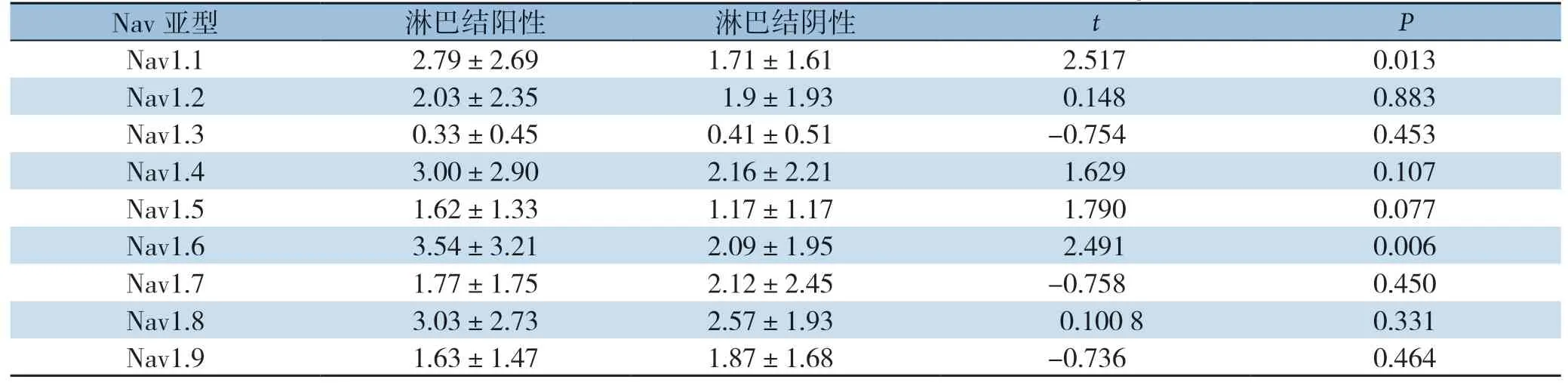
表3 淋巴结阳性与阴性患者的肿瘤组织中各Nav 的表达(±s)Table 3 Expressions of Nav subtypes in tumors tissues of patients with positive and negative lymph nodes (±s)
Nav 亚型 淋巴结阳性 淋巴结阴性 t P Nav1.1 2.79±2.69 1.71±1.61 2.517 0.013 Nav1.2 2.03±2.35 1.9±1.93 0.148 0.883 Nav1.3 0.33±0.45 0.41±0.51 -0.754 0.453 Nav1.4 3.00±2.90 2.16±2.21 1.629 0.107 Nav1.5 1.62±1.33 1.17±1.17 1.790 0.077 Nav1.6 3.54±3.21 2.09±1.95 2.491 0.006 Nav1.7 1.77±1.75 2.12±2.45 -0.758 0.450 Nav1.8 3.03±2.73 2.57±1.93 0.100 8 0.331 Nav1.9 1.63±1.47 1.87±1.68 -0.736 0.464
表4 脉管侵润与无侵润患者的肿瘤组织中各Nav 的表达(±s)Table 4 Expressions of Nav subtypes in tumors tissues of patients with and without vascular infiltration (±s)

表4 脉管侵润与无侵润患者的肿瘤组织中各Nav 的表达(±s)Table 4 Expressions of Nav subtypes in tumors tissues of patients with and without vascular infiltration (±s)
Nav 亚型 脉管侵润 无脉管Nav1.1 2.70±2.90 2.31±1 Nav1.2 1.58±1.38 2.32±2 Nav1.3 0.40±0.51 0.37±0 Nav1.4 2.79±2.84 2.36±2 Nav1.5 1.41±1.38 1.30±1 Nav1.6 3.83±3.15 1.86±1侵润 t P.98 0.791 0.431.48 -1.874 0.064.49 0.232 0.817.25 0.831 0.408.18 0.399 0.691.68 3.639 0.001 Nav1.7 2.60±2.58 1.57±1.85 2.287 0.024 Nav1.8 3.15±2.68 2.50±1.88 1.405 0.163 Nav1.9 1.41±1.30 2.06±1.78 -1.959 0.053
Spearman相关性分析结果提示,Nav1.1、Nav1.6 的表达与淋巴结转移呈明显正相关(r=0.272,P=0.006;r=0.234,P=0.019);Nav 1.6 的表达与脉管累犯相关(r=0.341,P=0.001),而Nav1.1的表达与神经累犯呈正相关(r=0.330,P=0.001)(表5)。
利用免疫组化分别检测了来自5 例患者的阳性淋巴结和阴性淋巴结中Nav1.1及Nav1.6的表达发现,在阳性淋巴结中Nav1.6的表达高于阴性淋巴结(图3A-B),而Nav1.1的表达则变化不明显(图3C-D)。通过统计阳性淋巴结中Nav1.1和Nav1.6阳性着色区域(棕黄色区域)的平均光密度发现,阳性淋巴结中Nav1.6的表达明显高于Nav1.1(P<0.05)(图3E)。

表5 肿瘤组织中Nav1.1 及Nav1.6 的表达与淋巴结转移及侵袭性的相关性Table 5 Correlations of Nav1.1 and Nav1.6 in tumor tissue with lymph node metastasis and invasiveness

图3 免疫组化分析Nav1.1 及Nav1.6 在淋巴结中的表达(×400) A:Nav1.6 在阴性淋巴结中低表达;B:Nav1.6 在阳性淋巴结中高表达;C-D:Nav1.1 在阳性淋巴结和阴性淋巴结中均低表达;E:阳性淋巴结中Nav1.1 和Nav1.6 阳性着色区域(棕黄色区域)的平均光密度比较统计(n=5)Figure 3 Immunohistochemical staining for Nav1.1 and Nav1.6 expressions in the lymph nodes A: Low Nav1.6 expression in negative lymph node; B: High Nav1.6 expression in positive lymph node; C–D: Low Nav1.1 expressions in both positive and negative lymph nodes; E:Comparison of the average optical densities of positive staining regions (brown-staining areas) of Nav1.1 and Nav1.6 in the positive lymph nodes (n=5)
3 讨 论
淋巴结转移是CRC发生最早也是最常见的侵袭方式,是影响预后的关键因素。临床统计研究发现无淋巴结转移(同时无远处转移)的患者,术后5年生存率可以达到80%以上;而伴发淋巴结转移的患者(同时无远处转移)术后5年生存率下降到55%左右[14-15]。目前针对CRC的VEGFR血管生成抑制剂、抗EGFR受体靶向药已经广泛应用于临床,而肠癌淋巴结转移的机制尚未明确,更加没有对应的药物。现有的淋巴细胞标记物如VEGFR3是在淋巴管内皮细胞上表达比较特异的受体,但是在内分泌器官中的有孔毛细血管以及单核细胞、巨核细胞上均有表达,其作为肿瘤淋巴转移标记物的特异性不足[16]。寻找更高特异性的淋巴管内皮标记物将是阐明CRC淋巴结转移机制的关键目标。
恶性肿瘤的淋巴结转移过程包含了复杂的分子机制,随着肿瘤组织在原发灶的恶性增生,部分具有高侵袭力的肿瘤细胞从原发病灶脱离,进入周围基质中,进一步穿过淋巴管壁进入淋巴系统,进入区域淋巴结的边缘窦,形成淋巴结转移灶[3-4]。多种蛋白溶酶、细胞因子、离子通道及膜受体蛋白参与了这个进程。电压门控钠通道由一个形成孔道的α亚基与一个或多个相关联较小的β亚基组成。前期研究表明,多种Nav α亚基的异常表达与肿瘤的侵袭和转移密切相关,但Nav过表达与肿瘤淋巴结转移之间的关系仍不清楚[17]。本研究发现Nav1.1、Nav1.2、Nav1.4、Nav1.5、Nav1.6、Nav1.8、Nav1.9在CRC组织中均高表达,并且先前有报道[10]Nav1.5 α亚基是控制CRC细胞侵袭的基因转录调控网络的关键调节因子。尽管如此,Nav1.5主要表达于心肌细胞,是多个心脏疾病的潜在靶标[18],作为CRC进展的标记物进行深入研究和开发将有诸多掣肘。
研究[19]表明Nav1.6 在中枢神经和外周神经中广泛表达,也见于表皮游离神经末端和肠道黏膜。Nav 1.6 的突变与多种神经系统疾病相关,如癫痫、神经病理性疼痛等[19]。近年的研究[17,20]发现Nav1.6在乳腺癌、宫颈癌、非小细胞肺癌、卵巢癌、前列腺癌等多种实体瘤中均有表达。Nav1.6的过表达可促进宫颈癌的转移和侵袭,采用Nav1.6抑制剂特异性阻断宫颈癌细胞中Nav1.6电流后可降低其细胞侵袭性[21]。这些结果表明,Nav1.6的表达和功能异常能促进肿瘤的转移。本研究通过分析高表达的Nav与CRC淋巴结转移相关性发现,仅有Nav1.1,Nav1.6的高表达与患者的淋巴结转移呈正相关,提示了这两者可能参与了CRC的淋巴结转移。
脉管累犯是肿瘤侵袭转移的第一步,预示着淋巴结转移或远处转移的风险增加。本结果提示,Nav1.6在CRC组织中的高表达与肿瘤的脉管累犯呈现正相关。而Nav1.1则只和神经累犯呈现正相关。Nav1.1主要表达于神经组织,然而近年来的研究发现Nav1.1也表达于外周感觉神经[22]。这个结果提示Nav1.1可能参与CRC的神经累犯,其具体机制尚需深入研究。免疫组化结果显示,在阳性淋巴结中Nav1.6呈现高表达。这个结果提示进入淋巴结的肿瘤细胞可能主要是Nav1.6阳性的肿瘤细胞,Nav1.6阳性的肿瘤细胞可能具有更强的转移性。这些结果提示,Nav1.6可能参与了CRC细胞由病灶向周围基质侵犯,并通过脉管向淋巴结转移的过程。但是其关键分子机制尚不明确,需要进一步研究。
总而言之,本研究考察了不同Nav亚型在CRC中的表达情况,分析了各Nav亚型的表达与CRC淋巴结转移之间的相关性,并发现了Nav 1.1 及Nav1.6的过表达与CRC的淋巴结转移密切相关,期以为探讨以电压门控钠通道作为新CRC淋巴结转移诊断分子标记物提供理论借鉴。

