PD-1/PD-L1免疫检查点抑制剂对右心室功能的影响
余 琳,许爱青,胡海龙,王海涛,刘 彤,李广平,富华颖*
1. 天津医科大学第二医院心脏科,天津市心血管病离子与分子机能重点实验室,天津心脏病学研究所,天津 300211 2. 天津医科大学第二医院泌尿外科,天津 300211 3. 天津医科大学第二医院肿瘤科,天津 300211
随着免疫治疗的发展,肿瘤患者的预后获得明显改善。自2006年第1个PD-1/PD-L1免疫检查点抑制剂(immune checkpoint inhibitor, ICI; 纳武单抗)被用于癌症治疗开始,多种PD-1/PD-L1抑制剂逐渐被应用于非小细胞肺癌、宫颈癌、乳腺癌、肾癌、尿路上皮癌、食管癌、胃癌、子宫内膜癌、结直肠癌、头颈癌和霍奇金淋巴瘤等肿瘤的治疗[1-4]。然而,伴随ICIs应用或联合应用出现的心脏损害不容忽视。
PD-1/PD-L1抑制剂的心脏毒性可表现为心肌炎、心力衰竭、心脏传导阻滞、心肌纤维化和急性冠状动脉(冠脉)综合征等[5-6]。因此,心脏功能的早期检测十分重要。但由于解剖结构复杂[7],目前右心室的检查手段效果不佳,且针对右心室功能变化及预后的研究较少。因此,本研究应用超声心动图及二维斑点追踪技术对PD-1/PD-L1抑制剂所致右心室功能的改变进行探索。
1 资料与方法
1.1 一般资料 选择2018年6月至2020年11月天津医科大学第二医院泌尿外科和肿瘤科收住的从未使用过ICIs且进一步需要ICIs治疗的肿瘤患者46例。记录患者基线特征和临床病史,在基线(治疗前),给药后21 d(T1)、42 d(T2)、63 d(T3)、84 d(T4)、105 d(T5)、126 d(T6)进行经胸超声心动图检查。本研究已在中国临床试验注册中心注册(ChiCTR18000162216)。本研究通过天津医科大学第二医院伦理委员会批准(KY2018K090);所有患者均知情并签署知情同意书。
纳入标准:年龄18~90岁;恶性肿瘤经我院组织病理检查证实,首次诊断为恶性肿瘤;预期存活时间6个月以上;无免疫治疗史;血常规、肝肾功能均在正常范围;有良好的依从性;自愿参与研究。排除标准:心力衰竭、心肌梗死、持续性心房颤动、心肌炎、严重瓣膜病等严重心脏病患者;孕妇和哺乳期妇女;超声心动图图像质量较差,无法获得清晰图像者。
1.2 经胸超声心动图检查 患者左侧卧位,应用Philips IE33超声心动图仪,配备X5-1(2.5~3.5 MHz)探头检查。在以下标准视图中记录图像:胸骨旁左心室长轴切面、胸骨旁短轴切面、心尖四腔切面、心尖三腔切面、心尖两腔切面。每个切面记录5个心动周期,图像以DICOM格式数字化存储,在QLab 10.8工作站离线分析。由超声心动图医师在不知情情况下测量基线及6次随访的超声检查数据,统计时纳入随访期内的最大变化值作为治疗后数据。
1.2.1 二维超声心动图常规参数 在胸骨旁长轴切面测量右心室前壁厚度(diastolic thickness of the right ventricular anterior wall,RVaw)、右心室舒张末期内径(right ventricular end-diastolic diameter,RVEDD)、左心房内径(left atrial diameter,LAD)、左心室收缩末期内径(left ventricular end-systolic diameter,LVESD)、左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)。在心尖四腔切面,测量右心室基底径(basal right ventricular diameter,RVD-B)、右心室中段径(middle right ventricular diameter,RVD-M)、右心室长径(long diameter of right ventricular,RVD-L)。通过左心室舒张末期面积(left ventricular end-diastolic area,LVEDA)及收缩末期面积(left ventricular end-systolic area,LVESA)计算左心室射血分数(left ventricular ejection fraction,LVEF),LVEF=(LVEDA-LVESA)/LVEDA×100%。通过右心室面积的最大值和最小值计算右心室面积变化(RV FAC),RV FAC=(RVAmax-RVAmin)/RVAmax×100%。同时测量三尖瓣环平面收缩期位移(tricuspid annular plane systolic excursion,TAPSE;图1A)。根据肺动脉频谱加速时间(acceleration time,AT)计算肺动脉平均压(mean pulmonary artery pressure,mPAP),mPAP=79-0.45×AT。
1.2.2 二维斑点追踪成像参数 使用QLab 10.8工作站离线分析图像,选择心尖四腔切面CMQ模式(图1B)。自动追踪心内膜边界,识别感兴趣区域。右心室分为7个心肌节段,以收缩期末平均纵向应变计算右心室整体纵向应变(global longitudinal strain of right ventricular,RV GLS)及右心室游离壁纵向应变(free wall longitudinal strain of right ventricular,RV FWLS)。在胸骨旁短轴切面视图上测量右心室流出道纵向应变(longitudinal strain of right ventricular outflow tract,RVOT LS)。测量应变时注意完整覆盖各节段。
1.3 心脏不良事件定义 心脏不良事件定义为LVEF降低超过10%且低于53%,或降低超过5%伴心衰症状,或肌钙蛋白I水平超过正常上限,或出现心血管死亡、心源性休克及心脏骤停。

2结 果
2.1 基线情况 46例患者中,男性33例,女性13例,年龄24~85岁,平均(62.06±11.91)岁。既往高血压病史15例,既往糖尿病史10例,既往心血管疾病史3例(分别为陈旧性心肌梗死、阵发性心房颤动、既往有室性心动过速病史且携带ICD),吸烟史18例。46例患者中最常见的PDI/PD-L1抑制剂使用指征为泌尿系统恶性肿瘤及肺癌,占89%。
2.2 治疗前后常规超声心动图参数比较 结果(表1)显示:与治疗前相比,治疗后RVD-B、RVD-M、RVEDD、mPAP、LVEDD及LVESD较基线水平明显增大(P<0.05),RVaw、RV FAC、LVEF较基线水平减小(P<0.05),但治疗前后均在正常范围内;治疗后LAD及RVD-L无明显变化。与治疗前相比,治疗后TAPSE较基线水平明显缩短[(15.15±3.42) mmvs(18.56±5.69) mm,P=0.000 1];治疗后TAPSE的变化多发生于T1~2期,占84%。
2.3 治疗前后右心室纵向应变参数的比较 结果(表1,图2)显示:与治疗前相比,治疗后RV GLS [(-15.76±3.27)%vs(-18.43±4.75)%,P=0.003 0]、RV FWLS [(-21.48±5.66)%vs(-25.72±6.71)%,P=0.002 0]和RVOT LS [(-11.83±3.74)%vs(-15.18±5.60)%,P=0.000 1]较基线水平明显减小,减小多发生于T1~2期,分别占62%、60%及70%。治疗后RV GLS及RVOT LS治疗后低于正常值,而RV FWLS治疗前后均在正常范围内。
2.4 预后生存分析 46例患者的随访时间均达到6个月,随访期间死亡4例;出现心脏不良事件5例,包括LVEF下降超过10%且低于53% 3例、肌钙水平Ⅰ升高超过正常上限1例、出现心力衰竭2例;出现间质性肺炎4例。
生存分析结果(图3A~3C)显示:RV GLS、RV FWLS减小及TAPSE缩短患者的死亡率更高,但差异无统计学意义。未出现联合终点事件(死亡联合心脏毒性事件)患者的累计生存函数分析结果(图3D~3F)显示:早期(T4前)RV GLS、RV FWLS减小及TAPSE缩短患者出现联合终点事件的概率更低,晚期(T4后)RV GLS、RV FWLS减小及TAPSE缩短患者出现联合终点事件的概率更高,但差异无统计学意义,说明RV GLS、RV FWLS减小及TAPSE缩短可能影响患者的远期预后。
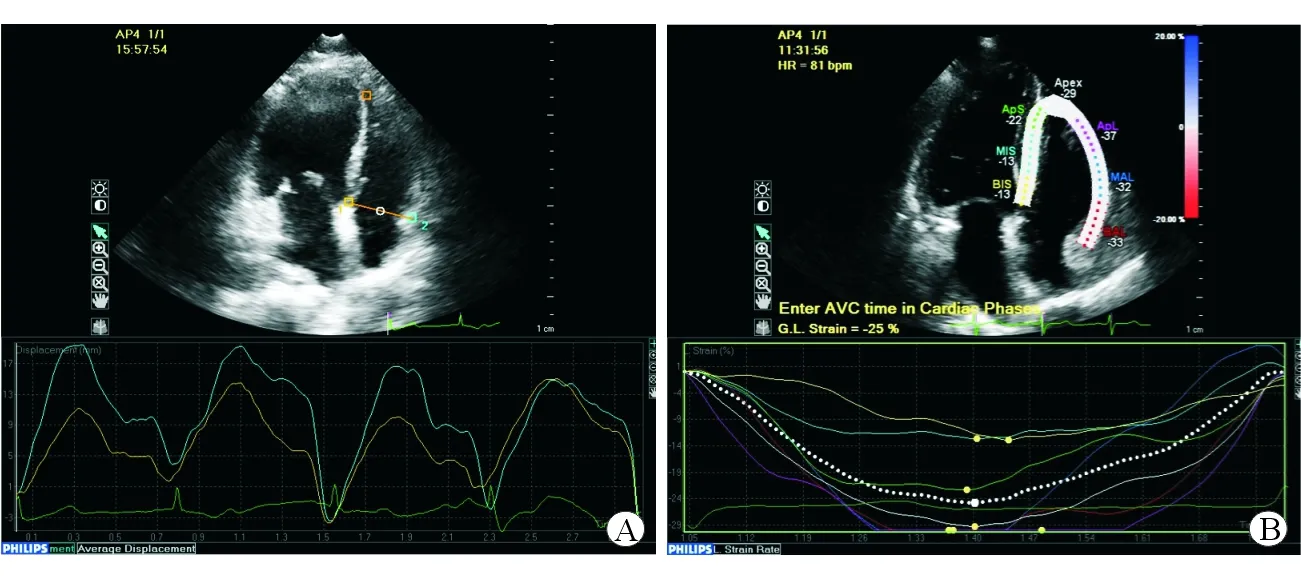
图1 三尖瓣环平面收缩期位移(A)及右心室整体纵向应变(B)测量示意图

表1 肿瘤患者ICIs治疗前后的超声心动图参数比较
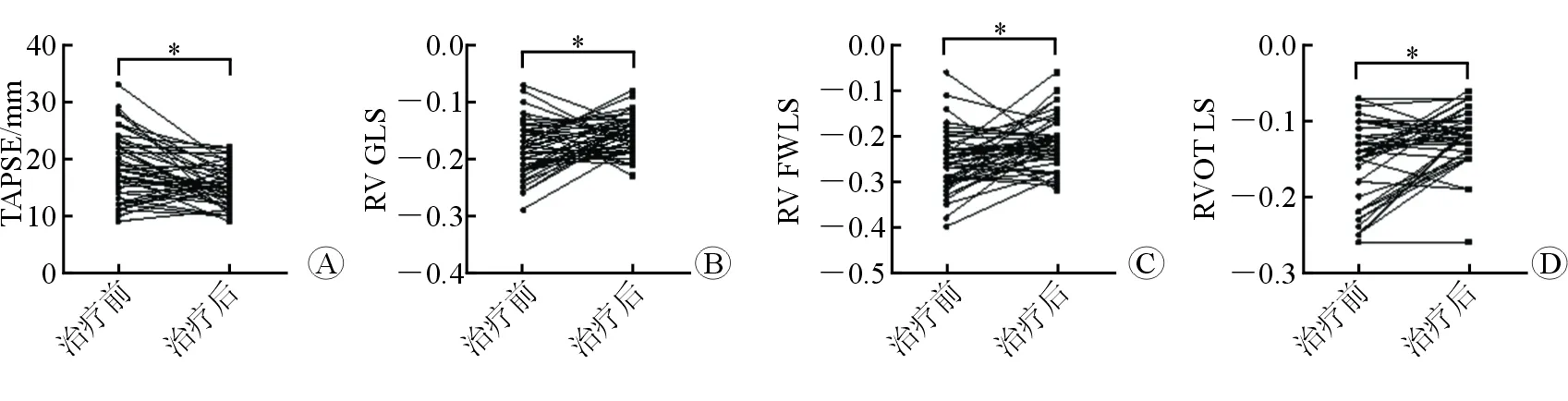
图2 ICIs治疗后TAPSE、RV GLS、RV FWLS及RVOT LS的变化
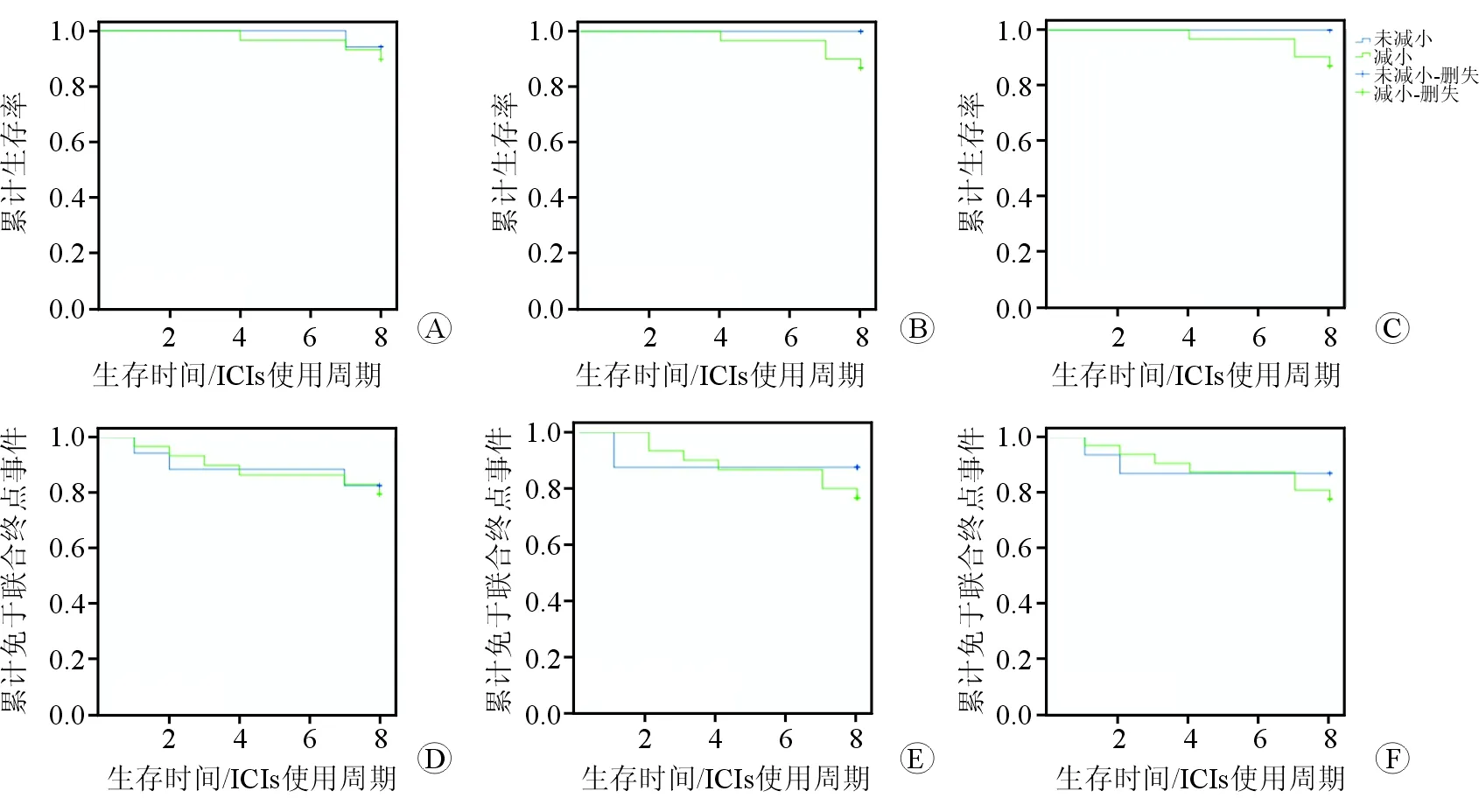
图3 肿瘤患者的预后生存Kaplan-Meier曲线
3 讨 论
3.1 PD-1/PD-L1抑制剂相关心肌损伤 PD-1/PD-L1抑制剂可控制肿瘤微环境、肿瘤特异性免疫反应和肿瘤微环境中的能量代谢[6],通过阻断免疫逃避信号诱导机体产生抗肿瘤反应[3],但其所致心脏毒性的相关机制尚未阐明。目前推测PD-1/PD-L1途径具有心脏保护作用,而PD-1/PD-L1抑制剂破坏心脏的免疫耐受,可能涉及细胞毒性T细胞的过度激活和细胞毒性T细胞对心血管组织的浸润[8-9]。多篇文献[1,6,10-12]指出,PD-1/PD-L1缺乏或基因敲除的小鼠有心肌损伤倾向,甚至出现致命性心肌炎或严重的自身免疫性扩张型心肌病,提示PD-1/PD-L1对心肌具有保护作用。故使用PD-1/PD-L1抑制剂进行抗肿瘤治疗时,应重视其潜在的心肌损伤作用。
3.2 右心室功能评估 右心室功能评估已被证明对心力衰竭、肺动脉高压、肺动脉栓塞、右心室心肌梗死和成人先天性心脏病等多种疾病具有重要的治疗参考和预后预测意义[13-15]。但由于右心室的几何形状复杂和心肌壁薄,且右心室功能呈容量依赖性,定量评估具有挑战性[13,16]。超声心动图相关技术的不断进步为右心室功能的评估提供了便利。
3.2.1 TAPSE TAPSE是美国超声心动图协会(American Society of Echocardiography,ASE)及欧洲心脏病学会(European Society of Cardiology,ESC)等指出的用以评价右心室收缩功能的常用参考指标[17-18]。其反映三尖瓣环外侧部分朝向心尖部的收缩运动程度,是评价右心室收缩功能的有效指标,具有识别癌症患者右心室收缩功能微小变化的能力[19],且与放射性同位素等测量的右心室整体收缩功能指标具有较好的相关性。ASE指南指出TAPSE<16 mm提示右心室收缩功能不全[18],而最新的英国超声心动图学会(British Society of Echocardiography,BSE)指南及多篇文献将右心室收缩功能不全的TAPSE放宽为小于17 mm[20-21]。本研究显示,治疗后TAPSE较基线水平明显缩短,缩短多发生于T1~2期;生存分析提示TAPSE缩短的患者死亡率可能更高,而联合终点事件累计生存函数分析提示TAPSE缩短可能影响患者的远期预后。DINI等[22]一项关于右心室功能的研究指出,与TAPSE持续异常的患者相比,表现出TAPSE缩短可逆性患者的存活率与右心室功能保留患者相似,印证了TAPSE对于右心室功能评估的重要性。
3.2.2 RV FAC RV FAC是ASE指南中提出的另一项右心室收缩功能评估指标,表示右心室舒张末期和收缩末期面积比值的变化[17]。ASE指南及多篇文献指出RV FAC<35%提示右心室收缩功能不全[18,20]。有研究[18]表明,RV FAC是肺栓塞及心肌梗死后患者并发心衰、猝死、卒中等不良事件及死亡率的独立预测因子;对于使用ICIs抗肿瘤治疗的患者,其对心脏相关不良事件具有一定预测价值。本研究结果显示,肿瘤患者接受免疫治疗后,RV FAC较基线值有所减小,但仍在正常范围内,考虑与随访时间较短相关,且右心室解剖复杂、形态不一,不排除不同角度切面测量的右心室面积变化较大可能。
3.2.3 纵向应变 文献[23-24]提示,RV GLS、RV FWLS及RVOT LS的截断值分别为-17.3%、-19.5%及-14.0%。在病理情况下,右心室重塑时,在出现压力超负荷后扩张,进而限制了左心室充盈,损害了左心室Frank-Starling机制,导致其每搏输出量减少[25],造成严重的心脏功能损害,故早期识别右心室损害有助于改善肿瘤患者的整体心功能。ESC认为GLS可用于识别亚临床左心室心脏毒性,比传统的超声心动图参数更敏感。有文献[20]指出,RV GLS损害几乎与左心室GLS损害同时发生,并且被Keramida等[26]一项关于曲妥珠单抗治疗乳腺癌效果的研究证实。肿瘤患者的RV GLS是唯一具有一致和同质性的收缩功能评估指标[19],故RV GLS对于肿瘤患者早期右心室功能评估及预后评估十分重要。本研究结果显示,ICIs治疗后RV GLS和RVOT LS较基线水平下调明显,并且小于正常值,减小多发生于T1~2期;同时生存分析预测提示,RV GLS减小患者的死亡率更高,说明RV GLS是反映右心室功能早期改变的良好指标。
右心室功能取决于前后负荷、收缩力、心包约束及与左心室的相互作用等多种因素,这些因素受多种机制和病理生理条件的影响,当其中一个因素变化时,右心室的功能将进行代偿[25]。右心室对后负荷的变化十分敏感,即使在前负荷正常的情况下,肺动脉压的异常轻微变化也会损害右心室和整体心脏功能[27]。RV FWLS是评估肺高压患者右心室功能的首选方法[28]。本研究结果显示,ICIs治疗早期RV FWLS已减小,虽然治疗前后均在正常范围内,但预测的患者死亡率较未减小者有升高趋势,且联合终点事件累计生存函数分析提示RV FWLS减小可能对患者的远期预后产生影响。
本研究结果显示,与治疗前相比,治疗后RV GLS、RVOT LS减小,TAPSE缩短,且不在正常范围内,以右心室应变变化更为显著。右心室与左心室共用室间隔,室间隔受左心功能影响较大,因此RV FWLS较RV GLS更能反映右心室收缩功能变化。但本研究中治疗后RV GLS的变化,可能提示ICIs免疫治疗对心肌产生了弥漫性损伤,而不仅局限于对右心室产生损伤。
综上所述,肿瘤患者采用PD-1/PD-L1抑制剂治疗后右心室功能下降,多出现于治疗后21~42 d;应用TAPSE及二维斑点追踪技术可较早发现亚临床右心室心肌毒性。本研究存在一定局限性:随访时间较短、患者数量相对较少。因此,这些发现需要多中心、大样本量研究来加以验证。

