甲基化改性ZrO2-SiO2材料的制备及其对罗丹明B的吸附性能
杨 靖,杨熙东,2,贾德宝,邹高菊
(1.西安工程大学 城市规划与市政工程学院,陕西 西安 710048;2.绍兴市柯桥区西纺纺织产业创新研究院,浙江 绍兴 312030)
0 引 言
罗丹明B(RhB)是一种价格低廉、着色率高的碱性染料,广泛应用于纺织、塑料、皮革、染料、造纸和印刷行业[1]。含RhB染料的废水表现出高毒性和致癌性,且难被生物降解[2]。因此,开发高效的染料废水处理技术迫在眉睫。目前染料废水处理技术有物理、生物和化学处理方法[3]。其中,物理吸附法由于操作简便、低成本、高效率和对各种染料的可用性成为最有竞争力的处理方法[4]。
SiO2具有较大的比表面积、低密度和良好的热稳定性,被广泛应用于催化、吸附、分离、绝热等领域的载体材料[5-6];而ZrO2表面活性位点多、具有大孔径和较高的化学稳定性[7],所以将ZrO2与SiO2进行复合,使得ZrO2-SiO2复合材料拥有更多、更优异的物理化学性质[8-9]。赵俊川等以正硅酸乙酯(TEOS)为原料制备了1种ZrO2-SiO2气凝胶,对铈的吸附容量达211.56 mg·g-1[10]。PADOVINI等以TEOS为硅源合成了1种ZrO2-SiO2纳米材料,发现对RhB有很好的吸附能力[11]。尽管ZrO2-SiO2复合材料已被用于吸附染料,但都是以TEOS为硅源的亲水性ZrO2-SiO2复合材料,而对甲基化改性ZrO2-SiO2复合材料吸附染料的相关内容却鲜有报道。因此,本文以甲基三乙氧基硅烷(MTES)为疏水改性剂,TEOS作为硅前驱体,采用溶胶-凝胶法制备甲基化改性ZrO2-SiO2复合材料,在复合材料中引入疏水性基团(—CH3),分析其在不同影响因素下对RhB的吸附性能和吸附机理。
1 实 验
1.1 试剂与仪器
1.1.1 试剂 正硅酸乙酯(TEOS,天津市科密欧化学试剂有限公司);甲基三乙氧基硅烷(MTES,杭州硅宝化工有限公司);五水硝酸锆(Zr(NO3)4·5H2O,天津市福晨化学试剂厂);硝酸(HNO3,四川西陇试剂有限公司);草酸(C2H2O4·2H2O,天津市河东区红岩试剂厂);无水乙醇(ETOH,天津市科密欧化学试剂有限公司);丙三醇(C3H8O3,天津市科密欧化学试剂有限公司);以上试剂均为分析纯。去离子水(实验室自制)。
1.1.2 仪器 红外光谱分析仪(Nicolet 5700,美国Thermo Electron公司);X射线衍射仪(Rigaku D/max2200pc,日本理学公司生产);物理吸附分析仪(AS AS 2020 Plus,美国Micromeritics公司生产);扫描电镜(SEM)发射扫描电子显微镜(JSM-6700F,日本电子公司);紫外可见分光光度计(日本Jasco公司)。
1.2 ZrO2-MSiO2复合溶胶制备
1.2.1 MSiO2溶胶 按物质的量之比TEOS∶MTES∶ETOH∶H2O∶HNO3=1.0∶0.8∶8.0∶0.72∶0.085,将一定量的TEOS、MTES和ETOH加入三口烧瓶,在冰水浴中强烈搅拌50 min,使其充分混合,在强烈搅拌下加入去离子水和HNO3的混合物,将混合液升温至60 ℃,搅拌回流3 h,冷却至室温得到甲基化改性SiO2(即MSiO2)溶胶。
1.2.2 ZrO2溶胶 将0.6 mol/L硝酸锆溶液加入三口烧瓶,按照硝酸锆/草酸(C2H2O4·2H2O)=4.5∶1的物质的量之比,将0.2 mol/L的草酸溶液逐滴加入硝酸锆溶液中,待水浴温度升至50 ℃,逐滴加入体积分数为30%的丙三醇,并强烈搅拌3 h,冷却至室温得到澄清透明的ZrO2溶胶。
1.2.3 ZrO2-MSiO2复合溶胶的制备 按Zr/TEOS物质的量之比NZr=0.15,将上述制备好的ZrO2溶胶逐滴加入MSiO2溶胶中,25 ℃下搅拌1 h,得到ZrO2-MSiO2复合溶胶。
1.3 ZrO2-MSiO2复合材料
将制备好的ZrO2-MSiO2复合溶胶倒入培养皿中,在50 ℃下真空干燥获得其凝胶材料,用玛瑙研钵将凝胶材料研磨成粉末,然后在氮气气氛下以1 ℃/min的升温速率,400 ℃下煅烧2 h,自然冷却至室温即得ZrO2-MSiO2复合材料。
1.4 测试表征
将ZrO2-MSiO2粉末焙烧后的红外光谱采用红外光谱分析仪测试,KBr压片法,波长测试范围为400~4 000 cm-1;XRD采用X射线衍射仪测试,CuKα靶,扫描范围4°~100°,扫描速度8(°)/min;N2吸附-脱附等温线和孔体积采用物理吸附分析仪测试;扫描电镜(SEM)采用场发射扫描电子显微镜测试;RhB溶液的吸光度采用紫外可见分光光度计测试,最大吸收波长λmax= 554 nm。
1.5 吸附实验
ZrO2-MSiO2复合材料对RhB的吸附实验是分批进行的,研究其最佳吸附条件。将0.05 g ZrO2-MSiO2复合材料分散在10 mL不同质量浓度的RhB溶液中,在一定温度下振荡,反应一段时间后离心分离,取上清液在554 nm波长下测量吸光度,用标准曲线法测定RhB的质量浓度C(mg·L-1)。吸附量q(mg·g-1)和去除率η(%),按照式(1)、(2)计算:
(1)
(2)
式中:C0为RhB的初始质量浓度,mg·L-1;Ct为t时刻的RhB质量浓度,mg·L-1;V为溶液的体积,L;M为ZrO2-MSiO2材料的质量,g。
2 结果与讨论
2.1 材料表征
2.1.1 红外光谱 图1为RhB(a)、ZrO2-MSiO2复合材料(b)和吸附RhB后ZrO2-MSiO2复合材料(c)的红外光谱图。图1中的b和c在3 488 cm-1处的吸收峰归属于吸收水引起的—OH基团的拉伸和弯曲振动;1 630 cm-1处的吸收峰是由于Zr—OH或Si—OH引起的—OH基团的拉伸振动[12];2 975 cm-1和1 272 cm-1处的吸收峰分别归属于—CH3和Si—CH3基团,表明在ZrO2-MSiO2复合材料中成功引入了疏水基团(—CH3);448 cm-1附近的峰是Zr—O键的拉伸振动产生的[13];1 110 cm-1处的吸收峰归属于Si—O—Si弯曲和拉伸振动,其中Zr取代了Si—O—Si的部分Si形成了Si—O—Zr键,Si—O—Si键受Zr的扰动导致波数从高偏移至1 110 cm-1处,表明SiO2与ZrO2颗粒化学键合[11]。此外,图1中a红外光谱在602~713 cm-1处的吸收峰出现在c的红外光谱中,证明了RhB被ZrO2-MSiO2复合材料吸附。
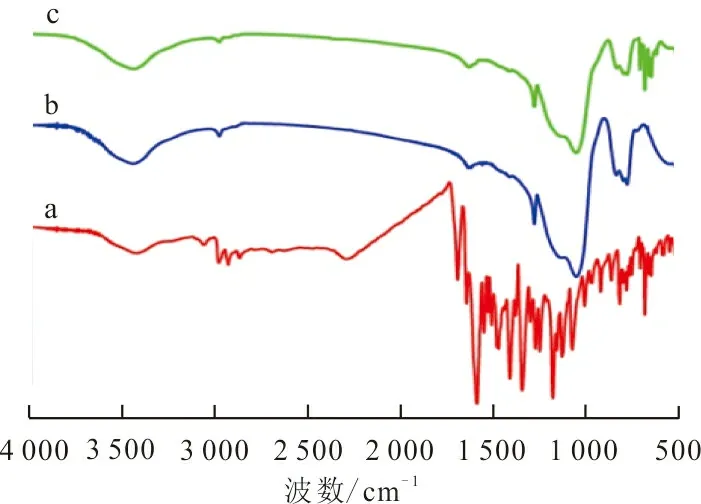
图1 ZrO2-MSiO2材料吸附RhB的红外光谱Fig.1 FTIR spectra of RhB adsorbed on ZrO2-MSiO2 materials
2.1.2 XRD 对ZrO2-MSiO2样品进行XRD测试,结果如图2所示。
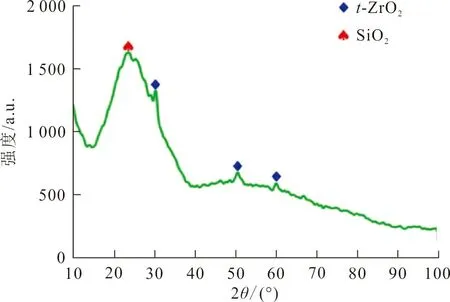
图2 ZrO2-MSiO2样品XRD谱图Fig.2 XRD patterns of ZrO2-MSiO2 materials
图2中,2θ=23.1°附近的宽峰对应于无定形SiO2[14],而2θ=30.2°、50.7°和60.2°处的衍射峰分别对应四方晶型t-ZrO2(JCPDS No.79-1771)的(202)、(112)和(101)晶面,说明在该复合材料中形成了SiO2和ZrO2的相关结构。
2.1.3 孔结构 图3为ZrO2-MSiO2复合材料的N2吸附-脱附曲线和孔径分布图。从图3可以看出,ZrO2-MSiO2材料的N2吸附曲线为BDDT分类的Ⅳ型等温线,相对压力在0.4~1.0范围内存在滞后环,吸附等温线呈上升趋势,因为毛细凝聚造成的吸附和脱附过程的等温线不重合,说明微孔和介孔同时存在。ZrO2-MSiO2材料孔径分布在0~5 nm之间,平均孔径为2.19 nm,其比表面积为616.77 m2·g-1,较大的比表面积有利于对染料分子的吸附。
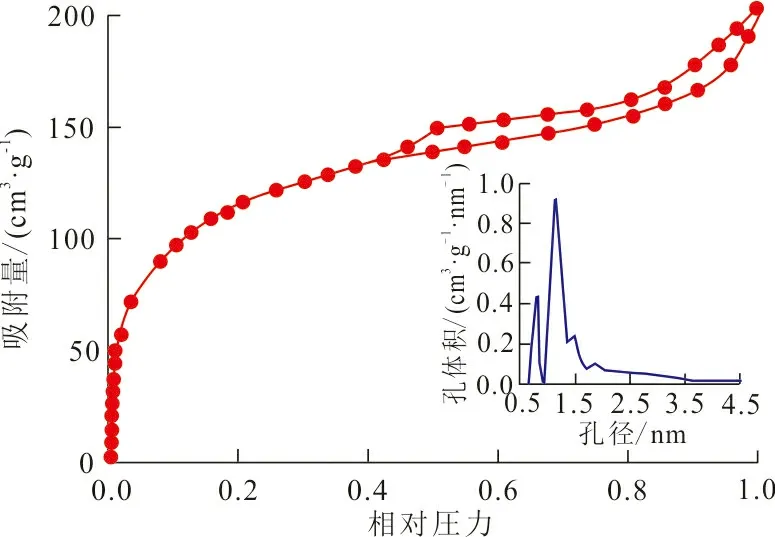
图3 N2吸附-脱附曲线及孔径分布Fig.3 N2 adsorption-desorption isotherm and pore size distribution
2.2 复合材料对RhB的吸附性能
2.2.1 ZrO2-MSiO2复合材料投加量 图4为25 ℃时不同ZrO2-MSiO2复合材料投加量对RhB的吸附量和去除率的影响。
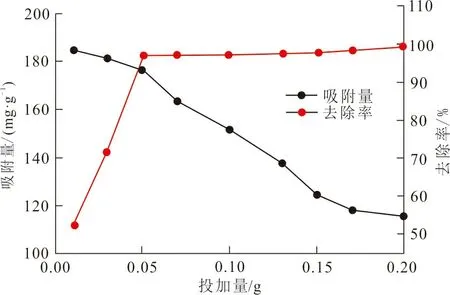
图4 吸附剂投加量对RhB吸附量和去除率的影响Fig.4 Effect of adsorbent dosage on the adsorption capacity and removal rate of RhB
从图4可以看出,当ZrO2-MSiO2复合材料投加量小于0.05 g时,去除率随着投加量的增加迅速增大,投加量超过0.05 g后,去除率上升较小。因为投加量的增加,表面活性吸附位点也随之增多,可吸附更多的RhB分子,所以去除率显著增加。另外,吸附量随投加量的增加而下降,这是由于单位质量的ZrO2-MSiO2复合材料的吸附量减少,活性位点利用率降低,导致吸附量减少。投加量为0.05 g时,RhB的去除率达到97.64%。考虑经济因素,后续实验选择投加量为0.05 g。
2.2.2 pH值 在ZrO2-MSiO2复合材料投加量为0.05 g、RhB质量浓度为50 mg·L-1、吸附温度25 ℃的条件下,pH对RhB去除率的影响如图5所示。
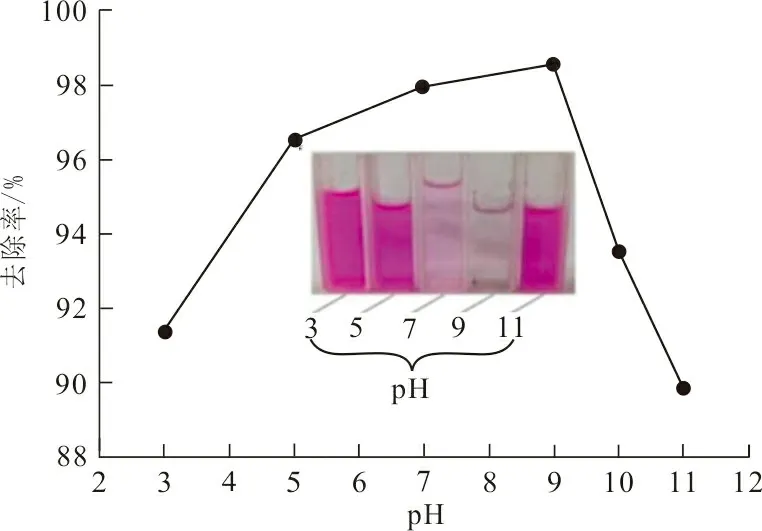
图5 pH对RhB去除率的影响Fig.5 Effect of pH on the removal rate of RhB
从图5可以看出,随着溶液pH值从3增加到9,RhB的去除率迅速增加,最大去除率为98.72%。在pH>7时,ZrO2-MSiO2复合材料表面会受到羟基的去质子化作用。材料本身在整个pH范围呈现负的Zeta电位,负电荷是SiO2晶格中Zr4+取代Si4+或是颗粒表面Si-O-Si断裂造成的[15]。因此,根据静电作用带正电的RhB分子可以被表面带负电荷的ZrO2-SiO2复合材料吸引。当pH>9时,由于羧基的去质子化,RhB从阳离子形式转变为两性离子状态,使得RhB分子表面不带电荷无法吸附到ZrO2-MSiO2复合材料表面[16]。同时,这种两性离子容易形成二聚体的RhB分子,如果材料孔径小会阻碍二聚体RhB分子进入导致吸附能力降低。综上所述,吸附研究的最佳pH值为9。
2.2.3 吸附时间 在ZrO2-MSiO2材料投加量为0.05 g、不同RhB质量浓度(20、40、60、80、100、150 mg·L-1)、pH=9、吸附温度25 ℃的条件下,吸附时间对RhB吸附量的影响如图6所示。
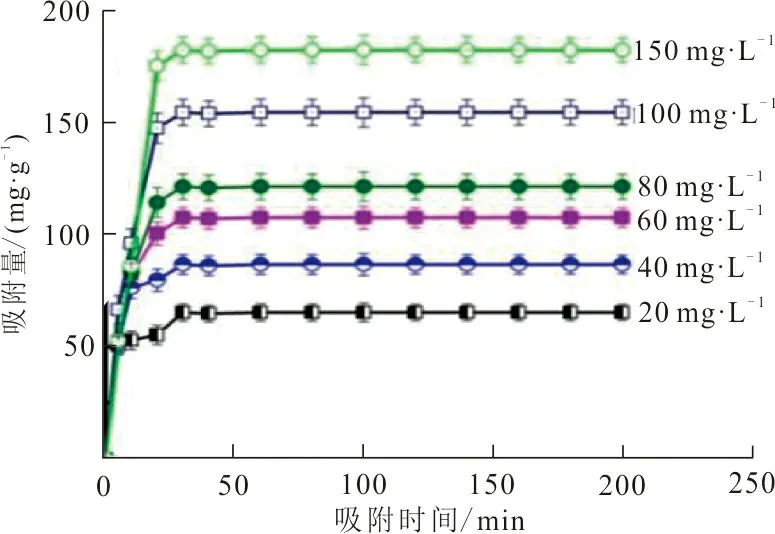
图6 吸附时间对RhB吸附量的影响Fig.6 Effect of adsorption time on the adsorption capacity of RhB
从图6可以看出,吸附时间在5~10 min内,ZrO2-MSiO2材料对不同初始质量浓度的RhB溶液的吸附均表现出快速吸附,而当吸附时间约为30 min时,基本都可以达到吸附平衡。因此,后续吸附实验应在30 min内完成。此外,将RhB的初始质量浓度从20 mg·L-1增加到150 mg·L-1,RhB吸附量也从50.53 mg·g-1上升到182.4 mg·g-1。这是由于吸附质溶液质量浓度的增大与吸附剂的表面形成更高的浓度差,更高的质量浓度差会推动RhB分子由ZrO2-MSiO2材料表面向其内部迁移,提高了RhB的吸附量。
2.2.4 吸附温度 在ZrO2-MSiO2复合材料投加量为0.05 g、不同RhB质量浓度(20、40、80、100、150 mg·L-1)、pH=9、吸附时间30 min、不同吸附温度(15、25、35、45、55 ℃)条件下,吸附温度对RhB吸附量的影响如图7所示。从图7可以看出,不同质量浓度的RhB在ZrO2-MSiO2复合材料上的吸附容量随温度升高而增加。表明该吸附过程是吸热的,升温加快了RhB分子的热运动,同时在ZrO2-MSiO2复合材料的多孔结构内克服了活化障碍,从而导致吸附量增加。因此,升温有利于吸附进行。
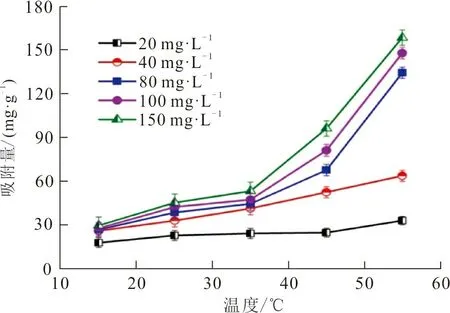
图7 温度对RhB吸附量的影响Fig.7 Effect of temperature on the adsorptioncapacity of RhB
2.2.5 吸附动力学 为了研究ZrO2-MSiO2复合材料对RhB的吸附动力学和机理,分别采用伪一级、伪二级和颗粒内扩散动力学模型[17-18]对实验数据进行拟合,3种模型分别为
1) 伪一级动力学模型:
lg(qe-qt)=lgqe-k1t/2.303
(3)
2) 伪二级动力学模型:
(4)
3) 颗粒内扩散模型:
qt=kdit0.5+C
(5)
式中:qt为t时间的吸附量,mg·g-1;qe为平衡时的吸附量,mg·g-1;t为吸附时间,min;k1为伪一级动力学速率常数,min-1;k2为伪二级动力学速率常数,g·mg-1·min-1;kdi为粒子内扩散速率常数,mg·g-1·min-0.5;C为吸附程度,mg·g-1。
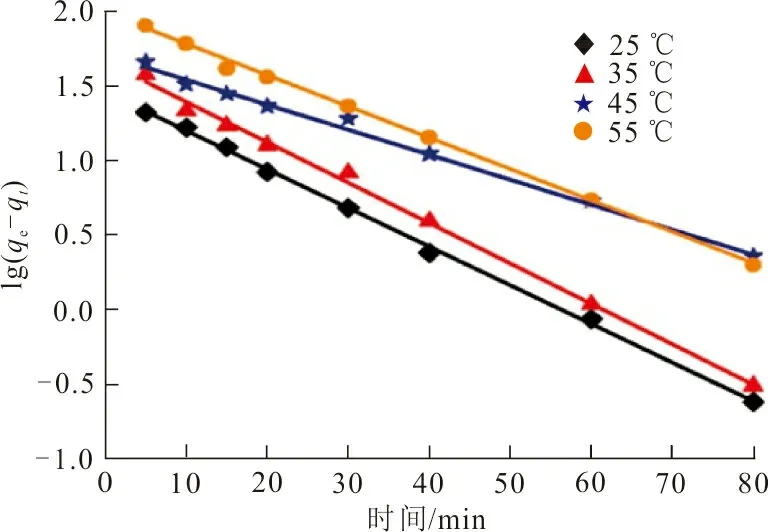
按式(3)~(5)进行线性回归分析,得到RhB 3种吸附动力学模型,结果如图8所示。
(a)伪一级动力学模型
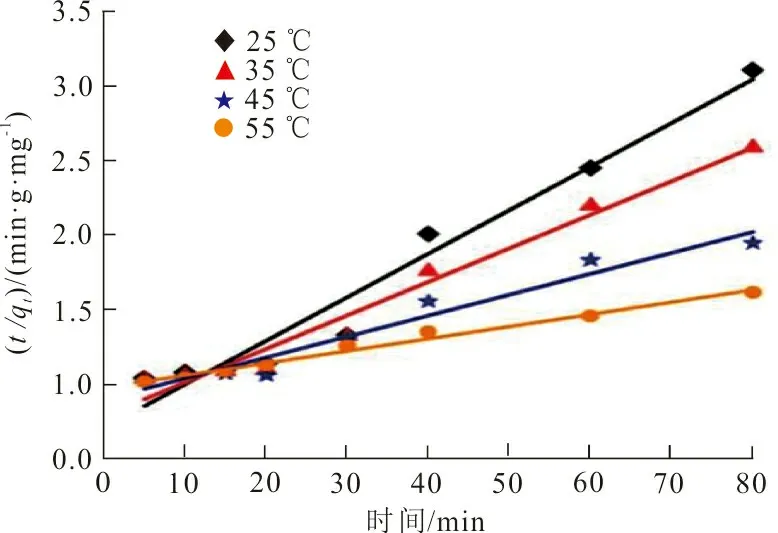
(b)伪二级动力学模型
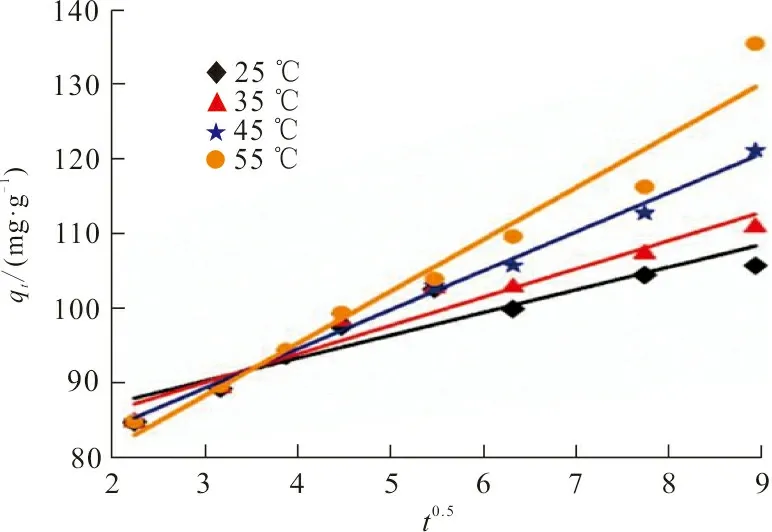
(c)颗粒内扩散模型图 8 ZrO2-MSiO2材料对RhB吸附拟合的动力学曲线Fig.8 Fitting adsorption kinetics curve of RhB on ZrO2-MSiO2 materials
图8中ZrO2-MSiO2投加量为0.05 g,RhB初始质量浓度为200 mg·L-1,pH=9,吸附时间30 min,吸附温度分别为25、35、45、55 ℃,3种吸附动力学模型的参数及其计算结果见表1。
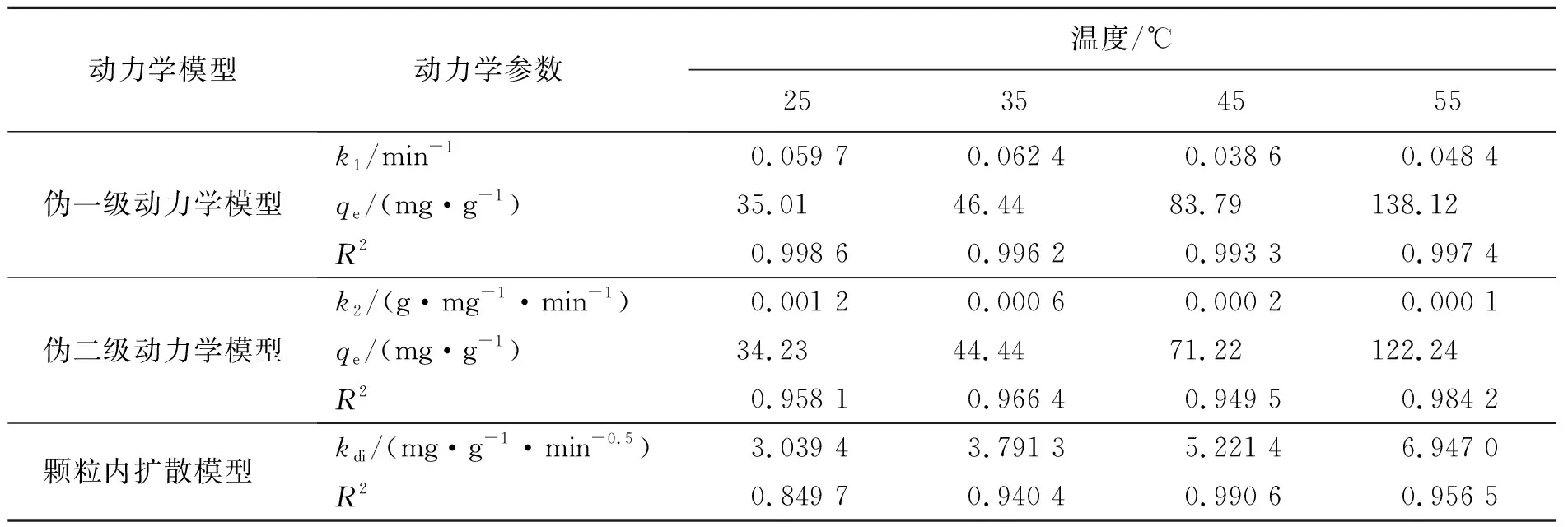
表1 ZrO2-MSiO2吸附RhB的动力学模型参数Tab.1 Kinetic model parameters for adsorption of RhB by ZrO2-MSiO2 materials
从表1可以看出,伪一级动力学模型拟合曲线的相关系数R2均大于0.99,且拟合得到的吸附量qe(72.99 mg·g-1)与实验所得73.55 mg·g-1接近,表明RhB在ZrO2-MSiO2复合材料上的吸附遵循伪一级动力学模型,是物理吸附过程。随着温度的升高,qe值也增大,表明RhB在ZrO2-MSiO2复合材料表面的吸附是吸热过程。伪二级动力学模型相关系数R2值较低,表明ZrO2-MSiO2复合材料对RhB吸附过程与其模型不符。根据伪二级动力学模型,边界层电阻不是速率限制步骤。在图8(c)中,RhB在ZrO2-MSiO2复合材料上吸附的线性拟合结果表明,颗粒内扩散是ZrO2-SiO2材料去除RhB的另一个速率确定步骤。同时颗粒内扩散模型的R2值在0.849 7~0.990 6之间,R2值均低于伪一级方程值,说明颗粒内扩散不是唯一的速率控制步骤,RhB在ZrO2-MSiO2复合材料上的吸附是复杂的过程。图8(a)~(c)表明,ZrO2-MSiO2复合材料对RhB吸附包括3个阶段[19]:第一阶段将RhB分子吸附到ZrO2-MSiO2复合材料的边界层或外层上大约30 min;第二阶段通过颗粒内扩散逐渐吸收约50 min,第三阶段是平衡吸附。
2.2.6 吸附等温模型 将吸附得到的数据分别采用Langmuir和Freundlich 2种吸附等温模型[20-21]进行数据拟合,2种模型分别为
1) Langmuir模型:
(6)
采用Langmuir等温线分离因子(RL)评估吸附可行性,RL计算公式如下[21]:
RL=1/(1+bC0)
(7)
2) Freundlich模型:
lnqe=lnKF+1/nlnCe
(8)
式中:qe为平衡时的吸附量,mg·g-1;Ce为吸附平衡时RhB溶液的质量浓度,mg·L-1;qm为单层吸附极限吸附量,mg·g-1;b为Langmuir吸附常数,L·mg-1;RL为无量纲常数;C0为RhB溶液的最高初始质量浓度,mg·L-1;KF和n是与吸附能力和吸附强度有关的Freundlich常数。
按式(6)和式(8)2种等温吸附模型对ZrO2-MSiO2复合材料吸附RhB的过程分别进行拟合(图9),拟合结果见表2。
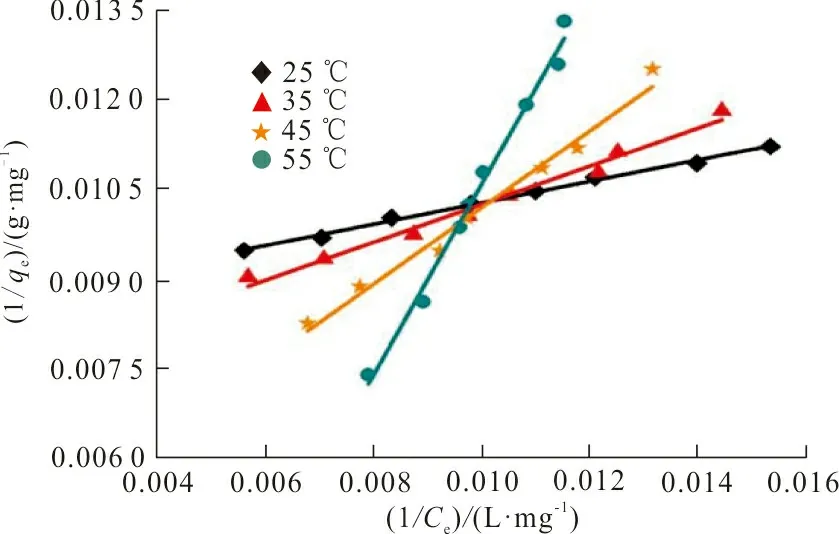
(a)Langmuir
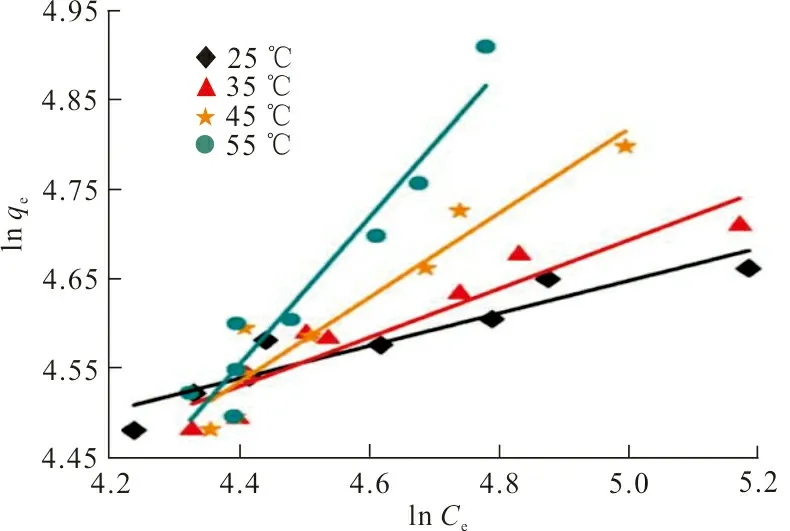
(b)Freundlich图 9 ZrO2-MSiO2材料对RhB吸附模型拟合曲线Fig.9 Adsorption model fitting curve of RhBon ZrO2-MSiO2 materials
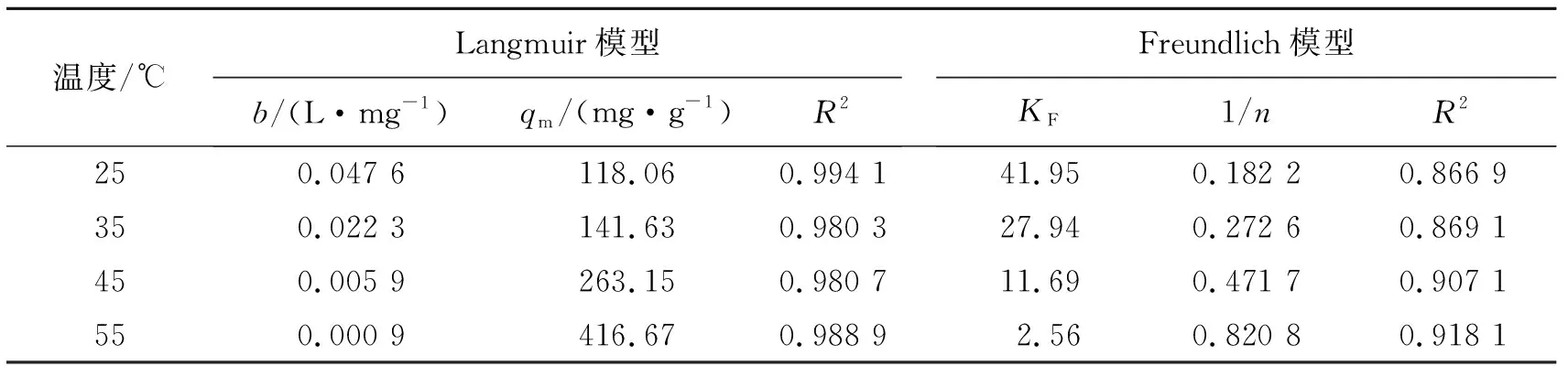
表2 ZrO2-MSiO2材料吸附RhB的等温线模型参数Tab.2 Adsorption isotherm parameter for adsorption of RhB by ZrO2-MSiO2 materials
从表2可以看出,Langmuir模型能更好地描述ZrO2-MSiO2对RhB的等温吸附,R2值均大于0.98,该吸附过程可能是单分子层吸附;当温度从25 ℃升温到55 ℃时,Langmuir的极限吸附从118.06 mg·g-1增加到416.67 mg·g-1;对于无量纲常数RL(RL=0,表示吸附过程不可逆,0
本文所制ZrO2-MSiO2复合材料与其他文献报道ZrO2-SiO2复合材料吸附性能的比较见表3。
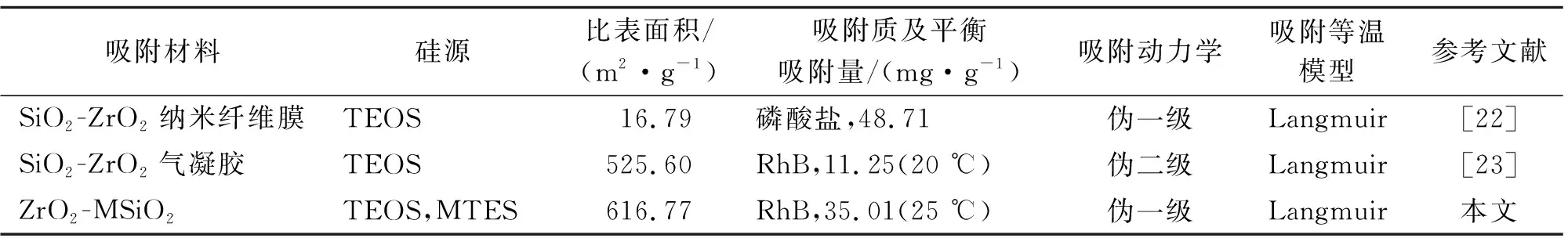
表3 不同ZrO2-SiO2复合材料吸附性能比较Tab.3 Comparison of adsorption performances of different ZrO2-SiO2 composite materials
从表3可以看出,ZrO2-SiO2复合材料对RhB的吸附过程均符合Langmuir等温吸附模型;相比较而言,甲基化改性ZrO2-SiO2复合材料的比表面积要高于亲水性ZrO2-SiO2复合材料(即TEOS为唯一硅源),吸附量也更大。值得注意的是,本文和文献[22]所制ZrO2-SiO2复合材料对溶质的吸附符合伪一级动力学模型,而文献[23]所制ZrO2-SiO2复合材料则符合伪二级动力学模型。
3 结 论
1) 采用溶胶-凝胶法制备了甲基化改性ZrO2-SiO2复合材料, ZrO2-MSiO2复合材料中存在Si—CH3和Zr—O—Si键,表明疏水改性成功,且SiO2与ZrO2颗粒化学键合,证实了RhB被ZrO2-MSiO2复合材料吸附;ZrO2-MSiO2复合材料的比表面积为616.77 m2·g-1,平均孔径为2.19 nm。
2) 在ZrO2-MSiO2投加量为0.05 g、pH值为9、吸附时间为30 min、RhB质量浓度为150 mg·L-1以及温度为25 ℃的条件下,其吸附量达到182.4 mg·g-1;ZrO2-MSiO2对RhB的吸附过程遵循伪一级动力学模型,颗粒内扩散也是吸附过程的速率控制步骤。
3) 等温吸附曲线拟合表明吸附过程既有单分子层吸附又存在非均匀吸附,不同温度下的等温吸附模型符合Langmuir等温式,在328.15 K时极限吸附量可达416.67 mg·g-1;0

