小鼠生殖细胞特异性转录因子NOBOX 调控初级卵泡发育机制的研究
张 雪金美玉于 洋郑志红*
(1.中国医科大学实验动物部,沈阳 110000; 2.辽宁省转基因动物研究重点实验室,沈阳 110000)
卵泡发育是一个复杂而又精密的调控过程[1],从原始生殖细胞分化为卵原细胞,再到原始卵泡发育为成熟卵泡,经历了一系列特定基因的程序性表达[2]。Nobox是小鼠生殖细胞特异性表达基因,编码一个转录因子,主要表达于卵巢组织,其基因敲除小鼠显示卵巢早衰[3-5],雌鼠无生育能力[6-7]。Nobox在整个卵泡发育阶段均有表达,参与原始卵泡的形成及激活。 由于卵泡发育是连续动态的过程,生殖细胞特异性基因具有阶段性特征,有必要分阶段对转录因子的作用进行研究。 目前广泛性敲除Nobox只能探究其在原始卵泡中的作用机制,其在初级卵泡及之后的作用尚未有人研究。Kit作为广泛性表达基因,在生殖细胞中也发挥着重要的作用。Kit表达于卵泡发育的所有阶段,贯穿整个卵子发生过程,影响PGCs 的增殖和分化,可参与PI3K/AKT 和KITL/KIT 通路影响卵泡发育[8-9]。 在原始卵泡激活过程中,生殖细胞特异性转录因子SOHLH1 可直接转录激活Kit表达,并通过PI3K/AKT 通路参与原始卵泡激活[8,10-11]。 与NOBOX 表达模式不同,SOHLH1 只表达于卵原细胞、原始卵泡,在初级卵泡中表达逐渐消失,而在次级卵泡和其之后的阶段不再表达[12-13]。 当原始卵泡发育为初级卵泡后,SOHLH1 表达逐渐消失,Kit仍持续大量表达,此时Kit还应受到其他转录因子调控。 作为生殖细胞特异性转录因子,NOBOX 在卵泡整个发育阶段均有表达,通过软件分析发现Kit启动子存在多个NOBOX 结合位点(NBE),存在转录调控的可能性。 此外,在初级卵泡发育至次级卵泡过程中,TGF-β/SMADs 信号通路作为卵母细胞与颗粒细胞沟通的标志性通路开始调控卵泡发育[14-17]。 生长因子GDF9 作为TGF-β 超级家族的成员,在初级卵泡中开始表达,已有研究表明NOBOX 可直接转录调控Gdf9[18],并参与GDF9/SMAD 通路影响颗粒细胞增殖分化。 本研究拟探索在初级卵泡发育阶段,转录因子NOBOX 对Kit的转录调控作用,以及通过GDF9/SMAD 通路对卵泡发育的影响,完善转录因子NOBOX 在卵泡发育过程中的作用机制。
1 材料和方法
1.1 实验动物
本实验中共使用20 只20 d 日龄及9 只6 周龄的SPF 级C57BL/6J 雌性小鼠(三次重复实验),体重分别约9~12 g 及16~18 g(误差不大于10%),来源于中国医科大学实验动物部[SCXK(辽) 2018-0004],取材在中国医科大学实验动物科学部屏障动物实验设施进行[SYXK(辽)2018-0008],取材过程按实验动物使用的3R 原则给予人道关怀。 本实验经过中国医科大学实验动物福利与伦理委员会及实验动物管理和使用委员会(Institutional Animal Care and Use Committee, IACUC) 审查通过(2019260)。
1.2 主要试剂与仪器
M2 培养基(Cat#M7167,Sigma);α-MEM(Cat#32571036,Gibco);FBS(Cat#FB15011,CLARK);ITS(Cat#I3146,Sigma);谷氨酸盐(Cat#25030-801,Gibco);矿物油(Cat#M8410,Sigma);Nobox-siRNA(上海吉玛制药技术有限公司, 中国);LipofectamineTM3000 (Cat # L3000015, Invitrogen);MinuteTM蛋白提取试剂盒(Cat#SD001/SN-002,Invent);Anti-NOBOX(Cat#sc-514178,Santa);Anti-KIT(Cat #3074 s, Cell Signal Technology); Anti-Phospho-SMAD2/SMAD3(Cat#8828 s,Cell Signal Technology ); Anti-GAPDH ( Cat # YM3029,Immunoway);mirVanaTMmiRNA Isolation Kit(Cat#AM1561, Invitrogen ); EZ-ChIPTM- Chromatin Immunoprecipitation Kit(Cat#17-371,Millipore);体式显微镜(麦克奥迪电器股份有限公司,中国);显微操 纵 器( Eppendorf, 德 国); 微 量 注 射 仪(Eppendorf,德国);拉针仪(Sutter,美国);显微镜热台(东海,日本);Western blot 电泳仪及转膜仪(Bio-Rad,美国)。
1.3 实验方法
1.3.1 初级卵泡分离、体外培养及显微注射
培养基准备:(1)体外分离M2 培养基(2)卵泡培养基:α-MEM+20%FBS+1×ITS+1×谷氨酸盐+1%青链霉素,分别将两种培养基于6 cm 培养皿中滴好若干5 μL 微滴,覆盖矿物油,提前2 h 置于培养箱平衡。
无菌条件下取5 只20 d 日龄C57BL/6J 雌鼠卵巢置于4℃预冷的PBS 中,剥去周围脂肪及结缔组织后,转移至M2 液滴中,刺破卵巢释放卵泡并通过自制卵泡口吸管收集初级卵泡。 通过卵泡直径及形态区分各级卵泡:原始卵泡直径小于40 μm,卵母细胞周围由单层扁平颗粒细胞包裹;初级卵泡直径约40~100 μm,卵母细胞由单层立方状颗粒细胞包裹;次级卵泡直径约100~200 μm,由两层以上颗粒细胞包裹。 第一组吸取100 个初级卵泡直接转移至卵泡培养基液滴中作为空白对照,即不加任何处理因素(每个液滴中培养1 个初级卵泡);第二组吸取100 个初级卵泡转移至M2 液滴中,注射10 pL 缓冲液(DEPC 水)至卵母细胞后,再将卵泡转移至卵泡培养基作为阴性对照;第三组吸取100 个初级卵泡转移至M2 液滴中,注射10 pLNobox-siRNA 至卵母细胞后,再将卵泡转移至卵泡培养基作为注射siRNA 组,三组卵泡均置于37℃,5% CO2条件下培养数日,隔天换液,每24 h 观察并记录三组初级卵泡发育情况及发育至次级卵泡时间。
1.3.2 qRT-PCR 检测注射Nobox-siRNA 后相关基因mRNA 表达变化
37℃,5% CO2条件下分别培养①空白对照组(未注射组,不加任何处理因素)②阴性对照组(注射DEPC 水)③实验组(注射Nobox-siRNA)三组初级卵泡,每组200 个初级卵泡,24 h 后收集,采用mirVanaTMmiRNA Isolation Kit 试剂盒分别提取三组的初级卵泡RNA 并反转录为cDNA,qRT-PCR 检测相关基因表达变化,引物序列如下:NoboxF:5’-GGCACTAGTATCGCCTCACC-3’,NoboxR: 5 ’-CATTGAGCTTGGGATGGGGT-3 ’;KitF: 5 ’-GATGGTGGGAATGGGTCAGA-3 ’,KitR: 5 ’-TCCATGTCGTCCCAGTTGGT-3 ’;Gdf9 F: 5 ’-GTCACCTCTACAATACCGTCCG-3’,Gdf9 R: 5’-CACCCGGTCCAGGTTAAACA-3 ’;KitlF: 5 ’-TCTGCGGGAATCCTGTGACT-3 ’,KitlR: 5 ’-CGGCGACATAGTTGAGGGTTAT-3’;β-actinF:5’-GATGGTGGGAATGGGTCAGA-3’,β-actinR: 5’-TCCATGTCGTCCCAGTTGGT-3’。
1.3.3 Western blot 检测注射Nobox-siRNA 后相关基因蛋白表达变化
37℃,5% CO2条件下分别培养①阴性对照组(注射DEPC 水)②实验组(注射Nobox-siRNA)的两组初级卵泡,每组100 个初级卵泡,24 h 后收集,采用MinuteTM蛋白提取试剂盒分别提取各组初级卵泡蛋白(检测Phospho-SMAD2/3 提取核蛋白),100℃煮沸5 min 变性。 SDS-PAGE 电泳,转膜,封闭。Anti-NOBOX 抗体以1 ∶100 比例稀释;Anti-KIT 抗体以1 ∶1000 比例稀释;Anti-Phospho-SMAD2/3 抗体以1 ∶1000 比例稀释;Anti-GAPDH 抗体以1 ∶5000 比例稀释,4℃摇床孵育过夜。 次日去除一抗孵育二抗(1 ∶5000)滴加ECL 发光液使用化学发光分析仪采集信息,并拍照记录。
1.3.4 染色质免疫沉淀(ChIP)验证NOBOX 与Kit基因启动子的结合情况
取6 对6 周龄C57BL/6J 小鼠卵巢,按照EZChIPTM- Chromatin Immunoprecipitation Kit 试剂盒说明书提取NOBOX 抗体结合的DNA 片段。 针对Kit转录起始位点上游-6177 bp ~-5218 bp、-4092 bp ~-2228 bp 序列(此区域为Kit启动子有效启动区域[19])使用JASPAR 软件预测转录因子NOBOX 特异性结合位点NBE,在Kit基因启动子中查找转录因子NOBOX 评分较高的5 个结合位点NBE(图1),并设计ChIP-PCR 引物验证。ChIP 引 物 序 列 如 下: Chip-Kit-960-1F: 5 ’-ATGAGGTGCCCTTGTGAG-3’,Chip-Kit-960-1R:5’-TCCAGACCGGAAGTGTTC-3’;Chip-Kit-960-2F:5’-CTCCGTTGAGCAGGGTTA-3’,Chip-Kit-960-2R:5’-CCTGGGAAGGAAAAGTCC-3 ’; Chip-Kit-1865-1F:5’-GGTTCATTCCCATAGCCC-3’,Chip-Kit-1865-1R:5’-ACCCACCTCACATCTCCTTA-3’; Chip-Kit-1865-2F:5’-TGTCTCAGGAGTGGGTTG-3’,Chip-Kit-1865-2R: 5’-CGTTCTGATAAGAGGCAAT-3’; Chip-Kit-1865-3F:5’-TGCCTCTTATCAGAACGG-3’,Chip-Kit-1865-3R: 5’-CCCAGGACTTGCCAGTAG-3’。 PCR扩增转录因子NOBOX 结合区域,验证在Kit基因启动子上的结合位点。
1.4 统计学方法
三组初级卵泡培养过程中发育为次级卵泡所占比例及卵泡存活率通过ANOVA 检验组间差异是否具有统计学意义。
检测目的基因mRNA 表达变化时,每个目的基因重复3 次qRT-PCR 实验,内参基因为β-actin,△Ct 值为目的基因Ct 值-内参基因Ct 值,△△Ct值为注射Nobox-siRNA 组目的基因的△Ct 值-阴性对照组目的基因的△Ct 值。 将阴性对照组的基因表达量设为1,计算注射Nobox-siRNA 组目的基因表达量相对对照组目的基因表达量的比值(2-△△Ct),实验数据均使用GraphPad 软件进行数据处理,以平均数±标准误差(±)表示,采用t检验,以P<0.05 为差异显著有统计学意义。
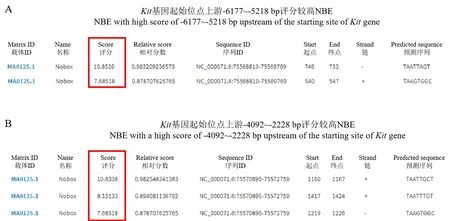
图1 Kit 转录起始位点上游评分较高NBEFigure 1 NBE with higher score upstream of Kit transcription initiation site
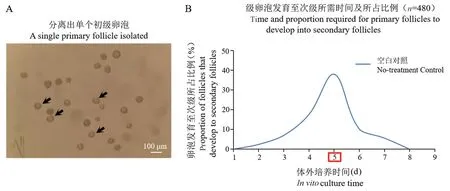
注:A:图中均为体外成功分离的单个初级卵泡,如箭头所示。图2 预实验分离出单个初级卵泡及卵泡发育时间统计Note. A, These are all single primary follicles successfully isolated in vitro, as shown by the arrows.Figure 2 Statistics of single primary follicle and follicle development time isolated in the preliminary experiment
2 结果
2.1 初级卵泡体外培养及显微注射
由于无法保证分离的单个初级卵泡处于统一发育状态,因此已通过预实验分离出480 个初级卵泡(图2A),转移至96 孔板每孔单独培养,观察并记录480 个初级卵泡发育至次级卵泡所需时间及所占比例。 结果显示,体外培养初级卵泡发育至次级卵泡的最短时间为2 d,最长为7 d,第5 天时,初级卵泡发育至次级的比例最高(图2B),因此体外培养初级卵泡发育至次级卵泡的时间为5 d。
37℃,5% CO2条件下分别培养①空白对照组(未注射组,不加任何处理因素)②阴性对照组(注射DEPC 水)③实验组(注射Nobox-siRNA)三组初级卵泡,每24 h 拍照记录卵泡发育情况并进行比较。 三组初级卵泡培养过程中的存活及死亡情况见图3,比较三组卵泡存活率,统计学分析均显示无统计学差异(P>0.05),结果表明体外分离及显微注射等操作未对初级卵泡存活造成影响。
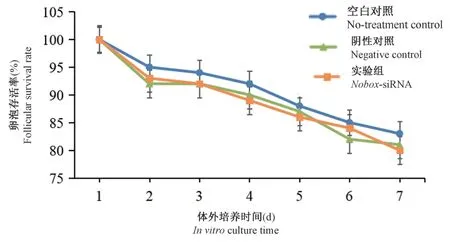
图3 三组初级卵泡体外培养不同天数存活率(n=100)Figure 3 The survival rate of three groups of primary follicles was different in vitro
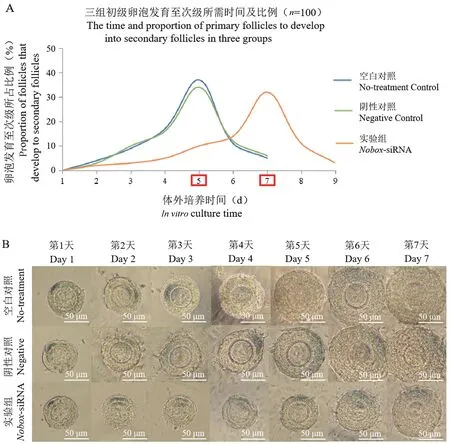
注:B:显微镜下观察三组初级卵泡体外培养7 d 的发育情况。图4 体外培养三组初级卵泡发育至次级卵泡的发育时间及存活率Note. B, The development of primary follicles in three groups cultured for 7 d in vitro was observed under microscope.Figure 4 Development time and survival rate of primary follicles to secondary follicles in three groups cultured in vitro
观察并记录三组初级卵泡发育至次级卵泡所需时间及所占比例,结果显示,空白对照组与阴性对照组均第2 天开始逐渐发生形态学变化,第5 天发育至次级卵泡(卵泡直径大于100 μm)(图4A、4B);注射Nobox-siRNA 组与阴性对照组相比:阴性对照组的初级卵泡从第2 天开始逐渐发生形态学变化,第5 天可发育至次级;而注射Nobox-siRNA 组的初级卵泡1~4 d 无明显形态学变化,卵泡直径无明显增长,第5 天开始逐渐发育,颗粒细胞增厚,卵泡体积增大,第7 天可发育为次级卵泡。 结果表明,Nobox-siRNA 干扰初级卵泡后,卵泡暂时停止发育,颗粒细胞增殖停滞,初级卵泡延缓2 d 发育至次级(图4A、4B)。

注:A:误差线代表三次重复实验的平均数±标准误差;1:阴性对照组(注射DEPC 水);2:空白对照组(未注射组);3:实验组(注射Nobox-siRNA)。 与阴性对照组比较,ns:P >0.05,***P<0.001。 B:1:阴性对照组(注射DEPC 水);2:实验组(注射Nobox-siRNA)。图5 Nobox-siRNA 干扰后初级卵泡中Nobox mRNA 及蛋白表达情况Note. A, Error bars represent the mean ± standard error of three replicate experiments. 1, Negative control group ( injected DEPC water); 2, No-treatment control group (no injection group); 3, Experimental group (Nobox-siRNA injection).Compared with the negative control group, ns, P>0.05,***P<0.001. B, 1, Negative control group (injected DEPC water);2, Experimental group (injection of Nobox-siRNA).Figure 5 Expression of Nobox mRNA and protein in primary follicles after Nobox-siRNA interference
2.2 初级卵泡中注射Nobox-siRNA 后Nobox mRNA 及蛋白表达情况
37℃,5% CO2条件下分别培养①空白对照组(未注射组,No-treatment Control)②阴性对照组(注射DEPC 水, Negative Control) ③实验组(注射Nobox-siRNA)的三组初级卵泡,每组300 个,24 h 后提取其中200 个初级卵泡RNA,反转为cDNA,经qRT-PCR 发现,空白对照组与阴性对照组相比数据无显著性差异,P>0.05,显微注射操作不影响初级卵泡中Nobox表达;注射Nobox-siRNA 组与阴性对照组相比,NoboxmRNA 表达水平显著下调,差异极显著,P<0.001(图5A)。 分别提取阴性对照组与注射Nobox-siRNA 组的100 个初级卵泡蛋白,经Western blot 发现,注射Nobox-siRNA 组与阴性对照组相比,NOBOX 蛋白表达明显减少(图5B)。 结果表明,在初级卵泡卵母细胞中显微注射NoboxsiRNA 可有效导致初级卵泡中Nobox基因沉默。
2.3 初级卵泡中Nobox 干扰后相关基因mRNA及蛋白表达变化
37℃,5% CO2条件下分别培养①空白对照组(未注射组,No-treatment Control)②阴性对照组(注射DEPC 水, Negative Control) ③实验组(注射Nobox-siRNA)的三组初级卵泡,cDNA 模板与结果2.2 为同一批反转录产物;24 h 后提取阴性对照组与注射Nobox-siRNA 组的100 个初级卵泡蛋白。 通过qRT-PCR 实验发现,空白对照组与阴性对照组相比数据无显著性差异,P>0.05,显微注射操作不影响初级卵泡中Kit、Kitl、Gdf9 mRNA 表达;注射Nobox-siRNA 组与阴性对照组相比,初级卵泡卵母细胞中的Kit、Kitl、Gdf9 基因mRNA 表达水平显著下调,P<0.001(图6A-6C),经Western blot 发现,注射Nobox-siRNA 后初级卵泡中KIT、P-SMAD2 /SMAD3 蛋白表达量明显降低(图6D)。 结果表明,NOBOX 在初级卵泡发育至次级卵泡阶段可能经KITL/KIT 及GDF9/SMAD 通路影响卵泡发育。
2.4 染色质免疫沉淀(ChIP)验证NOBOX 与Kit启动子结合区域
ChIP 实验中与NOBOX 抗体结合的DNA 片段洗脱纯化后进行PCR 检测。 将产物于2%琼酯糖凝胶电泳,结果显示为单一目的条带,未见其他杂带,转录因子NOBOX 在Kit启动子(-2933 bp ~-2926 bp)、(-2874 bp ~-2867 bp)和(-2676 bp ~-2669 bp)位点能够结合(图7A,a-c),在Kit启动子(-5638 bp~-5634 bp)及(-5432 bp ~-5425 bp)位点无法结合(图7A,d-e),表明转录因子NOBOX 在雌性小鼠卵巢中可直接结合Kit基因启动子。
3 讨论
卵巢中SOHLH1、SOHLH2、NOBOX 等多种生殖细胞特异性转录因子,在卵泡发育不同阶段发挥着不同的作用。 SOHLH1/2、NOBOX 均参与原始卵泡形成及激活过程,不同的是,转录因子SOHLH1/2只在卵原细胞和原始卵泡中表达,初级卵泡表达较少,次级卵泡及之后无表达,而NOBOX 的表达贯穿整个卵泡发育阶段。 当原始卵泡激活为初级卵泡后,SOHLH1/2 的表达逐渐消失,对于SOHLH1/2 直接调控的Kit等基因来说,还应受到其他转录因子的调控,有必要分阶段对转录因子的作用进行研究。 本研究选择卵泡发育过程中初级卵泡发育至次级卵泡的阶段,在小鼠初级卵泡中显微注射Nobox-siRNA,通过体外培养初级卵泡,观察到注射Nobox-siRNA 的初级卵泡颗粒细胞增殖停滞,延迟2 d 发育至次级,说明Nobox是初级卵泡发育至次级卵泡的关键基因;通过检测Kit、Gdf9、Kitl、P-SMAD的表达变化,说明初级卵泡中Nobox基因沉默对卵母细胞与颗粒细胞间的KITL/KIT 及TGF-β/SMAD通路有抑制作用;通过ChIP 实验发现转录因子NOBOX 可直接结合于Kit基因转录起始位点上游(-2933 bp ~-2926 bp)、(-2874 bp ~-2867 bp)和(-2676 bp ~-2669 bp)的NBE 位点,推测NOBOX可直接转录调控Kit基因的表达。
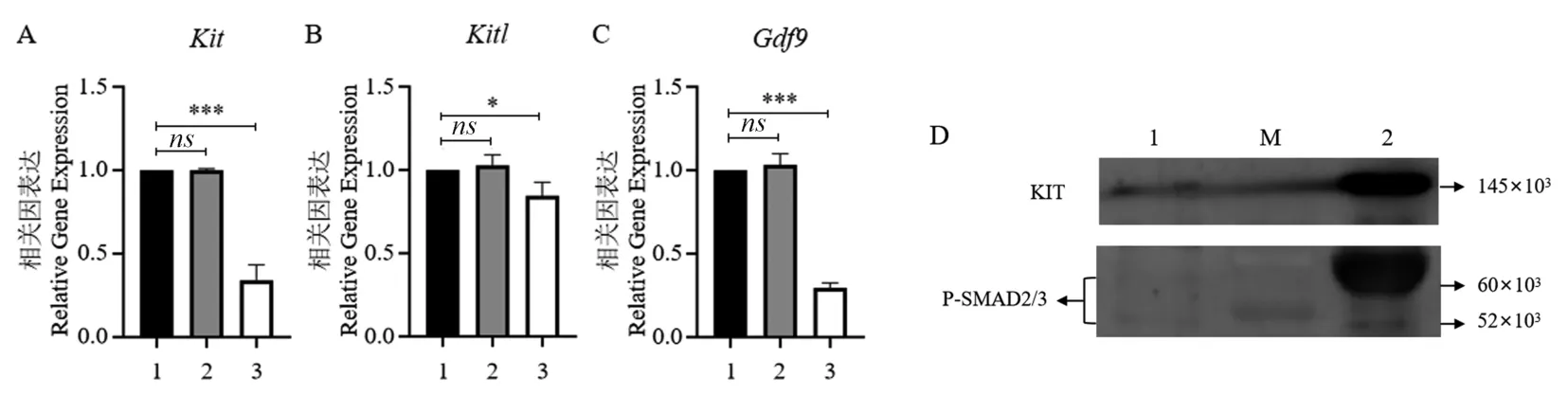
注:A-C:误差线代表三次重复实验的平均数±标准误差;1:阴性对照组(注射DEPC 水);2:空白对照组(未注射组);3:实验组(注射NoboxsiRNA)。 与阴性对照组比较,ns:P>0.05,*P<0.05,***P<0.001。 D:M:蛋白Marker;1:实验组(注射Nobox-siRNA);2:阴性对照组(注射DEPC 水)。图6 Nobox-siRNA 干扰后初级卵泡中相关基因mRNA 及蛋白表达情况Note. A-C, Error bars represent the mean ± standard error of three replicate experiments. Compared with the no-treatment control group, 1, Negative control group (injected DEPC water); 2, No-treatment control group (no injection group); 3, Experimental group (Nobox-siRNA injection).Compared with the negative control group, ns:P>0.05,*P<0.05,***P<0.001. D, M, Protein Marker; 1, Experimental group (injection of Nobox-siRNA); 2, Negative control group (injected DEPC water).Figure 6 mRNA and protein expressions of related genes in primary follicles after Nobox-siRNA interference
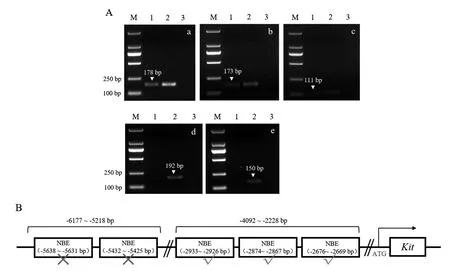
注:A 图中,a-c 代表NOBOX 可与Kit 启动子(-2933 bp ~-2926 bp)、(-2874 bp ~-2867 bp)和(-2676 bp ~-2669 bp)位点结合;d-e 表示NOBOX 在Kit 启动子(-5638 bp~-5634 bp)和(-5432 bp ~-5425 bp)位点无结合作用;M:TaKaRa DL2000 Marker;1:NOBOX-Kit;2:Input;3:阴性对照。 B:转录因子NOBOX 与Kit 启动子-6177 bp~-5218 bp 区域和-4092 bp~-2228 bp 区域结合位点示意图。图7 转录因子NOBOX 与Kit 启动子结合情况Note. In Figure A, a~c means that NOBOX can bind to Kit promoter (-2933 bp~-2926 bp), (-2874 bp ~-2867 bp) and (-2676 bp~-2669 bp) sites; d~e shows that NOBOX has no binding effect at the Kit promoter sites (-5638 bp ~-5634 bp) and (-5432 bp ~-5425 bp); M:TAKARA DL2000 Marker; 1: NOBOX-Kit; 2: Input; 3: Negative control. B: Schematic diagram of binding sites between transcription factor NOBOX and Kit promoter -6177 bp~-5218 bp region and -4092 bp ~-2228 bp region.Figure 7 Binding of transcription factor NOBOX to Kit promoter
表达于卵泡颗粒细胞中的KITL,包含可溶性蛋白KITL1 和膜结合蛋白KITL2 两种转录产物,两者虽功能相近,但是稍有不同,KITL1 主要促进早期卵泡发育,而KITL2 对卵泡生长发育起调控作用[20]。除实验验证的KITL/KIT 和GDF9/SMAD 通路外,本研究检测到注射Nobox-siRNA 的初级卵泡中Kitl2显著下调,提示转录因子NOBOX 在初级卵泡发育至次级卵泡阶段,也可能通过TGF-β/SMAD/KITL通路且主要通过KITL2 影响卵泡发育,其具体机制尚待深入开展。
综上所述,本研究证明NOBOX 是小鼠初级卵泡发育至次级卵泡的关键基因,首次发现转录因子NOBOX 在小鼠卵巢中可直接结合Kit基因启动子,且影响初级卵泡中KITL/KIT 和GDF9/SMAD 通路,完善转录因子NOBOX 在卵泡发育过程中的作用机制。

