豆渣中可溶性多糖的不同提取方法比较和工艺优化
傅晶依,石曾卉,汤琦龙,刘云,王静,赵晨皓,赵珺*
(1.长春大学 食品科学与工程学院,长春 130022;2.吉林大学 临床医学院,长春 130012;3.榆树市榆乡豆制品有限公司,长春 130400)
大豆(soybean)富含植物蛋白、大豆异黄酮、膳食纤维等多种对人体有益的成分,其营养和经济价值都很高。大豆作为中国最重要的粮食作物之一,在我国的生产和消耗量是巨大的。而在大豆加工分离蛋白、豆粉、豆浆、豆腐等产品的过程中,会产生大量的副产物——豆渣。豆渣(soybean residue,SR)由于水分含量特别大,极易产生腐败变质等问题[1]。目前我国对豆渣的处理利用仅限于用作饲料或肥料甚至直接废弃,造成了极大的资源浪费与环境污染问题。
多糖(polysaccharide)广泛存在于自然界中,是由中性糖与糖醛酸通过糖苷键连接在一起的长链复杂碳水化合物[2],作为植物细胞的主要结构物质之一,具有抑菌性、抗肿瘤、改善免疫力等生理活性[3-4],因此在结构和功能上都具有很高的研究价值,已成为近些年的研究热点。研究表明,豆渣中包含大约30%可溶性大豆多糖,并且是酸性多糖[5]。在食品加工中,常被用作稳定剂、乳化剂、澄清剂、强化剂、食品特性改善剂等来提高食品的食用品质特性[6]。
现阶段,国内多采用热水浸提、酸碱水解提取、超声辅助提取等方法从大豆中提取水溶性大豆多糖[7]。本文以豆渣为原料,优化超声辅助提取法与复合酶解提取法的工艺条件,并对比两种提取方法,以期找到提取豆渣中可溶性多糖的最佳方法,为合理利用豆渣、提高大豆利用率提供了理论依据。
1 材料与方法
1.1 材料与试剂
新鲜豆渣:由榆树市榆乡豆制品有限公司提供;苯酚:分析纯,国药集团化学试剂有限公司;盐酸、浓硫酸:分析纯,北京化工厂;纤维素酶、酸性蛋白酶:食品级,河南万邦实业有限公司;氨基磺酸、间羟基联苯:分析纯,范德(北京)生物科技有限公司;三氟乙酸:天津市光复精细化工研究所。
1.2 仪器
DZKW-172电热恒温水浴锅 天津天泰仪器有限公司;FA1104N电子天平、3K15高速冷冻离心机 上海精密科学仪器有限公司;KQ5200DE数控超声波清洗器 昆山市超声仪器有限公司;DZF-6050真空干燥箱 上海博迅实业有限公司;721型分光光度计 上海佑科仪器有限公司;LC-10AT高效液相色谱仪 日本岛津公司。
1.3 工艺流程
1.3.1 超声辅助提取法工艺流程
一定质量干豆渣→加蒸馏水→超声波→热水浸提→过滤去渣→浓缩醇沉→离心干燥→可溶性粗多糖。
1.3.2 复合酶解提取法工艺流程
一定质量干豆渣→加蒸馏水→调pH至4.0→加入复合酶(纤维素酶∶蛋白酶为1∶1)→热水浸提→高温灭活→过滤去渣→浓缩醇沉→离心干燥→可溶性粗多糖。
1.4 多糖得率计算
称量干燥后所得可溶性粗多糖粉末的质量,依据公式(1)计算多糖得率。

(1)
1.5 多糖溶解量测定
取多糖粉末10 mg溶解于1 mL蒸馏水中,振荡10 min,8000 r/min高速离心10 min后烘干至恒重,依据公式(2)进行计算。

(2)
1.6 总糖含量与糖醛酸含量测定
总糖含量的测定采用苯酚-硫酸法,将多糖样品配制成0.1 mg/mL多糖溶液,取0.6 mL至试管中,加蒸馏水补足1 mL,向试管中加入0.5 mL 6%的苯酚溶液,2.5 mL浓硫酸,振荡摇匀静置反应30 min,于490 nm处测吸光值,重复3次,计算样品中总糖含量。
糖醛酸的测定采用间羟基联苯法,将多糖样品配制成0.1 mg/mL多糖溶液,取0.4 mL至试管中,加入氨基磺酸40 μL,浓硫酸2.5 mL,振荡摇匀,沸水浴20 min后迅速用冷水冷却至室温,然后加入间羟基联苯40 μL,振荡摇匀,静置15 min,在525 nm处测吸光值,重复3次,计算样品中的糖醛酸含量。
1.7 单糖组成测定
称取1 mg多糖样品于酸水解小瓶中,加入1 mL盐酸-甲醇溶液,充氮气密封后于80 ℃反应16 h,空气泵吹干后加入1 mL 2 mol/L三氟乙酸,在120 ℃下反应1 h,反复加入少量无水乙醇,水浴蒸发三氟乙酸。向蒸干后的样品中加入PMP试剂0.5 mL和0.3 mol/L氢氧化钠溶液0.5 mL,振荡摇匀,取0.1 mL于EP管中,在70 ℃下水浴反应30 min后加入超纯水50 μL和0.3 mol/L盐酸溶液50 μL,充分混匀后加入1 mL氯仿,萃取得到剩余的PMP试剂,弃去三氯甲烷层,保留水层,重复萃取3次,进行高效液相色谱检测。
1.8 紫外全波长扫描分析多糖
将得到的两种多糖样品制成0.3 mg/mL的溶液,在200~900 nm范围内进行紫外全扫描分析,测定多糖样品的纯度情况。
1.9 多糖红外光谱分析
分别取两种不同提取方法得到的豆渣可溶性多糖1 mg,加入180 mg光谱级溴化钾,于玛瑙研钵内研磨均匀,压片至透明后,置于红外光谱扫描仪在400~4000 cm-1范围内进行扫描分析。
2 结果与分析
2.1 超声辅助提取法
利用超声辅助热水浸提豆渣中可溶性多糖,分别通过单因素和正交优化实验考察超声功率、浸提温度、浸提时间和料液比4个因素对多糖得率的影响。
2.1.1 单因素实验
由图1可知,超声辅助提取法的最佳单因素条件为超声功率120 W,浸提时间4 h,浸提温度60 ℃,料液比1∶20。超声波可在介质中产生空化、振动、破碎等综合效应,通过打破细胞壁从而成功提取出天然产物成分。在超声过程中,超声波使多糖分子振荡而加速溶出,因此当超声功率低于120 W时,多糖得率随功率增加而增大。而功率过大时,杂质的溶出量持续增加,造成有效成分的比例降低,多糖得率下降[8];温度会加快分子的无规则运动,加快溶液的扩散速度,促进细胞内的多糖分子由内向外传播,加速多糖分子的溶出。温度低于60 ℃时,多糖得率随温度升高而增加,但当温度超过60 ℃后,多糖得率下降,可能是由于高温加速多糖分子解离,破坏其结构,导致多糖得率下降[9];多糖本身具有一定的扩散性、渗透性和溶解性,当提取时间低于4 h时,随着时间的增加,溶出的多糖增多,得率上升。但是当提取时间超过4 h后,因为多糖的扩散达到平衡,继续浸提会导致蛋白质等成分溶出,降低多糖的比例,使得率出现下降趋势;料液比高于1∶20时,多糖得率随料液比降低而增加,此时豆渣浸没不完全,有效成分不能充分溶出[10]。但当料液比低于1∶20时,多糖类物质的比例降低,多糖得率下降。

图1 超声功率、浸提温度、浸提时间、料液比对多糖得率的影响Fig.1 Effects of ultrasonic power, extraction temperature, extraction time, solid-liquid ratio on the extraction yield of polysaccharides
2.1.2 正交优化实验
根据单因素实验的结果,进行四因素三水平L9(34)的正交实验,其因素及水平见表1,正交实验设计及结果见表2。

表1 超声辅助提取法正交实验因素水平表Table 1 The factors and levels of orthogonal array design for ultrasonic-assisted extraction method

表2 超声辅助提取法正交试验结果分析Table 2 Analysis of orthogonal test results for ultrasonic-assisted extraction method
由表2可知,影响多糖得率的各因素主次关系为:超声功率(C)>料液比(D)>浸提时间(B)>浸提温度(A);且最佳工艺条件A3B1C3D2,即浸提温度70 ℃、浸提时间3 h、超声功率140 W、料液比1∶20,此条件下多糖得率为6.13%。
2.2 复合酶解提取法
利用纤维素酶与酸性蛋白酶以1∶1的比例复配进行酶解提取豆渣中可溶性多糖,分别通过单因素与正交优化实验考察酶添加量、浸提温度、浸提时间和料液比对多糖得率的影响。
2.2.1 单因素实验
由图2可知,复合酶解提取法的最佳单因素条件为浸提时间1.5 h,酶添加量2%,浸提温度50 ℃,料液比1∶25。复合酶解提取法下的浸提时间和料液比对多糖得率的影响趋势基本与超声辅助提取法相同,但最佳浸提时间缩短至1.5 h,最佳料液比降低至1∶25;纤维素酶能够破坏细胞的细胞壁,促进多糖在溶剂中扩散,提高多糖得率。当酶添加量低于2%时,多糖得率随加酶量的增加而升高,这可能是由于酶添加量的增加使酶与底物接触的机会增加,有利于多糖溶出[11]。但酶的添加量过高时,各组分会在细胞内出现相互抑制反应,导致多糖得率下降;温度会加快分子的无规则运动,有助于多糖分子向细胞外扩散。温度低于50 ℃时,多糖得率随温度升高而增加,在50 ℃时达到峰值,温度超过50 ℃时得率下降,可能是因为酶的最适温度为50 ℃,温度过高会降低酶活,细胞壁分解不完全,降低了多糖溶出量,导致得率下降。

图2 酶添加量、浸提温度、浸提时间、料液比对多糖得率的影响Fig.2 Effects of enzyme additive amount, extraction temperature, extraction time and solid-to-liquid ratio on the extraction yield of polysaccharides
2.2.2 正交优化实验
根据单因素实验的结果,进行四因素三水平L9(34)的正交实验,其因素及水平见表3,正交实验设计及结果见表4。
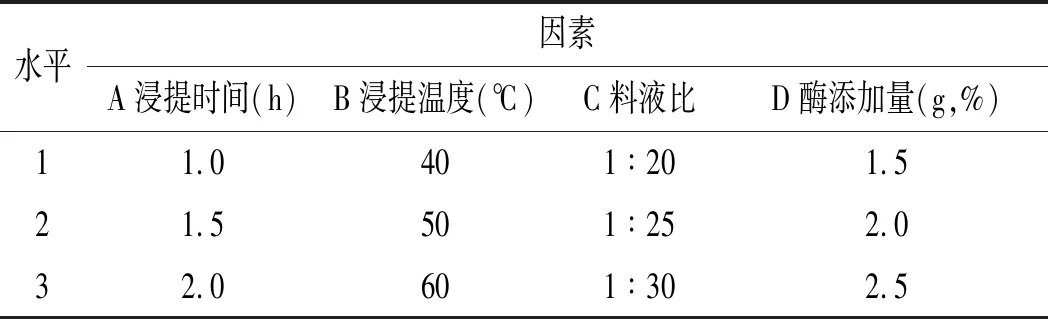
表3 复合酶解提取法正交实验因素水平表Table 3 The factors and levels of orthogonal array design for compound enzymatic extraction method

表4 复合酶解提取法正交试验结果分析Table 4 Analysis of orthogonal test results of compound enzymatic extraction method
由表4可知,影响多糖得率的各因素主次关系为:酶添加量(D)>料液比(C)>浸提时间(A)>浸提温度(B);且最佳工艺条件A1B3C3D3,即复合酶添加量2.5%、浸提温度60 ℃、浸提时间1 h、料液比1∶30,此条件下多糖得率为7.72%。
2.3 多糖形态特性对比
两种提取方法得到的多糖研磨成粉末后的形态对比图见图3。

图3 豆渣中可溶性多糖形态特性对比图Fig.3 The comparison diagrams of morphological characteristics of soluble polysaccharides in soybean residues注:A为超声辅助提取法得到的可溶性多糖;B为复合酶解提取法得到的可溶性多糖。
超声辅助提取法得到的多糖粉末颗粒较小,质地细密。复合酶解提取法得到的多糖粉末颗粒较大,质地粗糙,且研磨更加困难。这可能是由于超声的空化作用更有效地破坏了多糖的链式结构[12],使多糖分子量变小,所以相比复合酶解提取法得到的多糖呈现出粉末颗粒较小、质地细密的特点。
2.4 多糖溶解量测定
由表5可知,超声辅助提取法得到的豆渣中可溶性多糖的最大溶解量为5.1 mg/mL;复合酶解提取法的最大溶解量为4.2 mg/mL。超声波使多糖分子的羟基暴露更充分,亲水性更好,且超声波的空化作用使提取出来的多糖分子相比复合酶解提取得到的多糖分子的粒径更小,使得超声辅助提取法得到的多糖具有更高的溶解性。

表5 豆渣中可溶性多糖溶解量Table 5 The dissolution amount of soluble polysaccharides in soybean residues
2.5 总糖含量与糖醛酸含量分析
以葡萄糖为标准品制作标准曲线,以葡萄糖的浓度为横坐标,490 nm处的吸光值为纵坐标,得到的回归方程为y=0.0102x+0.0243,R2=0.9979。将两种多糖样品在490 nm处的吸光值带入标准曲线的线性回归方程中,经计算得到超声辅助提取法所得多糖总糖含量为83.28%,复合酶解提取法所得多糖的总糖含量为91.78%。
以半乳糖醛酸为标准品制作标准曲线,以半乳糖醛酸的浓度为横坐标,525 nm处的吸光值为纵坐标,得到的回归方程为y=0.014x+0.0217,R2=0.9952。将两种多糖样品在525 nm处的吸光值带入标准曲线的线性回归方程中,经计算得到超声辅助提取法所得多糖的糖醛酸含量为4.34%,复合酶解提取法所得多糖的糖醛酸含量为7.02%。
经过化学组成分析发现,复合酶解提取法所得多糖的总糖含量与糖醛酸含量均高于超声辅助提取法,多糖杂质少,酸性糖含量增加,可能是由于复合酶破坏了细胞壁,释放出半乳糖醛酸。
2.6 单糖组成分析
进一步通过HPLC测定两种不同提取方法所得多糖的单糖组成,以9种单糖标准品为对照,结果见表6。超声辅助提取法所得多糖中的主要单糖组分间物质的摩尔比是Gal∶Ara∶Glc∶Man为10.2∶2.4∶60.9∶26.4;复合酶解提取法所得多糖中的主要单糖组分间物质的摩尔比是Gal∶Ara∶Glc∶Man∶GalA为11.1∶5.9∶56.3∶21.3∶5.3。通过分析单糖组成可知,两种多糖的单糖组成基本一致,主要由甘露糖、葡萄糖和半乳糖组成,但酶解的糖中含有少量的半乳糖醛酸(GalA),可能是由于复合酶的参与使细胞壁降解得更加彻底。

表6 两种提取方法所得多糖的单糖组成Table 6 The monosaccharide composition of polysaccharides obtained by two extraction methods
2.7 紫外全波长扫描结果
超声辅助提取法与复合酶解提取法所得多糖的紫外可见光谱检测结果见图4。
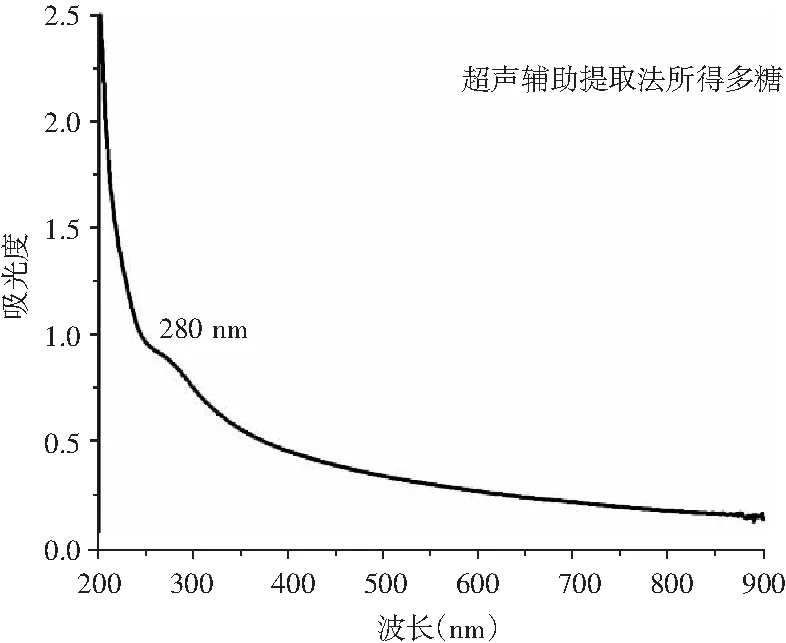
图4 两种提取方法所得多糖的UV-VIS吸收图谱Fig.4 UV-VIS absorption spectra of polysaccharides obtained by two extraction methods
由图4可知,两种多糖在280 nm处显示色氨酸特征吸收峰,表明两种多糖中均有蛋白的存在,但280 nm处峰面积较小,说明蛋白含量极低,多糖纯度较高[13]。
2.8 多糖红外光谱分析
两种提取方法得到的豆渣中可溶性多糖的红外测定结果见图5。
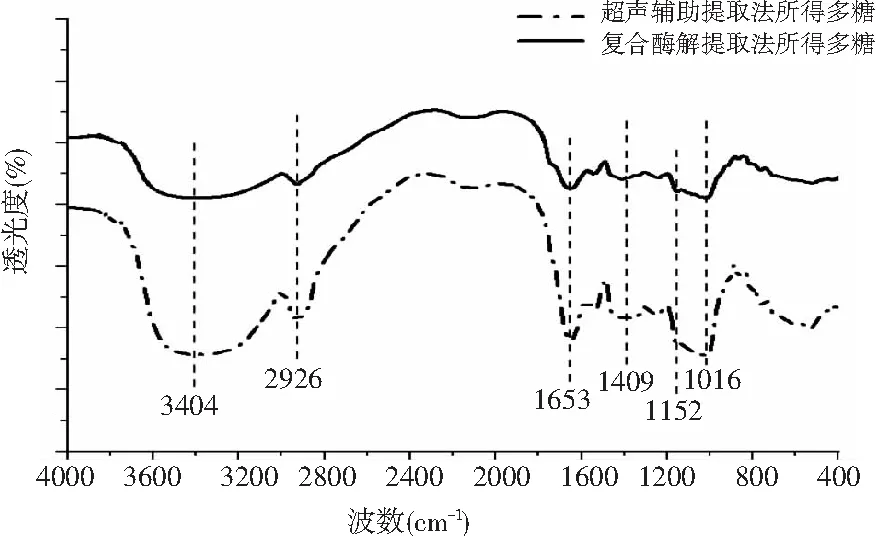
图5 可溶性多糖的红外谱图Fig.5 The infrared spectra of soluble polysaccharides
两种多糖在3404,2926,1653,1409,1152,1016 cm-1附近处有较强的吸收峰。其中在3404 cm-1附近处出现的吸收峰峰形较宽,为多糖-OH的伸缩振动。在2926 cm-1附近处的吸收峰为多糖的C-H伸缩振动。在1653 cm-1附近处的吸收峰为多糖的羰基O-C-O非对称振动。在1409 cm-1附近处的吸收峰由半乳聚糖骨架上的C-H振动产生。在1152 cm-1附近处的吸收峰由半乳糖共振产生,而在1016 cm-1附近处的吸收峰则表明该种多糖是吡喃型多糖。通过对以上官能团数据分析可知,超声辅助提取法和复合酶解提取法得到的多糖均具有多糖类物质的一般特征吸收峰[14-15],且对比两种多糖的红外谱图发现,两种提取方法均未破坏或者改变多糖的特征官能团,因此推断多糖的活性没有被改变。
2.9 两种提取方法总结比较
由表7可知,复合酶解提取法相比超声辅助提取法提取时间更短,提取温度低,用较少的豆渣且只需要添加少量的酶,便可以提高豆渣中可溶性多糖的得率。而超声辅助提取法得到的豆渣中可溶性多糖比复合酶解提取法的溶解性好,粉末颗粒较小,质地细密。

表7 两种提取方法的最佳提取工艺和结果比较Table 7 The comparison of the optimal extraction technology and results of the two extraction methods
3 结论
超声辅助提取法影响豆渣中的水溶性大豆多糖得率的最主要因素是超声功率,且最佳工艺条件为超声功率140 W、浸提温度70 ℃、浸提时间3 h、料液比1∶20,此条件下豆渣中可溶性多糖得率为6.13%。复合酶解提取法的最主要因素是酶添加量,且最佳工艺条件为酶添加量2.5%、浸提温度60 ℃、浸提时间1 h、料液比1∶30,此条件下豆渣中可溶性多糖得率为7.72%。
以上两种提取方法相比传统的热水浸提法,都具有快速、高效、节省能源、避免浪费等特点。且由红外分析可知,两种提取方法均未改变多糖的特征官能团,对多糖活性没有影响。虽然超声辅助提取法相比复合酶解提取法得到的多糖粉末质地更细密,溶解性更好,但考虑到实际应用时应该满足易操作、节能、省时和降低成本的特点,所以复合酶解提取法更易在生产中实现。为了增强豆渣中可溶性多糖的利用效果,未来可以考虑在复合酶解提取法的基础上加以超声辅助,提高多糖溶解性,以此促进豆渣的综合利用和大豆工业的发展,这也将是我们接下来进一步探讨的方向。

