Ti-40Nb 合金表面多孔结构的制备与形成机制
康彬彬, 李 伟, 刘 平, 张 柯
(上海理工大学 材料科学与工程学院,上海 200093)
在生物医用材料领域,纯钛和钛合金具有优异的生物相容性和耐腐蚀性,作为人体硬组织的最佳替代产品已在骨科和牙种植领域得到了广泛的应用[1-3]。具有高生物相容性和力学性能的氧化锆材料也已被应用到牙科种植体中[4]。然而,考虑到在表面形态、设计和连接等方面的广泛用途,钛及钛合金仍然是制备骨植入体的首选材料[5-7]。在众多合金中,Ti-Nb 系列β 钛合金由于其较高的强度和较低的弹性模量而受到越来越多的关注,并成为最具潜力的医用骨替代材料之一[8]。但是,β 钛合金在植入物的临床转化过程中会出现应力屏蔽现象,即自然骨和植入体之间弹性模量不匹配,导致其被植入人体后,载荷不能从植入体顺畅地传递到相邻的骨组织,致使周围出现骨吸收。为了解决这一问题,可以在纯钛或钛合金中引入孔隙以改善植入体的性能,从而降低材料的弹性模量。多孔结构的引入能够使植入体与植入部位骨组织的弹性模量相匹配,从而减轻甚至消除应力屏蔽的影响[9-10]。此外多孔结构使植入体具有更大的表面积和更粗糙的表面,这将有利于成骨细胞的黏附、增殖和分化,利于新生骨组织生长进入孔隙,获得植入体与骨组织之间的牢固结合,增强骨整合。
近年来,钛植入体的表面改性已成为许多公司和科研机构的主要关注点[11]。20 世纪70 年代初,牙科钛植入体的表面就已被加工成粗糙表面。植入体表面的纳米尺度特征以及化学成分决定了植入体周围早期的骨形成[12-14]。表面纳米尺度特征可以增加蛋白质的吸附并刺激成骨细胞迁移,从而加速骨整合[15-16]。大多数商用钛基植入体的粗糙表面都是通过混合技术制备的,例如喷砂处理后进行酸蚀处理[17]。此外,阳极氧化[18]、碱处理[19]、微弧氧化[20]以及各种沉积技术也被应用于钛合金的表面改性。然而,这些表面改性技术过程较为复杂且难以准确地控制多孔层的厚度和孔隙参数。去合金化是一个选择性腐蚀过程,通过从合金中选择性地去除一种成分,来制备连续多孔的高表面积金属[21],因其操作简便、可控性高和成本低廉等优点已引起国内外研究者的广泛关注[22];然而,该方法通常用于制备块状多孔材料,目前未见有报道将该方法应用于钛合金的表面改性。在各种钛合金表面改性的方法中,磁控溅射作为一种有力的方法,可以适应各种形状的植入体。将这两种技术相结合可以更方便地控制多孔结构层的厚度,为调控多孔结构的孔径和孔隙率提供更多的可能性和更广阔的空间。
本文采用磁控溅射和去合金化相结合的表面改性工艺,在Ti-40Nb 合金表面制备一层微纳通透的多孔结构层,以匹配人骨弹性模量,抑制应力屏蔽现象并促进组织生长。此外,通过对铸态合金的去合金化,探索磁控溅射薄膜与其铸态下成孔机制的区别。
1 试验方法
1.1 薄膜的制备
试验用Ti-40Nb 合金基底采用LG050 型悬浮熔炼炉熔炼而成,对熔炼获得的合金进行轧制和均匀化处理,然后切片并抛光。Ti-Nb-Cu 合金薄膜采用JGP-450 型多靶磁控溅射仪制备。磁控溅射采用Ti20.5Nb6.1Cu73.4复合靶材(质量分数99.95%),直径为75 mm,厚度为3 mm。合金薄膜沉积在Si 片和Ti-40Nb 合金基底上。试验前,Si 片和Ti-40Nb合金分别用丙酮和无水乙醇超声清洗各20 min 后烘干备用。在沉积之前,将真空腔室的真空度抽至低于3.0×10-4Pa。在沉积过程中,向溅射室注入25 cm3/min 流量的Ar,溅射时的工作气压为0.4 Pa。靶材由射频电源控制,薄膜溅射功率为120 W,沉积时间为1 h,基底不加热。试验过程中通过控制基底卡盘的自转获得均匀生长的Ti-Nb-Cu 合金薄膜,自转速度为10 r/min。
将溅射得到的样品放入0.5%HNO3水溶液中,在室温下搅拌,去合金化时间为4 h。去合金化完成后用去离子水冲洗样品,将剩余的酸洗净,然后放入1 mol/L 的KOH 水溶液中继续去合金化12,24,36 h。通过两种腐蚀剂的先后反应得到表面多孔结构,改变反应时间来调制薄膜的表面形貌以获得最佳的表面多孔结构。去合金化反应结束后,从溶液中取出样品,并依次用无水乙醇和去离子水冲洗数次以去除残留的腐蚀剂,然后将制备好的样品放入80 ℃的真空干燥箱中,避免氧化。
1.2 铸态Ti-Nb-Cu 合金的制备与去合金化
采用德国Buhler 真空非自耗电弧熔炼铸造设备制备Ti-Nb-Cu 合金铸锭。按20%Ti,10%Nb,70%Cu的配料比进行配料(配料比由磁控溅射出的Ti-Nb-Cu 合金薄膜中各元素的质量分数确定),将称量好的原材料放置于水冷铜模坩埚中,腔体抽真空至5×10-2Pa,并向腔体内通入高纯Ar,使腔体内气压保持在0.06 MPa 左右。使用约为350 mA 电流进行合金熔炼。为确保合金样品熔炼均匀,每个样品至少反复熔炼4 次,每次持续熔炼4~5 min,最后得到铸态Ti-Nb-Cu 合金。合金铸锭表面泛金属光泽,无氧化层。将铸态Ti-Nb-Cu 合金打磨抛光后放入30%HNO3水溶液中常温下去合金化4 h,然后将样品清洗、干燥。
1.3 表征与测试
采用Quanta 450 场发射环境扫描电子显微镜(scanning electron microscope, SEM)与能谱仪(energy dispersive spectroscopy, EDS)表征去合金化前后样品的表面和横截面形貌以及薄膜成分。采用X 射线衍射仪(X-ray diffraction, XRD)对去合金化前后的样品进行物相分析。样品的硬度、弹性模量以及载荷-位移曲线采用NANO Indenter G200 型纳米压痕仪进行测量。采用金相显微镜观察铸态Ti-Nb-Cu 合金的金相组织。
2 结果与分析
2.1 多孔结构的表征
通过磁控溅射制备Ti-Nb-Cu 合金薄膜,将其作为后续通过化学去合金化法制备多孔结构的试验样品。图1(a)为沉积在Si 片上的Ti-Nb-Cu 合金薄膜的表面和横截面SEM 图。从图1(a)中可以看出,薄膜表面呈现大颗粒聚集的形态,在此溅射条件下,沉积的薄膜均匀且致密,薄膜的厚度为1.2 μm左右。
图1(b)为沉积在Ti-40Nb 合金基底上的Ti-Nb-Cu 合金薄膜的SEM 图,对比图1(a)可以发现,沉积在Si 片和Ti-40Nb 合金基底上的薄膜具有相似的表面形貌,皆为大颗粒聚集在表面的具有一定表面粗糙度的薄膜。这是由于本试验中溅射功率较大,使得Ar 离子和沉积离子具有较高的能量,导致溅射速率较大,使得溅射在基底上的粒子来不及在表面进行迁移就已经形核长大,因此造成表面出现大颗粒聚集的现象;但是也增加了薄膜的表面粗糙度,使薄膜表面积增大,这有利于后续的去合金化制备多孔结构。对图1(b)~(d)中的薄膜进行EDS分析,结果见表1。Ti-Nb-Cu 合金薄膜中Nb 元素和Cu 元素的含量与靶材Ti20.5Nb6.1Cu73.4的成分相比,含量出现偏差,这是由于本试验溅射条件下,两种元素溅射速率的差异所致。
图1(c)为Ti-Nb-Cu 合金薄膜经过0.5%HNO3水溶液去合金化4 h 后的表面形貌。从图1(c)中可以看出薄膜表面出现了狭长的孔隙。对比表1 中的元素含量可知,薄膜中Cu 元素由原来的68.78%降低为25.09%,其他元素相应增加,这表明薄膜中Cu 元素在0.5%HNO3水溶液中被选择性地去除,其余元素扩散重组形成孔隙。继续延长去合金化时间,Cu 元素和薄膜表面形貌不会再有变化,这是由于随着表面Cu 元素被去除使得Ti 元素和Nb 元素暴露在表面,阻止了内部Cu 元素与酸的进一步反应。
试验选用KOH 碱性溶液对Ti-Nb-Cu 合金薄膜进行进一步去合金化,根据pH 电势图可知OH-很容易通过自发氧化与Cu 原子发生反应[23]。此外,Ti 原子也可以在碱性溶液中被腐蚀,与OH-反应形成Ti(OH)2,然后进一步分解为TiO2。图1(d)为Ti-Nb-Cu 合金薄膜经过0.5%HNO3水溶液去合金化4 h,随后在1 mol/L KOH 水溶液中去合金化12 h后的表面形貌。从图1(d)中可以看出,薄膜表面已经形成了具有微纳通透特征的多孔结构,孔隙均匀地分布在薄膜的表面,且表现为分层多级孔。这种多孔的纳米结构可以为成骨细胞的生长提供有利的条件,增强蛋白质的吸附,加强成骨细胞的迁移、血管的生成和早期的骨形成[24-25]。Park 等[26-27]研究发现,具有这种纳米多孔结构的植入体表面可以缩短骨整合的时间,使植入体与骨组织之间形成机械互锁,并确保骨和植入物界面的长期机械稳定性。从表1 中的元素组成可以看出,薄膜中的Cu 元素已经被完全去除,部分Ti 元素在 KOH 水溶液中形成TiO2,导致Nb 元素含量相对增加。将在 KOH 水溶液中去合金化的时间延长至24 h,多孔结构逐渐消失,形成封闭的孔洞,如图1(e)所示。将在KOH 水溶液中去合金化的时间延长至36 h,孔洞消失,薄膜表面趋于平整,如图1(f)所示。

图 1 去合金化前后Ti-Nb-Cu 合金薄膜的SEM 图Fig.1 SEM images of the Ti-Nb-Cu alloy films before and after dealloying

表 1 去合金化前后Ti-Nb-Cu 合金薄膜的元素组成(质量分数/%)Tab.1 Compositions of the Ti-Nb-Cu alloy films before and after alloying (mass fraction/%)
图2 为Ti-40Nb 合金和不同条件下Ti-Nb-Cu合金薄膜的XRD 谱图。在图2(b)和(c)的XRD衍射峰中,在43°附近出现Cu(111)的宽峰,说明沉积的Ti-Nb-Cu 合金薄膜中Cu 元素以非晶的形式存在。此外,对比图 2(a)Ti-40Nb 合金的衍射峰可知,Ti-Nb-Cu 合金薄膜中Ti 元素以β-Ti 的形式存在。薄膜在0.5 %HNO3水溶液中去合金化4 h 后,大部分Cu 元素被选择性地去除,对应于图2(d),Cu 元素的衍射峰消失,但此时薄膜中仍存在Cu 元素,这是由于在39°附近的NbTi 峰强度增加,少量Cu 元素的峰强度与之相比无法在衍射谱图中显示。在37°附近出现TiO2的衍射峰,这是由于在样品保存过程中与空气接触,表面的Ti 元素被氧化所致。图2(e)为经过1 mol/L KOH 水溶液去合金化12 h 后Ti-Nb-Cu 合金薄膜的XRD 谱图,NbTi(110)特征峰的强度再次加强,这是由于薄膜中Cu 元素已被完全去除。综合分析XRD 谱图发现,其与SEM图反映的结果相一致。

图 2 Ti-40Nb 合金和不同条件下Ti-Nb-Cu合金薄膜的XRD 谱图Fig.2 XRD patterns of the Ti-40Nb alloy and Ti-Nb-Cu alloy films under different conditions
2.2 多孔结构的力学性能分析
2.2.1 弹性模量和硬度

图 3 Ti-40Nb 合金(S1),Ti-Nb-Cu 合金薄膜(S2),HNO3 去合金化4 h(S3),HNO3 去合金化4 h+KOH 去合金化12 h(S4)的弹性模量与硬度Fig.3 Elastic modulus and hardness of Ti-40Nb alloy (S1),Ti-Nb-Cu thin alloy film (S2), dealloying in HNO3 for 4 h(S3) and dealloying in HNO3 for 4 h+KOH for 12 h(S4)
试验采用纳米压痕仪来测量多孔结构的弹性模量和硬度。图3 为Ti-40Nb 合金以及Ti-Nb-Cu合金薄膜去合金化前后弹性模量和硬度的变化图。从图3 中可以看出,随着多孔结构的形成,薄膜的弹性模量逐渐降低,但硬度也在降低。其中Ti-40Nb合金基底的弹性模量约90 GPa;沉积一层Ti-Nb-Cu合金薄膜后表面弹性模量降低到71 GPa;在0.5%HNO3水溶液中去合金化后,表面弹性模量降低到56 GPa;在1 mol/L KOH 水溶液中继续对其去合金化,形成了多孔结构,表面弹性模量降低到37 GPa,接近人体骨骼和皮质的弹性模量,达到了种植体所需的弹性模量。随着薄膜的沉积和多孔结构的形成,Ti-40Nb 合金的表面硬度也由原来的3.0 GPa降低到0.8 GPa,但是表面硬度的降低并不会影响合金的整体强度。
2.2.2 超弹性
采用纳米压痕仪测出Ti-40Nb 合金和去合金化前后Ti-Nb-Cu合金薄膜的载荷-位移曲线,见图4。比较图4 中的4 条载荷-位移曲线可以发现,随着多孔结构的形成,压头的压入深度逐渐增加,残余压痕深度也显著增加,而且在去合金化后出现压入深度突然增加的现象。这说明多孔结构的形成降低了合金的表面弹性模量,同时也大幅降低了合金的表面强度和硬度。但是从多孔结构的载荷-位移曲线可以看出,其仍然具有超弹性。
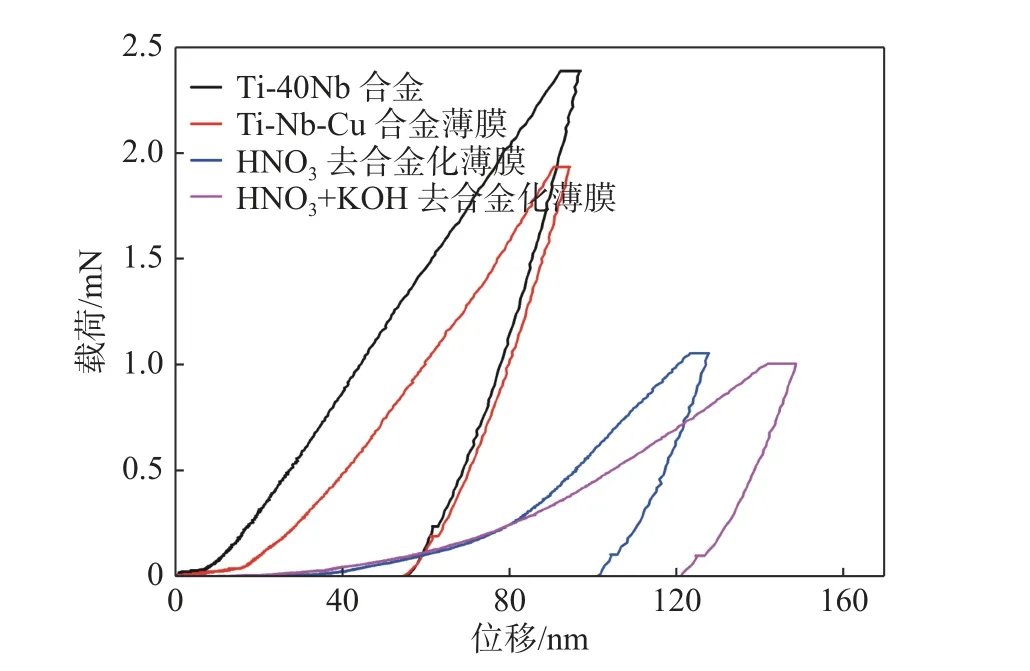
图 4 Ti-40Nb 合金以及去合金化前后薄膜的载荷-位移曲线Fig.4 Load-displacement curves of the Ti-40Nb alloy and thin films before and after dealloying
2.3 铸态合金的成孔机制
为了研究磁控溅射制备的Ti-Nb-Cu 合金薄膜与铸态Ti-Nb-Cu 合金成孔机制的区别,在相同的酸中对铸态合金进行去合金化。本文选择30%HNO3水溶液对铸态Ti-Nb-Cu 合金进行去合金化,与腐蚀Ti-Nb-Cu 合金薄膜所用的0.5% HNO3水溶液相比,在浓度上做出了调整,这是因为铸态合金厚度较大,为了能直观快速地观察多孔结构的形成,使用了浓度更高的30%HNO3水溶液。图5(a)和(b)为铸态Ti-Nb-Cu 合金的金相图。从图5 中可以看出,铸态Ti-Nb-Cu 合金主要由两种组织组成,从其XRD 谱图(图6a)分析得出,两种组织分别为CuNbTi 相和CuTi 相。经过30%HNO3水溶液去合金化4 h 后,出现不连续的细长孔(图5c)。对比分析图6 中铸态Ti-Nb-Cu 合金去合金化前后的XRD谱图可知,去合金化后39°,56°,69°附近TiNb 相的衍射峰消失,同时部分CuTi 相也在去合金化后从衍射谱图中消失。由此可以得出:在30%HNO3水溶液中去合金化4 h 后,CuTiNb 相被选择性地腐蚀掉,腐蚀掉的CuTiNb 相则由TiNb 的先析出相和部分CuTi 的固溶体组成。图5(d)为铸态Ti-Nb-Cu 合金去合金化后的表面形貌,此时由剩余的CuTi 相构成的多孔结构已经形成,为孔径5 μm 左右的大孔,且孔隙之间互不连通。

图 5 铸态Ti-Nb-Cu 合金去合金化前后的金相图和SEM 图Fig.5 Metallography and SEM images of the as-cast Ti-Nb-Cu alloys before and after dealloying
Ti-Cu 合金已在体外和体内试验中被证实具有出色的抗菌性能[28]。Liu 等[29-30]证明了由Ti-Cu 合
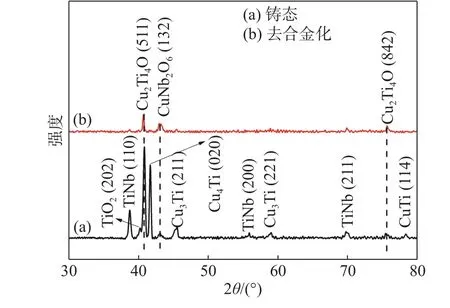
图 6 铸态Ti-Nb-Cu 合金去合金化前后的XRD 谱图Fig.6 XRD patterns of the as-cast Ti-Nb-Cu alloys before and after dealloying
金制成的牙科植入物在体内具有明显的抗菌活性,与纯钛植入物相比,抑制了细菌感染导致的骨吸收。但是,由于钛和钛合金的生物惰性,作为植入物难以与软组织形成生物整合,因此,需要在不降低抗菌活性的情况下改善其生物相容性。表面改性可以改变植入物的表面结构、形态和化学组成,从而提高材料的生物相容性[31]。本试验所制备的表面Ti-Cu 多孔结构有望解决这一问题,值得后续对其进行深入研究。
3 结 论
(1)本文通过磁控溅射在Ti-40Nb 合金基体上沉积了一层均匀且致密的Ti-Nb-Cu 合金薄膜,并以此薄膜作为制备纳米多孔结构的前驱体薄膜。在0.5%HNO3水溶液中去合金化4 h,随后继续在1 mol/L KOH 水溶液中去合金化12 h,可以得到微纳通透的分层多级孔。
(2)多孔结构的形成使合金的表面弹性模量达到37 GPa,接近人骨弹性模量,达到种植体所需的弹性模量,有效降低了应力屏蔽带来的影响。
(3)对比分析铸态Ti-Nb-Cu 合金和磁控溅射Ti-Nb-Cu 合金薄膜成孔的过程可以得出,Ti-Nb-Cu合金薄膜去合金化后,薄膜中的Cu 元素被选择性地去除,留下TiNb 相形成多孔结构,且为微纳通透的分层多级孔;而铸态Ti-Nb-Cu 合金则是选择性地将CuNbTi 相去除,留下CuTi 相形成多孔结构,孔径较大且互不连通。

