钙、磷对免疫抑制仔猪生长性能、血液生理生化指标及矿物元素代谢的影响
李 净 倪姮佳* 黄勇刚 李 梦 谭碧娥
(1.湖南农业大学动物科学技术学院,动物营养基因组与种质创新研究中心,长沙 2410128;2.中国科学院亚热带农业生态研究所,动物营养生理与代谢过程湖南省重点实验室,长沙 2410125)
新生仔猪免疫系统发育不够成熟,断奶前主要依赖于猪乳中母源抗体的保护[1]。断奶后,由于饲喂环境及饮食的改变,细菌、病毒、真菌等病原微生物通过损伤免疫器官和细胞,干扰抗原呈递,抑制或阻断抗体的生成,导致仔猪抗病能力下降,引发免疫抑制[2-5]。免疫抑制仔猪的临床症状为淋巴细胞(LYM)数量减少、活性下降,抗体生成减少,免疫器官发育不良等,表现为生长发育迟缓、腹泻严重及死亡率高[6-9]。因此,研究免疫抑制仔猪的营养调控对提高断奶仔猪存活率、提高养殖效益具有重要意义。
钙和磷是生物必需的元素,参与构建骨骼、肌肉、神经和体液等组织,参与神经传递、肌肉收缩以及激素分泌等重要生理过程[10]。钙离子作为第二信使参与了B淋巴细胞、T淋巴细胞、巨噬细胞和肥大细胞等免疫细胞间的信号传递[11]。磷也是代谢和信号传导过程的重要元素,与钙元素一起参与骨骼代谢和免疫调节[12]。当仔猪处于非健康状态时,机体对矿物元素的需要量与健康状态时存在差异,因此,部分学者认为适当提高非健康仔猪的矿物元素供给有助于改善免疫系统功能,缩短病程[13-14]。另外,研究表明,补钙可显著缓解高脂饮食导致的结肠炎症和免疫反应[15];提高细胞内钙离子的浓度可显著调高细胞毒性T淋巴细胞和自然杀伤细胞的功能[16]。因此,依据前人研究结果推测,适当补钙有助于提高机体的免疫功能,缓解免疫抑制对仔猪生长发育造成的影响,但目前缺乏相关的研究。
伊立替康(irinotecan,CPT)是一种治疗癌症的化疗药物,具有抑制机体免疫功能的副作用,临床表现为严重腹泻[17-18],目前,该药物常用于建立动物免疫抑制模型。研究表明,断奶仔猪在1.5倍NRC标准的钙水平饲粮饲喂下,料重比(F/G)最低,平均日增重(ADG)最高,生长性能达到最优[19]。在对仔猪没有毒副作用的前提下,本研究想进一步探讨1.5倍NRC(2012)标准的钙、磷对免疫的调控机制,拟通过腹腔注射CPT(注射剂量18 mg/kg BW)建立免疫抑制仔猪模型[20],研究适当提高饲粮钙、磷水平(固定钙∶磷为1.2∶对CPT所致免疫抑制仔猪生长性能、血液生理生化指标及矿物元素代谢的影响。
1 材料与方法
1.1 试验动物、分组和饲养管理
本试验选取18头2~4胎次22日龄的“杜长大”三元杂交断奶仔猪,公母各占1/2,随机分为3组,分别为对照组、模型组和试验组,其中对照组和模型组的饲粮钙、磷水平参考NRC(2012)标准,试验组的饲粮钙、磷水平为1.5倍NRC(2012)标准。每个组6个重复,每个重复1头猪,所有猪只单栏饲养。试验选用2种基础饲粮(饲粮组成及营养水平见表1),分别用于试验Ⅰ期(第1~14天)和试验Ⅱ期(第15~28天)。试验第23天,模型组和试验组仔猪腹腔注射18 mg/kg BW CPT,连续注射4 d,对照组注射等量生理盐水。试验期间所有猪只自由采食和饮水(以吃完后料槽内有少量剩料为准),每天饲喂3次(08:00、12:00和18:00)。饲喂期间观察仔猪健康和腹泻情况,记录每日饲粮消耗量。
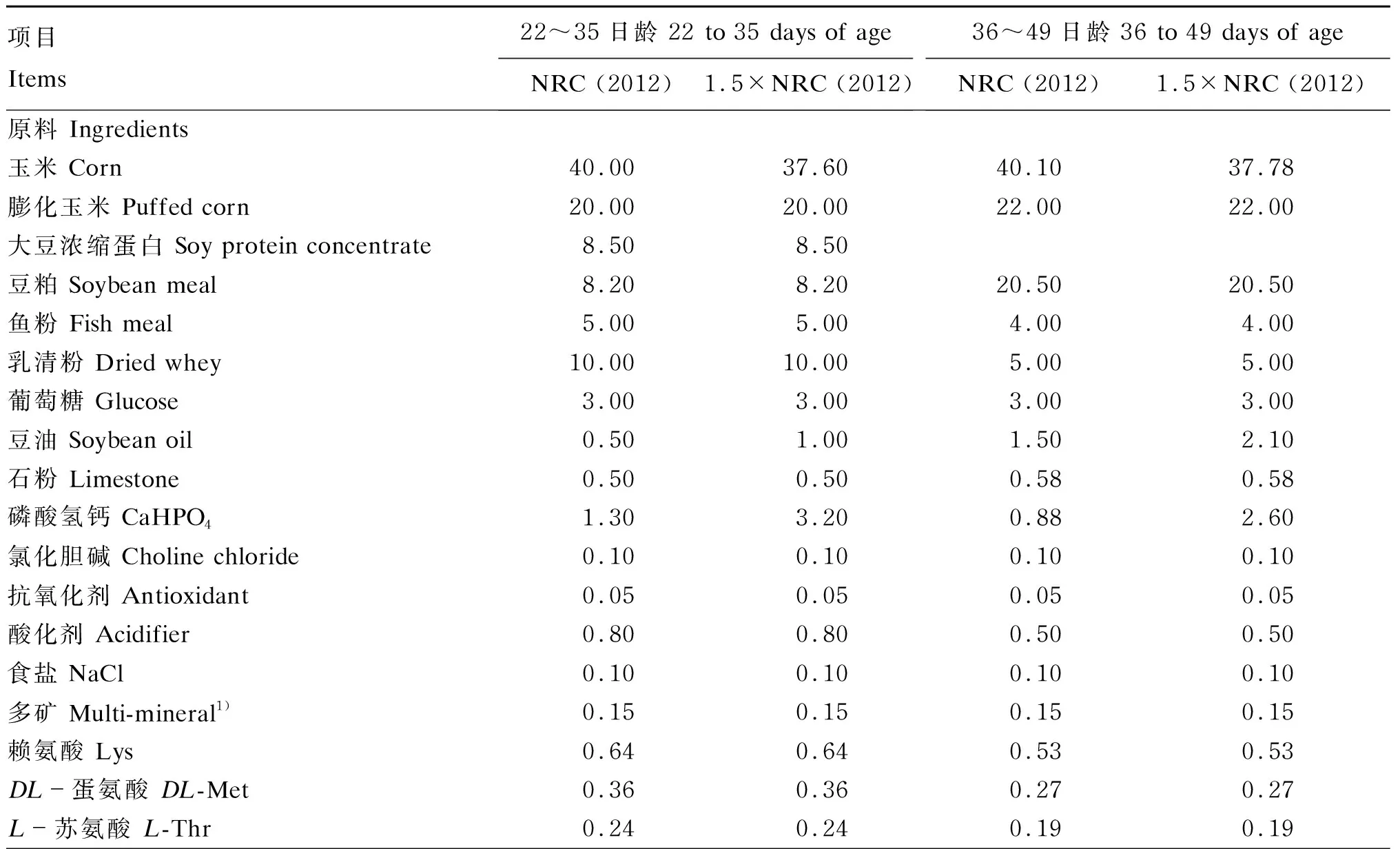
表1 饲粮组成及营养水平(风干基础)

续表1项目 Items22~35日龄 22 to 35 days of ageNRC (2012)1.5×NRC (2012)36~49日龄 36 to 49 days of ageNRC (2012)1.5×NRC (2012)L-色氨酸 L-Trp0.060.060.050.05预混料 Premix2)0.500.500.500.50合计 Total100.00100.00100.00100.00营养水平 Nutrient levels3)消化能 DE/(MJ/kg)14.4113.7014.4213.78代谢能 ME/(MJ/kg)14.2513.5514.3213.67粗蛋白质 CP 17.9417.8917.6417.46粗脂肪 EE3.103.524.194.70钙 Ca0.811.190.721.07总磷 TP0.691.000.570.84有效磷 AP0.490.800.360.64
1.2 样本采集
试验第29天,对禁食12 h的仔猪进行屠宰采样。采集前腔静脉血液,一部分置于5 mL乙二胺四乙酸二钾(EDTA-K2)抗凝管中,用于测定血常规和血浆生化指标;另一部分置于普通采血管中,静置15 min后,1 237×g离心10 min,分离血清,-80 ℃保存,用于血清微量元素含量的测定。仔猪放血处死后取出肝脏、肾脏和结肠食糜,并于-20 ℃保存,用于钙、磷、铜、铁和锰含量的测定。
1.3 指标测定
1.3.1 生长性能和腹泻指数
记录仔猪每天的采食量,于试验第1、15和29天早上对仔猪进行空腹称重,计算试验Ⅰ期、试验Ⅱ期和全期的ADG、平均日采食量(ADFI)和F/G。
试验期间观察并记录每头仔猪每天的腹泻情况,依据腹泻状况评分标准进行评分[21],不腹泻为0分,轻度腹泻为1分,中度腹泻为2分,重度腹泻为3分,分别计算试验Ⅰ期、试验Ⅱ期和全期的腹泻指数,计算公式如下:
腹泻指数=每头仔猪腹泻评分之和/
该头仔猪饲养天数。
1.3.2 血常规指标
使用全自动血液细胞分析仪(BC-5000VET,深圳迈瑞生物医疗电子股份有限公司)测定血液中各类常规指标,包括白细胞(WBC)、中性粒细胞(NEU)、LYM、单核细胞(MON)、嗜酸性粒细胞(EOS)、嗜碱性粒细胞(BAS)及红细胞(RBC)数量、血红蛋白(HGB)含量、红细胞压积(HCT)、平均红细胞体积(MCV)、平均红细胞血红蛋白含量(MCH)、平均红细胞血红蛋白浓度(MCHC)、红细胞分布宽度变异系数(RDW-CV)、红细胞分布宽度标准差(RDW-SD)、血小板(PLT)数量、平均血小板体积(MPV)、血小板体积分布宽度(PDW)以及血小板压积(PCT)等。
1.3.3 血浆生化指标
使用全自动生化分析仪(Cobas c311,罗氏公司)测定仔猪血浆中总蛋白(TP)、白蛋白(ALB)、补体4(C4)、免疫球蛋白M(IgM)的含量以及谷丙转氨酶(ALT)和谷草转氨酶(AST)的活性等。测定方法参照相关试剂盒说明书。
1.3.4 肝脏、肾脏、结肠上段食糜和血清中钙、磷、铜、铁和锰的含量
取15.0 g左右肝脏、肾脏和结肠上段食糜冷冻干燥并粉碎。称取0.20 g粉碎样品或0.5 mL血清置于微波消解罐中,依次加入10 mL浓硝酸和1 mL过氧化氢,使用微波消解仪进行消煮,消煮结束后在消解罐中再加入0.5 mL高氯酸,180 ℃赶酸2 h。最后,用1%硝酸定容至10 mL,用电感耦合等离子体发射光谱仪(Agilent 5110 ICP-OES)检测样品中钙、磷、铜、铁和锰的含量。
1.4 数据统计分析
仔猪免疫抑制模型评估采用SPSS 25.0软件进行t检验(student’st-test),其余试验数据采用单因素方差分析(one-way ANOVA),差异显著时采用Duncan氏法进行多重比较。试验结果以平均值(mean)和均值标准误(SEM)表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 仔猪免疫抑制模型的建立
以腹泻指数和血液免疫细胞数为指标,对本研究建立的免疫抑制仔猪模型进行评估,结果如图1所示,建模后(试验第23~28天),与对照组相比,模型组仔猪血液中WBC、NEU、LYM、MON和EOS的数量显著降低(P<0.05),腹泻指数显著升高(P<0.05),表明本试验的免疫抑制仔猪模型建立成功。

*表示P<0.05,**表示P<0.01,***表示P<0.001。
2.2 钙、磷对免疫抑制仔猪生长性能和腹泻指数的影响
钙、磷对免疫抑制仔猪生长性能和腹泻指数的影响结果如表2所示。试验Ⅰ期,各组间仔猪生长性能和腹泻指数无显著差异(P>0.05)。试验Ⅱ期,与对照组相比,模型组仔猪ADG显著降低(P<0.05),F/G和腹泻指数显著升高(P<0.05);而与模型组相比,试验组仔猪ADG有升高趋势(P>0.05),F/G有降低趋势(P>0.05),腹泻指数显著降低(P<0.05)。试验全期,对照组仔猪ADG显著高于其他2组(P<0.05),F/G显著低于其他2组(P<0.05)。

表2 钙、磷对免疫抑制仔猪生长性能和腹泻指数的影响
2.3 钙、磷对免疫抑制仔猪血常规指标的影响
钙、磷对免疫抑制仔猪血常规指标的影响结果如表3所示。与对照组相比,模型组和试验组仔猪血液中WBC、NEU、LYM和EOS的数量显著降低(P<0.05),模型组仔猪血液中MON的数量显著降低(P<0.05),血液中HGB的含量显著升高(P<0.05);而与模型组相比,试验组仔猪血液中MON的数量有升高趋势(P>0.05),血液中HGB的含量有降低趋势(P>0.05)。

表3 钙、磷对免疫抑制仔猪血常规指标的影响

续表3项目 Items对照组Control group模型组Model group试验组Experimental groupSEMP值P-value血小板 PLT/(×109个/L)310.20278.17262.5029.6980.829平均血小板体积 MPV/fL9.789.7710.220.1570.430血小板体积分布宽度 PDW/%15.2615.1815.250.0900.939血小板压积 PCT/%0.300.270.260.0270.875
2.4 钙、磷对免疫抑制仔猪血浆生化指标的影响
钙、磷对免疫抑制仔猪血浆生化指标的影响结果如表4所示。与对照组相比,模型组和试验组仔猪血浆中TP的含量显著升高(P<0.05),模型组和试验组仔猪血浆中TP的含量无显著差异(P>0.05)。

表4 钙、磷对免疫抑制仔猪血浆生化指标的影响
2.5 钙、磷对免疫抑制仔猪肝脏、肾脏、血清和结肠食糜中钙、磷、铜、铁和锰含量的影响
饲粮添加高钙、高磷对免疫抑制仔猪肝脏、肾脏、血清和结肠食糜中钙、磷、铜、铁和锰含量的影响结果如表5~表8所示。与对照组相比,模型组和试验组仔猪血清中铜的含量显著升高(P<0.05)(表5),结肠上段食糜中铜、铁的含量显著降低(P<0.05)(表6)。与对照组和模型组相比,试验组仔猪肝脏中磷的含量显著升高(P<0.05)(表7)。饲粮添加高钙、高磷对免疫抑制仔猪肾脏中钙、磷、铜、铁和锰的含量无显著影响(P>0.05)(表8)。

表5 钙、磷对免疫抑制仔猪血清中钙、磷、铜、铁和锰含量的影响
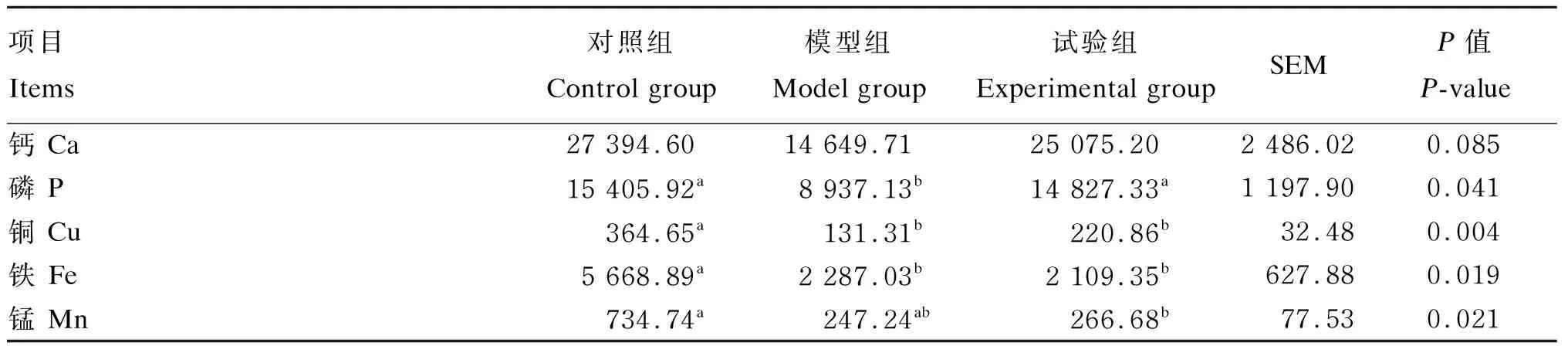
表6 钙、磷对免疫抑制仔猪结肠上段食糜中钙、磷、铜、铁和锰含量的影响

表7 钙、磷对免疫抑制仔猪肝脏中钙、磷、铜、铁和锰含量的影响
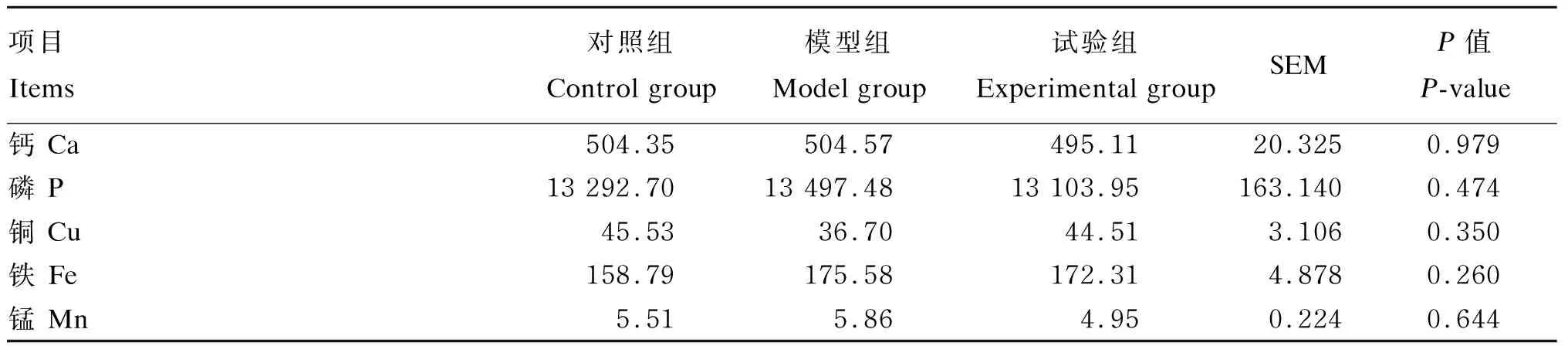
表8 钙、磷对免疫抑制仔猪肾脏中钙、磷、铜、铁、锰含量的影响
3 讨 论
当机体发生免疫抑制时,动物生长发育缓慢。研究发现,母猪采食脱氧雪腐镰刀菌烯醇污染的饲粮,会产生免疫抑制,并且使得ADFI显著降低,生长速度减慢[7];给BALB/C小鼠腹腔注射100 mg/kg CPT会引发小鼠延迟性腹泻[22]。本研究发现,CPT严重影响了断奶仔猪的生长,并导致了腹泻,而提高饲粮的钙、磷水平可显著降低免疫抑制仔猪的腹泻指数,有助于提高仔猪的ADG,这一现象可能与膳食钙对肠道健康的调控有关。Zhang等[23]比较不同水平丙酸钙对犊牛生长性能的影响,发现补钙可以改善犊牛的ADG和饲料转换率。此外,研究表明,高钙饲粮可以通过缓解肠腔内的有害物质对肠黏的刺激,抑制肠道通透性的增加,最终缓解腹泻[24]。
血液中WBC的数量与体内的免疫反应有关。其中,NEU比例升高可能为细菌感染[25],LYM比例发生变化可能与病毒感染有关[26]。研究表明,钙离子可调控LYM的功能,并作为第二信使参与了免疫细胞间的信号传导[27-28]。本研究发现,提高饲粮钙、磷水平有助于提高免疫抑制仔猪血液中MON的数量,该现象可能与钙对MON功能的调控有关。因为钙可通过作用于MON的钙敏感受体,促进MON的聚集,从而调节体内和体外的先天免疫应答[29]。当机体免疫功能受阻时,血液生化指标也会产生变化[30]。例如呕吐、腹泻、高热和休克等可导致血浆因水分丧失而浓缩,使得血浆蛋白含量相对性升高[31]。本研究中,免疫抑制仔猪的血浆TP含量升高可能与免疫抑制仔猪的严重腹泻有关。
虽然补充矿物元素对机体健康有诸多好处,但其对免疫功能的调控具有两面性。缺乏或过量均会导致免疫抑制,并且补充过高剂量的钙、磷还会影响其他微量元素的吸收和代谢[32]。因此,为了探讨本试验所使用的钙、磷水平是否影响了微量元素的代谢,我们对仔猪脏器和结肠食糜中的矿物元素含量进行了分析。结果发现,免疫抑制仔猪饲喂1.5倍NRC(2012)水平的钙、磷后,肝脏中的微量元素含量与对照组无显著差异,而肝脏是机体储存微量元素的主要器官,这表明本试验所用的钙、磷剂量对机体的微量元素代谢无显著影响。但是,本研究发现,免疫抑制仔猪结肠食糜中铜的含量显著降低,血清中铜的含量显著升高,表明免疫抑制仔猪会提高对铜的利用率。铜是参与免疫反应的关键元素,病畜适当补充铜元素有助于提高机体的免疫功能,恢复正常的生理功能[33]。因此,本研究中仔猪的铜利用率升高可能是机体在免疫抑制状态下的一种反馈调节,促进了仔猪免疫功能的恢复。
4 结 论
① 仔猪腹腔注射CPT可引起仔猪腹泻,严重影响仔猪的生长性能,降低仔猪血液中免疫细胞的数量,据此建立仔猪免疫抑制模型。
② 饲粮补充1.5倍NRC(2012)标准的钙、磷可有效缓解CPT所致免疫抑制对仔猪生长的影响,减少腹泻,有助于恢复血液中MON的数量,并且不会干扰其他微量元素的代谢。

