龙眼核多酚对蛋白非酶糖基化的抑制及机制研究
郑子锋,孙培冬*
1(食品胶体与生物技术教育部重点实验室(江南大学),江苏 无锡,214122)2(江南大学 化工与材料工程学院,江苏 无锡,214122)
自1981年MONNIER提出体内蛋白的非酶褐变可能与衰老、相关病理有关[1],这一“非酶糖基化衰老假说”[2]揭示了非酶糖基化反应产物是衰老的生物标志之一[3]。蛋白结构中游离的氨基与还原糖的羰基在非酶的条件下,经过缩合、重排、降解、氧化等复杂的反应,生成不可逆程度非常高的晚期糖化产物(advanced glycation end-products,AGEs)。这些AGEs的形成除了可能导致蛋白本身的功能丧失,还能通过与其受体结合使NF-κB激活,加重机体的氧化应激和炎症反应,它们在细胞和细胞间基质中的积累导致细胞、组织和器官的代谢紊乱,对多种慢性病(糖尿病、动脉粥样硬化等)具有致病作用[4-5]。因此寻找可以抑制蛋白糖基化的物质具有重要意义。
氨基胍(amino guanidine,AG)是实验室中最常用的标准抗糖化剂,但它在临床测试中与机体产生不良反应而被中止应用[6]。据报道,许多天然物质具有抗糖化性能,植物多酚在体外实验中表现出较好的抗糖化活性[7-8],多酚通过与羰基结合[9],或者与氨基结合[10],以及抗氧化和螯合金属离子[11]等机制抑制AGEs产生。虽然多酚抑制非酶糖基化的一些机制已经被报道,但是多酚对蛋白质糖化各阶段的影响尚不清晰。
龙眼核中含有多种多酚类物质,包括柯里拉京、诃子鞣质、地榆酸内酯、鞣花酸等多种化学成分[12-13]。本课题组已对龙眼核多酚进行分离和纯化,发现龙眼核多酚有良好的抗氧化性,与常用抗氧化剂抗坏血酸相当[12]。本研究通过检测具有荧光特性的AGEs和非交联AGE羧甲基赖氨酸(Nε-(carboxymethyl) lysine,CML)的含量,对龙眼核多酚抑制蛋白非酶糖基化效果进行评价,并利用不同的反应模型对龙眼核多酚抑制蛋白非酶糖基化的作用机制进行较为完整的分析,为龙眼核多酚的抗糖基化功能研究提供理论依据。
1 材料与方法
1.1 试剂与仪器
龙眼核多酚(乙酸乙酯相),实验室自制,经Folin-酚比色法检测总酚含量为663.5 mg/g[12];牛血清白蛋白(bovine serum albumin,BSA,≥96%)、氨基胍盐酸盐(≥98%)、二甲基亚砜(dimethyl sulfoxide,DMSO,≥99%)、丙酮醛(methylglyoxal,MGO,40%水溶液)、N(α)-Boc-L-精氨酸(98%),阿拉丁;无水葡萄糖、冰乙酸、氯化硝基四氮唑蓝(nitrotetrazolium blue chloride,NBT),均为分析纯,邻苯二胺(o-phenylenediamine,OPD)、乙二醛(glyoxal,GO,40%水溶液),化学纯,甲醇(≥99.9%,色谱纯),国药集团化学试剂有限公司;牛羧甲基赖氨酸(Nε-(carboxymethyl) lysine,CML)试剂盒,上海联迈生物工程有限公司;Proclin 300,美国Rohm & Haas公司。
超滤管,美国Millipore公司;ME204E型电子分析天平,Mettler Toledo仪器(上海)有限公司;Infinite M200 PRO酶标仪,瑞士Tecan集团;CARY Eclipse荧光分光光度计,美国Varian有限公司;1525u高效液相色谱仪,美国Waters公司;TG16高速离心机,上海卢湘仪离心机有限公司。
1.2 实验方法
1.2.1 体外蛋白非酶糖基化模型的建立
参考PENG等[14]的方法,建立BSA-葡萄糖反应模型。用0.2 mol/L pH 7.4的磷酸缓冲液(phosphate buffered solution,PBS, 0.2% proclin 300作为防腐剂)配制30 mg/mL BSA、300 mg/mL葡萄糖溶液、60 μg/mL AG溶液。用DMSO溶解龙眼核多酚配制成质量浓度为20 mg/mL的溶液,然后用PBS稀释龙眼核多酚溶液至15、60、120、180、240 μg/mL。在超净工作台上将BSA、葡萄糖和龙眼核多酚溶液过0.22 μm滤膜,并等体积混合。将龙眼核多酚替换成60 μg/mL AG作为阳性对照,未加龙眼核多酚或AG作为阴性对照,将葡萄糖溶液替换成PBS溶液作为对照。在37 ℃恒温培养箱中培养10 d,分别在1、3、5、7、10 d取培养液进行Amadori产物、二羰基化合物含量、荧光性AGEs测定。
1.2.2 Amadori产物测定
采用ZHANG等[15]的方法,将0.2 mL培养液和0.8 mL 0.3 mmol/L NBT试剂加入到2 mL碳酸盐缓冲液(100 mmol/L,pH 10.1)中,在40 ℃下反应1 h,用酶标仪在530 nm波长处测定OD值。
1.2.3 二羰基化合物含量测定
采用柱前衍生高效液相色谱法[16]对GO、MGO和3-脱氧葡萄醛酮(3-deoxyglucosone,3-DG)进行测定。取1 mL培养液于30 kD超滤管,以4 500 ×g离心12 min。取外管滤液900 μL,加入20 μL乙酸和30 μL 100 mmol/L OPD液在样品瓶中混合,充氮气,在40 ℃下衍生反应80 min。以GO、MGO浓度(x,μmol/L)与峰面积(y)建立GO、MGO的标准曲线,分别为y=8 221.8x+45.8,R2=0.999 8,y=7 556.6x+129.16,R2=0.998,根据标准曲线计算GO、MGO含量。通过液质联用,确定3-DG出峰位置[17],对3-DG用峰面积进行含量相对比较。高效液相色谱条件为:
色谱柱:WondaCract ODS-2 C18柱(150 mm×4.6 mm, 5 μm);柱温25 ℃;流速0.8 mL/min;进样量10 μL;紫外检测器:313 nm;流动相:A相为体积分数10%的甲醇水溶液(0.2%乙酸),B相为甲醇(0.2%乙酸);洗脱条件:0 min,90%A;12~15 min,0%A;16~20 min,90%A。
1.2.4 荧光性晚期糖基化产物测定
采用PAGEON等的方法[18],利用荧光分光光度计,在激发/发射波长(ex/em)370/440 nm、335/385 nm对培养液中荧光值进行测定,并按公式(1)计算龙眼核多酚或AG对荧光性AGEs的抑制率。

(1)
式中:A1,阴性对照荧光值;A0,只含有BSA组的荧光值;A2,加入龙眼核多酚或AG组荧光值;A3,加入龙眼核多酚或AG组相应对照组的荧光值。
1.2.5 非交联晚期糖基化产物CML测定
采用酶联免疫技术(enzyme-linked immunosorbent assay, ELISA)对培养液中CML的含量进行测定[19]。往包被CML抗体的微孔加入样品(或标准品),再与辣根过氧化物酶标记的CML抗体结合,形成抗体-抗原-酶标抗体复合物。洗涤后加入TMB显色,用酶标仪在450 nm波长下测定OD值,根据标准曲线计算CML含量。以CML含量(x,μg/g protein)与OD值(y)建立CML标准曲线,为y=0.080 99x+3.07×10-18,R2=0.999 9。
1.2.6 捕获MGO、GO能力测定
用PBS溶液将MGO或GO溶液进行稀释,并与龙眼核多酚溶液混合。在混合液中,当龙眼核多酚终质量浓度为80、60、40 μg/mL时,MGO浓度为1.100 mmol/L,GO为1.801 mmol/L;当龙眼核多酚终质量浓度为20、5 μg/mL时,MGO浓度为0.304 mmol/L,GO为0.446 mmol/L。在37 ℃下恒温培养1 d后测定MGO、GO的含量,按公式(2)计算龙眼核多酚的捕获能力。

(2)
式中:c0,初始时测定的MGO或GO浓度;c1,1 d后测定的MGO或GO浓度。
1.2.7 Amadori反应模型的建立
用PBS配制30 mg/mL BSA溶液和900 mg/mL葡萄糖溶液,与PBS等体积混合,在37 ℃培养5 d制备Amadori产物。利用超滤管分离除去反应混合液中的葡萄糖、二羰基化合物,然后将截留蛋白转移到相同体积的PBS溶液中。取4 mL蛋白溶液于培养瓶中,加入80 μL 2 mg/mL龙眼核多酚和90 μL PBS作为未加乙酸体系实验组,加入80 μL 2 mg/mL龙眼核多酚和90 μL乙酸作为乙酸体系实验组,加入170 μL PBS或者80 μL PBS和90 μL乙酸作为对照组。在37 ℃下培养7 d,在第4、7天时测定它们的荧光值和二羰基化合物含量(峰面积),并按公式(1)计算对荧光性AGEs的抑制率。
1.2.8 MGO反应模型的建立
建立MGO-精氨酸(arginine,Arg),MGO-BSA反应体系。在MGO-BSA体系中,将1.5 mL 30 mg/mL BSA溶液与1.5 mL 120 μg/mL龙眼核多酚溶液混合,在37 ℃培养1 h,然后加入1.5 mL MGO(约3.924 mmol/L),将PBS溶液替换龙眼核多酚作为空白对照,将PBS溶液替换MGO作为对照组。在MGO-Arg体系中,将含有N(α)-Boc-L-精氨酸(10.5 mmol/L)的PBS溶液替换BSA,其他实验条件不变。在37 ℃培养2 d,在6、21、26、48 h利用荧光分光仪测定(ex/em)320/420处的荧光值,在48 h测定各组培养液中的MGO含量,并按公式(1)计算对荧光性AGEs的总抑制率。
2 结果与讨论
2.1 Amadori产物含量测定结果分析
Amadori产物是蛋白非酶糖基化反应第一阶段的产物,它是由蛋白上游离的氨基或者N端氨基与还原糖之间形成的亚胺中间体(席夫碱)经过Amadori重排生成的。从图1可见,阴性对照培养至7 d时,体系中Amadori产物含量不断升高,添加有不同浓度的龙眼核多酚、AG的体系与阴性对照中Amad-ori产物含量基本相等。第10天时,阴性对照中Amadori产物水平趋于平稳,而龙眼核多酚和AG略高于阴性对照。所以龙眼核多酚和AG不能抑制蛋白非酶糖基化的第一阶段。
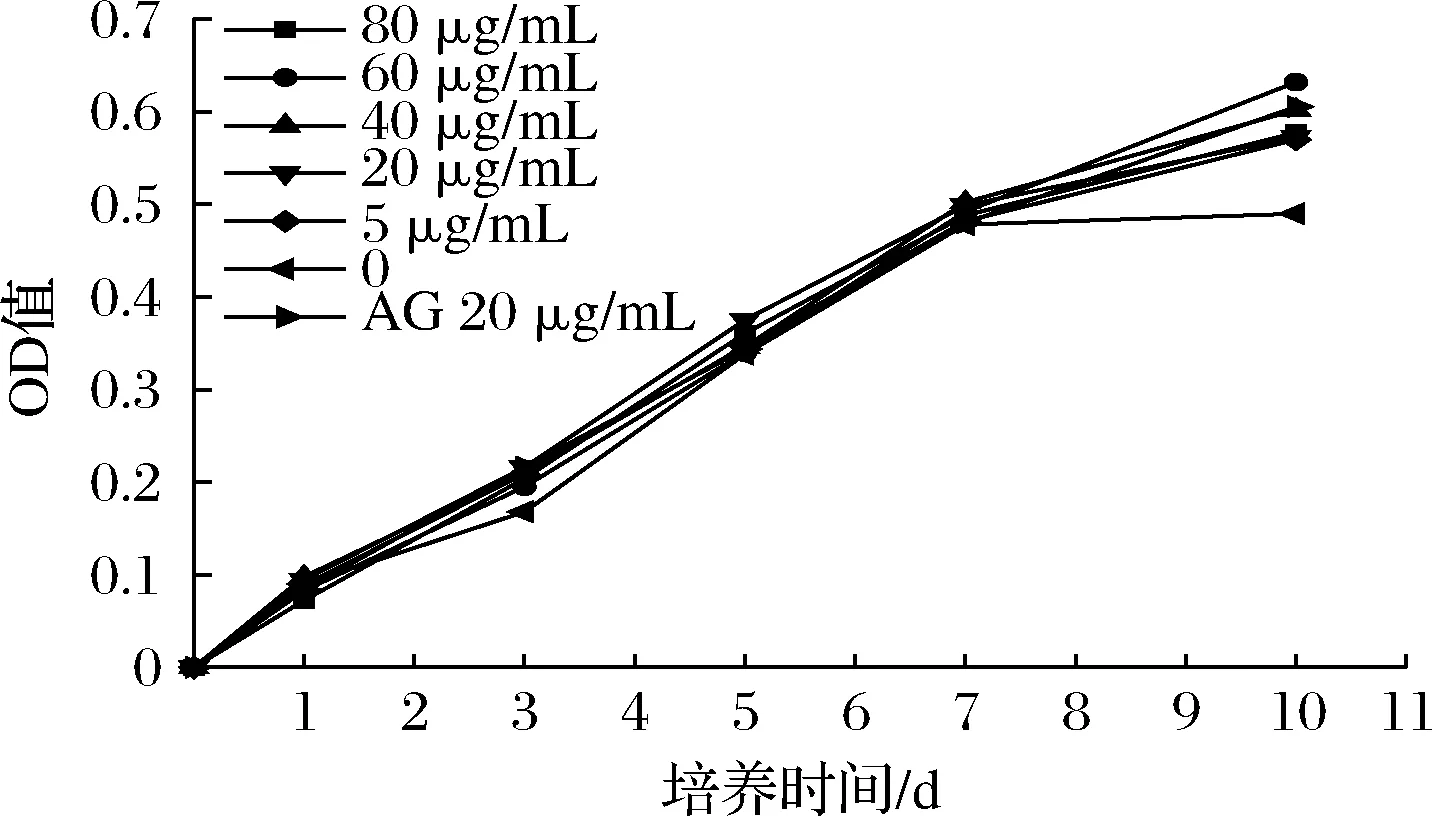
图1 不同质量浓度龙眼核多酚对Amadori产物含量的影响Fig.1 Effects of different concentration of longan seed polyphenols on the content of Amadori products
2.2 二羰基化合物含量的测定
糖基化反应的第二阶段是羰基中间体的形成。第一阶段物质葡萄糖、席夫碱和Amadori产物能够经过氧化或非氧化降解生成反应活性远高于葡萄糖的二羰基化合物,主要有GO、MGO、3-DG、D-葡萄酮醛等。它们直接作用于蛋白中游离氨基,具有高度生理损伤危害,被称为羰基应激,所以降低二羰基化合物的含量能够有效地抑制蛋白的非酶糖基化反应,减少AGEs的产生。在BSA-葡萄糖体系培养期间3种二羰基化合物的水平如图2所示,阴性对照中GO和MGO先增加后趋于稳定,各浓度龙眼核多酚体系的GO和MGO含量基本都低于阴性对照GO和MGO含量的30%,处于较低的水平,即便是低浓度龙眼核多酚对GO和MGO水平都有着很明显的抑制作用。GO和MGO在AG体系中的水平高于阴性对照。图2-c显示,3-DG水平随着培养时间不断增强,加入龙眼核多酚组低于阴性对照和AG组,并且龙眼核多酚对降低3-DG水平呈现浓度依赖性。

a-GO;b-MGO;c-3-DG图2 不同质量浓度龙眼核多酚对二羰基化合物含量的影响Fig.2 Effects of different concentration of longan seed polyphenols on the content of dicarbonyl compounds
2.3 荧光性AGEs抑制测定
在糖基化反应后期,可有多种途径形成结构复杂的AGEs。其中一种途径是Amadori产物直接经过氧化或非氧化、重排,另一种途径是二羰基化合物直接与蛋白上赖氨酸残基和精氨酸残基反应。这2个途径最终都可以形成荧光性AGEs,比如Amadori产物直接氧化降解可以形成戊糖素(pentosidine,ex/em,335/385 nm),MGO可以与2个赖氨酸反应形成具有荧光交联特性的MOLD(methylglyoxal derived lysine dimer)等。因此,采用不同的激发波长可以检测多种荧光性AGEs。由图3可知,龙眼核多酚对荧光性AGEs有着强烈的抑制作用,并且呈现浓度依赖性。图3-a中,不同浓度的龙眼核多酚均表现出较好的抑制效果,优于AG,在第5天之后,低浓度的龙眼核多酚呈现抑制率下降的情况。图3-b中,最低质量浓度5 μg/mL的龙眼核多酚添加量就能达到60%的抑制效果,远远大于AG,并且龙眼核多酚对于在(ex/em)335/385 nm体现的荧光性AGEs表现出稳定的抑制作用,龙眼核多酚培养10 d后就能稳定抑制一些荧光性AGEs生成。

a-(ex/em) 370/440 nm;b-(ex/em) 335/385 nm图3 不同质量浓度龙眼核多酚和AG对荧光性AGEs的抑制Fig.3 Inhibition of fluorescence AGEs with different concentrations of longan seed polyphenols and AG
2.4 CML含量测定
CML是从人体分离鉴定的第一种AGE,广泛存在于各个组织的糖基化蛋白中,是一种非交联AGE,主要由Amadori产物氧化降解以及GO与蛋白上赖氨酸残基反应这2个途径形成。图4显示,加入龙眼核多酚和AG能明显抑制体系中CML的生成,CML的抑制率似乎与龙眼核多酚的浓度没有相关性,可能与体系GO的水平有关,图2-a显示,不同浓度的龙眼核多酚均能保持很低的GO水平,从而抑制CML的生成。

图4 不同质量浓度龙眼核多酚对CML含量的影响Fig.4 Effects of different concentration of longan seed polyphenols on the content of CML
2.5 龙眼核多酚捕获GO、MGO醛能力测定
多酚在碱性条件下能够通过苯环上的亲电取代反应捕获二羰基化合物[15]。图5显示,龙眼核多酚具有较好的清除率,且龙眼核多酚对GO的清除率更强,40、60、80 μg/mL的龙眼核多酚对GO清除率均在70%以上,这可能是因为GO在溶液中多以水合单体、二聚体等需要缓慢转化为游离的形式存在[19],使各质量浓度龙眼核多酚的游离GO浓度基本相同。在捕获能力实验中,龙眼核多酚表现出了较强的和MGO和GO的结合能力。
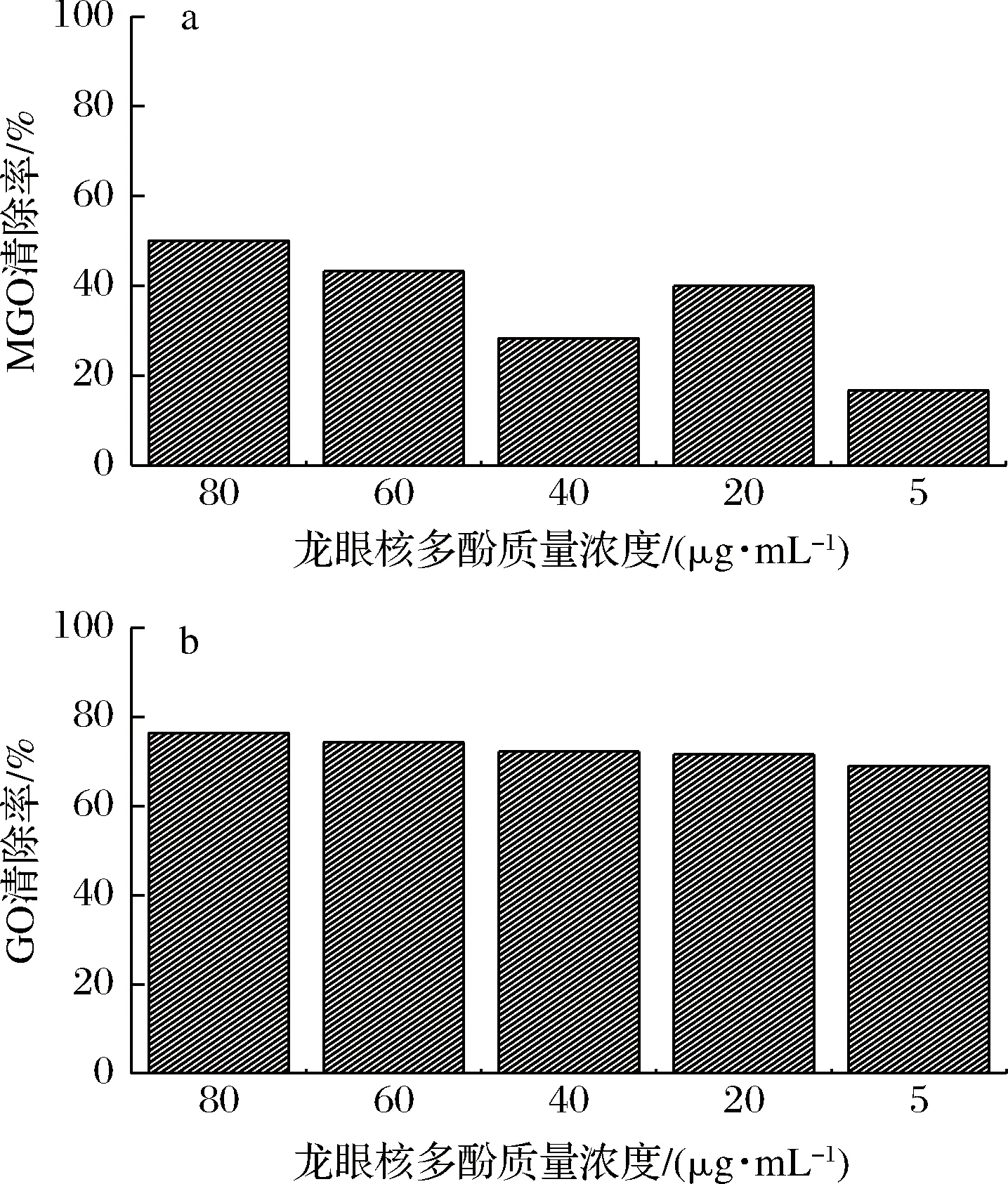
图5 不同浓度多酚捕获MGO(a)和GO(b)能力测定Fig.5 The ability to capture MGO (a) and GO (b) of polyphenols at different concentrations
2.6 Amadori产物反应模型结果分析
通过超滤除去培养液中的葡萄糖和二羰基化合物,截留含有Amadori产物的蛋白,建立Amadori产物反应模型,研究龙眼核多酚对糖基化中后期反应的影响。调节溶液pH能够影响多酚捕获二羰基化合物的能力,通过在Amadori反应模型中加入乙酸,使得龙眼核多酚捕获羰基能力消失[15]。建立Amadori乙酸体系能够研究龙眼核多酚对Amadori产物生成二羰基化合物的影响以及对由Amadori产物直接生成荧光性AGEs的影响。Amadori产物能够在氧化条件下发生断裂形成GO,以及经非氧化重排、水解形成3-DG[20]。由图6可知,龙眼核多酚能够抑制Amadori产物裂解产生GO,但是对MGO和3-DG基本没有影响,所以龙眼核多酚能够抑制Amadori产物氧化降解形成GO。龙眼核多酚除了通过捕获GO,还可通过抑制Amadori产物氧化降解来降低GO的含量。

图6 乙酸体系中二羰基化合物水平测定Fig.6 Determination of dicarbonyl compounds in acetic acid system
图7显示,未加乙酸体系中,龙眼核多酚对在(ex/em)335/385、370/440 nm表现的荧光性AGEs抑制率分别为93%、47%,说明龙眼核多酚确实能够在蛋白非酶糖基化中后期抑制荧光性AGEs的产生。在乙酸体系中,龙眼核多酚对在(ex/em)335/385、370/440 nm的荧光性AGEs抑制率分别为80%、45%。在Amadori产物反应模型中,可以由Amadori产物降解形成的二羰基化合物与氨基残基反应或者Amadori产物直接形成AGEs。由于在乙酸体系中,龙眼核多酚不具有捕获二羰基化合物能力,可能是其抗氧化性能抑制了部分Amadori产物经氧化、重排产生的荧光性AGEs。所以龙眼核多酚不仅能够通过降低二羰基化合物含量,还能通过抗氧化性能直接抑制Amadori产物生成荧光性AGEs。

图7 Amadori反应模型龙眼核多酚对荧光性AGEs抑制率Fig.7 Inhibition rate of longan polyphenols on fluorescence AGEs in Amadori reaction model.
2.7 MGO反应模型结果分析
图8-a显示,在培养0~6 h,Arg体系中的抑制率只有26.7%,而BSA体系中多酚抑制率有53%。随着培养时间的增加,Arg体系多酚组中龙眼核多酚对MGO逐渐进行捕获,降低了体系中MGO浓度,使得Arg体系中抑制率上升,并在50%稳定不变。图8-b显示,在26~48 h BSA体系中荧光值增加很快,说明荧光性AGEs大量生成。而对于这段时间而言,加入多酚组对荧光抑制率达到了80%左右。在MGO含量测定中显示,培养2 d后,所有组中MGO基本反应完全。这些结果说明,在BSA体系中龙眼核多酚能更好地抑制荧光性AGEs生成。

a-两体系龙眼核多酚对荧光性AGEs的总抑制率;b-各组荧光增长值图8 MGO模型荧光性AGEs测定Fig.8 Determination of fluorescence AGEs in MGO model
实验室制备的龙眼核多酚中含量最多的成分为柯里拉京[12],利用分子对接软件,对柯里拉京与牛血清白蛋白进行分子对接。赖氨酸残基和精氨酸残基是蛋白糖基化反应中主要的反应位点。在分子盲对接中,BSA中有10个赖氨酸和6个精氨酸(Lys:106,131,159,187,204,221,294,431,439,465;Arg:194,196,217,335,336,435)通过氢键、范德华力和共轭作用直接与柯里拉京相互影响,还有一些赖氨酸与精氨酸与柯里拉京多酚的结合能较小,但也在多酚结合蛋白区域附近。结合图8结果分析,龙眼核多酚很有可能是通过与蛋白相互作用,结合到蛋白分子区域里,当具有反应活性二羰基化合物靠近这些赖氨酸、精氨酸等反应位点时,能够被多酚迅速清除,从而保护蛋白分子。

a-BSA与柯里拉京多酚盲对接所有方位;b-分子对接最小能量的二维视图图9 BSA与柯里拉京多酚分子对接Fig.9 Molecular docking between BSA and Coriolis polyphenols
3 结论
在BSA-葡萄糖反应模型研究中,龙眼核多酚和AG并没有抑制第一阶段Amadori产物的生成,龙眼核多酚能够显著降低体系中的GO和MGO的水平,对抑制3-DG的水平具有浓度依赖性。在抑制AGEs的测定中,龙眼核多酚能很好地抑制AGEs的产生,即使是5 μg/mL的低浓度龙眼核多酚,对(ex/em)335/385、370/440 nm的荧光性AGEs抑制率分别为62.4%和21.3%,对CML生成的抑制率为61.5%。通过Amadori产物反应模型不加乙酸体系中荧光AGEs的测定,龙眼核多酚确实能够在非酶糖基化中后期抑制AGEs的生成。Amadori产物反应模型乙酸体系中测定的GO/MGO水平和捕获羰基实验表明,龙眼核多酚能够通过抗氧化作用抑制GO的生成并具有很好的捕获GO和MGO能力,来降低非酶糖基化第二阶段反应中间产物二羰基化合物的水平。此外,Amadori产物反应模型乙酸体系的荧光AGEs的测定结果还表明,龙眼核多酚能抑制非酶糖基化第三阶段中Amadori产物生成荧光性AGEs。通过比较MGO-BSA与MGO-Arg两个体系并结合分子对接结果分析,龙眼核多酚能与蛋白相互作用,更加有效的保护氨基不受二羰基化合物的进攻。总之,龙眼核多酚能够通过抗氧化作用和捕获羰基能力,在糖化反应的中后期较好地抑制AGEs的产生,所以龙眼核多酚可用于功能性食品添加剂和化妆品抗糖化活性成分的开发。

