硼对根瘤菌胞外多糖和吲哚乙酸分泌的调控研究
陈永岗,康文娟,吴芳,阿芸,师尚礼,张翠梅,李自立
(甘肃农业大学草业学院,甘肃 兰州 730070)
根瘤菌能与豆科植物共生结瘤固氮,将大气中分子态氮转化为氨供宿主植物吸收利用,进而促进宿主植物生长发育[1]。现代农业生产中,根瘤菌拌种提高豆科植物生产力已经成为一种常见的农业措施[2]。然而由于宿主种类、根瘤菌种以及其他因素的影响,使根瘤菌结瘤能力千差万别,部分根瘤菌难以高效地与宿主植物结瘤固氮,达到应有的增产效果[3]。因此如何提高根瘤菌接种效率,一直是豆科植物固氮体系构建研究的热点。
研究发现,根瘤菌可以内生于植物体内,并运移至种子器官定殖,随种子的萌发而优先共生结瘤[4]。但根瘤菌在侵染宿主过程中,会诱发植物的防御反应,减弱根瘤菌的侵染能力[5]。根瘤菌侵染宿主并侵入体内的过程中,根瘤菌分泌的次生代谢产物胞外多糖和吲哚乙酸(indole-3-acetic acid,IAA)扮演着重要角色,它们不仅可以减弱宿主的防御能力,促进根瘤菌的侵染及侵入[5−6],还可以促进根瘤菌在植物根皮层细胞内运移及根与根瘤菌的有效互作[7]。据报道,硼是根瘤菌固氮所必需的微量元素[8],其在根瘤菌与宿主信号传递、根瘤细胞壁和膜结构的形成等过程中发挥着重要作用[9],它不仅对宿主植物生长有影响,还对根瘤菌侵染宿主以及侵染成功后在宿主体内运移定殖有重要作用[10]。苗阳阳等[11]发现,添加外源硼可以促进根瘤菌侵染宿主以及侵入后在宿主体内运移定殖的数量。缺硼会减弱根瘤菌定殖能力、减少根瘤菌定殖数量并削弱固氮能力,同时也会降低根瘤菌表面多糖的形成,进而影响其功能的发挥[12]。硼还可以促进宿主植株及根瘤菌IAA 合成,有利于其在植物组织内扩散和运输[13−14],而IAA 能增大宿主植物细胞壁膜透性,促进养分释放及根系根瘤菌侵染,同时可以降低宿主植物防卫系统胞壁降解酶活性,使入侵根瘤菌易定殖于植物组织内[5,15]。因此,阐明硼对根瘤菌分泌胞外多糖及IAA 的调控机制,对于研究硼促进根瘤菌侵染宿主的机制,提高根瘤菌接种效率具有指导意义。
1 材料与方法
1.1 试验材料
根瘤菌:荧光标记根瘤菌[Ensifer meliloti,gn5f,分离自甘农 5 号紫花苜蓿(Medicago sativa)种子]。硼酸:购自无锡市晶科化工有限公司,含量大于99.5%。YMA 液体培养基:准确称取10 g 甘露醇,0.5 g 磷酸氢二钾,0.2 g 七水硫酸镁,0.1 g 氯化钠,1 g 酵母粉,并调节 pH 为 6.8~7.0,定容至 1 L。YMA 固体培养基加琼脂:16~20 g⋅L−1。
1.2 最适硼浓度确定
设置硼浓度梯度为 0(CK)、0.05、1、5、10 和 100 mg⋅L−1,然后按浓度梯度加至 40 mL YMA 液体培养基,每个处理3 次重复,以上操作均在无菌操作台内进行;将活化后的根瘤菌gn5f 接种于50 mL YMA 液体培养基,28 ℃、180 r⋅min−1培养至OD600值为0.5~0.8。取5 mL 该菌液加入上述含有不同硼浓度的40 mL YMA 液体培养基中,再在 28 ℃、180 r⋅min−1培养至 OD600值为 0.5~0.8,在不同时间段测定 OD600值,确定根瘤菌 gn5f 最适硼浓度。
1.3 硼处理根瘤菌gn5f 胞外多糖和IAA 的测定
1.3.1 胞外多糖的测定 采用苯酚−硫酸法测定胞外多糖[16]。步骤如下:配制上述所选最适硼浓度,添加至40 mL YMA 液体培养基中,对照不加硼液,每个处理3 个重复。将已培养至OD600值为0.5~0.8 的根瘤菌gn5f 取5 mL 加入 40 mL 液体培养基中,在 28 ℃、180 r⋅min−1培养 72 h 后,在 4 ℃下,15000 r⋅min−1离心 10 min,弃沉淀,收集上清液;将上清液转入新的离心管,加入Sevag 试剂(氯仿−正丁醇体积比为5∶1,样液与试剂体积比为2∶1),振荡 30 min,然后 6000 r⋅min−1,离心 10 min,收集上清液,反复处理 4 次;将上清液移到另一 50 mL 离心管中,加入 3倍体积 95% 乙醇,4 ℃冰箱中浸提 12 h,4 ℃,15000 r·min−1,离心 45 min,并收集沉淀,弃上清液;在超净工作台内风干,称重,即得粗胞外多糖含量。测定粗胞外多糖吸光度值,代入曲线方程:y=54.4858x−0.01024,R2=0.9951,计算根瘤菌gn5f 胞外多糖含量。
1.3.2 吲哚乙酸(IAA)的测定 采用高效液相色谱(high performance liquid chromatography,HPLC)测定IAA[17]。步骤如下:根瘤菌培养方法同上,培养 72 h 后,在 4 ℃下,15000 r·min−1,离心 10 min,弃沉淀,收集上清液;将上清液低温干燥至 10~15 mL,并用盐酸(1 mol⋅L−1)将 pH 值调至 2.8;转入分液漏斗,加入 20 mL 乙酸乙酯,振荡5 min,待分层后;转移上层溶液于另一分液漏斗中,向下层溶液再加入乙酸乙酯提取一次,合并上层溶液于50 mL 烧瓶中,于低温干燥浓缩至近干;用2 mL 无水乙醇溶解后盛于小试管中。于高效液相色谱仪测定IAA含量,测定条件为:进样量 10 uL,流动相∶甲醇∶水∶乙酸(45∶54∶1),流速0.8 mL⋅min−1,Eclipse Plus C18色谱柱(4.6 mm×250 mm,美国Thermo fisher 公司)。
1.4 硼处理根瘤菌gn5f 蛋白质测定及纯化
根据1.3.1 的方法收集最适硼处理后的根瘤菌gn5f 的菌体,低温保存备用;冷冻状态下取出样品,转移至MP振荡管中,加入适量抽提 buffer(1% SDS,200 mmol⋅L−1DTT,50 mmol⋅L−1Tris−HCl,pH 8.8 含蛋白酶抑制剂),涡旋混匀并用高通量组织研磨仪振荡3 次,每次40 s,裂解30 min。100 ℃下孵化10 min,置冰上冷却。在4 ℃ 12000 r·min−1条件下,离心 20 min,取上清,加入预冷丙酮(1∶4),在−20 ℃下过夜沉淀。次日在 4 ℃、12000 r·min−1条件下,离心20 min,弃上清,向沉淀中加入90%预冷丙酮,混匀后离心弃上清,重复2 次。向沉淀中加入蛋白裂解液(8 mol⋅L−1尿素,含蛋白酶抑制剂),在 4 ℃ 12000 r·min−1条件下,离心 20 min,弃沉淀,留上清[18]。然后根据BCA 试剂盒(苏州达麦迪生物医学科技有限公司)操作测定蛋白质浓度,并进行SDS−PAGE 电泳[19];取样品各100 μg,向各样品中加入终浓度为100 mmol·L−1三乙基碳酸氢铵缓冲液(tetraethylammonium bromide,TEAB)和 10 mmol·L−1TCEP[tris(2-carboxyethyl)phosphine],在 37 ℃下反应 60 min。加入终浓度 40 mmol⋅L−1碘乙酰胺,室温避光反应 40 min。加入 7 倍体积 100 mmol⋅L−1TEAB 和胰蛋白酶,37 ℃酶解过夜。酶切后用HLB(hydrophile lipophile balance)、阳离子固相萃取进行脱盐纯化。
1.5 液相串联质谱分析
使用 Q-Exactive HF-X 质谱仪(Thermo fisher 公司,美国)鉴定蛋白质序列,扫描范围为 350~1300 m⋅z−1,采集模式为DDA(discontinous deformational analysis);一级质谱分辨率为70000,最大注入时间为20 ms,AGC tar⁃get 为3e6,采用高能碰撞解离(high energy collision dissociation,HCD)碎裂方式;选择母离子中信号最强的20 个进行二级碎裂,二级分辨率 17500,AGC target 为 1e5,最大注入时间 50 ms,起始质荷比:100 m⋅z−1;最小 AGC tar⁃get 8e3,临界强度为1.6e5,动态排除时间18 s。液相条件为:采用C18 column 色谱柱(Thermo fisher 公司,美国),A 液:0.1%甲酸和 2% 乙腈,B 液:0.1%甲酸和 80% 乙腈,流速为 300 nL⋅min−1,分离时间为90 min。
1.6 数据处理
用SPSS 19.0 和Excel 2010 软件进行数据分析处理。用PEAKS Studio 8.5 进行质谱数据搜索,选择已经建立好的数据库。将搜库得到的蛋白质数据重新分析,在蛋白质层面进行t配对检验,计算相应的P-value 及差异倍数(fold change,FC),以此作为显著性指标。根据FC 以及P-value 进行差异蛋白质筛选。当FC≥1.5 且P-val⁃ue<0.05 时,表示该蛋白质表达量显著上调;当FC≤1 且P-value<0.05 时,表示该蛋白表达量显著下调。并对差异蛋白进行GO(gene ontology)功能注释以KEGG(kyoto encyclopedia of genes and genomes)通路富集分析。
2 结果与分析
2.1 适宜硼浓度的筛选
在 20~180 min 时,适宜的硼浓度可以促进根瘤菌 gn5f 的生长。20 min 时,硼浓度为 100 mg⋅L−1,根瘤菌生长速度最快,显著大于对照(P<0.05),其余处理与对照差异不显著(P>0.05);60 和140 min 时,当硼浓度小于10 mg⋅L−1,根瘤菌gn5f 生长速度与对照相比差异均不显著(P>0.05),其余处理生长速度较对照均差异显著(P<0.05),且硼浓度为 100 mg⋅L−1时生长速度最快;100 min 时,硼浓度为 100 mg⋅L−1生长速度最快,除添加 1 mg⋅L−1硼生长速度较对照差异不显著(P>0.05)外,其余处理较对照均差异显著(P<0.05);180 min 时,除100 mg⋅L−1硼浓度处理较对照差异显著(P<0.05)外,其余处理较对照差异均不显著(P>0.05)(图1)。
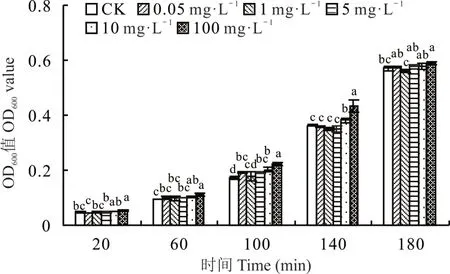
图1 不同硼浓度对根瘤菌gn5f OD600的影响Fig.1 Effects of different boron concentrations on gn5f OD600
结合前期试验结果[11](100 mg⋅L−1硼处理根瘤菌gn5f 后接种紫花苜蓿时,根瘤菌gn5f 在紫花苜蓿体内运移数量最多),确定根瘤菌gn5f 的最适硼浓度为100 mg⋅L−1。
2.2 根瘤菌gn5f 的生长曲线
对照和添加最适硼时的生长曲线均呈现S 型,分为延迟期、对数生长期、稳定期和衰亡期。在根瘤菌的对数期,细胞数量呈几何级数增长,细胞内各种酶的合成也最活跃、代谢旺盛,各种物质成分和生理特性较为一致,结合图1 和图2 确定后续蛋白组学取样时间为180 min,即对数期时进行菌体收集,以进行后续蛋白组学的研究。添加硼与对照相比,达到相同OD600值的培养时间以及进入对数期的培养时间均明显缩短。说明最适硼处理显著促进了根瘤菌生长。由于胞外多糖以及IAA 是根瘤菌的次生代谢产物,根据细菌的特性,次生代谢产物分泌主要在稳定期,结合最适硼处理下的生长曲线,确定后续试验最适硼浓度处理下,根瘤菌gn5f 培养时间为72 h(图2)。
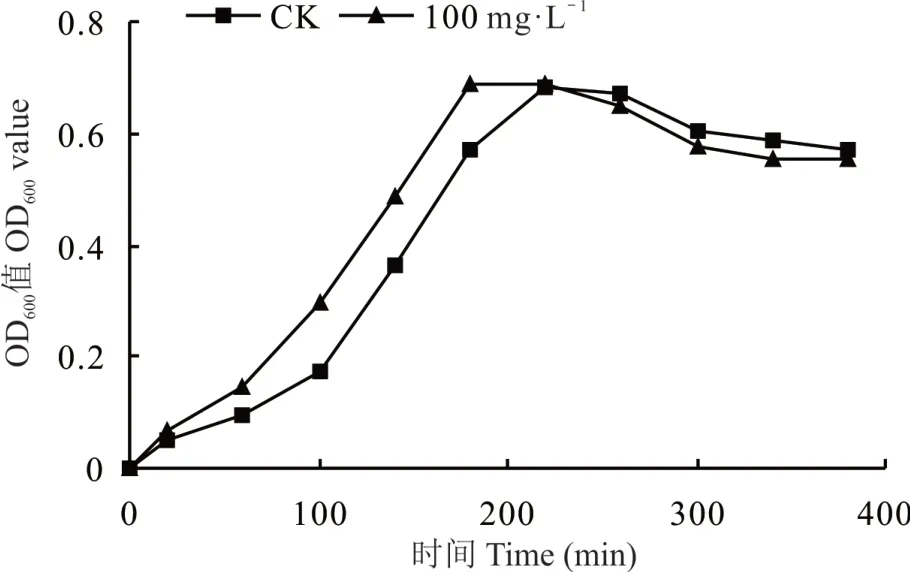
图2 硼处理前后根瘤菌gn5f 生长曲线Fig. 2 Growth curve of strain gn5f treated by boron before and after
2.3 硼对根瘤菌gn5f 产胞外多糖和IAA 的影响
相比对照,100 mg⋅L−1硼处理根瘤菌 gn5f 显著提高了其胞外多糖和IAA 产量(P<0.05),其中胞外多糖提高33.0%,IAA 提高65.9%。表明,最适硼处理根瘤菌gn5f 可显著提高胞外多糖和IAA 含量(图3)。
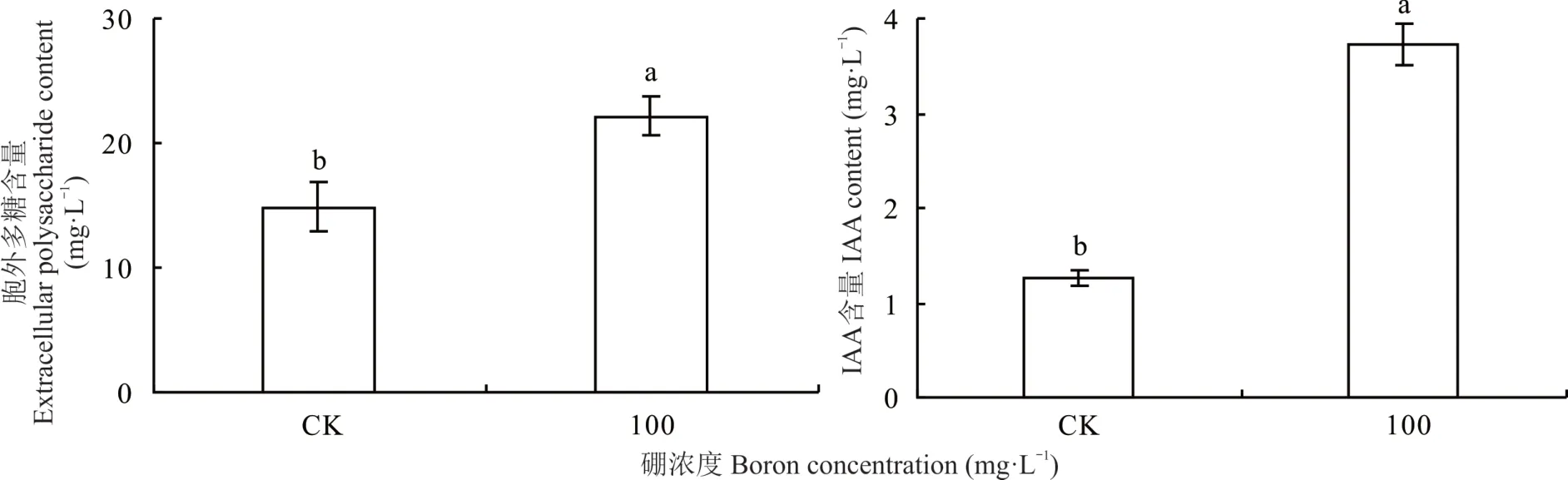
图3 硼对根瘤菌gn5f 产胞外多糖和IAA 的影响Fig.3 Effect of boron on extracellular polysaccharides and IAA production of gn5f
2.4 硼处理根瘤菌gn5f 蛋白质SDS−PAGE 电泳
各样本电泳条带均清晰,样本间平行性较好。蛋白预测质谱显示酶解正常,色谱质谱行为正常,可以进行后续试验(图4)。
图4 SDS-PAGE 电泳结果Fig. 4 SDS-PAGE electrophoresis results
2.5 硼处理根瘤菌gn5f 差异蛋白质生物信息学分析
采用 Label free 技术,对 100 mg⋅L−1硼处理根瘤菌gn5f 进行定量蛋白组学分析,共鉴定出160 个蛋白点,54 个差异表达蛋白,其中7 个蛋白表达上调,47 个蛋白表达下调。表明最适硼浓度处理根瘤菌,可引起部分蛋白表达上调和下调。
2.5.1 硼处理根瘤菌gn5f 差异蛋白GO 富集分析
根据分子功能(molecular function,MF)、细胞组分(cellular component,CC)、生物过程(biological pro⁃cess,BP)对差异表达蛋白进行GO 功能注释,统计对应差异蛋白所占的百分比(图5)。结果表明,100 mg⋅L−1硼处理根瘤菌gn5f 后,差异蛋白参与的分子功能主要包括催化活性(36 个),结合(20 个)及转运活性(7个)等;而参与的细胞组分主要有细胞组分(11 个),生物膜(5 个)及蛋白质复合物(5 个)等;主要参与的生物过程为代谢过程(30 个),细胞过程(23 个)及定位(7个)等。结果表明,100 mg⋅L−1硼处理根瘤菌 gn5f 后差异表达蛋白具有多种分子功能,并参与多个生物过程(图5)。

图5 硼处理根瘤菌gn5f 差异表达蛋白GO 功能富集分析Fig.5 Functional enrichment analysis of boron-treated rhizobium gn5f differentially expressed protein
2.5.2 硼处理根瘤菌gn5f 差异蛋白KEGG pathway 富集分析 对差异蛋白进行KEGG pathway 富集分析,发现差异蛋白分布于4 个功能区,有28 个蛋白参与代谢(全局和概览通路),7 个参与环境信息处理(膜运输),6 个参与细胞过程(运输和分解代谢)、3 个参与遗传信息处理(转录)及13 个未知功能(图6)。已知功能的差异蛋白主要富集在抗生素合成、碳代谢、赖氨酸降解、丁酸脂代谢、酪氨酸代谢(tyrosine metabolism)及色氨酸代谢(trypto⁃phan metabolism)等代谢通路中(图7)。其中已知功能的上调蛋白乙酰辅酶A 合成酶(A0A4R3PRU1)共参与11条代谢通路,琥珀酸半醛脱氢酶(NADP+)(A0A1Q9AU32)和烟酰胺腺嘌呤二核苷酸(nicotibnamide adenine di⁃nucleotide,NAD)依赖性琥珀酸半醛脱氢酶(A0A0Q6ZU08)各参与7 条代谢通路,且共同参与γ-氨基丁酸(γ-aminobutyric acid,GABA)代谢、丙氨酸代谢及谷氨酸代谢等与三羧酸循环有关的代谢通路。4 种上调蛋白未找到KEGG 相对应通路。下调蛋白乙酰辅酶 A 乙酰转移酶(A0A0N0JNE5)、烯酰辅酶 A 水合酶(A0A2M8UJS2)、脂酰辅酶 A 脱氢酶(J2L150)、烟酰胺腺嘌呤二核苷酸(NAD)依赖性琥珀酸半醛脱氢酶(A0A0Q7XRQ0)、磷酸烯醇丙酮酸合酶(A0A4Q8YPJ5)、色氨酸合酶 β 链(A0A2T0P7K1)等共同参与抗生素合成、碳代谢及次生代谢产物生物合成等通路(图7)。
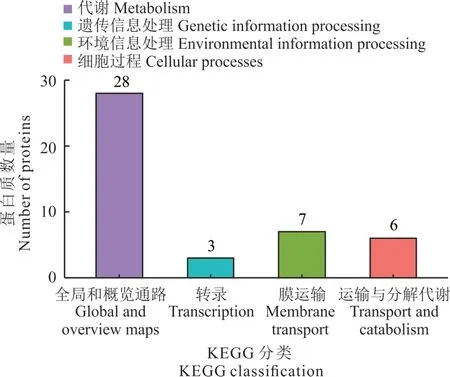
图6 硼处理根瘤菌gn5f 差异表达蛋白KEGG 注释统计Fig. 6 KEGG annotation statistics of gn5f differentially ex⁃pressed protein of boron-treated rhizobium

图7 根瘤菌gn5f 差异表达蛋白数量最多的前20 个通路Fig. 7 Top 20 pathways with the most differentially ex⁃pressed proteins from rhizobia gn5f
综上,硼处理根瘤菌gn5f 会引起多种蛋白表达上调和下调,且多个蛋白协同调节多个代谢通路,继而促进根瘤菌gn5f 生长以及其他生理代谢过程。
3 讨论
3.1 根瘤菌gn5f 适宜硼浓度筛选以及生长曲线的测定
OD600值表示细菌吸收的光密度值,用来反映细菌相对生长量[20]。细菌的生长主要是指细胞数目的增多以及胞内物质的倍增[21],本研究发现,与对照相比,硼浓度为 100 mg⋅L−1时,根瘤菌 gn5f OD600值增加最显著,说明适宜的硼可以促进该根瘤菌生长[11]。Mon⁃tanari 等[22]发现,细菌在受到环境胁迫时,会诱发体内生理应激反应,包括蛋白质复合物的重组以及代谢物质变化,以此来适应微生态环境的变化,本研究表明,硼胁迫诱发了根瘤菌的响应机制,使体内某些代谢途径或酶发生变化,继而使生长加快,对数期缩短。根瘤菌的繁殖和个体的生长依赖于胞内物质的合成和加倍[23],研究发现原核生物体内的类钙调蛋白与细胞分裂以及细胞内多种酶的活性有关[24],硼可能是通过激活该蛋白,促进细胞分裂以及与生长相关酶的活性,间接促进根瘤菌的繁殖和生长。
3.2 硼对根瘤菌gn5f 产胞外多糖和IAA 的影响
硼是固氮细菌固氮所必需的微量元素,在根瘤菌与宿主共生关系建立、表面多糖形成以及根瘤菌固氮等过程中发挥着重要作用[6,8]。缺硼可以减弱根瘤菌定殖能力,影响根瘤菌表面多糖形成及功能发挥[11,25],同时减少IAA 含量和根瘤菌侵染宿主时的侵染位点[26]。本研究发现,最适硼可以显著促进根瘤菌gn5f 胞外多糖和IAA 含量,Martin 等[27]也发现,适宜的硼酸会影响白链球菌碳水化合物的能量代谢,且可以导致根瘤菌Botrytiscinerea胞质内溶物:可溶性糖的泄露[28],同时硼还可以影响多种酶的活性,其中大多数与能量底物代谢有关[29]。因此,推测硼对根瘤菌胞外多糖和IAA 产量的影响,可能主要是通过影响碳水化合物代谢过程及各种关键酶活性,继而影响其合成以及分泌。
3.3 硼对根瘤菌gn5f 差异蛋白组学的影响
硼是固氮细菌固氮所必需的微量元素,在根瘤菌与宿主共生关系建立,促进根瘤菌侵染宿主以及促进根瘤菌次生产物胞外多糖和IAA 合成等过程中扮演着重要作用,硼处理根瘤菌接种苜蓿后,根瘤菌对苜蓿的影响已有研究[11]。本研究发现,硼处理下根瘤菌gn5f 蛋白组学发生变化,其中一些重要的参与γ-氨基丁酸(GABA)代谢、丙氨酸代谢,天冬氨酸和谷氨酸代谢的蛋白表达上调,包括乙酰辅酶A 合成酶、烟酰胺腺嘌呤二核苷酸(NAD)依赖性琥珀酸半醛脱氢酶及琥珀酸半醛脱氢酶(NADP+)。乙酰辅酶A 合成酶与生物体内物质和能量的生成有关,主要参与能量代谢及物质合成相关的代谢通路[30]。丙氨酸可以转化为丙酮酸,丙酮酸可以进入三羧酸循环(tri⁃carboxylic acid cycle,TCA)。天冬氨酸和谷氨酸在特定条件下可以相互转换,谷氨酸主要参与γ-氨基丁酸、蛋白质以及葡萄糖等的合成;γ-氨基丁酸与丙酮酸在特定条件下可以生成琥珀酸半醛和丙氨酸,琥珀酸半醛在琥珀酸半醛脱氢酶(NADP+)的作用下生成琥珀酸,进入三羧酸循环,该过程称为γ-氨基丁酸(GABA)旁路[31]。有研究发现,在许多细菌体内存在两种类型的琥珀酸半醛脱氢酶,其活性分别依赖于烟酰胺腺嘌呤二核苷酸磷酸(nico⁃tinamide adenine dinucleotide phosphate,NADP)或烟酰胺腺嘌呤二核苷酸(NAD)[32]。表明硼处理根瘤菌 gn5f 后烟酰胺腺嘌呤二核苷酸(NAD)依赖性琥珀酸半醛脱氢酶、乙酰辅酶A 合成酶、琥珀酸半醛脱氢酶(NADP+)蛋白表达上调,琥珀酸半醛脱氢酶(NADP+)Gab D(W6S1U0)蛋白表达下调均与上述代谢通路有关。上述代谢过程可以为根瘤菌生长及胞外多糖和IAA 的合成提供各种前体物质和能量。
烯酰辅酶A 水合酶可以催化脂肪酸β 氧化中水分子可逆地顺式加成到a,β 不饱和硫酯双键上[33−34],脂酰辅酶A 脱氢酶主要参与脂肪酸β 氧化,是脂肪酸β 氧化中一种重要的酶[35],本研究中烯酰辅酶A 水合酶和脂酰辅酶A脱氢酶表达均显著下调,表明硼可以减弱或抑制根瘤菌gn5f 的脂肪酸β 氧化。
磷酸烯醇丙酮酸合酶与细菌糖异生路径中磷酸烯醇式丙酮酸的合成有关[36]。乙酰辅酶A 乙酰转移酶在多种酶存在条件下可以将乙酰辅酶A 转化成多聚3-羟丁酸[Poly(3-hydroxybutyrate),PHB],而PHB 是根瘤菌的储能物质[37]。色氨酸合酶β 链可以催化吲哚乙酸合成色氨酸[38]。这些蛋白表达下调,表明硼处理会抑制该根瘤菌的糖异生途径、储能物质合成以及色氨酸的分解。
可见,100 mg⋅L−1硼处理根瘤菌gn5f,会引起与三羧酸代谢有关的蛋白表达上调,进而促进三羧酸循环,同时会引起与糖异生、脂肪酸β 氧化以及氨基酸代谢有关的蛋白表达下调,进而抑制这些代谢通路。表明硼对根瘤菌gn5f 胞外多糖及IAA 的调控是一个复杂的反应过程,是多个蛋白协同作用的结果。
3.4 硼对根瘤菌gn5f 产胞外多糖和IAA 的调控探究
根据100 mg⋅L−1硼处理根瘤菌gn5f 后上调差异蛋白主要富集的代谢通路以及已知根瘤菌胞外多糖合成的调控[39],推测硼可能是通过促进GABA 旁路代谢、丙酮酸代谢以及谷氨酸代谢等与三羧酸循环有关的代谢通路,为胞外多糖合成提供能量以及所需要的各种糖类物质(D-半乳糖残基,D-葡萄糖残基以及D-葡萄糖醛酸等),继而促进胞外多糖的合成。具体机制有待进一步研究证明。
100 mg⋅L−1硼处理根瘤菌gn5f 后,上调表达蛋白促进了色氨酸代谢通路,推测硼促进色氨酸合成,然后色氨酸经吲哚-3-乙酰胺(indole-3-acetamide,IAM)或吲哚-3-丙酮酸途径合成吲哚乙酸(IAA),继而促进IAA 合成。
4 结论
筛选的根瘤菌 gn5f 最适硼浓度为 100 mg⋅L−1;100 mg⋅L−1硼可显著促进根瘤菌 gn5f 胞外多糖和 IAA 的合成;最适硼处理根瘤菌gn5f 后共鉴定到54 个差异表达蛋白,7 个上调蛋白,47 个下调蛋白。推测硼可能是通过促进丙酮酸代谢、GABA 旁路代谢,谷氨酸代谢等代谢通路,为胞外多糖合成提供能量以及所需要的各种单糖(D-半乳糖残基,D-葡萄糖残基以及D-葡萄糖醛酸等),继而促进胞外多糖的合成;IAA 合成机制为:硼通过促进色氨酸的合成,然后色氨酸在相关酶的作用下经吲哚-3-丙酮酸或吲哚-3-乙酰胺(IAM)途径合成吲哚乙酸(IAA),继而促进IAA 合成。

