蓖麻种子萌发和幼苗生长对重金属Zn2+的胁迫响应※
●尹明达 罗 蕊 包春光 孟祥越 孙 雪 王凡浩 贾崇宁 李正彩 张圆圆 黄凤兰,3,4,5,6,7※※
(1.内蒙古民族大学生命科学与食品学院 内蒙古 通辽 028000;2.通辽市农畜产品质量安全中心 内蒙古 通辽 028000;3.蓖麻育种国家民委重点实验室 内蒙古 通辽 028000;4.内蒙古自治区高校蓖麻产业工程技术研究中心 内蒙古 通辽 028000;5.内蒙古自治区蓖麻育种重点实验室 内蒙古 通辽 028000;6.内蒙古自治区蓖麻产业协同创新中心 内蒙古 通辽 028000;7.蓖麻产业技术创新内蒙古自治区工程研究中心 内蒙古 通辽 028000)
蓖麻(Ricinus communisL.)属双子叶植物纲、大戟目、大戟科、蓖麻属草本植物[1],是重要的油料作物,在生态修复、医药前体开发、生物防治等领域具有很高的开发利用价值[2]。蓖麻耐旱、耐瘠薄,适应性强,不与粮棉争地,地边拐角均可栽植,因此我国的蓖麻资源十分丰富且分布广泛[3]。
锌是所有生物体必需的元素,它密切参与植物体内的各种生命代谢活动[4]。对于植物来说,锌有利于植物生长素的形成,还有增强抗逆性的作用。植物缺锌会导致植株短小、叶片的扩展与伸长受到限制、节间短[5],但并不是说锌的浓度越高植物生长就越好。对植物幼苗来说,吸取过量的锌会明显降低叶绿素含量,且会严重影响植物根和叶片的生长。现阶段,锌矿的开采、镀锌、仪器仪表及机械制造等工业活动,各种化工厂排放的工业废水中都含有大量的Zn2+,燃煤的烟尘中的锌含量也常超标,会对土壤、水源和大气造成严重污染[6]。锌污染会破坏土壤的结构与功能;还会影响土壤的理化性状,严重时还会威胁土壤的自然生产力[7]。被锌污染的土壤中微生物的种类和数量显著降低,土壤酶的活性被破坏[8]。锌对水的污染更加严重,因为锌对水生动物的毒性更大,如用含锌污水浇灌作物,会造成污染范围扩大。
蓖麻对各种重金属离子有着很高的耐受性,而锌是蓖麻生长必不可少的微量元素,浓度过高的Zn2+又会对蓖麻产生胁迫影响。研究蓖麻对Zn2+的耐受程度及其耐受原因,对治理锌污染土壤具有重大意义,且为后续深入开展蓖麻抗逆性研究奠定了基础。本研究以‘2129’品系蓖麻为材料,对该种蓖麻种子及幼苗测定各项生理指标,从而研究蓖麻种子萌发和幼苗生长对Zn2+的耐受程度。
1 材料与方法
1.1 材料
1.1.1 植物材料‘2129’品系的蓖麻种子,由内蒙古自治区蓖麻育种重点实验室提供。
1.1.2 设备与器具设备:各种型号移液器、分析电子天平EP214Dcd、高速大容量低温离心机(multifuge X3)、小型高速低温离心机(eppendorf Centrifuge 5424 R)、 酶 标 仪(infinite M200 pro)、HVE-50 型高温高压灭菌锅、超低温冷冻冰箱(Thermo Scientific Forma 702)。
器 具:1.5mL、4mL、15mL 离 心 管,30mL玻璃试管,50mL、100mL、500 mL、1 000mL 容量瓶,100mL、1 000mL 烧杯,玻璃棒,石英管,1 300mL 圆形塑料培养盒,直径100mm 陶瓷研钵及钵杵。
1.1.3 试剂七水合硫酸锌(Z nSO4·7H2O)、液氮、愈创木酚、30% H2O2、20% TCA、0.5%TBA、PBS(pH7.8,50mm)、0.1mol/L H2O2、2mm NADPH、10mm GSSG。
1.1.4 其他干净的蛭石、干净无污染的黄土。
1.2 试验设计
准备饱满健康的蓖麻种子若干,蛭石若干,黄土若干,1 300mL 圆形塑料培养盒17 个,滤纸。将圆形塑料培养盒进行121℃、20min 高压灭菌,取出后在每个盒盖中间部位打若干直径为15mm 的孔洞并将滤纸粘在上面,将孔洞全部遮住。选出1 700 粒蓖麻种子,平均分成17 份。在培养盒中加入大约150g 蛭石,将17 份种子分别均匀地撒在17 个培养盒的蛭石上,再用大约150 g 蛭石将其覆盖。用无水硫酸锌配制不同浓度的ZnSO4溶液,分别为120mg/L、240mg/L、360mg/L、480mg/L、600mg/L、720mg/L、840mg/L、960mg/L、1 080mg/L、1 200mg/L、1 320mg/L、1 560mg/L、1 800mg/L、2 040mg/L、2 280mg/L,每种浓度的溶液800mL。向15 个培养盒中浇入不同浓度硫酸锌溶液,并做好标记,剩余两个培养盒中各加入800mL 清水,作为种子对照和栽种幼苗预备。将17 个培养盒放在25℃有光照的温室中培养72 h。后用清水筛洗出来,并按不同处理分开摆放在干净的桌面上。
在最后一个清水培养的培养盒中取根长、大小一致的40 粒蓖麻萌发种子,播种至装有大约1.5kg/盆黄土的花盆中,使用清水与浓度120mg/L至2 280mg/L 的ZnSO4溶液分别对幼苗进行培养。
1.3 测试方法
1.3.1 种子形态学观察对上述经过清水与浓度120mg/L 至2 280mg/L 的ZnSO4溶液培养过的蓖麻种子进行观察,并拍照保存。
1.3.2 种子发芽率统计取上述清水与浓度120mg/L 至2 280mg/L 的ZnSO4溶液培养过的蓖麻种子,统计每份种子的萌发数量与未萌发数量,记录数据并计算不同浓度处理后的种子发芽率。
1.3.3 种子生理指标测定膜脂受损程度以及植物的抗逆性通过检测MDA 含量来测定[9]。蓖麻种子中MDA 含量的测定原理参照张清航[10]论文中的原理。公式:
注:V1为提取液总体积(4mL);V2为测定用的酶液体积(1mL);W为样品鲜重(0.4 g)。
CAT 活性的测定。过氧化氢酶主要用于催化过 氧化氢进行反应[11-12]。对CAT 活性的测定及其原理参照Gill S S、Quan L J 与杨节[13-15]的论文。以每分钟 OD 值变化(减小)0.1为1个酶活性单位(U)。公式:
注:ΔA240为反应时间内吸光度的变化;W为样品鲜重(0.4g);t为反应时间(3min);V1为提取酶液总体积(4mL);V2为测定时取用酶液体积(0.2mL)。
GR 的测定。对谷胱甘肽还原酶活性的测定参照刘振玉[16]论文中所述的GR 的特性来进行测定与计算。按每克样本每分钟催化1μmol NADPH氧化为1 个酶活单位(U)。公式:
注:ΔA340为实验组在反应时间内吸光度的变化;ΔA空白为空白组在反应时间内吸光度的变化;ε 为NADPH 摩尔消光系数6.22×103L·mol-1·cm-1;d为比色皿内径(5.85mm);W为样品鲜重(0.4g);t为反应时间(2min);V1为提取酶液总体积(4mL);V3为反应体系总体积(2.25mL);V2为测定时取用酶液体积(0.3mL)。
P OD 的测定。POD 活性的测定原理参照GARCíA-PONCE Á L[17]等人的论文。以每分钟OD值变化(升高)0.01 为1 个酶活性单位(U)。公式:
注:ΔA470为反应时间内吸光度的变化;W为样品鲜重(0.4g);t为反应时间(3min);V1为提取酶液总体积(4 mL);V2为测定时取用酶液体积(0.02mL)。
1.3.4 幼苗形态学观察分别取培养7d、15d、21d 的蓖麻幼苗的根与叶片,用清水洗净并进行拍照对比观察,清洗时注意不要损坏根茎与叶片。
1.3.5 幼苗生理指标测定叶片的生理指标测定方法参 照1.2.1 中对 种 子MDA、CAT、GR、POD 四个指标的测定,测定材料为四叶期处理后的新鲜叶片。
2 结果与分析
2.1 种子萌发对Zn2+的胁迫响应
对用清水与不同浓度ZnSO4溶液处理3d 后的种子进行观察,蓖麻种子发芽率统计结果见表1。由表1 可以看出,用不同浓度Zn2+处理的蓖麻种子的萌发程度与清水组相比差异显著,但未表现出明显规律,在Zn2+浓度达到960 mg/L 时,发芽率达到最高且显著性差异最大。
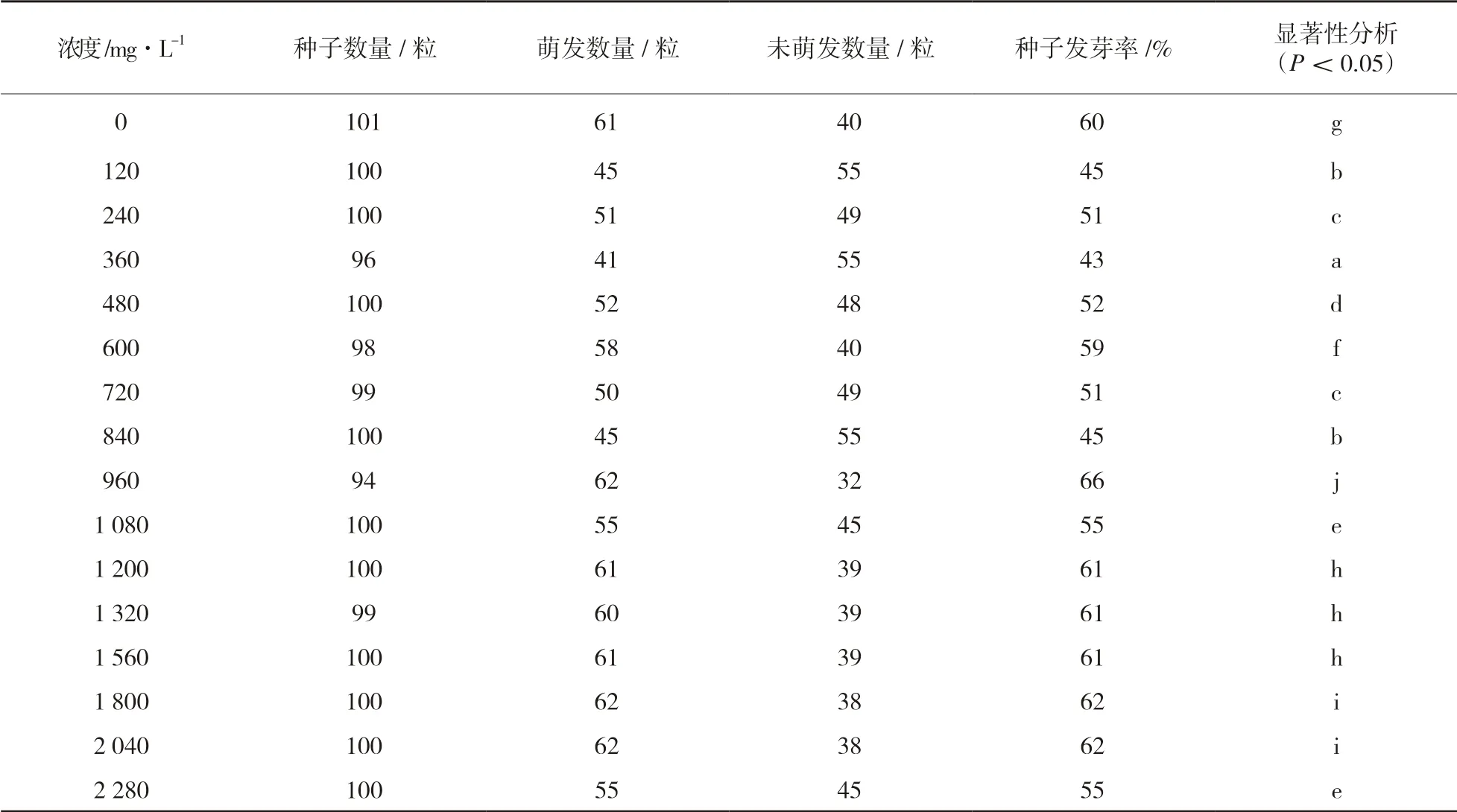
表1 蓖麻种子发芽率统计结果
对种子进行不同浓度的Zn2+处理与培养,3d后,蓖麻种子根长统计结果见表2,蓖麻种子根粗统计结果见表3。
由表2 可以看出,与清水组相比,当Zn2+浓度在480mg/L 以下时,种子根长逐渐增长;在Zn2+浓度超过480mg/L 后差异显著,但未表现出明显规律;在Zn2+浓度达到960mg/L 时,蓖麻种子的根长达到最高值41.32mm。由表3 可以看出,根粗则仅在部分浓度处理时差异显著且未出现明显规律,但在Zn2+浓度大于1 320mg/L 后,根粗数值全部低于正常数值,但没有出现蓖麻种子死亡,证明蓖麻对锌具有很高的耐性。此结果与吕冬梅[18]的研究Zn2+结果相吻合。
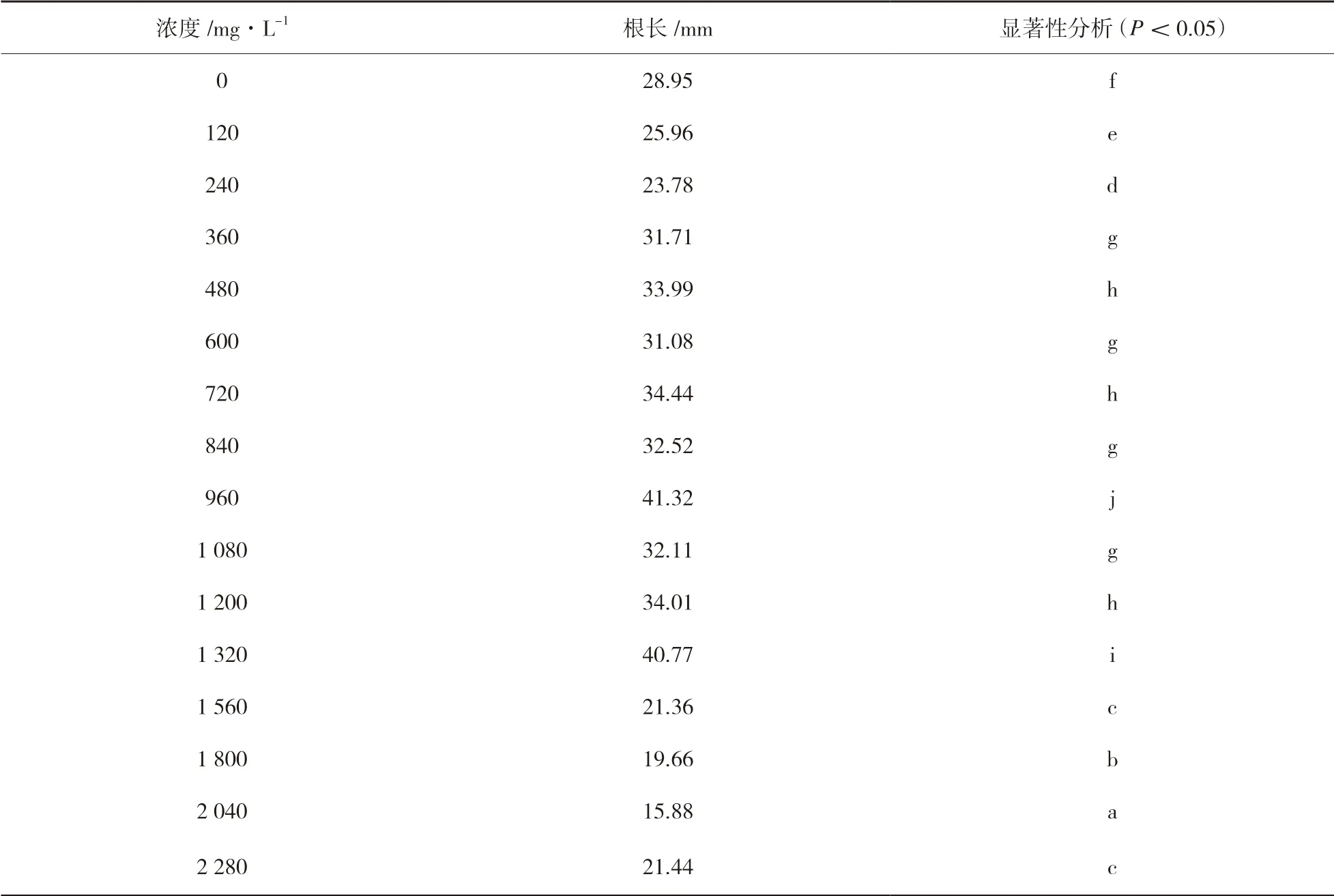
表2 蓖麻种子根长统计结果
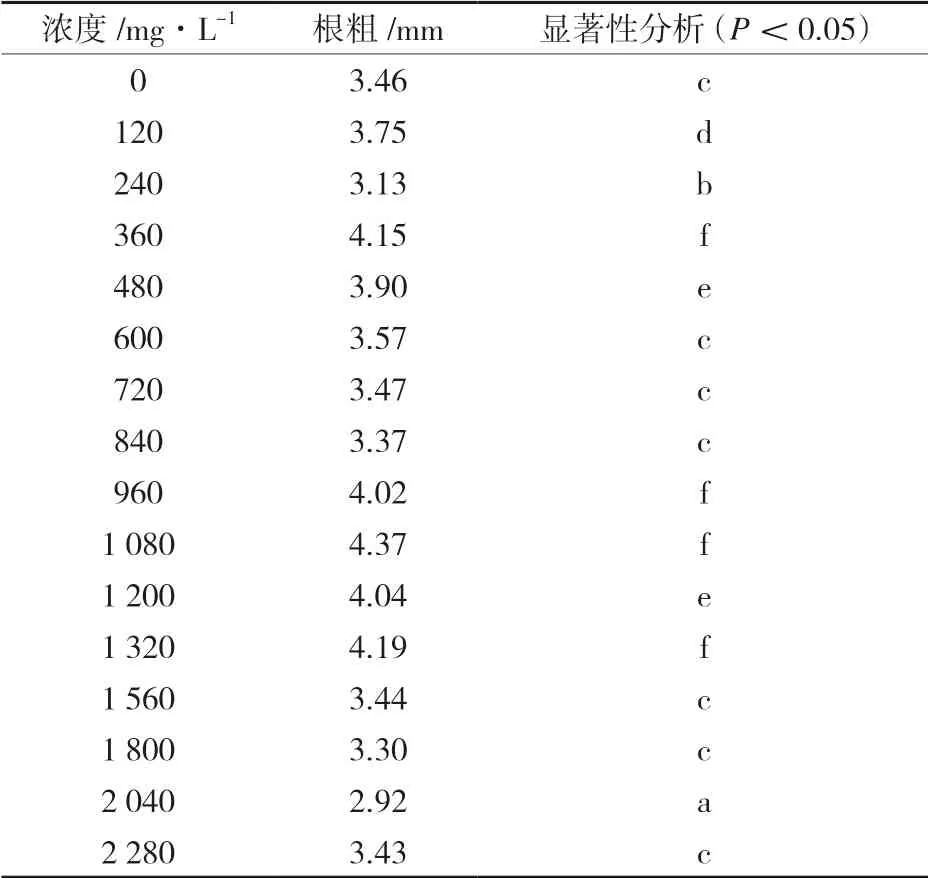
表3 蓖麻种子根粗统计结果
分别用480mg/L、720mg/L、960g/L、1 200mg/L、1 560mg/L、2 040mg/L 的ZnSO4溶液对蓖麻种子进行培养,如图1~7,图中A 为处理后萌发的种子,B 为处理后未萌发的种子。
从图1~4 可以看出,与清水组相比,Zn2+浓度达到720mg/L 时,蓖麻种子表面开始出现黄色斑块;Z n2+浓度达到960mg/L 时斑块明显减少;Zn2+浓度在1 080 ~1 320 mg/L 之间时,部分种子主根明显增长,但侧生根数量减少且黄色斑块少量增加;Zn2+浓度大于1 320mg/L 时,种子表面黄色斑块增加,主根长度减小,几乎无侧生根。
由表1 可以看出,用不同浓度Zn2+处理的蓖麻种子与清水组相比差异显著,但未表现出明显规律,且在Zn2+浓度达到960 mg/L 时,显著性差异最大。同时,在处理浓度大于960mg/L后,部分数值大大低于正常数值,因此,本实验选用960mg/L 浓度处理的种子进行生理指标测定。
按照1.3 中所述方法对培养后的种子进行生理指标测定,种子中MDA 含量、CAT 活性、GR活性和POD 活性的测定结果,见图8。
由图8 可以看出,与清水培养后的种子相比,不同Zn2+浓度处理的种子MDA 含量、CAT和POD 活性都低于对照,GR 活性则远远高于对照。
2.2 幼苗生长对Zn2+的胁迫响应
根据各处理下蓖麻种子萌发情况,选用Zn2+浓度为960mg/L 的ZnSO4溶液对蓖麻幼苗进行培养,分别在7d、15d、21d 时对幼苗的整体、叶片及根部进行观察并分析。结果见图9、图10、图11。图A 为处理后的幼苗植株形态,图B 为处理后的幼苗叶片形态,图C 为处理后的幼苗根形态;CT 为实验组,CK 为对照。
可以发现,幼苗植株在培养7d 时与对照相差不大,随着时间增加,植株越来越小;幼苗根长在培养7d 时比对照长约1/3,到15d 时根长严重缩短,到21d 时,侧生根明显减少且主根呈现不健康的棕红色;幼苗叶片在培养7d 时与对照无明显差异,到15d 时叶片开始褪绿并出现黄色斑点,到21d 时,叶片严重褪绿,叶面大幅度缩小且黄色斑块增多。但即使在该浓度下处理21d,幼苗仍未出现死亡,证明蓖麻对Zn2+具有很强的耐性。
根据1.3中所述方法对培养7d、15d、21d 后的幼苗分别进行生理指标测定,幼苗MDA 含量、CAT活性、GR 活性、POD 活性的测定结果,见图12。
由图12 可以看出,用Zn2+浓度为960mg/L的ZnSO4溶液处理的幼苗MDA 的含量与POD 活性低于对照很多,而CAT 与GR 活性则高出对照很多,其中用Zn2+浓度为960mg/L 的ZnSO4溶液处理的幼苗的POD 活性与对照相差最多。且在整个实验过程中,没有出现幼苗死亡现象,证明蓖麻对Zn2+的耐受程度极高。
3 讨论
随着锌污染日益增加,大量含锌污染物以尘、烟等形式排放到环境中,并最终通过土壤、水源、植物吸收和积累对人类健康造成威胁[19]。高效的处理锌污染逐渐成为目前急需解决的问题。植物对重金属的耐受程度与重金属在其体内的积累、转运等因素密切相关[20]。重金属胁迫不但会影响植物中叶绿素的合成,还会影响植物体内的正常代谢,最终导致植物体中各物质含量的改变[18]。相关分析表明,Zn2+在植物体内积累超出阈值,会对植物造成毒害,抑制植物生长发育,严重可能造成植物死亡[21]。蓖麻根系发达,抗逆性较强,对Zn2+有很大的耐受性,可以通过吸收和代谢实现对土壤中锌的吸附、净化、固定[22]。Rosselli[23]等的研究表明,植物中Zn2+的转运能力较好,大部分向地上部分运输。抑制生长和减少植株生物量是植物对Zn2+胁迫的普遍响应[24,25]。本实验表明,蓖麻吸收小于960mg/L 浓度的Zn2+会促进其生长,而吸收超过960mg/L 浓度的Zn2+则会对蓖麻产生毒害,抑制其生长,这与Rosselli的研究结果一致。与蓖麻相比,臭椿仅能适应在Zn2+浓度不超1 000mg/L 的土壤中生存,法桐对Zn2+的耐受性更弱,不适合种在锌污染土壤中[26]。而本实验中所用最高浓度Zn2+(2 280mg/L)处理的蓖麻仍未出现死亡现象,证明相比于其他植物,蓖麻对Zn2+耐受性更强。
4 结论
在种子萌发阶段,随着Zn2+浓度升高,蓖麻种子的发芽率虽然差异显著,但无明显趋势,在Zn2+浓度达到960mg/L 时达到最大发芽率且显著性差异最大;根长与根粗显示出先增后降,再增再降的趋势;在生长过程中即使Zn2+浓度达到2 280mg/L,种子仍未出现死亡现象,证明蓖麻对锌有很高的耐受程度;在Zn2+浓度达到960mg/L 时,蓖麻种子中吸收了过量锌,影响了其生长。在幼苗生长阶段,用Zn2+浓度为960mg/L 的ZnSO4溶液处理幼苗,随着处理时间的增加,幼苗植株越来越矮小,根长缩短,叶片越来越小且褪绿越来越严重;生理指标与对照相比证明在Zn2+浓度为960mg/L 的ZnSO4溶液培养下,蓖麻幼苗吸收的Zn2+逐渐增多,最终超过阈值,对蓖麻苗产生了严重伤害,影响其生长。但在整个实验过程中,处理后的种子和幼苗均未出现死亡现象,证明蓖麻对Zn2+有极高的耐受性。

