建构模型指导化学理论学习
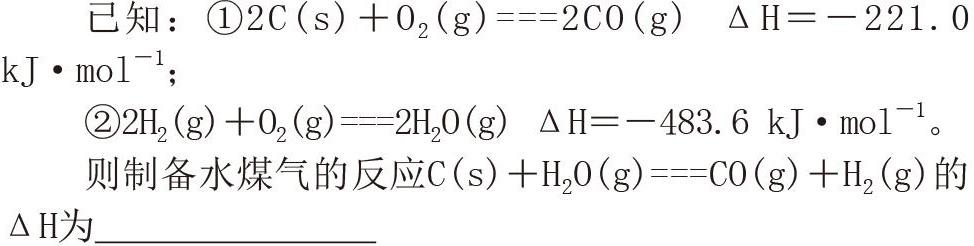


新课程标准明确提出课程改革的目的是“立德树人”。“树人”是培养学生的各方面能力,使其成为既有知识又有创新能力的人才。因此在实际教学中不仅要教给学生知识,更要教会学生学习的方法,培养学生的学科核心素养,让学生学会自主学习,掌握技能去解決实际问题。化学核心素养的五个维度中提出,学生应学会“证据推理和认知模型”,这对学习化学理论知识提出了很好的建议。化学反应原理理论性较强,学生理解不透彻,不会用原理去解决问题。教师可以帮助学生建构模型,培养学习思维,促进理解和记忆。用模型去解决一类问题时往往可以起到事半功倍的效果,学生在使用模型的过程中逐渐理解基础知识,对模型中应用的化学原理的理解也会更加深刻。
一、利用“数学运算”模型解决化学反应中能量变化问题
化学反应伴有能量的变化,涉及的主要原理包含热化学方程式和盖斯定律等。在学习热化学方程式时应抓住两点,即化学变化既有物质变化又有能量变化。物质变化涉及反应物、生成物、反应条件、物质的状态、配平等等。少数学生在书写热化学方程式时会遗忘物质状态的标注,在教学中可以强调物质的状态是其能量的重要体现,增强记忆。能量变化涉及△H的符号、数值和单位。其中△H的符号可以利用数学运算模型帮助理解,如“+”数学上表示“加”,即能量增加,也就是说该反应是一个吸热反应;“—”数学上表示“减”,即能量降低,也即该反应为放热反应。吸收或放出能量的多少与反应物的量成正比例关系,解决了△H的数值问题。
盖斯定律是指某个化学过程无论是一步完成还是分几步完成,其热效应是相同的。利用此原理可以计算某些难以实现的化学反应或者是伴有副反应的反应中的能量变化。例如:
二、利用“电流循环”物理模型和“双线桥法”分析电化学原理
电化学原理在生产生活及科研等领域应用广泛,如新能源中化学电池的探索,利用电解原理制备新物质、金属的冶炼、电镀,金属的防腐等等。因此,电化学原理试题是历年高考中必考试题,也是化学原理中的重要内容。然而一部分同学在遇到电化学试题时几乎一做就错,究其原因是没有理解电化学原理,不会分析,凭感觉答题。如何准确快速理解原电池和电解池的工作原理呢?可以运用物理中“电流是循环”的模型来进行分析。
例如,锌铜原电池工作原理分析:根据氧化还原反应原理及金属活泼性等知识可以判断,锌是电池负极铜是正极。电流从电池正极流出,再流入负极。电子的电性与电流相反,可推知电子由负极流出经导线流向正极。但电子不能进入溶液,而电路又是闭合回路,因此在溶液中是由离子的定向移动形成电流的。根据“电流循环”原理,带相同电荷的粒子运动方向一致,形成闭合电路,可推知溶液中阴离子由正极移向负极,阳离子移动方向相反。在电极上,负极因失去电子发生氧化反应,正极因得到电子发生还原反应。
电极反应式是电化学装置的重要表示方法,也是考查的重点。在实际教学中发现,不少学生不能准确书写原电池和电解池的电极反应式。书写电极反应式有多种方法,其中氧化还原反应中的“双线桥法”是比较常见的一种。学会将氧化还原反利用双线桥法拆成两个半反应(氧化反应和还原反应),可有效提高学生书写电极反应式的效率。例如:若要将反应
②书写电极反应式,负极:6I- — 6e- = 3I2 ,正极:ClO3- + 6e- + 6H+ = 6Cl- + 3H2O。在书写电极反应式时要考虑反应条件和离子共存问题。根据电极反应式可以发现,发生氧化还原反应的是离子,电极本身没有反应,所以可以选择惰性电极(如C或Pt)。为避免溶液混合直接发生反应,应设计成双液原电池,一池盛放KI溶液,另一池盛放KClO3和稀HCl的混合溶液。外电路用导线连接,内电路由盐桥沟通。
三、利用“消元法”思想探究溶液中离子浓度守恒式
水溶液中的离子平衡是化学原理中又一个重点和难点。在实际生产生活中,溶液中的离子种类、浓度关系是科研工作者必须明确的内容,它们直接关系科研的成败以及生产等带来的环境问题。教师在进行教学活动时,要培养学生了解溶液中离子浓度对科研、环境的影响的意识,要能准确分析离子浓度关系式。
化学原理教学还有许多模型可以建构,如模仿思维在影响平衡移动因素问题的应用;答题模板在实验操作中的归纳等等,都能很好地帮助学生对知识的理解。教师要学会建构模型,培养学生学会建构模型,利用模型举一反三,可以收到良好的学习效果。
安徽省肥西第三中学 王玉庭

