抗稻瘟病生防细菌的分离与筛选
卫甜 吕敏 刘怀阿 朱锦磊 苏建坤

摘要:由病原真菌Magnaporthe oryzae引起的稻瘟病是水稻生产上的一种毁灭性病害。从稻瘟病发病严重的田块分别采集健康株和病株,从14个不同生境(土壤、根茎叶围、根茎叶内)中共分离得到304株潜在生防细菌。通过对各细菌胞外产酶活性(葡聚糖酶、纤维素酶、蛋白酶)及产吲哚乙酸活性进行测定,并根据不同指标对细菌进行赋值,最终选择评分≥3分的114株细菌进行稻瘟病菌的平板拮抗试验,从中筛选得到15株对稻瘟病病菌有明显拮抗作用的生防细菌。最终根据赋值评分结果及平板拮抗试验在实验室条件下对筛选出的17株具有防治稻瘟病潜在能力的生防细菌进行16S rDNA鉴定,鉴定结果表明,有15株为芽孢杆菌,1株为糖霉菌,另1株为水库杆菌。本研究以此建立一个针对稻瘟病生防细菌筛选的系统,得到的生防细菌可以为田间防治稻瘟病并最终应用于实际生产提供理论基础。
关键词:稻瘟病;细菌筛选;酶活性测定;平板拮抗;生防细菌
中图分类号: S435.111.4+1文献标志码: A
文章编号:1002-1302(2021)07-0106-05
收稿日期:2020-06-04
基金项目:江苏里下河地区农业科学研究所专项基金[编号:SJ(17)103]。
作者简介:卫 甜(1990—),女,山西运城人,硕士,助理研究员,主要从事植物病害的生物防治工作。Tel:(0514)87302229;E-mail:weitian900128 @163.com。
通信作者:苏建坤,硕士,研究员,主要从事植物病虫害的绿色防控工作。Tel:(0514)87302325;E-mail:yzsujk@163.com。
水稻(Oryza sativa)是草本稻属中的一种,全球近50%的人口以此为主粮[1]。2019年全球水稻种植面积约为1.63亿hm2,其中我国水稻种植面积约占全球的18.57%。由病原真菌稻瘟病病菌(Magnaporthe oryzae)引起的稻瘟病是水稻生产上的一种毁灭性病害,被列为水稻三大病害之首,每年可造成10%~20%的产量损失,危害严重的地区损失达到40%~50%[2]。抗病育种、化学防治是目前针对稻瘟病防治的主要手段。
在抗病育种方面,由于稻瘟病病原真菌变异分化速度快、多样性程度高及新的生理小种层出不穷,但常规育种方法选育周期长,育出的抗病品种抗性单一,并且抗性丧失比较快,使抗病品種的广谱抗性和持久抗性难以实现,育种行业发展举步维艰[3]。在化学防治方面,相继出现了一些防治稻瘟病效果较好的化学农药。据相关报道,0.2% 苯丙烯菌酮微乳剂、30% 戊唑·嘧菌酯悬浮剂、9%吡唑醚菌酯(稻清)微囊悬浮剂等均对稻瘟病的防效可达到60%~90%[4-6]。化学农药的出现虽在一定程度上解决了稻瘟病防治难的问题,但随着公众食品安全意识的提高,其过量使用带来了病原菌抗性增强、环境污染加重、稻米农药残留等新问题。化学防治带来了植物抗药性及食品安全问题,而传统的农业防治又难达到预期的控制效果。在这种形式下,利用有益微生物来防治该病成为一种新的防治方向。
本研究通过筛选生防菌对稻瘟病进行防治,最终筛选得到17株具有生防潜力的细菌,以此为基础,建立防治稻瘟病快速筛选、评估体系,以期为生物农药田间防控稻瘟病提供理论基础。
1 材料与方法
1.1 稻瘟病生防细菌的采集与分离
细菌采集:于2018年9月在江苏省扬州市广陵区湾头水稻试验基地稻瘟病发病严重的地块,采用5点取样法分别采集健康植株和发病植株及其根围土壤。将采集后的样品迅速装入写好编号的塑料袋中带回实验室进行分离,植株体表及体内细菌的分离方法分别参照Berg等的方法[7-8]。
细菌编号:B表示病株,J表示健康株;土壤分离的细菌用T表示;根围细菌用GW表示,根内细菌用GN表示;茎围细菌用JW表示,茎内细菌用JN表示;叶围细菌用YW表示,叶内细菌用YN表示;阿拉伯数字连续表示每次保留的细菌数量。如:细菌编号为BGW11,表示从发病植株根围分离保留的第11株细菌,以此类推。
1.2 产酶和代谢产物活性测定
产纤维素酶活性的测定:将待鉴定的菌落用牙签转移到纤维素酶活性测定平板,28 ℃条件下培养 48 h,用1 g/L的刚果红溶液染1 h后,倒掉染液,用1 mmol/L的NaCl溶液浸泡1 h[9];产蛋白酶活性的测定采用同样的方法,将待鉴定的菌落转移到蛋白培养基于28 ℃培养箱中培养3 d[10];产β-1,3-葡聚糖酶活性的测定:将待鉴定的菌落用牙签转移到葡聚糖平板上,28 ℃培养48 h。以上均须观察透明圈有无,并记录透明圈大小。产吲哚乙酸活性的测定,完全参照Sawar 等的方法[11]。
1.3 细菌的赋值评估
潜在生防细菌赋值评估,评分如下:产蛋白酶、纤维素酶活性各3分,其中酶活透明圈半径为0~3 mm 赋1分,3~6 mm 赋2分,>6 mm赋3分;产吲哚乙酸和葡聚糖酶活性各赋1分,共计8分。
1.4 细菌对稻瘟病菌的平板拮抗
采用对峙培养法,将保存于4 ℃冰箱中的稻瘟病病菌斜面用接种针接种到马铃薯葡萄糖琼脂(PDA)培养基平板上活化,待菌丝长满平板后用灭菌的打孔器从菌落外边缘均匀地打成直径为8 mm的圆形菌块。将菌丝块接种在PDA平板的中心,在其四周距中心约35 mm处分别接种1株待测定的细菌。25 ℃条件下培养至菌丝长满平板后,分别记录各抑菌圈的半径(cm),重复4次。
1.5 细菌的16S rDNA鉴定
引物采用细菌16S rDNA扩增通用引物U8-27、L1494-1514,测序由通用生物系统(安徽)有限公司完成。获得的16S rDNA序列在Basic Local Alignment Search Tool(BLAST)中进行比对,取得鉴定结果。
2 结果与分析
2.1 不同生境中生防菌的分离结果
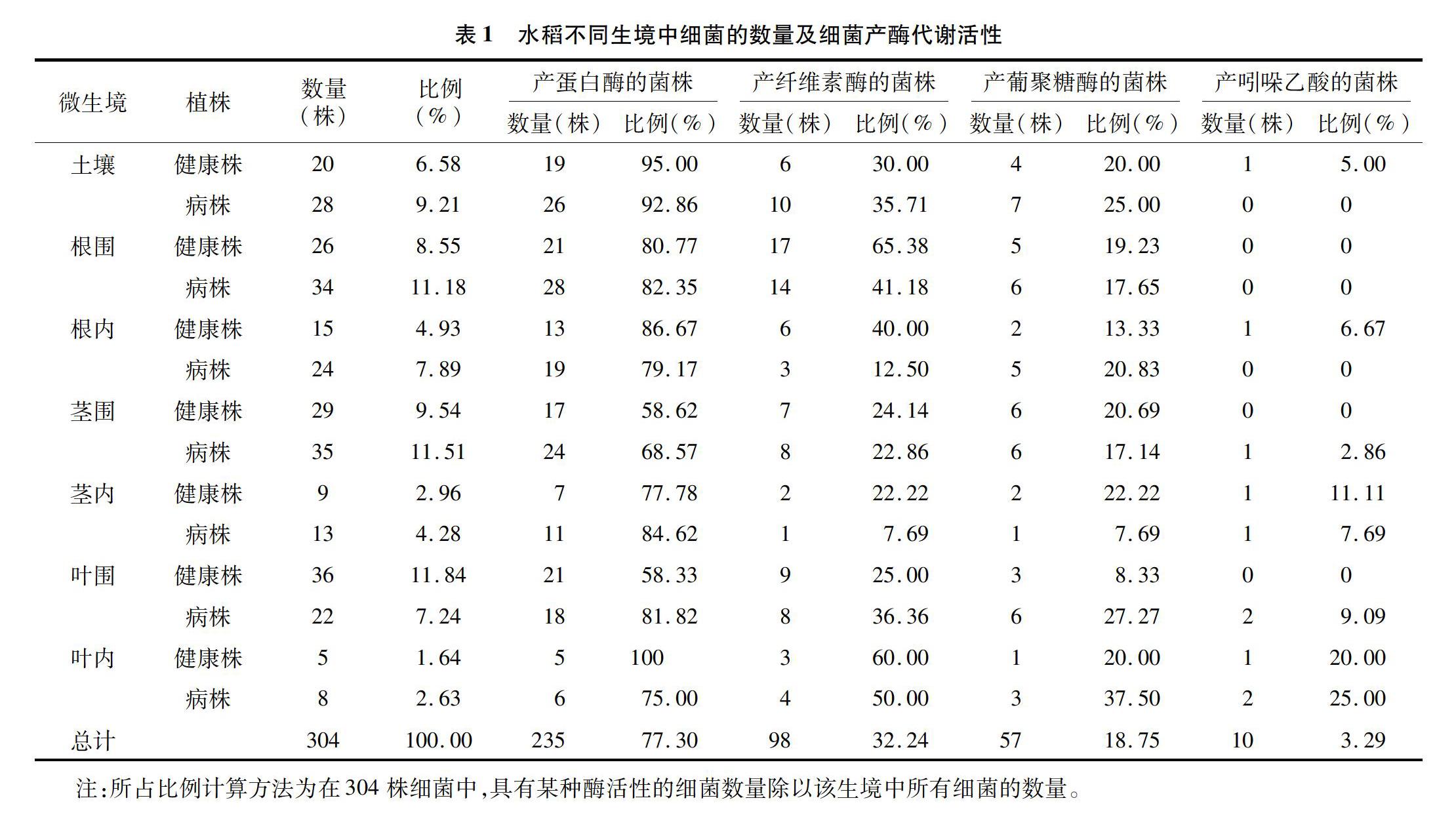
本次试验共从水稻14个不同生境(分别是健康株和病株的根茎叶围、根茎叶内以及土壤等)中分离得到304株生防细菌(表1)。其中从健康株和病株不同生境中分离得到的细菌数量分别为140、164株,分别占总分离菌数的46.05%、53.95%,總体相差不大。而从健康株叶围、病株茎围以及病株根围分离得到的细菌数量最多,分别为36、35、34株,共占总菌数的34.54%。叶内分离到的细菌总数为13株,只占总菌数的4.28%。整体来说,本研究通过对水稻稻瘟病健康株各个生境进行细菌分离,初步获得了数量比较丰富的潜在生防菌。
2.2 细菌产酶活性测定结果
研究发现,生防细菌产生的某些次生代谢产物如水解酶蛋白酶、纤维素酶以及胞壁降解酶β-1,
3-葡聚糖酶会帮助增强寄主植物的竞争力;吲哚乙酸作为一种生长激素,会影响植物细胞的分裂、伸长、分化和种子萌发、根系的发育以及营养生长过程。为此,对从不同生境中分离得到的304株细菌分别进行胞外酶活性及产吲哚乙酸活性测定,结果(表1)表明,在304株潜在生防菌中,具有蛋白酶活性的细菌最多,共计235株,占总菌数的77.30%;其次是纤维素酶(98株)、葡聚糖酶(57株),分别占总菌数的32.24%、18.75%;产吲哚乙酸的生防细菌最少(10株),只占3.29%。
具体分析各种酶活性发现,在健康株中,产蛋白酶活性高的细菌来源于叶内,高达100%,产纤维素酶活性高的细菌来源于根围(65.38%),产葡聚糖酶活性高的细菌来源于茎内(22.22%),产吲哚乙酸活性高的细菌来源于叶内(20.00%);在病株中,产蛋白酶活性高的细菌来源于根围(82.35%),产纤维素酶活性高的细菌来源于叶内(50.00%),产葡聚糖酶活性高的细菌来源于叶内(37.50%),产吲哚乙酸活性高的细菌来源于叶内(25.00%)。总之,在不同植株生境中分离得到的细菌产酶活性和产吲哚乙酸能力差异较大,从病株不同生境中分离得到的细菌数量明显高于健康株生境。无论是健康或发病植株,从叶围和根围中分离得到的细菌普遍具有较高的产酶活性。
2.3 细菌中酶活性赋值得分结果
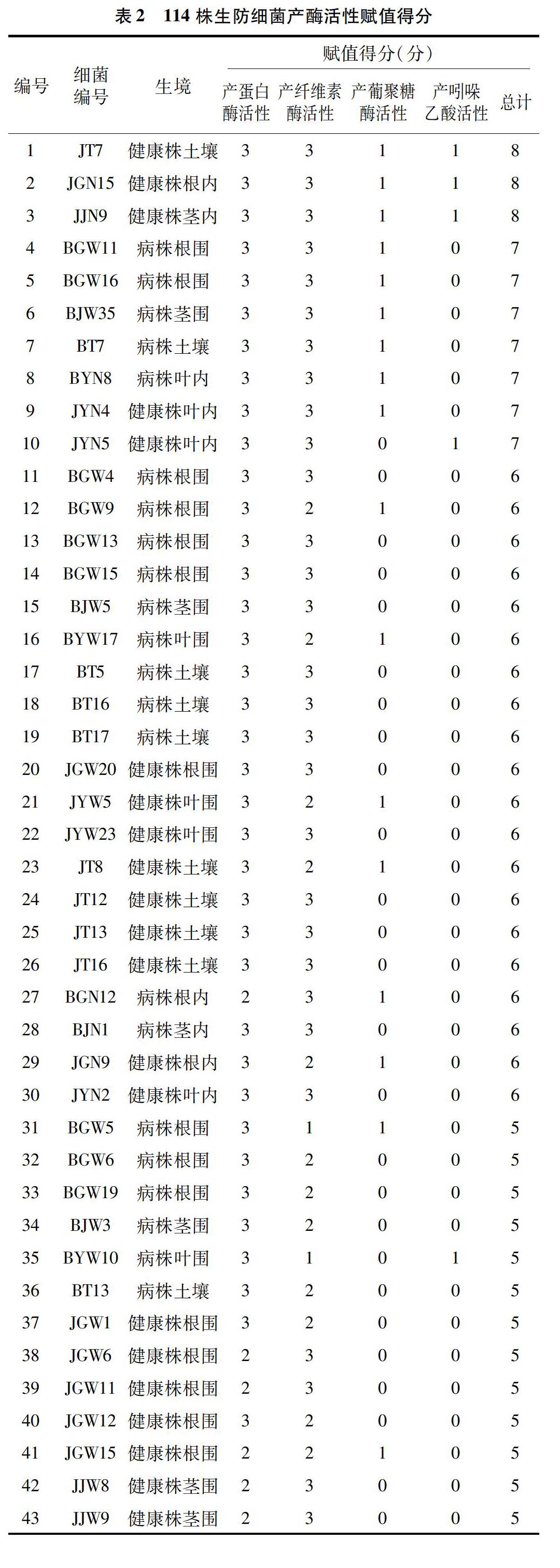
对分离得到的304株潜在生防细菌进行赋值评估,评分较高的说明防治稻瘟病效果好的可能性高。在304株细菌中,有256株细菌至少具有1种活性,其中有3株细菌同时具有4种活性,有23株细菌具有3种活性,有91株细菌具有2种活性。具有4种活性的3株生防细菌全部来自健康植株内,赋予最高分值8分。7株生防菌评分为7分,大多数来自病株。根据赋值评分结果,选取赋值评分≥3分的细菌对稻瘟病病菌进行平板拮抗试验,共计114株(表2)。
2.4 细菌对稻瘟病病菌的平板拮抗结果
通过114株细菌对稻瘟病病菌的平板拮抗试验,发现共15株对稻瘟病病菌具有不同程度的抑制效果,占总测定菌数的13.16%。抑菌率在50%以上的有10株,其中7株来源于病株,3株来源于健康株(表3)。来自健康株叶围的JYW21对稻瘟病病菌的抑制率最高,达78.25%。
2.5 生防菌的鉴定结果
结合表2的酶活测定结果,选取赋值评估为8分,外加15株对稻瘟病具有明显拮抗作用的生防细菌,本次共初步得到17株潜在生防细菌。根据16S rDNA基因序列的测序结果,与BLAST数据库的比对结果(表4)显示,筛选出的17株细菌中有1株为糖霉菌属(Glycomyces)细菌,1株为水库杆菌属(Piscinibacter)细菌,另外15株均为芽孢杆菌属(Bacillus sp.)细菌,其中4株为蜡质芽孢杆菌(Bacillus cereus),4株为高地芽孢杆菌(Bacillus altitudinis),2株为枯草芽孢杆菌(Bacillus subtilis)。
3 结论与讨论
本研究在对防治稻瘟病生防细菌的酶活筛选、平板拮抗及赋值评估体系时发现,在植株不同生境中分离得到的细菌产酶活性和产吲哚乙酸能力差异较大,从病株不同生境中分离得到的具有产酶活性和产吲哚乙酸能力的细菌数量明显高于健康株生境,可能是由于在稻瘟病病菌侵染的情况下,更能激发植株体内的防御反应,分离得到的细菌产生防御酶活性也相对更高。对稻瘟病病菌的平板拮抗是建立在酶活筛选基础上的,因为有些细菌酶活评分很高但对稻瘟病病菌并未表现出明显的拮抗效果(如来源于健康土壤内的JT7),分析可能是由于该细菌对稻瘟病的防治并不会直接杀死病原菌,而是通过诱导抗病性。在分离得到的细菌田间防效指标未知的情况下,评估生防细菌潜能应该是取两者之和更为客观科学。因此,该体系可以作为针对稻瘟病筛选生防细菌的基础,为大规模筛选生防菌体系的建立提供参考。
本研究以此体系为基础最终得到具有防治稻瘟病潜在能力的17株生防细菌,并且其中9株来源于健康株,分析可能是此时植株生境有益生菌能保护植物,抑制病原菌发生发展,而益生菌也会相应发展成为优势菌群,但最终得到的17株细菌也不能说对稻瘟病的防治会有绝对的效果,后期仍须进行温室及田间试验等研究,主要由于当这些细菌实际应用于水稻时,其防效必将会受到田间土壤、气候、温湿度、土壤微生物等诸多因素的综合影响。
芽孢杆菌属(Bacillus)的细菌早已在国内外得到了广泛的关注,应用潜力最大[12]。其广泛受关注的原因是芽孢杆菌易于分离和纯化,同时能产生耐热、抗逆性强的芽孢,且制剂稳定、抑菌能力强、施用方便、便于运输[13]。针对稻瘟病的生物防治,早有研究报道,从水稻根际筛选的208 株细菌对稻瘟病病菌有较好的拮抗作用,其中包括蜡状芽孢杆菌和枯草芽孢杆菌在内的一些芽孢杆菌防效可达50%以上[14];枯草芽孢杆菌 IK-1080的培养滤液,当芽孢浓度在1×108、5×108CFU/mL时,明显可以抑制稻瘟病病菌分生孢子萌发和菌丝生长,叶瘟的发生率分别减轻13.8%、7.7%,产量损失减少522%、735%[15];从水稻根系土壤中分离得到的枯草芽孢杆菌 T492对稻瘟病病菌的抑制率达 626%[16]。本次试验初步得到17株生防细菌,经过鉴定绝大多数为芽孢杆菌,相信对稻瘟病的生物防治具有重要意义,后续将专门对芽孢杆菌的生防效果进行系统评价并且研究其抗病机制,从理论及实际应用为稻瘟病的生物防治提供基础。
参考文献:
[1]Ju C X,Buresh R J,Wang Z Q,et al. Root and shoot traits for rice varieties with higher grain yield and higher nitrogen use efficiency at lower nitrogen rates application[J]. Field Crops Reserch,2015,175:47-55.
[2]王巧兰,郭 刚. 水稻稻瘟病生物防治研究进展[J]. 河南农业科学,2005(10):10-13.
[3]王丹,沙 岩,胡俊峰,等. 抗稻瘟病基因的克隆及其分子育种研究进展[J]. 分子植物育种,2019,17(14):4661-4666.
[4]陈婷婷,向礼波,龚双军,等. 0.2%苯丙烯菌酮微乳剂防治水稻稻瘟病田间药效试验[J]. 湖北植保,2019(5):4-6.
[5]周柏超. 30%戊唑·嘧菌酯懸浮剂防治水稻纹枯病和稻瘟病试验总结[J]. 现代农业,2019(8):30.
[6]冯春水,张再仁,陈文化. 水稻稻瘟病防治药剂筛选研究[J].湖北农业科学,2019,58(22):108-110.
[7]Berg G,Kurze S,Buchner A,et al. Successful strategy for the selection of new strawberry-associated rhizobacteria antagonistic to Verticillium wilts[J]. Canadian Journal of Microbiology,2000,46(12):1128-1137.
[8]Krechel A,Faupel A,Hallmann J,et al. Potato-associated bacteria and their antagonistic potential towards plant-pathogenic fungi and the plant-parasitic nematode Meloidogyne incognita(Kofoid & White) Chitwood[J]. Canadian Journal of Microbiology,2002,48(9):772-786.
[9]Ghose T K. Measurement of cellulase activities[J]. Pure and Applied Chemistry,1987,59(2):257-268.
[10]Yang J H,Liu H X,Zhu G M,et al. Diversity analysis of antagonists from rice associated bacteria and their application in biocontrol of rice diseases[J]. Journal of Applied Microbiology,2008,104(1):91-104.
[11]Sarwar M,Kremer R J. Determination of bacterially derived auxins using a microplate method[J]. Letters in Applied Microbiology,1995,20(5):282-285.
[12]孔令春,魏松红,王海宁,等. 抗稻瘟病的生防细菌筛选与鉴定[J]. 沈阳农业大学学报,2018,49(6):655-660.
[13]朱玥妍,刘 姣,杜春梅. 芽孢杆菌生物防治植物病害研究进展[J]. 安徽农业科学,2012,40(34):16635-16658.
[14]彭化贤,刘波微,陈小娟,等. 水稻稻瘟病拮抗细菌的筛选与防治初探[J].中国生物防治,2002,18(1):25-27.
[15]Taguchi Y,Hyakumachi M,Horinouchi H,et al. Biological control of rice blast disease by Bacillus subitilis IK-1080[J]. Japanese Journal of Phytopathology,2003,69(2):85-9
[16]张 芬. 水稻稻瘟病和白叶枯病拮抗细菌的筛选及防治作用研究[D]. 南京:南京农业大学,2011.

