稻瘟病菌MoSCJ1基因的生物学功能分析
陈 浩, 王 敏, 杨子峰, 廖 煌, 吴 欢, 凌 菡, 汤 蔚
(福建农林大学闽台作物有害生物生态防控国家重点实验室,福建 福州 350002)
稻瘟病是全球水稻生产上的重要病害之一,对水稻的产量和品质具有巨大的威胁,发生严重时能造成整片稻田绝收.稻瘟病菌(Magnaportheoryzae)通过分生孢子传播,分生孢子在水稻叶片表面萌发产生芽管并形成附着胞,后产生侵染栓穿透叶片的角质层和表皮细胞壁,在寄主细胞内分化产生次生菌丝并侵染邻近细胞和组织,继而发病.
内质网是由囊状、管状和泡状结构组成的一个连续的网膜系统.真核细胞中,在折叠酶、伴侣结合蛋白等协助下,内质网对分泌性蛋白质合成、转运和加工并运输到相关的细胞部位发挥功能.为了保证蛋白质能正确折叠和修饰,以达到天然构象从而转运到目标细胞器或分泌到胞外,细胞内部有一套严格的蛋白质质量控制系统,一旦蛋白质由于转录翻译失败或不同条件压力等原因发生错误折叠并聚集在内质网中,内质网就会产生压力,影响细胞的正常生理功能[1-2].
真核细胞存在两条途径调控内质网压力:非折叠蛋白响应(unfolded protein response, UPR)和内质网相关蛋白降解(endoplasmic reticulum-associated protein degradation, ERAD)[3].其中,ERAD主要通过泛素化降解内质网中错误折叠或未折叠的蛋白[4],其包括底物识别、定位、泛素化、逆向运输和蛋白酶体降解等步骤.底物识别水平决定底物的降解程度.蛋白质错误折叠是由于其本应在蛋白质内部的疏水区暴露在外从而引起蛋白质之间的聚集而发生,在底物识别的过程中,热休克蛋白Hsp70家族成员(Bip/Kar2)会与疏水区结合促进多肽链折叠,从而避免蛋白质分子的聚集[5].与Hsp70长时间作用后的底物会被E3泛素连接酶Hrd1复合物识别[6].Hsp40/DnaJ是一个可以调节Hsp70分子伴侣活性的蛋白质家族,Hsp40s刺激Hsp70蛋白固有的弱腺苷三磷酸(adenosine triphosphate, ATP)酶活性,使其由ATP状态转变为腺苷二磷酸(adenosine diphosphate, ADP)状态,从而对底物有强亲和性,促进Hsp70与多肽底物的相互作用.Hsp70家族成员通常有多个Hsp40伴侣,其特定的配对控制Hsp70伴侣参与调控特定过程.所有Hsp40均含有高度保守的75个氨基酸J结构域,该结构域与Hsp70的ATP酶结构域相互作用,促进ATP水解[7].研究表明,酿酒酵母(Saccharomycescerevisiae)基因组的Hsp40/DnaJ家族中有22种蛋白质,其中包括Scj1蛋白[8].
Scj1作为一种蛋白分子伴侣参与蛋白的折叠过程.已有研究发现,缺失Scj1会影响Hsp70的活性,进而影响ERAD途径中底物的识别及降解过程,最终启动细胞的凋亡程序[8].目前,有关Scj1在丝状真菌中的研究较少.本试验利用基因敲除技术获得MoSCJ1基因敲除突变体(ΔMoscj1),研究其营养生长、无性繁殖、致病力及对细胞壁胁迫剂的应答等情况,以探讨MoSCJ1基因在稻瘟病菌中的生物学功能,为其他病原真菌中SCJ1基因的研究提供一定的参考.
1 材料与方法
1.1 供试菌株及其他材料
本研究中所用稻瘟病菌野生型菌株Guy11由福建农林大学闽台作物有害生物生态防控国家重点实验室保存,ΔMoscj1突变体和互补菌株ΔMoscj1/MoSCJ1均由本试验获得.
试验所用的水稻品种CO39、大麦种子均保存于福建农林大学闽台作物有害生物生态防控国家重点实验室的4 ℃冷库中.
完全培养基(complete medium, CM):20×硝酸盐50 mL·L-1,1 000×微量元素1 mL·L-1,1 000×维生素溶液1 mL·L-1,葡萄糖10 g·L-1,蛋白胨2 g·L-1,水解酪蛋白1 g·L-1,酵母提取物1 g·L-1,琼脂粉15 g·L-1.基本培养基(minimal medium, MM):NaNO36 g, KCl 0.52 g, MgSO4·7H2O 0.152 g, KH2PO41.52 g,维生素B1 0.01 g,微量元素溶液1 mL,葡萄糖10 g,琼脂粉15 g.稻秆培养基(straw decoction and corn, SDC):稻秆100 g·L-1(煮沸20 min,两层纱布过滤),玉米粉40 g·L-1,琼脂粉15 g·L-1[9].TB3培养基:水解酪蛋白3 g·L-1,酵母提取物3 g·L-1,蔗糖20%,琼脂粉12 g·L-1.色氨酸缺陷型合成葡萄糖基础培养基(synthetic dextrose minimal medium without tryptophan, SD-Trp):无氨基酵母氮源6.7 g, D-山梨糖醇182.2 g,缺色氨酸氨基酸粉末0.74 g,葡萄糖20 g,琼脂粉15 g,pH 5.8[10].LB培养基:胰蛋白胨10 g·L-1,酵母提取物5 g·L-1, NaCl 10 g·L-1,琼脂15 g·L-1;酵母膏胨葡萄糖琼脂培养基(yeast extract peptone dextrose medium, YPD):葡萄糖20 g·L-1,蛋白胨20 g·L-1,酵母提取物10 g·L-1,琼脂粉15 g·L-1.
试剂与仪器:潮霉素B,北京索莱宝科技有限公司;博来霉素,美国Innivogen公司; Southern杂交试剂盒,美国罗氏公司;rTaq酶、RNase,宝日医生物技术(北京)有限公司;刚果红(congo red, CR),西格玛奥德里奇(上海)贸易有限公司;microcloth, EMD Millipore公司;T100 PCR仪,美国Bio-Rad公司;智能培养箱,宁波江南仪器厂;Nikon E200生物显微镜、激光扫描共聚焦显微镜,日本尼康公司;血球计数板,北京索莱宝科技有限公司;Centrifuge 5420离心机,德国艾本德股份公司;PowerShot G7 X Mark Ⅱ相机,佳能(中国)有限公司.
1.2 MoScj1的系统发育分析
在酵母基因组数据库中得到酿酒酵母Scj1的蛋白质序列,根据其与本试验稻瘟病菌Guy11的序列同源性比对结果,得到的同源蛋白为MoScj1.在NCBI中利用Blast比对得到一组MoScj1的同源蛋白序列,选取8个不同物种的序列在MEGA 5.0软件中采用邻接法(neighbor-joining, NJ)建立系统发育树[11].
1.3 MoSCJ1突变体的获得
1.3.1MoSCJ1基因的敲除 以稻瘟病菌野生型菌株Guy11基因组为模板,以MoSCJ1-F1/MoSCJ1-F2和MoSCJ1-F3/MoSCJ1-F4(表1)两对引物对MoSCJ1基因上游和下游各1 000 bp左右的DNA片段进行PCR大量扩增.与此同时,将pCX62质粒作为模板,以引物HYH-F/HYH-R(表1)对潮霉素磷酸转移酶基因全长进行PCR扩增,并对扩增结果进行纯化回收.将扩增好的MoSCJ1基因上游和下游各1 000 bp左右的DNA片段及潮霉素磷酸转移酶基因全长中的目的片段进行融合PCR,获得长度约为3 400 bp的重组片段.以引物MoSCJ1-F1/MoSCJ1-F4(表1)对重组片段进行大量扩增,纯化回收所得片段,将回收产物用于原生质体的转化[12].用潮霉素(600 μg·mL-1)筛选转化子.

表1 试验所用引物Table 1 Primers used in this study
1.3.2MoSCJ1突变体的鉴定 用灭菌的牙签挑选转化子至CM培养基上,培养4 d后,用CTAB法粗提转化子DNA[13].然后以粗提的转化子DNA为模板,用引物MoSCJ1-KO-F/MoSCJ1-KO-R(表1)进行PCR验证,阳性对照以野生型菌株Guy11基因组为模板,阴性对照以无菌水为模板,在阳性对照有条带、阴性对照无条带的前提下,对无条带出现的转化子进行下一步验证;以无条带的粗提转化子DNA为模板,用引物MoSCJ1-BY-F/HY-R(表1)再次进行PCR验证,阳性对照和阴性对照同上,在阳性对照、阴性对照均无条带的前提下,有条带的转化子即为突变体.
1.4 回补菌株的获得
1.4.1 回补载体的构建 以野生型菌株Guy11基因组为模板,以引物NP-SCJ1-F/NP-SCJ1-R(表1)进行PCR扩增,得到长度为4 247 bp的片段.将其与pYF11骨架片段共同转入XK-125酵母感受态细胞中,并于SD-Trp培养基上培养24 h.以酵母转化子为模板,用引物MoSCJ1-KO-F/GFP-R(表1)进行PCR验证,取有条带的酵母转化子在YPD培养基中摇培18 h,提取质粒.将酵母质粒转入大肠杆菌中,再进行PCR验证,并将结果测序,获得回补载体.
1.4.2 回补菌株的鉴定 将回补质粒转入突变体的原生质体中,培养4 d后挑出转化子,在激光扫描共聚焦显微镜下用博来霉素(200 μg·mL-1)进行筛选.
1.5 MoSCJ1突变体的生物学表型分析
1.5.1 突变体在不同培养基上的营养生长 从保菌袋中取出野生型菌株Guy11、突变体和回补菌株的存菌滤纸片分别接种于CM培养基上,于28 ℃黑暗培养箱中培养5 d.然后在各菌落边缘切取3 mm×3 mm的菌块并接种于CM、MM、SDC培养基上,每个菌株设3个重复.在28 ℃黑暗培养箱中培养7 d后,测量、记录其直径并拍照.
1.5.2 突变体对细胞壁胁迫剂的响应 从野生型菌株Guy11、突变体和回补菌株的菌落边缘切取3 mm×3 mm的菌块,分别接种于含有胁迫剂CR(400 μg·mL-1)的CM培养基上,每个菌株设3个重复.在28 ℃黑暗培养箱中培养7 d后,测量、记录其直径并拍照,同时计算抑制率,抑制率=(空白组菌株直径-处理组菌株直径)/空白组菌株直径×100%.
1.6 MoSCJ1突变体的产孢量测定及分生孢子梗观察
1.6.1 产孢量的测定 从野生型菌株Guy11、突变体和回补菌株的菌落边缘切取3 mm×3 mm的菌块,分别接种于SDC培养基上,每个菌株设3个重复,在28 ℃黑暗培养箱中培养5 d.刮去表面气生菌丝,置于黑光灯下培养5 d后,用无菌水冲洗培养基,2层microcloth过滤于10 mL离心管中得到孢子液,并最终定容至2 mL.在血球计数板上统计孢子数目,并记录数据.
1.6.2 分生孢子梗的观察 菌株培养方法同1.6.1.切2 cm×2 cm的菌块于载玻片上,菌丝面贴载玻片,黑光灯下培养2 d后,在Nikon E200生物显微镜下观察分生孢子梗产孢情况并拍照.试验重复3次.
1.7 MoSCJ1突变体的附着胞萌发试验
孢子液的制备方法同1.6.1,调整孢子液浓度为8×105个·mL-1.将疏水性盖玻片置于载玻片上,向盖玻片上滴40 μL孢子液后,将载玻片放入保湿盒中,于28 ℃黑暗培养箱中培养,分别于4、8、12、24 h在Nikon E200生物显微镜下观察分生孢子的萌发情况并拍照,每个菌株统计100个孢子,计算孢子萌发率和附着胞形成率.试验重复3次.
1.8 MoSCJ1突变体的侵染试验
1.8.1 水稻侵染 种植感病水稻品种CO39,于26 ℃温室中培养至三叶一心期.孢子液的制备方法同1.6.1,用血球计数板调整孢子液浓度为8×105个·mL-1,向孢子液中加入0.2%(体积分数)明胶,混匀,用喷壶均匀地喷洒在水稻叶片上.然后将水稻置于28 ℃黑暗培养箱中培养24 h,再放在接种室培养6 d,观察水稻的感染情况,统计并记录病斑等级[14],对感病水稻叶片进行拍照.试验重复3次.
1.8.2 离体大麦侵染 种植大麦,于温室中培养9 d.孢子液的制备方法同1.6.1,用血球计数板调整孢子液浓度为8×105个·mL-1,向孢子液中加入0.2%(体积分数)明胶.剪取长度一致的大麦叶片,滴20 μL孢子液于大麦叶片背部,将大麦叶片置于28 ℃黑暗培养箱中保湿培养24 h.撕取大麦背部表皮,在Nikon E200生物显微镜下观察菌丝侵染情况并拍照.试验重复3次.
1.9 数据处理
用Excel 2010软件对试验数据进行分析和处理,用DPS数据处理系统进行单因素统计分析.
2 结果与分析
2.1 MoScj1系统发育分析
系统发育树分为两大分支,MoScj1与酿酒酵母S288C具有高度同源性,且从整体来看与其他7个物种裂殖酵母(Schizosaccharomycespombe)、拟南芥(Arabidopsisthaliana)、粘菌(DictyosteliumdiscoideumAX4)、果蝇(Drosophilamelanogaster)、利什曼原虫(Leishmaniadonovani)、秀丽线虫(Caenorhabditiselegans)、人类(Homosapiens)的同源蛋白序列均有相似性.由此推测这些物种的Scj1同源蛋白在功能上可能具有保守性.

图1 稻瘟病菌Scj1与其他8个物种同源蛋白序列的系统发育树Fig.1 Phylogenetic tree of the homologous amino acid sequences of Scj1 in M.oryzae and other 8 species
2.2 MoSCJ1突变体的鉴定
利用同源重组原理构建了基因敲除载体(图2A),通过原生质体转化的方法,得到具潮霉素抗性的转化子.粗提转化子基因组DNA,利用基因内部引物、臂外引物进行PCR验证,基因内部引物验证无条带、臂外引物验证有条带的转化子即为突变体.结果显示,转化子ΔMoscj1-4、ΔMoscj1-22、ΔMoscj1-23和ΔMoscj1-37为符合条件的MoSCJ1基因敲除突变体(图2B).随机选取ΔMoscj1-22突变体用于后续试验.
2.3 MoSCJ1突变体的营养生长
图3显示,突变体菌株在CM和SDC培养基上生长的直径与野生型菌株和回补菌株相比无明显差异,而在MM培养基上生长的直径相比于野生型菌株和回补菌株极显著缩小(P<0.01).可见,MoSCJ1参与调控稻瘟病菌在基本培养基上的营养生长过程.
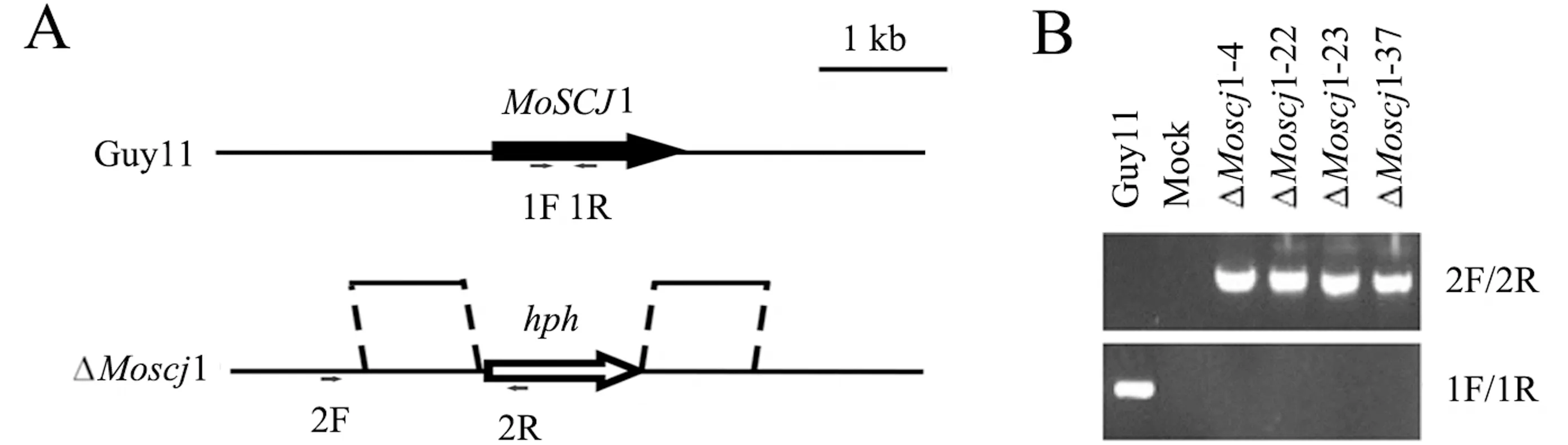
A.MoSCJ1基因的敲除策略;B.PCR验证结果(Guy11为以野生型菌株为模板的阳性对照,Mock为以无菌水为模板的阴性对照).图2 MoSCJ1基因的靶向敲除Fig.2 The targeted deletion of MoSCJ1 gene

**表示同一培养基下不同菌株之间的差异极显著(P<0.01).图3 野生型菌株Guy11、突变体ΔMoscj1、回补菌株ΔMoscj1/MoSCJ1在CM、MM、SDC培养基上的营养生长情况(A)和菌落直径(B)Fig.3 Vegetative growth (A) and colony diameters (B) of Guy11, ΔMoscj1 and ΔMoscj1/MoSCJ1 on CM, MM, SDC plates
2.4 MoSCJ1突变体对细胞壁胁迫剂的响应
相比于野生型菌株和回补菌株,突变体对CR更加敏感(图4),抑制率呈现极显著差异(P<0.01).这说明MoSCJ1参与调控稻瘟病菌对细胞壁胁迫剂的应答过程.

CK为不加入胁迫剂的对照组;CR为加入刚果红的处理组.**表示差异极显著(P<0.01).图4 野生型菌株Guy11、突变体ΔMoscj1、回补菌株ΔMoscj1/MoSCJ1在含有CR的CM培养基上的生长情况(A)和抑制率(B)Fig.4 The growth (A) and inhibition rate of Guy11, ΔMoscj1 and ΔMoscj1/MoSCJ1 on CM plates containing CR
2.5 MoSCJ1突变体的无性繁殖
结果显示,野生型菌株、突变体和回补菌株均能产生大量孢子(图5A),且三者之间的产孢量无显著差异(图5B).由此推测MoSCJ1不参与调控稻瘟病菌的无性繁殖过程.

图5 野生型菌株Guy11、突变体ΔMoscj1、回补菌株ΔMoscj1/MoSCJ1在SDC培养基上分生孢子梗的产孢情况(A)和产孢量(B)Fig.5 Conidia formation (A) and conidial production (B) of Guy11, ΔMoscj1 and ΔMoscj1/MoSCJ1 strains on SDC plates
2.6 MoSCJ1突变体的附着胞形成
图6A显示,野生型菌株、突变体和回补菌株均能正常形成附着胞,4 h后均能形成圆球状的附着胞,黑色素在8 h后均明显累积,24 h后三者的附着胞已经完全形成.统计结果显示,突变体的分生孢子萌发率在4 h后达到80%以上,且与野生型菌株和回补菌株无显著差异; 24 h后3种菌株的分生孢子萌发率均超过90%(图6B).不同时间段突变体的附着胞形成率与野生型菌株和回补菌株相比也不存在显著差异.由此推测MoSCJ1不参与调控稻瘟病菌附着胞的形成过程.

图6 野生型菌株Guy11、突变体ΔMoscj1、回补菌株ΔMoscj1/MoSCJ1的附着胞形态(A)、孢子萌发率(B)和附着胞形成率(C)Fig.6 Morphology of appressorium (A) , spore germination rate (B) and appressorium formation ratio (C) of Guy11, ΔMoscj1 and ΔMoscj1/MoSCJ1 strains
2.7 MoSCJ1突变体的致病性
突变体能在水稻叶片表面形成清晰、典型的病斑(图7A),其发病程度与野生型菌株和回补菌株无显著差异,且同一等级的病斑数量与野生型菌株和回补菌株也无显著差异(图7B).接种24 h后,野生型菌株、突变体和回补菌株均能在大麦叶片背部表皮形成附着胞,且附着胞形成的侵染菌丝能大量扩展至相邻细胞(图7C).这说明MoSCJ1不参与调控稻瘟病菌的致病过程.

A.水稻叶片的发病情况;B.水稻叶片的病斑比例;C.大麦叶片背面侵入菌丝的扩展情况.图7 野生型菌株Guy11、突变体ΔMoscj1、回补菌株ΔMoscj1/MoSCJ1的致病性Fig.7 Pathogenicity of Guy11, ΔMoscj1 and ΔMoscj1/MoSCJ1 strains
3 讨论
有研究表明,SCJ1p的缺失会引起酿酒酵母的细胞壁缺陷[8].本研究发现,稻瘟病菌MoSCJ1基因缺失突变体在MM培养基上的生长速率较野生型菌株显著下降,表明MoSCJ1参与对稻瘟病菌营养生长的调控.相比于CM培养基和SDC培养基,MM培养基的成分比较简单,均为无机物,推测MoSCJ1基因在稻瘟病菌利用无机物进行菌丝营养生长的过程中具有重要作用.而突变体在CM和SDC培养基上的生长速率正常,提示MoSCJ1可能参与了稻瘟病菌对于部分营养物质的吸收过程.另外,与野生型菌株和回补菌株相比,突变体对于细胞壁胁迫剂更为敏感,推测在缺失MoSCJ1基因后,稻瘟病菌本身的细胞壁组分和结构可能发生了变化,导致其对于细胞壁胁迫剂的应答反应出现缺陷,敏感性增加,提示MoSCJ1基因可能参与调控稻瘟病菌对细胞壁胁迫剂的应答过程.同时,该结果与酿酒酵母[8]的表现类似,提示SCJ1基因在维持不同物种细胞壁完整性的功能上存在一定的保守性.
细胞壁是真菌细胞最外层的结构,由几丁质、α-1,3-葡聚糖、β-葡聚糖等物质组成,其对病原菌的生长发育、侵染性等有重要的作用[15].有研究表明,缺失了几丁质合酶(CHS7)的稻瘟病菌,附着胞功能异常,致病过程受影响[16].由此可得,细胞壁的完整性对稻瘟病菌的生长和致病性具有重要作用.根据试验结果推测,突变体细胞壁的某些组分和结构发生变化,使得细胞壁的渗透性和对营养物质的选择性受到影响,从而降低了稻瘟病菌对于部分营养物质的吸收效率,导致稻瘟病菌的营养生长异常,提示MoSCJ1基因缺失突变体对部分营养物质吸收功能的异常与细胞壁完整性的改变存在关系.另外,敲除稻瘟病菌细胞壁中的α-1,3-葡聚糖合酶(AGS1)会导致突变体的致病性丧失[17];而本试验中,突变体细胞壁的破坏未对该菌致病性产生影响,与张梦园等[18]的研究结果一致,说明MoSCJ1基因的敲除对于细胞壁完整性的改变是轻微的.
综上所述,MoSCJ1基因不参与调控稻瘟病菌的无性繁殖、附着胞形成及致病过程,但调控稻瘟病菌的营养生长和对细胞壁胁迫剂的响应过程.具体的调控机制还有待进一步研究.

