赤芍的抑菌作用及其防治慢性牙周炎的机制研究
龚 怡,吴泽钰,2,王 琛,赵 今,2
慢性牙周炎(chronic periodontitis,CP)主要由牙龈卟啉单胞菌(Porphyromonasgingivalis,P.g)、具核梭杆菌(Fusobacteriumnucleatum,F.n)和伴放线聚集杆菌(ActinobacillusActinomycetes,A.a)等多种牙周致病菌侵犯牙周组织引起,是一种进行性破坏性疾病,也是导致成年人丧失咀嚼功能的主要原因[1]。牙周致病菌产生的内毒素、蛋白酶可以感染牙周组织并刺激机体产生炎症细胞因子,介导全身性慢性炎症[2]。在牙周炎治疗领域,中医药因其不良反应小、标本兼治等优点引起广泛关注[3]。
赤芍是毛茛科植物芍或川赤芍的干燥根,赤芍提取物具有良好的抑菌、抗炎作用[4]。本研究拟探讨赤芍提取物对牙周致病菌的体外抑菌活性,并通过网络药理学方法研究赤芍治疗CP的潜在活性成分和药理机制。
1 材料与方法
1.1 体外抑菌实验
1.1.1 主要材料和仪器 酶标仪(赛默飞世尔,美国);7.0 L密封培养罐、厌氧产气袋、厌氧指示剂(三菱,日本);旋转蒸发仪(爱朗,中国上海);冷冻干燥机(博医康,中国北京);脑心浸液(BD,美国);琼脂(Biofroxx,德国);无菌脱纤维羊血(源叶,中国上海)。
1.1.2 药材提取 将干燥赤芍药材(天诚,河北)粉碎后过60目筛制备赤芍粉。称取500 g赤芍粉,40 ℃环境下70%乙醇(体积比1∶8)浸提2 h,重复3次,合并浸取液。抽滤后,40 ℃旋蒸,低温冷冻干燥后将赤芍提取物置4 ℃备用[5]。
1.1.3 菌株及细菌培养 采用P.gBAA 308、F.nATCC 25586和A.aATCC 700685进行实验,以上菌株均购自美国模式培养物集存库(American type culture collection,ATCC)。将菌株复苏后接种于BHI血琼脂平板,37 ℃厌氧(80%N2,20%CO2)培养48 h,菌落鉴定后挑取菌落于BHI液体培养基中,继续培养48 h,取处于生长对数期的细菌用于实验,调整菌液浓度备用(P.g为1×107CFU/mL,F.n为1×107CFU/mL,A.a为1×108CFU/ml)。
1.1.4 最低抑菌浓度(minimum inhibitory concentration,MIC)及最低杀菌浓度(minimal bactericidal concentration,MBC)测定 赤芍提取物用BHI液体培养基进行倍比稀释,最终浓度为64.0、32.0、16.0、8.0、4.0、2.0、1.0、0.5 g/L。将含不同浓度实验药液的无菌BHI液体培养基作为溶剂组;将P.g、F.n菌悬液与实验药液按照体积比1∶1,A.a菌悬液与实验药液按照体积比1∶9混合作为实验组,37 ℃厌氧(80%N2,20%CO2)培养48 h后,酶标仪测定OD600 nm,实验组与溶剂组OD值差值≤0.05的最低浓度为MIC。选择大于MIC浓度的各孔,接种于BHI固体培养基,37 ℃厌氧培养48 h,观察菌落数少于5个对应的药物最低浓度为MBC。每组实验均设置阳性对照组(含0.05%氯己定的菌悬液)、阴性对照组(不含药物的菌悬液)和空白对照组(不含细菌和药物的BHI培养基),重复3次实验取平均值。
1.2 赤芍中活性成分筛选及靶点预测
使用中药系统药理学数据库及分析平台(TCMSP)筛选并整理赤芍化学成分及靶点[6]。筛选条件为口服生物利用度(oral bioavailability,OB)≥30%,化合物类药性(drug likeness,DL)≥0.18。
1.3 CP靶点的筛选
在Genecards、DrugBank、OMIM数据库以词“periodontitis,chronic periodontitis”为关键词检索,获得CP靶点,与上述赤芍作用靶点进行韦恩分析,得到赤芍治疗CP的潜在作用靶点[7]。
1.4 构建“赤芍-成分-靶点-CP”网络
利用Cytoscape 3.7.2软件构建“赤芍-成分-靶点-CP”网络图,Network Analyzer计算网络拓扑参数,包括度值(degree)、中心度(betweenness centrality,BC)、接近中心性(closeness centrality,CC)和拓扑系数(topological coefficient,TC)的相关信息[8]。
1.5 构建蛋白相互作用(PPI)网络
STRING 11.0数据库上传所得的交集靶点,设置“homo sapiens”属性,置信度得分>0.4,构建PPI网络图,连接前10的靶基因作为赤芍治疗CP过程的中心基因[9]。
1.6 基因本体(gene ontology,GO)和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析
利用Cluster Profiler软件包对获得的靶点进行GO富集分析及KEGG富集分析绘图,阈值P<0.01,筛选有显著性差异的生物过程和信号通路[10-12]。
2 结 果
2.1 体外抑菌实验结果
赤芍提取物对P.g、F.n、A.a这3种牙周致病菌株均有不同程度的抑菌作用,其中药物对P.g的抑制作用更强。通过比较OD值差值≤0.05的孔,肉眼可见赤芍提取物浓度2 g/L以上的P.g,浓度4 g/L以上的F.n、A.a孔内菌液均呈清亮。测得的MIC、MBC值见表1。
2.2 赤芍化学成分筛选
通过TCMSP数据库筛选出鞣花酸、芍药苷元、催乳素等赤芍化学成分29个,见表2。

表2 赤芍主要化学成分及参数
2.3 赤芍与CP的共同靶点
在Genecards、OMIM、DrugBank数据库检索得到CP相关的疾病靶点4 543个,去除重复后得2 132个。赤芍在TCMSP数据库检索得到赤芍作用靶点240个,去除重复后得175个。韦恩分析二者交集,获得赤芍与CP共有靶点89个(表3),包括环氧化酶2(cyclooxygenase 2,COX2/PTGS2)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)、MMP8等。

表3 赤芍治疗CP的成分作用靶点信息
2.4 “赤芍-成分-靶点-CP”网络
根据获得的交集靶点,对应到赤芍中13个主要化学成分。使用Cytoscape 3.7.2软件构建的“赤芍-成分-靶点-CP”网络图(图1)中共含节点105个,边缘468条。网络拓扑学结构分析显示,化合物的平均度数为4.5,其中度数较大(度数>10)的化合物为黄芩素、黄芩苷、β-谷甾醇、豆甾醇、鞣花酸、二甲氧基-2R,将赤芍中的主要化学成分根据网络拓扑学结构中的度值从大到小依次进行排列(表4)。

图1 赤芍-成分-靶点-CP网络关系

表4 赤芍化学成分的拓扑学参数分析
2.5 PPI网络分析
将89个交集靶点导入STRING数据库,利用Cytoscape 3.7.2软件进行网络拓扑学分析,得到PPI网络(图2A)。根据Count值大小筛选出前30位的靶点(图2B),其中前10位分别为是IL6、AKT1、ALB、TNF、VEGFA、TP53、EGFR、CXCL8、PTGS2、FOS(表5)。
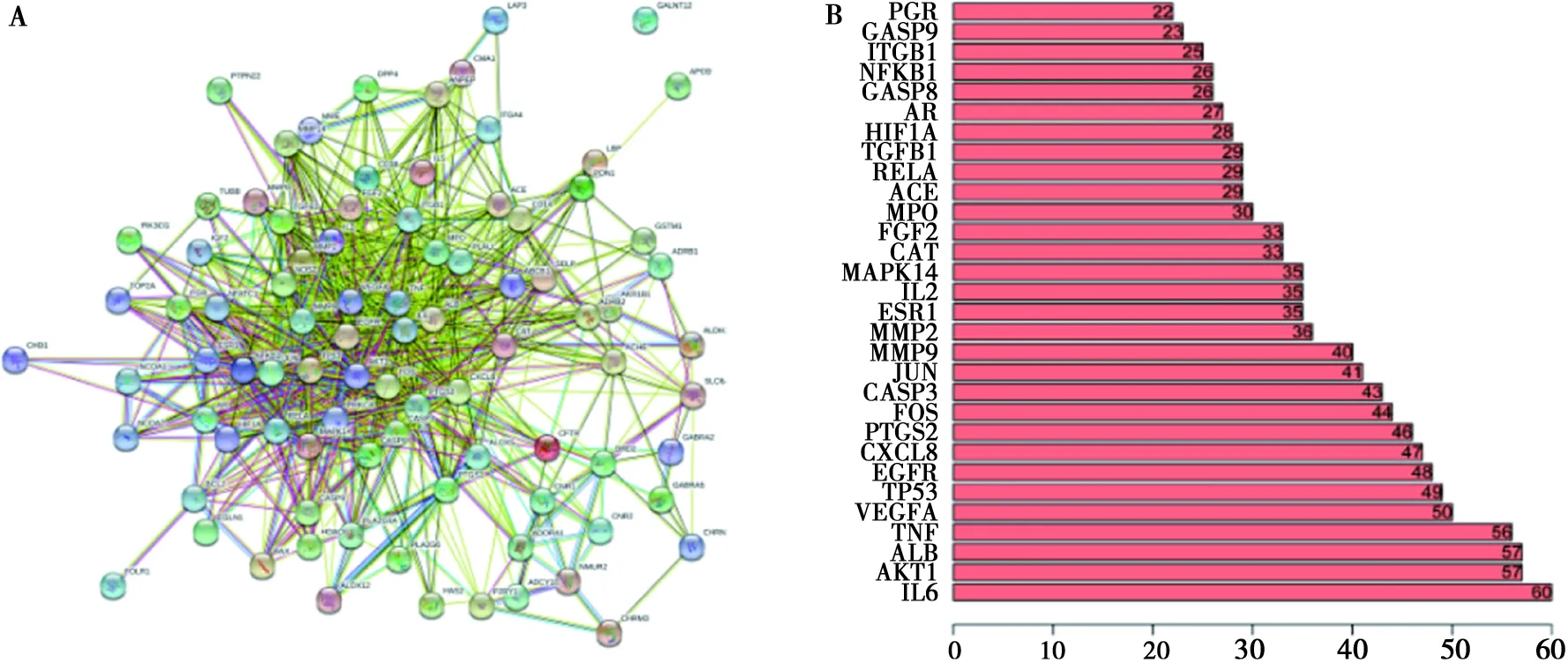
A:PPI网络;B:PPI网络中的基因边缘数排序
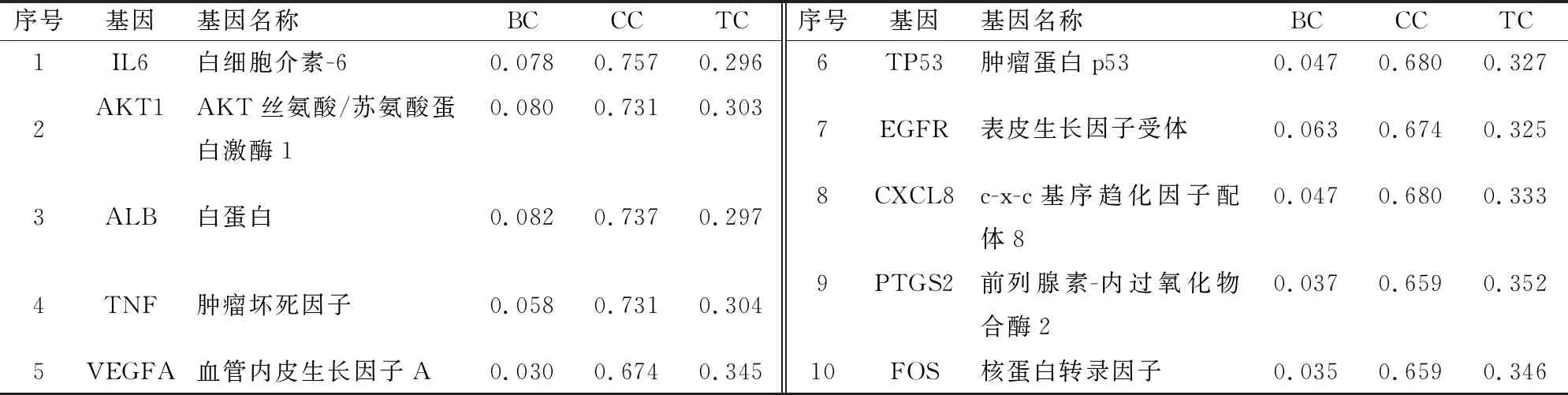
表5 赤芍治疗CP核心蛋白互作的拓扑学参数
2.6 GO富集分析
对上述89个交集靶点进行GO富集分析,设置阈值P<0.01,得到126个条目。分析发现,赤芍可能通过蛋白质异构化活性、内肽酶活性及染色质结合等生物学过程在治疗CP中发挥作用。根据基因比例绘制富集程度较高的GO条目气泡图(图3),排列后得出前10条GO条目信息(表6)。

图3 赤芍治疗CP的潜在靶点的GO富集分析

表6 赤芍治疗CP的潜在靶点GO富集分析结果
2.7 KEGG通路富集分析
利用Cluster Profiler软件包进行KEGG通路富集分析,筛选阈值P<0.01,FDR校正后Q<0.01的条目,共获得110条结果。在前20条通路中,包括6条信号通路(MAPK、AGE-RAGE、IL17、TNF、Toll样受体和松弛素信号通路)、1条生物系统相关通路(内分泌抵抗)和13条疾病通路(乙型肝炎、卡波西肉瘤相关疱疹病毒感染、美国锥虫病、弓形虫病等)(图4),其中,前10条通路信息如表7所示。

图4 赤芍治疗CP的潜在靶点的KEGG富集分析

表7 赤芍治疗CP的潜在靶点KEGG富集分析(前10条)
3 讨 论
赤芍是我国一味传统中药,性味苦,具有清热凉血、活血散瘀之功效。现代药理学证明,赤芍可以镇痛、抗炎、抗氧化,常作为心血管疾病、保肝和神经保护的用药[13]。薛琴等[14]发现赤芍提取物对耐甲氧西林金黄色葡萄球菌、耐碳青霉烯鲍曼不动杆菌和耐甲氧西林凝固酶阴性葡萄球菌等耐药菌均有一定的抑菌作用。本实验发现赤芍提取物对P.g、F.n、A.a这3种牙周主要致病菌的活性均有不同程度的抑制作用,提示我们赤芍可能是治疗CP的潜在药物。
本研究通过网络药理学分析发现赤芍治疗CP作用机制具有多成分、多靶标的特点。赤芍中含有的黄芩苷、β-谷甾醇、鞣花酸等成分参与治疗CP。其中黄芩苷具有清热解毒、抑菌抗炎、螯合金属离子和抗肿瘤等药理作用。李会英等[15]发现应用黄芩苷可以减轻大鼠牙周炎的炎性反应,并且可以降低大鼠牙龈组织中TNF-α mRNA和IL-6 mRNA的水平。β-谷甾醇是一种常见的植物甾醇之一,有抗炎、免疫调节、抗肿瘤、中枢神经系统调节作用。研究发现,β-谷甾醇不仅可以减轻动物模型中血清的IL-1β、IL-6和TNF-α表达水平,而且可下调ERK1/2通路[16]。鞣花酸是一种天然存在的多酚化合物,可以通过降低IL-2、IL-8水平以及诱导人β-防御素2等保护剂的表达来保护人牙龈上皮细胞[17]。由疾病靶点互相作用网络筛选出的IL-6、AKT1、ALB等主要靶点在治疗CP中起重要作用。IL-6不仅可以加速破骨细胞形成,而且还参与CP的炎症过程,抑制牙周膜的再生[18]。蛋白激酶B α(protein kinase B α,PKB α/AKT1)是一种丝氨酸/苏氨酸蛋白激酶,在体外实验中证实用AKT的化学抑制剂可降低AKT表达骨保护素[19]。
本研究对赤芍治疗CP的89个靶点进行了GO富集分析和KEGG信号通路分析。GO富集分析后获得的126项条目主要涉及了蛋白质异构化活性、内肽酶活性、染色质结合等生物学过程,与核因子κB1(nuclear factor kappa-B,NF-κB1/p50)、MMP9等基因相关。研究发现,NF-κB1主要在蛋白质异构化活性和染色质结合过程中发挥作用。NF-κB是以p65/p50亚单位蛋白异构化形成的二聚体蛋白,是参与治疗牙周炎潜在分子机制的核心转录因子[20]。芍药苷是赤芍的组成成分,实验证明芍药苷可以使LPS刺激的细胞中NF-κB表达水平明显降低,减少炎症因子的产生[21]。MMP9是一种蛋白质水解酶,具有螺旋和变性胶原束的能力,可破坏牙周组织[22],使用丝氨酸水解酶抑制剂后,MMP9的表达降低[23]。此外,通过KEGG富集分析获得了110条相关通路,赤芍在治疗CP时与丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、AGE-RAGE、IL-17等通路相关性较高,涉及多条重要信号通路参与,主要在炎症机制调节、血管内皮损伤、细胞分化方面发挥作用。不仅如此,赤芍中的主要活性成分还可能作用于KEGG富集到的因子从而调控多种疾病通路(如乙肝、卡波西肉瘤相关疱疹病毒感染、结核病等)。有学者研究发现激活MAPK通路及IL-17通路可促进下游的炎症因子IL-6、TNF-α分泌,也可促进破骨细胞前体细胞分化[24-25]。RAGE在炎症反应区域内可导致血管功能障碍、促炎激酶的活化,激活AGE-RAGE通路可释放NF-κB,从而刺激多种炎症因子生成,炎症介质的释放为慢性牙周炎的形成提供了可能[26]。
综上所述,本研究表明了赤芍提取物对牙周致病菌有很好的抑制作用,并且间接预测了赤芍治疗CP的活性成分、靶点和通路,不仅为临床开发新药提供思路和依据,也为其有效成分筛选和作用机制的研究提供参考。

