基于可控/“活性”自由基聚合的生物传感分析
胡琼,甘世宇,包宇,韩冬雪,牛利
(广州大学化学化工学院,分析科学技术研究中心,广东广州510006)
蛋白质和核酸等生物分子的简便、快速、低成本、高灵敏和高选择性检测[1]一直是生物传感和生物分析等领域的一个重要研究热点,在环境监测[2]、生化战剂侦检[3]、食品安全[4]、发酵工业[5]、生物医学研究[6]以及临床诊断[7]等领域具有广阔的应用前景。为满足实际样品中低浓度生物分子的检测需求,迄今为止,研究人员已经探索建立了一系列信号放大策略,使得检测灵敏度获得了极大的提高。其中,基于可控/“活性”自由基聚合(controlled/“living”radical polymerization,CLRP)技术的信号放大策略,由于具有操作简便、成本低廉和高效等优良特性,在生物分子的高灵敏检测中具有相当广阔的应用前景。
1 生物传感器的概念及特点
生物传感器(biosensor)是将生物活性材料(如核酸等)、生物衍生材料(如适配体等)或仿生材料(如印记聚合物等)作为固定化分子识别元件与适当的传感微系统[如场效应管(FET)等]或理化换能部件集成的对靶物质敏感并能将其浓度信号转换为热学、压电、电、磁、光学或微观机械等可检测信号的分析工具或平台(图1)。具有检测成本低廉、响应快速、设备简单、灵敏度高、选择性好、操作简便等优良特性,在恶性肿瘤等重大疾病的早期诊断、食品安全和环境监测等领域获得了广泛的应用[8]。
2 传统信号放大策略
在疾病的早期诊断等领域的实际样品中,靶生物分子的含量可能处于极低的水平(临床相关小分子、蛋白质和核酸的质量浓度参考范围见文献[9])。以循环肿瘤DNA(ctDNA)为例,其在人血浆中的含量仅为1810~12639拷贝/mL[10]。为实现生物分子的高灵敏检测,传统策略通常是借助于使用催化反应或标记纳米材料来对检测信号进行放大。
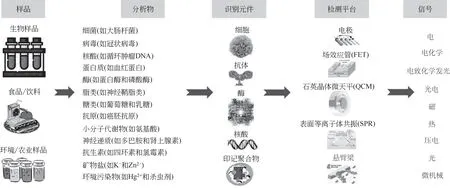
图1 生物传感器的组成与应用
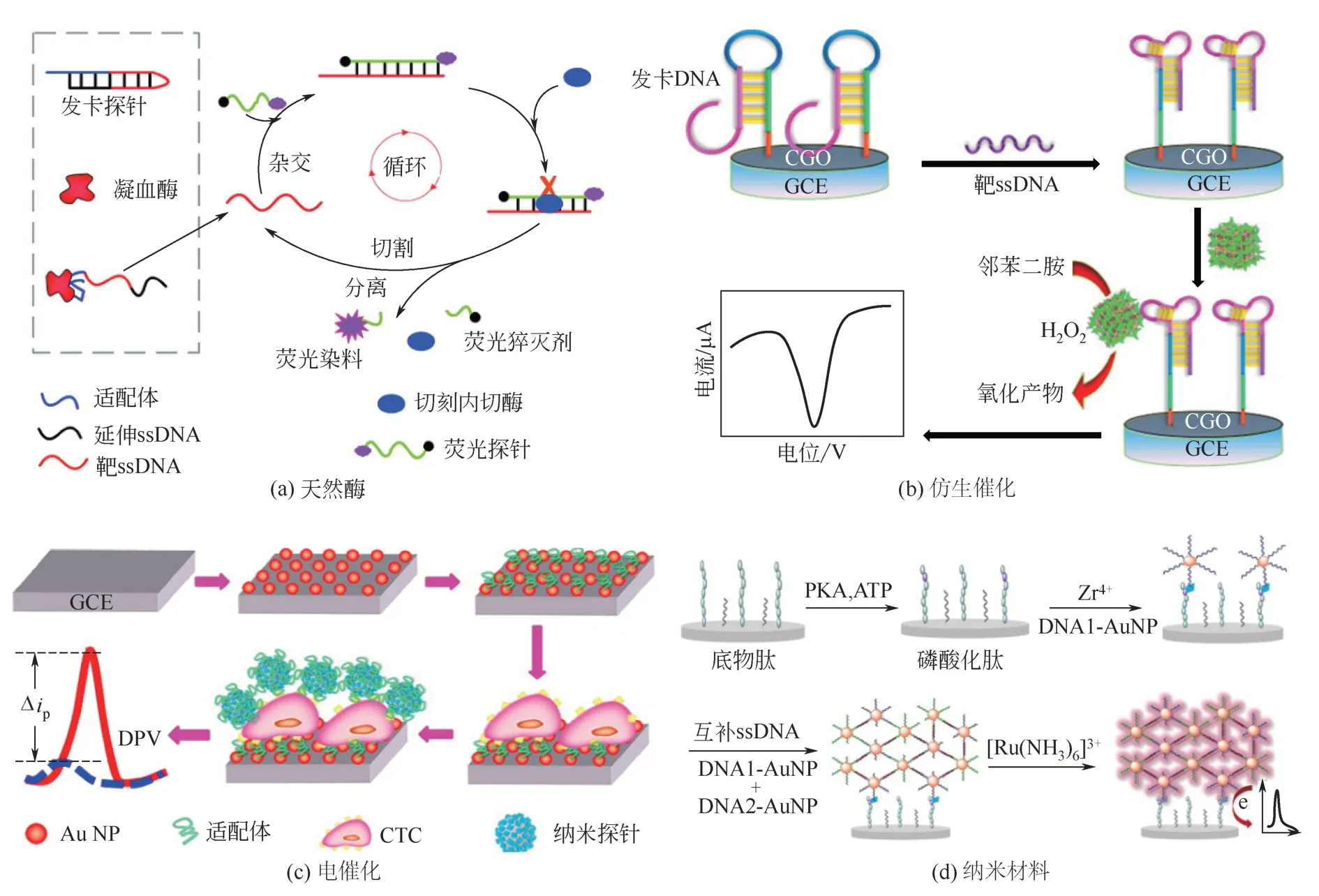
图2 基于天然酶[14]、仿生催化[20]、电催化[21]和纳米材料[24]的信号放大策略
基于催化反应的信号放大策略可分为使用天然酶[如碱性磷酸酶(ALP)[11]、辣根过氧化物酶(HRP)[12]、核酸外切酶Ⅲ(ExoⅢ)[13]、切刻内切酶[14]等]、仿生催化剂[15]以及具有电催化活性的纳米材料[16]三类。其中,天然酶由于具有选择性好、催化效率高以及反应条件温和等优点,在生物分子的高灵敏检测中获得了广泛的应用[17-18]。例如,Xue等[14]借助于切刻内切酶辅助的目标循环引发的荧光信号放大作用,实现了凝血酶浓度的高灵敏荧光分析,检测下限为100pmol/L[图2(a)]。不过,利用天然酶来进行信号放大,存在检测成本高昂、稳定性差(酶易变性失活)以及标记过程复杂等不足。为克服上述缺陷,近年来,金属卟啉等仿生催化剂[19]以及各种具有电催化活性的纳米材料[16]由于具有廉价易得(可化学合成)、化学性质稳定以及标记过程简单等优势,已被大量用作天然酶的替代物来对检测信号进行放大。例如,Ling等[20]报道了一种发卡型电化学生物传感器,对单链DNA(ssDNA)浓度进行高灵敏检测,检测下限为0.48fmol/L[图2(b)]。在该方法中,研究人员首先将发卡ssDNA片段固定在玻碳电极(GCE)表面作为捕获探针,其与靶ssDNA的杂交反应引起发卡环发生构像变化形成链霉亲和素(SA)的适配体,接着将表面修饰有SA的铁卟啉基金属有机框架(FeTCPP@MOF-SA)引入到电极表面,借助于FeTCPP对邻苯二胺的仿生催化作用,使得检测灵敏度获得了显著提高。Zheng等[21]将核酸适配体分子通过金-硫键自组装的方式固定在沉积有金纳米粒子(AuNPs)的GCE表面,待适配体与循环肿瘤细胞(CTCs)发生特异性识别后,进一步将表面修饰有适配体分子的Fe3O4@Ag-Pd杂合纳米粒子引入到电极表面,借助于杂合纳米粒子对硫堇分子的电催化活性,实现了CTCs的高灵敏电化学检测[图2(c)]。不过,与天然酶相比,仿生催化剂和纳米材料尚存在催化效率低、选择性差等缺陷[22]。
基于纳米材料的信号放大策略,主要是通过将纳米材料引入到检测体系中,由于它们具有较大的比表面积,可以负载大量的信号探针,从而有效地提高检测灵敏度[23]。例如,Wang等[24]借助于AuNPs的信号放大作用,实现了蛋白激酶A(PKA)活性的高灵敏电化学检测,检测下限为30mU/mL[图2(d)]。在该方法中,研究人员首先将底物肽通过自组装的方式固定在金电极表面,待PKA将底物肽在特定位点进行磷酸化而引入磷酸基团后,通过Zr(Ⅳ)的配位键合作用将表面修饰有大量ssDNA片段的AuNPs引入到电极表面,并进一步借助于DNA杂交反应在电极表面形成由ssDNA片段功能化的AuNPs所组成的网络结构,使得大量的电活性[Ru(NH3)6]3+探针能通过静电相互作用的方式被富集到电极表面,从而实现对PKA活性的高灵敏检测。基于纳米材料的信号放大策略,尽管能有效地提高生物传感器的检测灵敏度,但是纳米材料的合成及其表面功能化的过程存在操作复杂等不足。
3 基于聚合物的信号放大策略
近年来,为提高生物传感器的检测灵敏度,已有多种基于聚合物的信号放大策略被报道[25-26]。聚合物链一般由成千上万个单体构成,通过使用聚合物,因而可以在传感器表面引入大量的信号探针[如二茂铁(Fc)等]或者大量可用于修饰信号探针的官能团(如氨基、羧基、醛基等),从而实现对检测信号进行放大的目的。基于聚合物的信号放大策略主要包括直接法和间接法两种途径。直接法是指直接使用现成的聚合物来对检测信号进行放大。例如,Gibbs等[25]将作为捕获探针的ssDNA片段通过自组装的方式固定在金电极表面,待其与靶ssDNA杂交后,将一端偶联有多条ssDNA片段另一端修饰有大量Fc探针的共聚合物通过“夹心型”杂交反应的方式标记到电极表面,用于对靶ssDNA浓度进行高灵敏电化学检测,检测下限为0.1nmol/L。Hu等[26]以骨架呈电中性的肽核酸(PNA)分子作为固定化捕获探针,待其与靶ssDNA杂交后,通过Zr(Ⅳ)的配位键合作用将多聚半乳糖醛酸(PGUA)分子修饰到被捕获的ssDNA上,然后用NaIO4将PGUA分子骨架里的邻位羟基氧化成醛基,生成的醛基进一步将Ag+还原成银纳米粒子(AgNPs)并原位沉积在电极表面,通过对沉积的AgNPs进行溶出分析,实现了ssDNA浓度的高灵敏电化学检测,检测下限低至2.5amol/L[图3(a)]。此外,水溶性共轭聚合物由于具有显著的荧光信号放大作用,在生物分子的高灵敏检测中也获得了大量的应用[27-28]。例如,Ho等[27]直接以阳离子聚噻吩作为传感元件,借助于阳离子聚噻吩与ssDNA或双链DNA(dsDNA)片段发生静电结合时会具有不同的构象且聚噻吩/dsDNA复合物与邻近的偶联在ssDNA探针末端上的荧光团之间存在高效、快速的能量转移的现象,实现了核酸的高灵敏检测,检测下限低至3.0zmol/L。直接使用现成的聚合物来对检测信号进行放大,具有操作简便等优势。不过,在非均相检测体系中(如电极等固体基底表面),由于聚合物链从溶液中扩散到特定结合位点并与之结合的过程需要经历构象变化并克服位阻障碍,使得标记过程存在效率低下以及负载量低等问题[29]。
为克服上述缺陷,可以通过原位从头合成聚合物的途径来进行信号放大,即间接法。在聚合过程中,大量单体分子聚集形成长链聚合物,聚合物的侧链可以包含大量的信号探针或者大量可供后续修饰信号探针的官能团,从而显著提高信号探针的负载量,实现对生物分子的高灵敏检测。例如,以脱氧核糖核苷酸(A、T、G、C)为单体,借助于滚环扩增(RCA)[30]或末端脱氧核苷酸转移酶[TdT,如图3(b)所示][31]原位延伸获得较长的ssDNA片段,然后通过静电相互作用等方式引入大量的信号探针(如[Ru(NH3)6]3+等),即可实现对核酸等生物分子的高灵敏检测;不过,延伸反应需要在酶(如phi29 DNA聚合酶或TdT等)的催化下才能进行,导致存在成本高昂等问题。类似地,直接以发卡ssDNA片段作为单体,借助于杂交链反应(HCR)[32]或双核酸催化组装技术(CHA)[33],也可以原位延伸获得较长的dsDNA片段,并进一步通过静电相互作用等方式引入大量的[Ru(NH3)6]3+等探针,从而实现对生物分子的高灵敏检测;然而,以发卡ssDNA片段作为单体,存在成本高昂和杂交反应效率低下等问题。
4 可控/“活性”自由基聚合技术概述
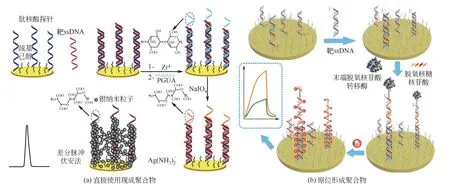
图3 基于直接使用现成聚合物[26]和原位形成聚合物[31]的信号放大策略
自由基聚合(又称游离基聚合,RP)指由自由基引发,使链增长自由基持续增长的聚合反应,包含链引发、链增长、链终止和链转移4种基元反应。在传统RP体系中,由于自由基浓度较高,容易发生自由基-自由基终止反应,导致聚合反应不可控,使得聚合产物存在分子量分布宽以及结构难以控制等缺陷。可控/“活性”自由基聚合(CLRP)是通过在聚合反应体系中加入特定组分,其能与链增长自由基(活性种)进行可逆的链转移或链终止反应,使活性种失活转变成无增长活性的休眠种,该休眠种又可重新分裂成活性种,从而建立活性种与休眠种的快速动态平衡,使得体系中的自由基浓度保持在很低的水平(约10nmol/L),从而抑制自由基-自由基终止反应,达到可控/“活性”的目的[34]。主要的CLRP技术包括稳定自由基聚合(stable free radical polymerization,SFRP)、原子转移自由基聚合(atom transfer radical polymerization,ATRP)以及可逆加成-断裂链转移(reversible addition-fragmentation chain transfer,RAFT)聚合等。
SFRP是通过在聚合体系中加入TEMPO(2,2,6,6-四甲基哌啶-1-氧自由基)或Co(Ⅱ)等稳定自由基来达到可控/“活性”的目的[35]。TEMPO属于稳定的有机自由基,基于TEMPO的SFRP体系具有工艺简单等优点。不过,TEMPO价格昂贵、合成困难;此外,该体系只适用于苯乙烯及其衍生物的聚合,且存在聚合速率低以及需要在高温(110~140℃)下进行等缺陷[36]。·Co(Ⅱ)属于稳定的有机金属自由基,主要用于丙烯酸酯的聚合,合成的聚合物存在分子量低、分子量分布较宽等不足[36]。
ATRP是由卡内基-梅隆大学的Matyjaszewski课题组[37]在1995年首次提出的一种CLRP技术,通过基于内层电子转移(ISET)的协调原子转移机制进行[38]。ATRP以有机卤化物为引发剂,在过渡金属(如CuI/CuII)络合物的作用下实现卤原子(如Br等)在活性种和休眠种之间的可逆转移,以保持自由基浓度在很低的水平,从而使得聚合反应得到有效的控制[37]。根据引发方式的不同,可分为常规ATRP、反向ATRP、电子转移产生活化剂ATRP(AGET ATRP)、电子转移再生活化剂ATRP(ARGET ATRP)、引发剂连续再生活化剂ATRP(ICAR ATRP)、补充活化剂和还原剂ATRP(SARA ATRP)、电化学调控ATRP(eATRP)、光诱导ATRP(photoATRP)等多种类型[39]。由于具有适用单体范围宽[如(甲基)丙烯酸酯、丙烯腈、苯乙烯、(甲基)丙烯酰胺等]、聚合产物分子量分布窄、反应条件温和以及分子设计能力强等优良特性[39],ATRP已经在材料合成[40]和表面功能化[41]等领域获得了大量的应用。不过,由于ATRP反应过程中需要使用过渡金属(如CuI/CuII)络合物作为活化剂和钝化剂,因而存在过渡金属残留等问题。
RAFT聚合是1998年由澳大利亚的CSIRO团队报道了一种CLRP技术[42]。不同于ATRP,RAFT聚合是在反应体系中加入硫代羰基硫化物(如黄原酸盐、二硫代苯甲酸酯、三硫代碳酸酯等)作为链转移剂(CTAs,也叫RAFT试剂),通过加入的CTAs与初级自由基(由引发自由基与单体反应生成)发生链转移生成增殖自由基,随后建立增殖自由基与CTAs之间的可逆加成-断裂平衡,实现控制聚合体系中增长自由基的浓度,达到可控/“活性”的目的[42-44]。CTAs的一般结构为S=C(Z)S-R。其中,R为自由基离去基团,能够重新引发自由基聚合;Z基团则控制着C=S的反应活性,对自由基的加成和断裂反应速率具有很大的影响。RAFT聚合除具有ATRP等CLRP技术的一般特征(如聚合产物的分子量可控等)之外,还具有:①适用单体范围广[除(甲基)丙烯酸酯、(甲基)丙烯酰胺和丙烯腈等单体外,丙烯酸等酸、碱性单体或质子性单体均可聚合];②对于工业生产而言反应条件温和;③可用于溶液、本体、悬浮、乳液等不同聚合体系;④可以借助于活性末端引入特定功能基团,并可合成嵌段、星型等具有精细拓扑结构的聚合物等优良特性[43-44]。尤其重要的是,RAFT聚合不需要使用过渡金属络合物作为活化剂和钝化剂,因而具有较好的生物相容性,而且不会存在过渡金属残留等问题。不过,由于存在自由基-自由基终止等不可逆终止反应,在RAFT聚合过程中需要连续补充引发自由基,其在与单体反应生成初级自由基而引发自由基聚合的同时也会引起链终止反应。此外,硫代羰基硫化物的制备过程比较复杂,其存在可能使聚合物带有一定的气味和颜色。
5 基于CLRP的信号放大策略及生物传感应用
为克服传统信号放大策略所存在的成本高昂和操作复杂等不足,研究人员提出将ATRP和RAFT聚合等CLRP技术作为一类新型信号放大策略,以烯类小分子为单体,通过原位从头合成聚合物,来对生物分子进行高灵敏检测[36,45-47]。
5.1 基于ATRP的高灵敏生物传感
近年来,基于ATRP的信号放大策略,在蛋白质和核酸等生物分子的高灵敏检测中已经获得了一定的应用[36,45]。例如,Lou等[48]以ssDNA片段作为捕获探针,待其与靶ssDNA杂交后,将末端修饰有ATRP引发剂的ssDNA片段通过“夹心型”杂交反应引入到基底表面,以甲基丙烯酸羟乙基酯(HEMA)作为单体,在基底表面原位从头合成聚合物,通过观察基底透光性的改变,对靶ssDNA浓度进行可视化检测,检测下限为1.0nmol/L。类似地,Qian等[49]和Xu等[50]借助于AGET ATRP的信号放大作用,通过观察基底表面原位形成的聚合物斑点,分别实现了对卵清蛋白和免疫球蛋白G(IgG)的高灵敏可视化检测。在没有任何检测设备协助的情况下,含量极低的靶生物分子(如飞摩尔量级别的靶ssDNA[48]或皮摩尔量级别的卵清蛋白[49])仍可被清晰辨别;因此,基于ATRP的可视化检测方法具有操作简便、成本低廉等优良特性,具有很好的实用性。Wu等[51]借助于AGET ATRP的信号放大作用,构建了一种电致化学发光(ECL)免疫传感器,实现了对癌胚抗原(CEA)浓度的高灵敏检测,检测下限低至0.5pg/mL。Hu等以PNA作为捕获探针,以甲基丙烯酸二茂铁基甲酯(FcMMA)作为单体,借助于eATRP的信号放大作用,对ssDNA[52]和dsDNA浓度[53]进行高灵敏电化学检测,检测下限分别为0.072fmol/L和0.47fmol/L。此外,Hu等[54]将底物肽通过自组装的方式固定在金电极表面,待PKA将底物肽在特定位点进行磷酸化而引入磷酸基团后,通过Zr(Ⅳ)的配位键合作用将溴苯乙酸(BPAA)连接到电极表面作为引发剂,以FcMMA作为单体在电极表面进行eATRP反应,原位从头生成大量的含Fc的电活性聚合物,实现了PKA活性的高灵敏电化学检测,检测下限为1.63mU/mL。最近,Hu等[55]进一步借助于基于eATRP的信号放大策略,实现了胰蛋白酶活性的高灵敏电化学检测[图4(a)],检测下限为0.016mU/mL(约2.68pmol/L或0.064ng/mL)。基于ATRP的信号放大策略,凭借其所具备的操作简便、成本低廉和高效等优良特性,在蛋白质和核酸等生物分子的高灵敏检测中具有广阔的应用前景。不过,在进行ATRP的过程中,需要使用到Cu(Ⅰ)/L和Cu(Ⅱ)/L(L为配体)分别作为活化剂和钝化剂,具有一定的生物毒性,限制了其在生物医学等领域中的应用潜能,而且残留的过渡金属可能会对后续的电化学检测存在干扰[56-57]。
5.2 基于RAFT聚合的高灵敏生物传感
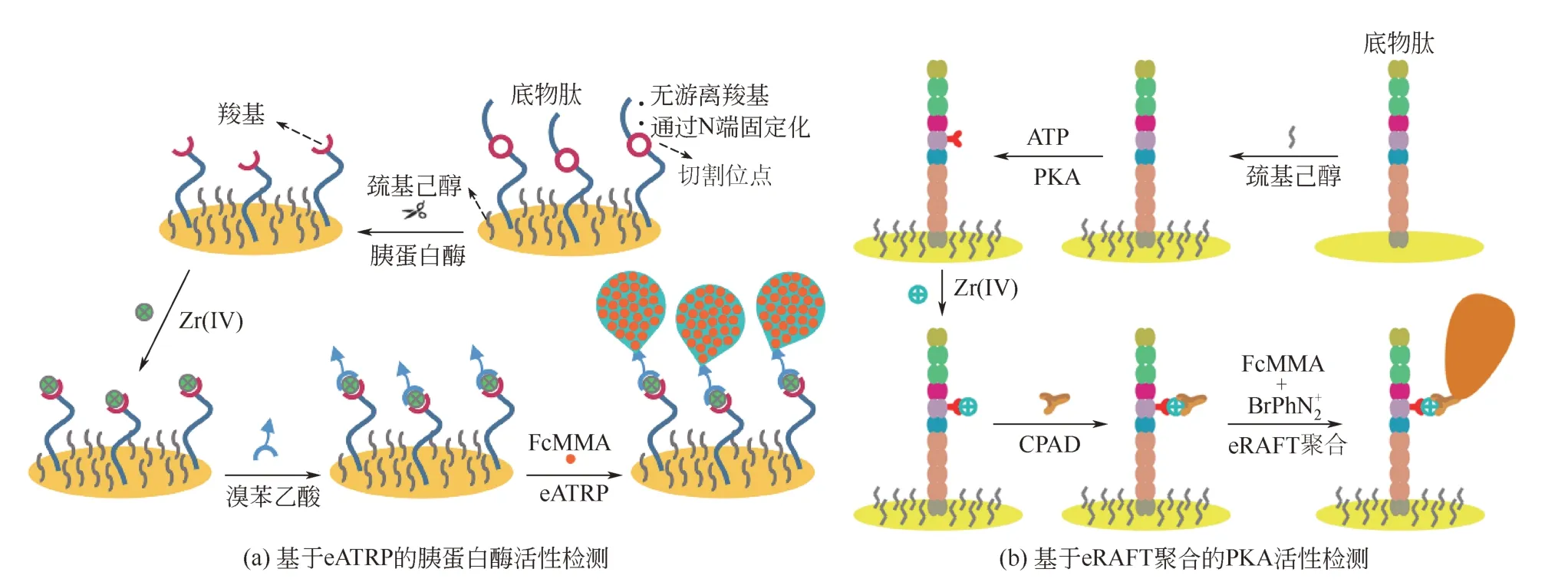
图4 基于eATRP的胰蛋白酶活性检测和基于eRAFT聚合的PKA活性检测[55,62]
RAFT聚合由于不需要使用过渡金属络合物作为活化剂和钝化剂,因而具有较好的生物相容性,而且不会存在过渡金属残留等问题。为克服基于ATRP的信号放大策略所存在的过渡金属残留等缺陷,He等[56]将RAFT聚合用作一种信号放大策略,借助于RAFT聚合在基底表面从头合成聚合物,对ssDNA浓度进行可视化检测,检测下限为1.0fmol/L。在没有使用任何检测设备的情况下,含量为2000拷贝的靶ssDNA仍可被清晰地检测到。类似地,He等[46]借助于RAFT聚合的信号放大作用,通过观察基底表面原位形成的聚合物斑点,对人X和Y染色体DNA进行可视化检测,其检测结果与基于聚合酶链式反应(PCR)的检测方法相当。Hu等借助于RAFT聚合的信号放大作用,实现了ssDNA浓度[57]、PKA活性[58]以及凝血酶活性[59]的高灵敏电化学检测,检测下限分别为3.2amol/L、1.05mU/mL和2.7μU/mL。基于RAFT聚合的信号放大策略,同样具有操作简便、成本低廉和高效等优良特性。不过,由于存在自由基-自由基终止等不可逆终止反应,在RAFT聚合过程中需要连续补充引发自由基。通常情况下,引发自由基可以通过热分解(>50℃)偶氮二异丁腈(AIBN)等自由基引发剂产生。然而,如此高的热引发温度,可能会引起生物分子变性失活。此外,以一种常用的水溶性链转移剂4-氰基-4-(硫代苯甲酰)戊酸(CPAD)为例,经过24h,其在50℃下可被分解约36%,在60℃下可被分解约84%,在70℃下可被分解高达约90%[60]。因此,在相对温和的条件下进行RAFT聚合,对生物传感等领域来说十分必要。为此,Hu等建立了一种基于电化学调控RAFT(eRAFT)聚合的信号放大策略,实现了对ssDNA浓度[61]和PKA活性[图4(b)][62]的高灵敏电化学检测,检测下限分别为4.1×10-18mol/L和1.02mU/mL。在eRAFT聚合中,引发自由基是在常温下通过电化学还原芳基重氮盐等化合物产生[63]。与传统热引发等方式相比,利用电化学手段引发和调控RAFT聚合,具有反应条件温和、生物相容性好等优良特性。而且,仅通过调节电位或电流等参数,就可以实现对聚合反应过程进行精确的调控。凭借其所具有的操作简便、成本低廉、高效和反应条件温和等优良特性,基于eRAFT聚合的信号放大策略在生物分子的高灵敏检测等方面必将具有广阔的应用前景。
6 结语
蛋白质和核酸等生物分子的简便、快速、低成本、高灵敏和高选择性检测,一直是生物传感等领域的一个重要的研究热点,在恶性肿瘤等重大疾病的早期诊断等诸多领域具有广阔的应用前景。为克服传统信号放大策略所存在的成本高昂和操作复杂等不足,近年来,研究人员探索建立了一类基于ATRP和RAFT聚合等CLRP技术的新型信号放大策略,通过在基底表面原位生成大量的聚合物,实现了对蛋白质和核酸等生物分子的高灵敏检测。基于CLRP的信号放大策略,具有操作简便、成本低廉和高效等优良特性,在生物分子的高灵敏检测中具有相当广阔的应用前景。
然而,围绕基于CLRP的信号放大策略的研究工作尚处于初步阶段,在聚合物固-液界面生长动力学与调控、聚合物表面接枝量对界面电荷转移动力学的影响规律以及分子识别元件组装密度等因素对聚合反应动力学的影响规律等方面的研究还有待进一步深入,以期为基于CLRP的信号放大策略的广泛应用提供坚实的理论支撑与技术保障。

