固定化生物吸附剂对Cd(Ⅱ)的去除性能及机理
余关龙,彭海渊,王世涛,汪国梁,陈宏,杜春艳,刘媛媛,孙士权,禹丽娥,王建武
(1长沙理工大学水利工程学院,湖南长沙410114;2湖南省环境保护河湖污染控制工程技术中心,湖南长沙410114;3洞庭湖水环境治理与生态修复湖南省重点实验室,湖南长沙410114)
水环境中重金属污染是当前主要的环境问题之一[1]。在许多工矿企业和电池、电镀、半导体行业排放的废水中存在大量重金属镉(Cd)[2]。镉对于生物的代谢和生长是非必要的,并且在各种重金属污染中Cd(Ⅱ)因具有强烈的生物毒性和高转移风险而被认定为最危险的污染物之一[3]。而且Cd(Ⅱ)可以通过动植物富集转移进入食物链,导致人体癌症和严重的健康危害[4]。因此对水环境中Cd(Ⅱ)的修复研究具有重要意义。
目前,传统的Cd(Ⅱ)污染处理方法主要有化学沉淀法、离子交换法、电化学法和膜过滤法等,但在实际应用中存在处理成本高、易造成二次污染和产生大量有毒污泥的局限性。因此工艺简单且成本低廉的Cd(Ⅱ)污染修复方法越来越受到重视[5-6]。近年来,采用微生物法修复重金属污染受到广泛关注,因其修复过程环境友好且经济高效,特别是使用高耐受性微生物能够实现重金属的原位修复而受到研究者的青睐[7]。微生物对重金属Cd(Ⅱ)的去除主要通过细胞外富集和沉淀(细胞产物)、细胞表面的吸附和交换(通过官能团或原始金属离子)或通过代谢作用完成细胞内转化[3,8]等途径实现。通常高耐受性微生物用于环境中重金属离子的修复具有明显优势,但采用外源微生物进行修复时可能会导致位点的污染,因此筛选具有高去除效率的耐受性原位微生物对水环境中Cd(Ⅱ)的修复意义重大。
尽管微生物法处理重金属废水已经得到了广泛应用,但是仍然存在重金属废水处理后难于固液分离、微生物易流失和易受重金属离子的毒害抑制作用而影响对重金属离子的吸附效果[9-10]。为了克服这些缺点,许多研究者通过将单一的细菌、酵母或真菌进行固定化,制成生物吸附剂后处理重金属废水[11-12]。文晓凤等[13]通过将内生菌Bacillus nealsonii固定化制成生物吸附剂,在最佳吸附处理条件下对Cd2+吸附率可达96%以上,并发现小球孔隙率大,利于Cd2+的吸附。Zhang等[14]利用聚乙烯醇(PVA)和海藻酸钠(SA)作为包埋材料,制备了新型固定化硫酸盐还原菌小球,处理含高浓度的Fe3+、Cu2+、Cd2+和Zn2+的合成酸性矿山废水时,对硫酸盐和重金属的去除率分别达到61%~88%和99.9%。杨培等[5]通过SA凝胶包埋Chryseobacterium rhizosphaeraeSH-1而制成的生物吸附剂对Zn2+的去除率高达93.2%。众多研究结果表明微生物可以通过游离和固定的形式从废水中去除重金属,而且微生物固定化可以提高生物吸附剂的机械强度以及微生物对重金属的耐受性[15-17]。显然,固定化生物吸附剂的吸附能力受到溶液中pH、重金属离子种类及初始浓度、吸附剂投加量和吸附时间等影响,而很难得出一般性的通用结论,因此需对这些影响因素展开深入研究。此外,不同的微生物固定化方法对重金属离子的去除机理也有很大的影响。
综上所述,目前采用包埋具有耐性的混合菌群制备固定化生物吸附剂吸附Cd(Ⅱ)的研究还较少。因此,本文将受重金属污染原位微生物提取进行重金属浓度梯度筛选,使用聚合酶链式反应(PCR)技术对采用重金属浓度梯度筛选后的微生物进行生物鉴定并分析微生物的组成成分。然后将筛选后的微生物进行包埋固定化,制成固定化生物吸附剂,考察了溶液初始pH、Cd(Ⅱ)初始浓度、生物吸附剂投加量和吸附时间等因素对Cd(Ⅱ)吸附效果的影响,并通过吸附平衡研究、比表面积测试法(BET)和傅里叶变换衰减全反射红外光谱法(FTIR-ATR)分别分析了其吸附类型和吸附容量、材料的孔隙结构和吸附剂吸附Cd(Ⅱ)前后官能团的变化等揭示其吸附机理。最后进行了吸附解析和竞争吸附实验来验证其实用性能,以期能为包埋固定化耐性混合微生物吸附剂对水环境中重金属的修复提供理论基础。
1 材料与方法
1.1 主要试剂与仪器
胰蛋白胨、酵母浸粉、氯化钠、硫酸镉、硫酸锌等,均为分析纯。
立式压力蒸汽灭菌锅(DY04-13-44-00)、离心机(TG16-1)、金埃普(V-Sorb 2800)、赛默飞(IS5)、恒温震荡器(TS-2120)、超净工作台(VD-650)、紫外分光光度计(UV-2600)、原子吸收分光光度计(AAalyst700)、冷冻干燥机(BTP-3ESEOX)。
1.2 微生物来源与筛选
本文中微生物来自于处理重金属Cd(Ⅱ)的水平潜流人工湿地基质层中,微生物取样深度为填料层(碎石)下15~20cm。将培养液(luria-bertani,LB)置于立式压力蒸汽灭菌锅中于121℃灭菌20min,在超净工作台中(后续实验均在无菌环境进行),将2~3g基质样品加至含100mL LB培养液的锥形瓶中。在28℃、150r/min的恒温震荡器中培养48h,然后取1mL菌液在LB培养液中接种培养,按此步骤重复3次培养后,再取1mL菌液依次加入含Cd(Ⅱ)浓度为20mg/L、40mg/L、60mg/L、80mg/L、100mg/L、120mg/L、140mg/L、160mg/L、180mg/L和200mg/L的LB培养液中进行重金属浓度梯度的培养以筛选微生物。在各浓度梯度中培养48h后,取1mL菌液接种至下一浓度,并取培养液样品过0.22μm滤膜检测水样中的重金属浓度。每隔24h以空白培养液为对照,用紫外分光光度计检测不同Cd(Ⅱ)浓度下培养液在600nm波长处的吸光值(OD600)。当菌液经Cd(Ⅱ)浓度为200mg/L的培养基培养48h后,取1mL接种至Cd(Ⅱ)浓度为50mg/L的LB培养液中。每隔48h接种1次,此时培养的微生物为筛选后的对Cd(Ⅱ)耐受性高的微生物,并将此培养液称为种液。
1.3 固定化生物吸附剂的制备
1.3.1 菌悬液制备
取1mL种液至LB培养液,在28℃、150r/min下的恒温震荡器中培养24h。将培养液倒入干净离心管中,在4°C、4500r/min条件下的离心机中离心15min,倾倒上清液,用无菌生理盐水洗涤2~3次,保存至4°C的冰箱备用(可保存5天)。
1.3.2 生物吸附剂的制备
称取聚乙烯醇(PVA)6%(质量体积分数)和海藻酸钠(SA)2%(质量体积分数)溶解在100mL去离子水中形成包埋剂。搅拌均匀使PVA和SA不粘在瓶壁,浸泡5~10min;称取CaCl20.5%(质量体积分数)溶解于饱和H3BO3溶液中形成交联剂。将以上溶液置于立式压力蒸汽灭菌锅中于121℃灭菌20min,取出后冷却至室温。向包埋剂中加入菌悬液,使菌悬液浓度为5%(质量体积分数)并搅拌均匀制成混合液。将混合液加至10mL注射器使其自然缓慢滴入交联剂中,边滴边摇动瓶身形成类球型的固定化微生物小球(即固定化生物吸附剂)。在4℃的冰箱中交联反应12h,再取出用无菌生理盐水润洗2~3次,放入4℃冰箱备用。
1.4 Cd(Ⅱ)吸附实验设计
1.4.1 吸附影响因素实验
通过改变pH、Cd(Ⅱ)初始浓度、固定化生物吸附剂用量和吸附时间来探究生物吸附剂吸附Cd(Ⅱ)的影响。采用单因素实验,均在150r/min、28℃恒温震荡器中进行,每隔一定时间取样过0.22μm滤膜,用原子吸收分光光度计分析溶液中重金属离子浓度,每个样品设定3个平行样,测量结果取平均值。其中pH变化范围2~6,使用0.1mol/L的H2SO4和NaOH溶液调节pH;Cd(Ⅱ)初始浓度变化范围40~200mg/L;固定化生物吸附剂投加量变化范围10~60g/L(湿重);吸附时间为12~60h。
1.4.2 吸附动力学实验
探究固定化生物吸附剂吸附动力学模型,Cd(Ⅱ)初始浓度为50mg/L、100mg/L和150mg/L,固定化生物吸附剂投加量为50g/L,pH为4.5,在28℃、150r/min的恒温震荡器中进行,检测0~480min不同时间段的重金属浓度。由于在吸附前期微生物存在复苏阶段,因此先将材料在28℃、150r/min摇床中运行36h,再加入重金属离子和调节pH进行准一级动力学和准二级动力学研究。
1.4.3 吸附等温实验
探究Freundlich模型和Langmuir模型,在28℃、150r/min的恒温震荡器中进行,其中固定化生物吸附剂投加量为50g/L,溶液pH为4.5,吸附时间48h,对20~200mg/L浓度范围的Cd(Ⅱ)进行吸附实验,检测在每个浓度下吸附达到平衡时的Cd(Ⅱ)浓度和计算出相应的吸附容量。根据实验数据,与两种吸附等温线模型进行拟合,以拟合的相关性高低来判断吸附类型。
1.5 固定化生物吸附剂的结构表征
1.5.1 BET
对固定化生物吸附剂吸附Cd(Ⅱ)前后的样品先进行12h冷冻干燥处理,再用金埃普(V-Sorb 2800)进行BET测试,通过检测得出吸附脱附曲线和孔径分布曲线,分析吸附前后的比表面积、孔体积、孔隙率变化情况。
1.5.2 FTIR-ATR
对固定化生物吸附剂吸附Cd(Ⅱ)前后的样品进行表面官能团的表征,将样品进行12h冷冻干燥处理,再将样品置于两片干净称量纸中压成薄片,取少量样品置于金刚石ATR模块中,波数范围4000~400cm-1,扫描次数32,分辨率4cm-1,用赛默飞(IS5)进行红外光谱仪测试。
1.6 微生物分析
1.6.1 亚细胞结构分级
通过对文献[8,18]中提供的方法改进后获得本研究中亚细胞结构的分析方法。具体实验过程分为两步:第一步样品的制备,取1mL种液分别接种至含100mg/L Cd(Ⅱ)的LB培养液和空白LB培养液中,在28℃、150r/min的恒温震荡器培养48h,取样分析,将样品在4℃、6000g离心力下离心10min,并用pH为7的磷酸缓冲溶液清洗两次去除培养液,将离心后的上清液和微生物分别保存在4℃冰箱备用,第二步亚细胞分级,将上述样品用含有0.1mol/L乙二胺四乙酸(EDTA)、pH 8.0的1mL 0.03mol/L Tris缓冲溶液在12000g离心力下洗涤3次,每次2min,将上清液收集在干净离心管中4℃冰箱保存,并将此溶液称为细胞外膜溶液。将沉淀物重新悬浮在上述Tris缓冲液中,制备原生质体,加入溶菌酶,使溶菌酶浓度为600μg/mL,并在25℃下将细胞培养30min,将原生质体在2576g、4℃下离心15min收集,所获得的上清液是由肽聚糖层组成的周质液体,放入干净离心管4℃冰箱保存。将沉积物重新悬浮在包含0.1mol/L EDTA、pH为8.1的0.03mol/L Tris缓冲液中,然后用超声波破碎机对原生质体进行2次破碎,每次30s,然后在12000g离心力下离心2min,上清液为细胞质溶液,沉积物为细胞内膜,收集于干净离心管中置于4℃冰箱保存。取一定量以上样品于聚四氟乙烯烧杯中,加入5mL浓硝酸,在150℃下高温消解,再通过原子吸收分光光度计检测重金属离子。
1.6.2 微生物鉴定
采用PCR技术对筛选后的微生物进行鉴定,测序结果分析使用上海美吉生物医药科技有限公司的网络云平台,其具体PCR扩增引物设计如表1所示。
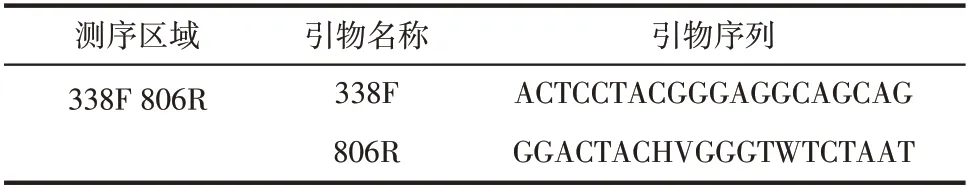
表1 PCR扩增引物设计
1.7 固定化吸附剂实用性能验证实验
1.7.1 吸附解析实验
吸附实验条件:Cd(Ⅱ)初始浓度100mg/L,溶液pH为4.5,固定化生物吸附剂投加量为50g/L,在150r/min、28℃的恒温震荡器中运行48h。
解吸实验条件:收集吸附重金属离子后的固定化吸附剂,加入50mL硝酸溶液(0.1mol/L),在150r/min、28℃恒温震荡器中解吸40min。
1.7.2 常见离子竞争吸附实验
在借助信息技术开展小学语文教学的过程中,教师的教学观念起着决定性的作用。因此,在实际的教学过程中,教师首先要对自身的教学观念进行优化,重视信息教学,以提升学生的综合素养;其次,教师还需要提升自身运用信息技术的能力,能够合理地运用该种技术开展教学,以促进学生的综合发展。
水环境中常见离子Na+、K+、Ca2+对Cd(Ⅱ)的竞争吸附通过在含有Cd(Ⅱ)浓度为100mg/L的溶液中分别加入阳离子Na+、K+、Ca2+,使其浓度为50mg/L、100mg/L、150mg/L,其中阴离子类型均为氯离子,在pH为4.5,固定化生物吸附剂投加量为50g/L,在150r/min、28℃恒温震荡器中运行48h后取样分析。
2 结果与讨论
2.1 耐受性微生物的筛选
从图1(a)中可以看出,随着Cd(Ⅱ)浓度的逐渐提高,OD600值不断降低,说明微生物的生长受到Cd(Ⅱ)的抑制与毒害作用,其中部分不能耐受Cd(Ⅱ)的微生物被淘汰。而在整个筛选过程,48h的OD600值均大于24h的值,且在Cd(Ⅱ)浓度小于60mg/L的情况下相差较大,表明耐性微生物的筛选在24h内已经完成,微生物逐渐适应培养基的环境并利用营养物质进行繁殖。OD600值在Cd(Ⅱ)浓度为100mg/L、120mg/L、140mg/L和160mg/L的情况下趋于平稳,下降趋势渐缓。这是因为培养液中的微生物种类逐渐稳定,不能耐受Cd(Ⅱ)胁迫的微生物得到了筛除。在Cd(Ⅱ)浓度为200mg/L的情况下,经过24h的培养,OD600值在0.7~0.8,说明微生物生长状况良好,但从OD600值的趋势可以看出在200mg/L时Cd(Ⅱ)对微生物的抑制与毒害作用最为明显。
在图1(b)中,随着Cd(Ⅱ)浓度的提高,Cd(Ⅱ)的去除率也在不断提高,当Cd(Ⅱ)浓度为120mg/L时Cd(Ⅱ)的去除率最大68.3%。随着Cd(Ⅱ)浓度继续提高,去除率呈下降趋势,而从图1(a)中可以看出,OD600值呈显著下降趋势,此时的微生物受到Cd(Ⅱ)的抑制与毒害作用不断增大,影响正常的繁殖与代谢功能。重金属浓度区间在60~180mg/L时,生物吸附剂对重金属的去除率趋于平缓,结合图1(a),此时的微生物菌群对Cd(Ⅱ)的去除更加稳定可靠。

图1 微生物重金属浓度梯度筛选
图2为经Cd(II)浓度梯度筛选后种液中微生物的种水平分布图。从图中可以看出,种液中菌种的丰 度 大 小 顺 序 为Lactococcus<Stenotrophomonas<Serratia<Pseudomonas,其中其他组是丰富度占比小于0.01的微生物合并组成。通过文献分析发现Lactococcus[19-20]、Stenotrophomonas[21]、Serratia[22-24]、Pseudomonas[25-26]均对Cd(Ⅱ)具有较高的耐受性和吸附能力。
2.2 吸附影响因素实验
2.2.1 pH对吸附效果的影响
由图3可知,溶液pH对固定化生物吸附剂吸附Cd(Ⅱ)的影响较大。当溶液pH从2增加到4时,去除率逐渐增加。而对大多数生物吸附剂而言,极高和极低的pH都不利于生物吸附剂吸附重金属离子[27]。溶液pH为2时效果最差,此时Cd(Ⅱ)的去除率仅为34.67%。这是因为溶液中存在大量的H+,这些H+能与生物吸附剂表面的阳离子吸附位点相结合,使得生物吸附剂与重金属离子的结合位点相对减少;且极低的pH环境对微生物的活性有较大影响,导致菌群对Cd(Ⅱ)的吸附效果较差,但这一结果并不适用所有固定化生物吸附剂。Zhang等[14]发现在pH为2.7的条件下,固定化硫酸盐还原菌对高重金属浓度的合成酸性矿山废水中Fe3+、Cu2+、Cd2+和Zn2+去除达到99.9%。当溶液pH从4增加到5时,处理效果最佳,Cd(Ⅱ)的去除率达到了91%±2%。随着pH的升高去除率升高的原因可能是固定化生物吸附剂上的官能团产生了去质子化现象,从而形成了带负电荷的重金属吸附点位,使得更多的Cd(Ⅱ)被吸附去除。而相同条件下,未固定化微生物对Cd(Ⅱ)的去除率仅为50%±5%。当溶液pH增加到6时,去除效果呈下降趋势,另外在调节pH时溶液中出现一些氧化物或氢氧化物不溶物。显然,去除效果随pH的升高出现下降与溶液中生成的金属氧化物或氢氧化物不溶物有关,这些不溶物可能造成了固定化生物吸附剂表面空隙堵塞,影响了材料的传质性能。这些结论与其他研究者[13,15,28]的研究结果相一致。以上结果表明pH在4~5时固定化生物吸附剂对Cd(Ⅱ)的吸附效果最佳,后续实验选择在pH为4.5下进行。
2.2.2 初始浓度对吸附效果的影响
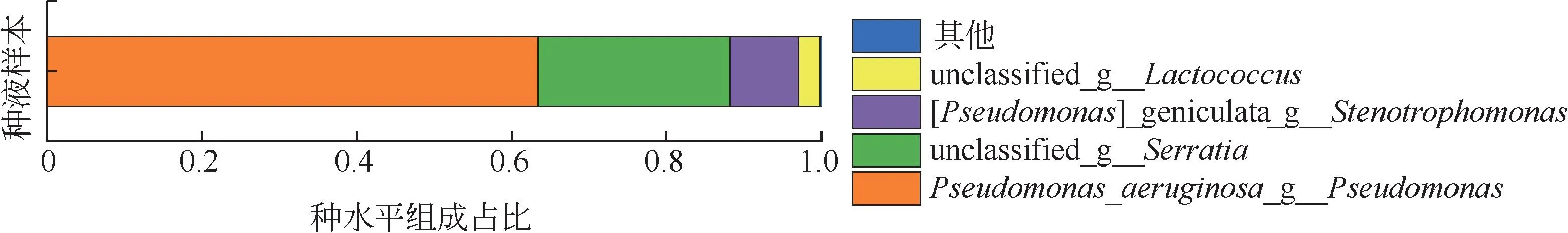
图2 种液中微生物种水平分布
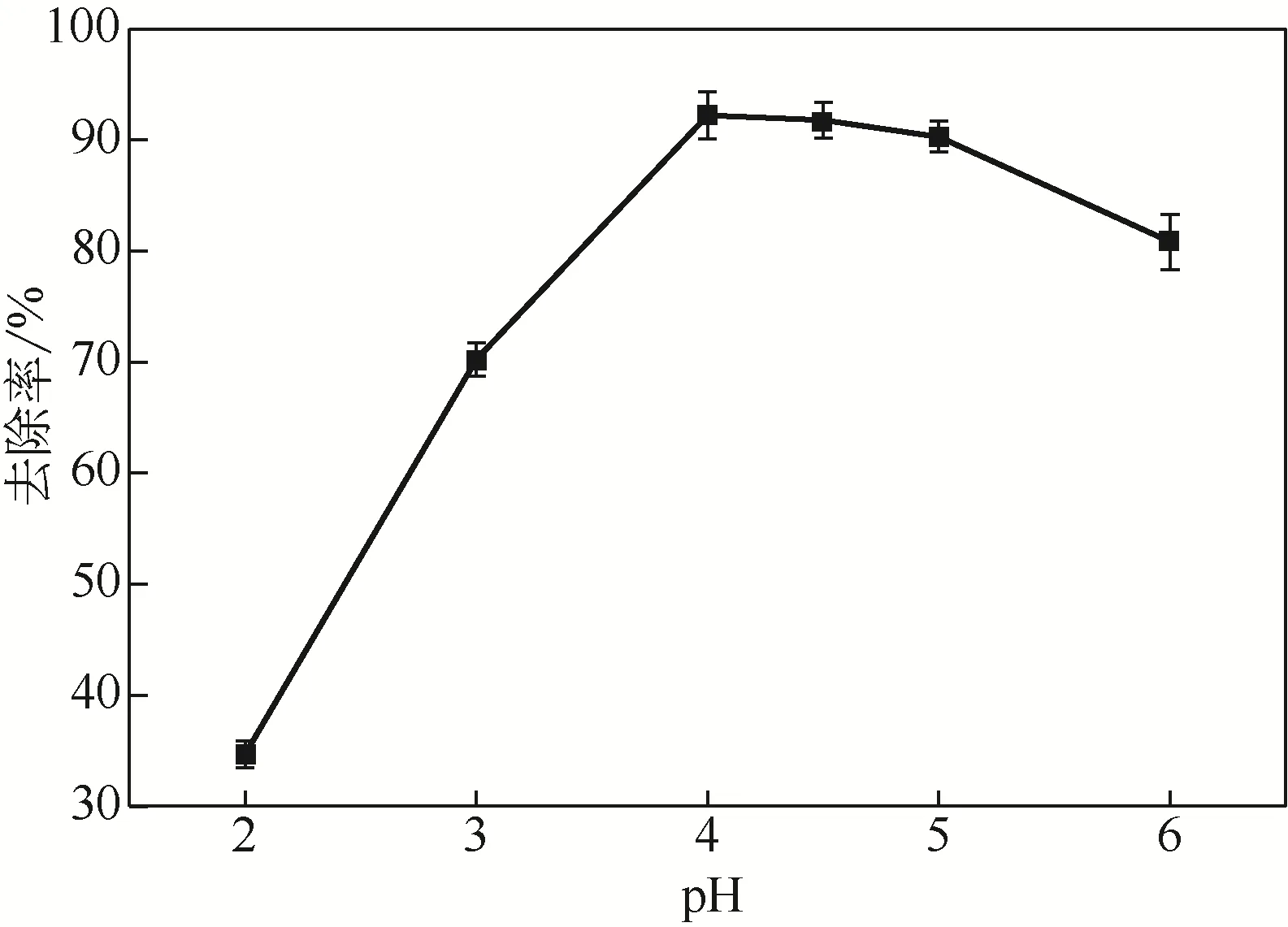
图3 pH对吸附效果的影响
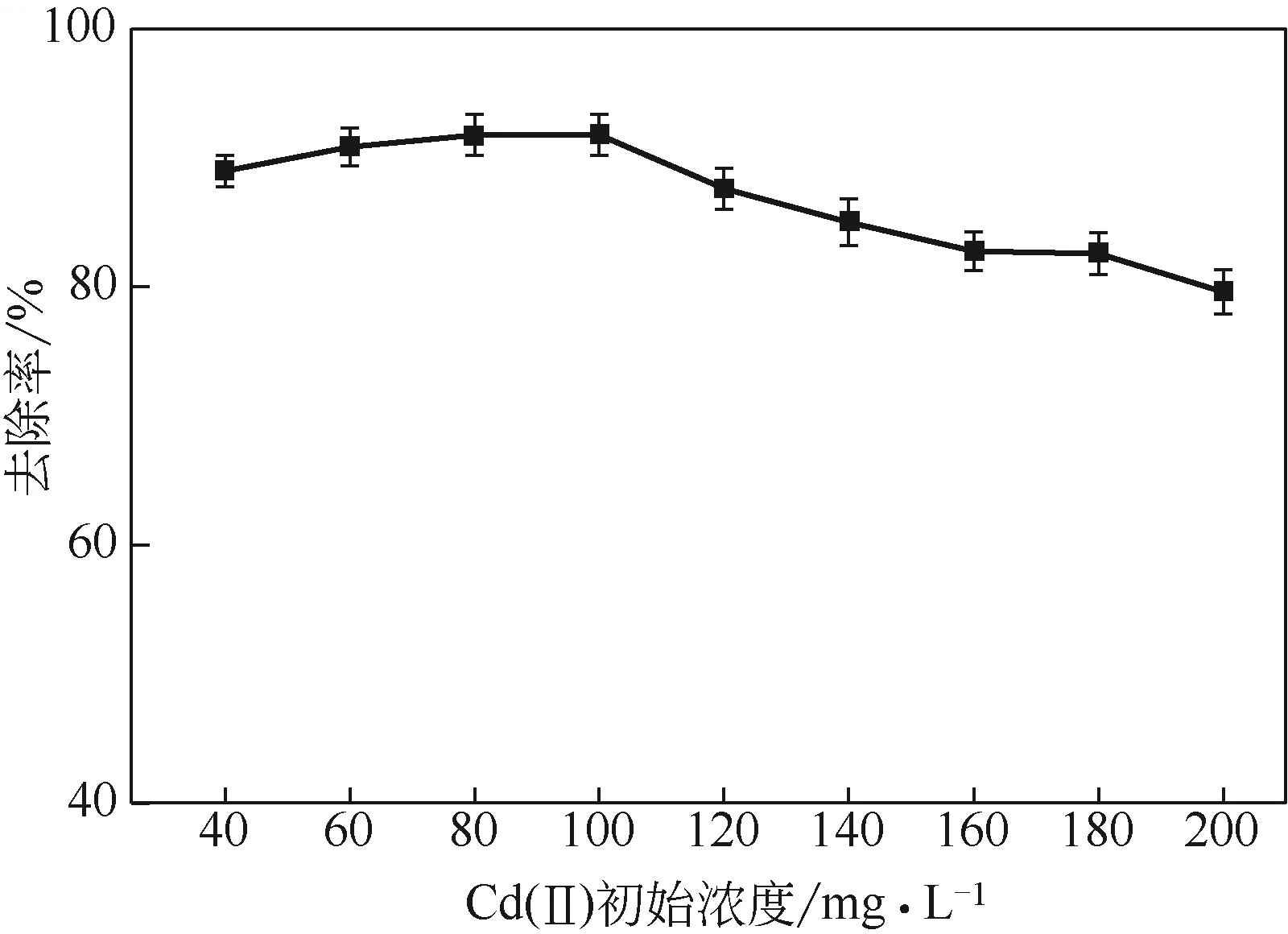
图4 Cd(Ⅱ)初始浓度对吸附效果的影响
如图4所示,当Cd(Ⅱ)初始浓度在40~100mg/L范围时,去除率缓慢提高。随着浓度的增加,重金属离子的扩散速率增加,提高了固定化生物吸附剂上有效吸附点位的利用效率。而Cd(Ⅱ)初始浓度在100~200mg/L时,Cd(Ⅱ)去除率随着初始浓度的提高而呈下降趋势,这可能归因于随着Cd(Ⅱ)浓度的不断提高,固定化生物吸附剂上能与Cd(Ⅱ)相结合的有效吸附点位被充分利用,因此Cd(Ⅱ)浓度的扩散速率提高导致吸附剂上没有足够的有效吸附点位与重金属离子结合。这一结论与文献[12-13]得出的Cd(Ⅱ)初始浓度对生物吸附剂吸附效果影响的结论相吻合。但随着初始浓度的提高,生物吸附剂对Cd(Ⅱ)的吸附量提高了。Huang等[29]也指出随着Cd(Ⅱ)浓度的提高,生物吸附剂对Cd(Ⅱ)的吸附量增加,而去除率降低。另一方面,不断提高的Cd(Ⅱ)浓度对于固定化生物吸附剂中微生物的生物毒性不断增大,微生物的生长与代谢受到影响,从而影响了去除效果,这与文献[8,30-31]的结论一致。Zhou等[32]研究指出,使用游离微生物吸附剂在Cd(Ⅱ)浓度为50mg/L时的吸附效果最佳,但随着浓度增加到100mg/L时,去除率急剧下降,其研究结果表明在高Cd(Ⅱ)浓度下微生物的正常代谢功能受到了抑制,体现了本文使用固定化生物吸附剂提高微生物特别是混合菌群对重金属耐受性方面的优点。为避免高浓度重金属的抑制影响,后续影响因素实验均在Cd(Ⅱ)初始浓度100mg/L下进行。
2.2.3 投加量对吸附效果的影响
如图5所示,随着固定化生物吸附剂投加量的增加,去除率不断增加。当固定化生物吸附剂投加量为50g/L(湿重)时吸附效果最佳。这是由于固定化生物吸附剂的投加量增大使重金属吸附位点增多造成的。当投加量超过50g/L后,随投加量的增加去除率不再提高,而是趋于平稳和略微下降。其原因可能是随着固定化生物吸附剂数量的增加,固定生物吸附剂间的团聚作用限制了有效比表面积和吸附位点的增加甚至使之减少。这些结果与其他[1,13]的结论类似。因此,后续实验选择投加量为50g/L进行。

图5 投加量对吸附效果的影响
2.2.4 吸附时间对吸附效果的影响
图6为吸附时间对固定化生物吸附剂吸附Cd(Ⅱ)的影响。从图中可以看出,吸附时间对固定化生物吸附剂处理含Cd(Ⅱ)废水的影响较大。随着吸附时间的延长,12~48h的去除率不断提高,在吸附时间为48h去除率达到最高。继续延长吸附时间至48~60h,去除效果趋于平稳,说明固定化生物吸附剂的重金属吸附位点已被充分利用。因此,最佳的吸附时间为48h。
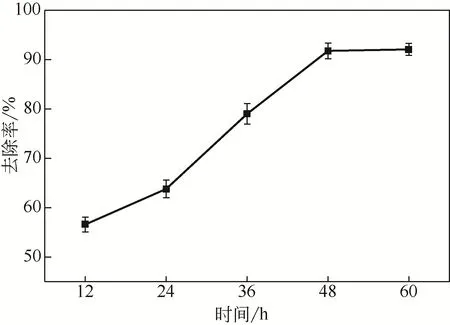
图6 吸附时间对吸附效果的影响
从表2中数据可知,固定化微生物吸附的量占溶液中总Cd(Ⅱ)含量的75.2%,其中细胞外膜的Cd(Ⅱ)含量达到22.6%,而细胞外膜的吸附容易产生离子的脱附,使得吸附效果不稳定,而本文采用的微生物固定化技术能改善这一现象。经分析,微生物亚细胞结构内Cd(Ⅱ)总含量为52.6%。其中,细胞内膜对重金属离子的吸附贡献最大,占亚细胞结构中总Cd(Ⅱ)含量的60.9%。这与Kumar[18]和Bai[30]等的研究结果有所不同,他们认为重金属离子主要吸附在细胞壁上。Li等[8]通过对不同时间段的微生物进行亚细胞分析发现,随着时间的增加Cd(Ⅱ)在亚细胞中的分布会发生变化。菌株大概需要0.5h才能将Cd(Ⅱ)主动运输到细胞的内部结构中,而这个过程可能涉及扩散、吸附、鳌合、络合和微沉淀,结合图6,12~48h小球内部微生物可能正经历这一过程。

表2 亚细胞结构的Cd(Ⅱ)吸附量(质量分数,%)
2.3 吸附动力学模型
图7为固定化生物吸附剂对Cd(Ⅱ)的吸附动力学拟合曲线。从表3中可以看出相较于准一级动力学模型,准二级动力学模型的R2值更高,说明固定化生物吸附剂对Cd(Ⅱ)的吸附更加符合准二级动力学模型,影响吸附反应的主要因素是化学键的形成,随着Cd(Ⅱ)浓度的提高其反应速率常数呈现下降趋势。
2.4 吸附等温模型
将实验数据拟合后得到Freundlich方程为lnqe=1.7338+0.4707lnCe,其中,qe为吸附平衡时吸附容量,mg/g;Ce为吸附平衡时溶液中Cd(Ⅱ)的浓度,mg/L。Langmuir方 程 为1/qe=0.0291+0.2446/Ce。根据Freundlich和Langmuir方程进行吸附等温线拟合,结果见图8。表4列出了等温吸附模型参数,两种吸附模型的R2均较大,Langmuir模型为0.9945,Freundlich模型为0.9826,说明固定化生物吸附剂对Cd(Ⅱ)的吸附过程用这两类模型都能较好拟合。但是比较而言,Langmuir模型的R2值更大,所以固定化生物吸附剂对Cd(Ⅱ)的吸附过程更适用Langmuir模型描述,Langmuir模型将吸附过程描述为一个可逆的平衡过程,在吸附剂表面均匀分布的独立活性结合位点上进行吸附,每个位点只与一个分子结合。一般来说,Langmuir模型描述的是均相吸附,而Freundlich模型描述的是在非均相吸附剂上进行的过程。因此,此固定化生物吸附剂对Cd(Ⅱ)的吸附过程是一个可逆的平衡过程,在吸附剂表面均匀分布的独立活性结合位点上进行,属于均相吸附,由此计算出对Cd(Ⅱ)的最大单分子层吸附量为34.4mg/g。
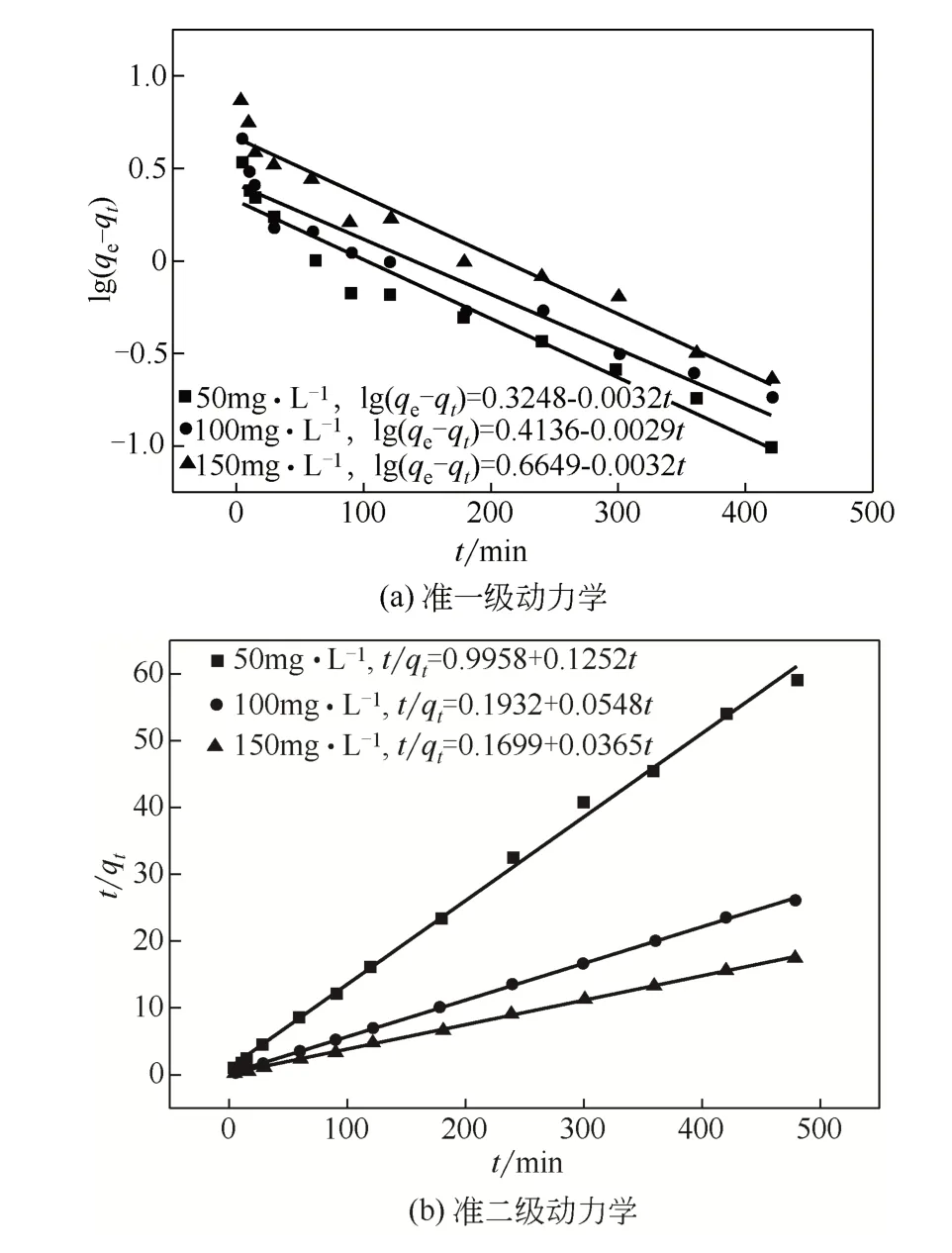
图7 吸附动力学拟合曲线

表3 Cd(Ⅱ)动力学模型参数
2.5 固定化生物吸附剂结构表征
2.5.1 BET分析
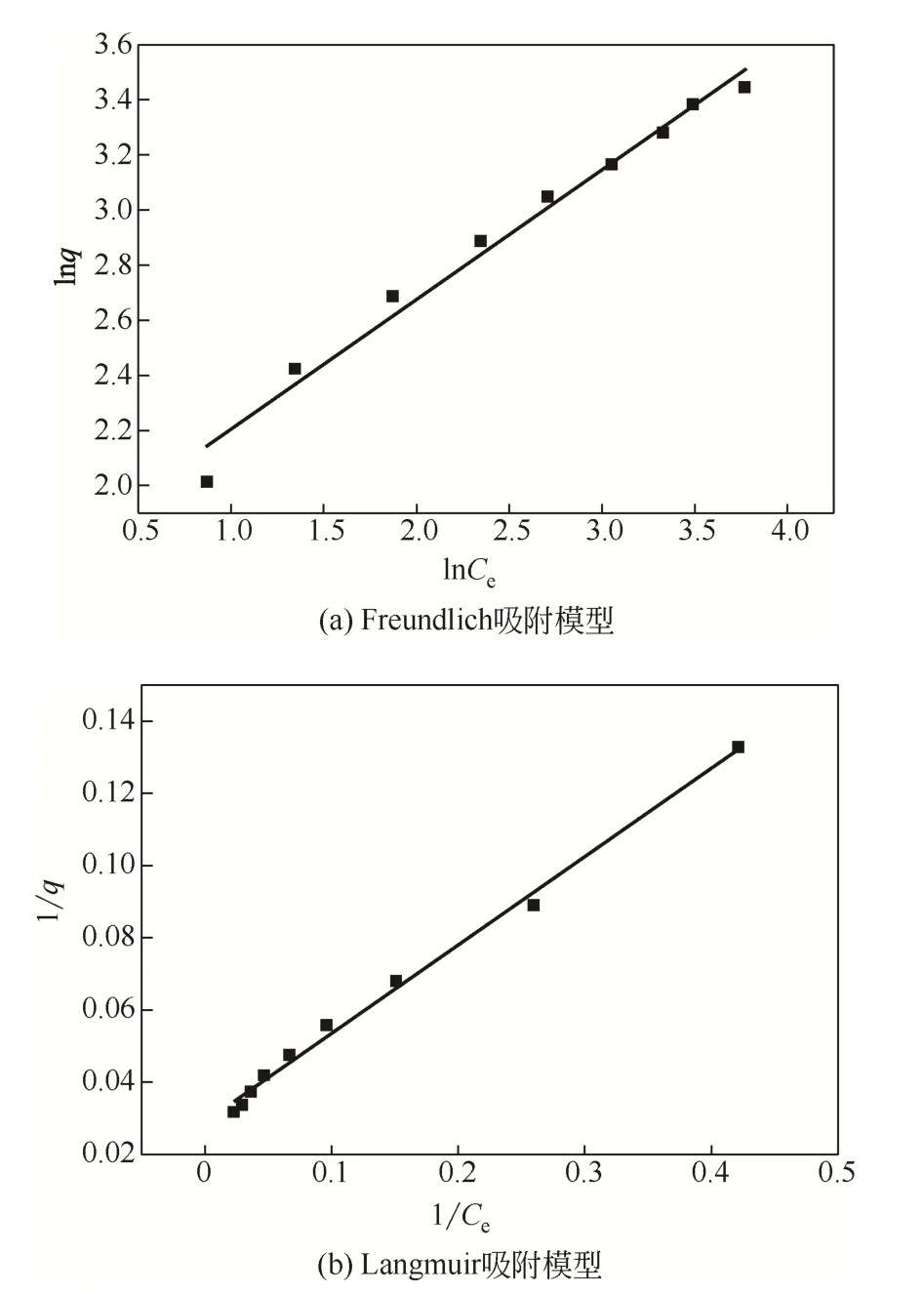
图8 吸附等温线拟合
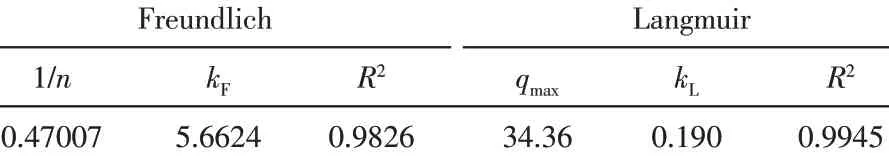
表4 等温吸附模型参数

表5 材料孔结构数据
表5为材料孔结构数据,从表中可以看出,固定化生物吸附剂在经过重金属离子吸附实验后其比表面积、孔体积均有增加,而孔径减小。一方面原因是材料内的PVA或SA在水溶液中溶解了一部分,另一方面可能是由于微生物的生长繁殖与新陈代谢作用使得材料内部孔隙结构发生改变(孔道更通畅)。图9为吸附前后BET分析曲线,图9(a)曲线低压端(0~0.1)明显偏向X轴,说明材料与N2作用弱。而且也可以看出吸附-脱附曲线均出现了滞后环,且均是H3型,说明材料中有片状粒子堆积形成的狭缝孔,即两种吸附剂均有介孔结构存在[33]。由图9(b)可知,两种材料均有介孔和大孔,介孔段所占的比例较高,这些孔结构有利于微生物的附着与生长,同时也有较高的传质性能,对Cd(Ⅱ)的吸附更加有利,比表面积数据较冯克等[34]的更好,和李骅[35]、王青松[36]等的研究结果较为接近。
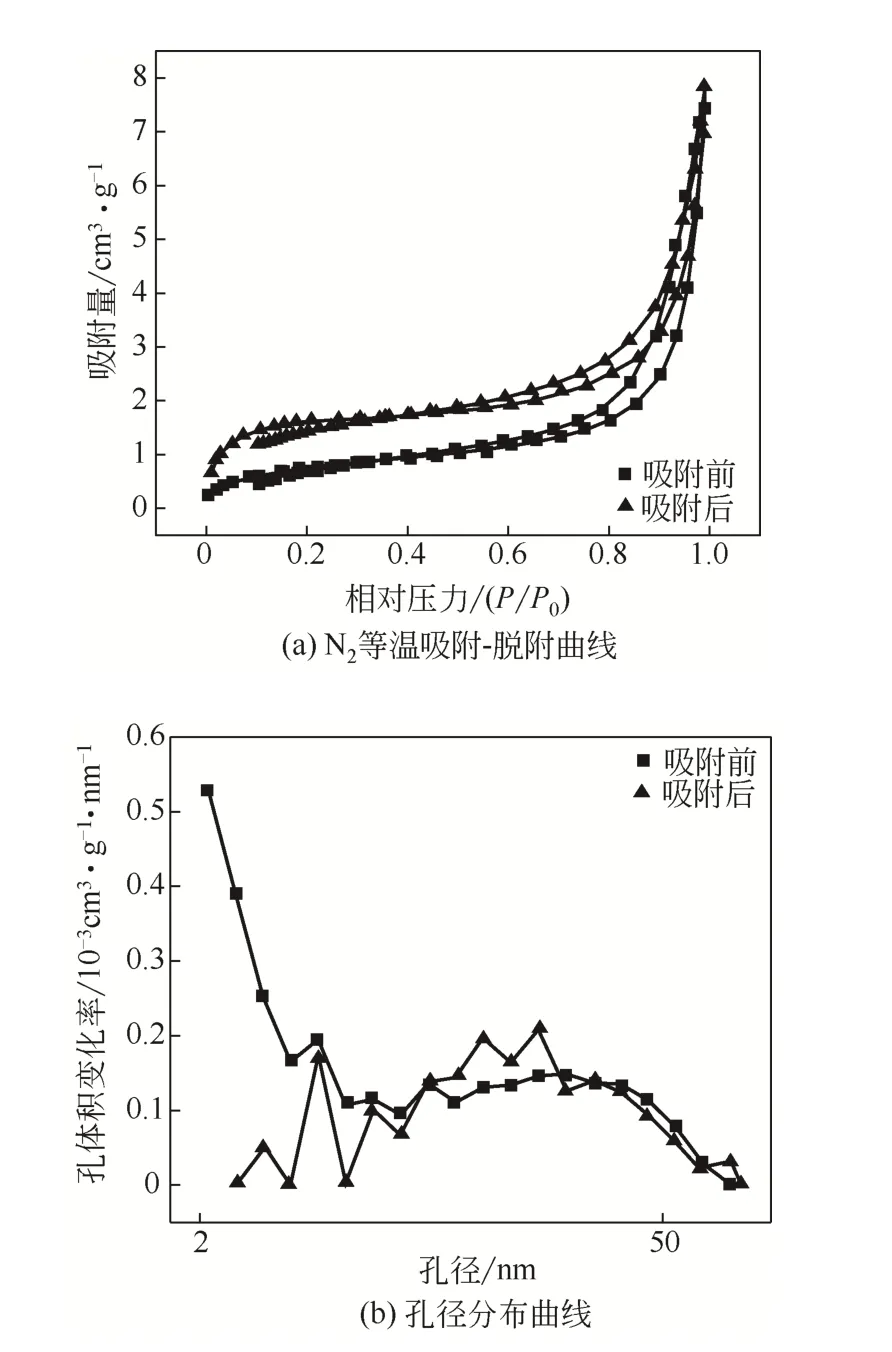
图9 吸附前后BET分析曲线
2.5 .2 FTIR-ATR分析
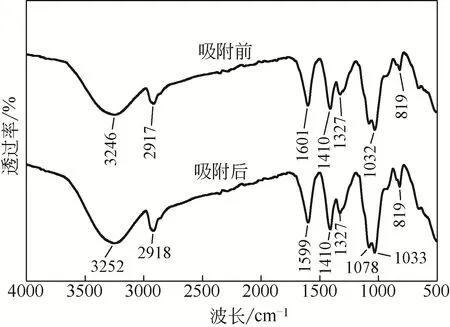
图10 固定化生物吸附剂吸附Cd(Ⅱ)前后的FTIR-ATR谱图
图10为固定化生物吸附剂吸附Cd(Ⅱ)前后的FTIR-ATR谱图,阐明了吸附剂在吸附Cd(Ⅱ)前后官能团的变化情况。因为材料是固体材料,制成样品较大,适用于ATR模式,因此峰的偏移程度和指纹区不明显。从吸附前的FTIR-ATR谱图可以看出,在3000cm-1以上存在3246cm-1的宽强峰,属于—OH基团伸缩振动峰,也可能存在不饱和基团(羧基、羰基、氨基),由于氢键的作用而使得峰较宽。在2917cm-1处为—CH不对称伸缩振动峰。在1601cm-1存在C==C的伸缩振动与—NH的剪刀弯曲振动,关于N—H的推断可以从819cm-1处看到N—H的摇摆振动中得到证实。在1410cm-1是—OH弯曲振动峰与—CH的剪刀弯曲振动,由于其他基团(可能是羰基或羧基)的共振作用,发生位移。1079cm-1和1032cm-1处是由C—O产生的伸缩振动峰。从图中还可以看出,在(2500±300)cm-1出现细微波动,而这是—COOH基团的特征区域,可能是由于大量微生物的存在引起的。对比吸附前3246cm-1处的峰,吸附后的峰偏离到3252cm-1,可能有不饱和基团参与了Cd(Ⅱ)的吸附,在1601cm-1处吸附后峰值右移,说明有C==C参与了Cd(Ⅱ)的吸附过程,综合3246cm-1、1601cm-1和819cm-1处峰值的变化,对Cd(Ⅱ)的吸附过程可能有蛋白质的参与。总体来说,在固定化生物吸附剂中含有较为丰富的基团,这对吸附反应过程较为有利,Cd(Ⅱ)的去除与—COOH、—OH、—NH、—CH等基团有关[5,8,29]。
2.6 实用性能实验
2.6.1 吸附解析
为了探究固定化生物吸附剂的经济实用性能,将材料进行了吸附解吸重复利用实验。图11为吸附解吸次数对固定化生物吸附剂吸附Cd(Ⅱ)的影响。当使用次数超过3次后,去除率大大下降,Cd(Ⅱ)去除率从91.8%下降至53.1%,下降了38.7%。在第4、第5、第6次使用时,去除率保持平稳。吸附效果低的原因可能是吸附解吸过程对材料内微生物造成了破坏,降低了微生物的活性。这一结果与杨培等[5]的研究结果类似。霍凯利[37]的研究也表明生物吸附剂的解析时间、解析试剂类型(EDTA、HNO3、HCl)与浓度对材料有一定的影响,后续研究可以进一步优化此方面内容,提高重复利用次数。
2.6.2 竞争吸附
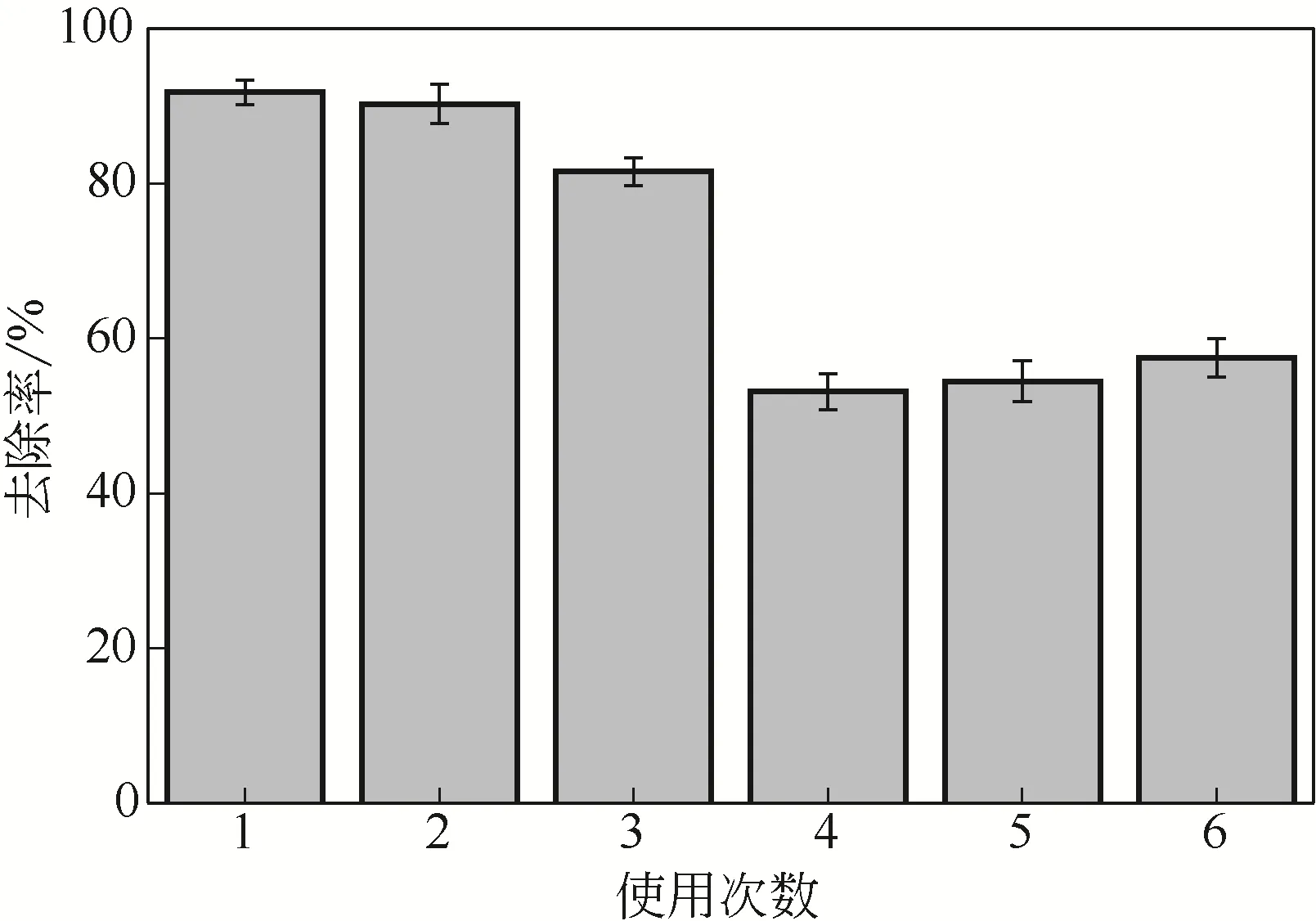
图11 使用次数对Cd(Ⅱ)去除率的影响
图12为常见阳离子对Cd(Ⅱ)吸附的影响。由图可知,此时溶液中Cd(Ⅱ)浓度为100mg/L,随着Na+、K+、Ca2+离子浓度的不断提高,三者对Cd(Ⅱ)吸附的影响也在增加,但影响程度不尽一致。其中Na+的影响微乎其微,在最高浓度150mg/L时去除率下降了1.8%±0.5%。而K+的影响较Na+大,在最高浓度150mg/L时去除率下降了5.1%±0.5%。Ca2+影响最大,在Ca2+浓度分别为50mg/L、100mg/L和150mg/L时去除率分别下降了5.3%±0.5%、7.7%±0.5%和13.5%±0.5%。综上所述,水环境中的Na+和K+在较低浓度时对固定化生物吸附剂吸附Cd(Ⅱ)的影响较小,而Ca2+在较高浓度时对固定化生物吸附剂吸附Cd(Ⅱ)产生了一定的影响,这可能是由于Ca2+是正二价金属离子易于侵占吸附剂上Cd(Ⅱ)的结合位点造成的。在加入Zn(Ⅱ)后,Zn(Ⅱ)浓度在20~60mg/L时对固定化生物吸附剂吸附Cd(Ⅱ)基本无影响。Zn(Ⅱ)浓度为80~100mg/L时,Cd(Ⅱ)去除率下降了6%±0.5%,因此当Zn(Ⅱ)浓度低于80mg/L的情况下固定化微生物活性小球对Cd(Ⅱ)的吸附影响较小。
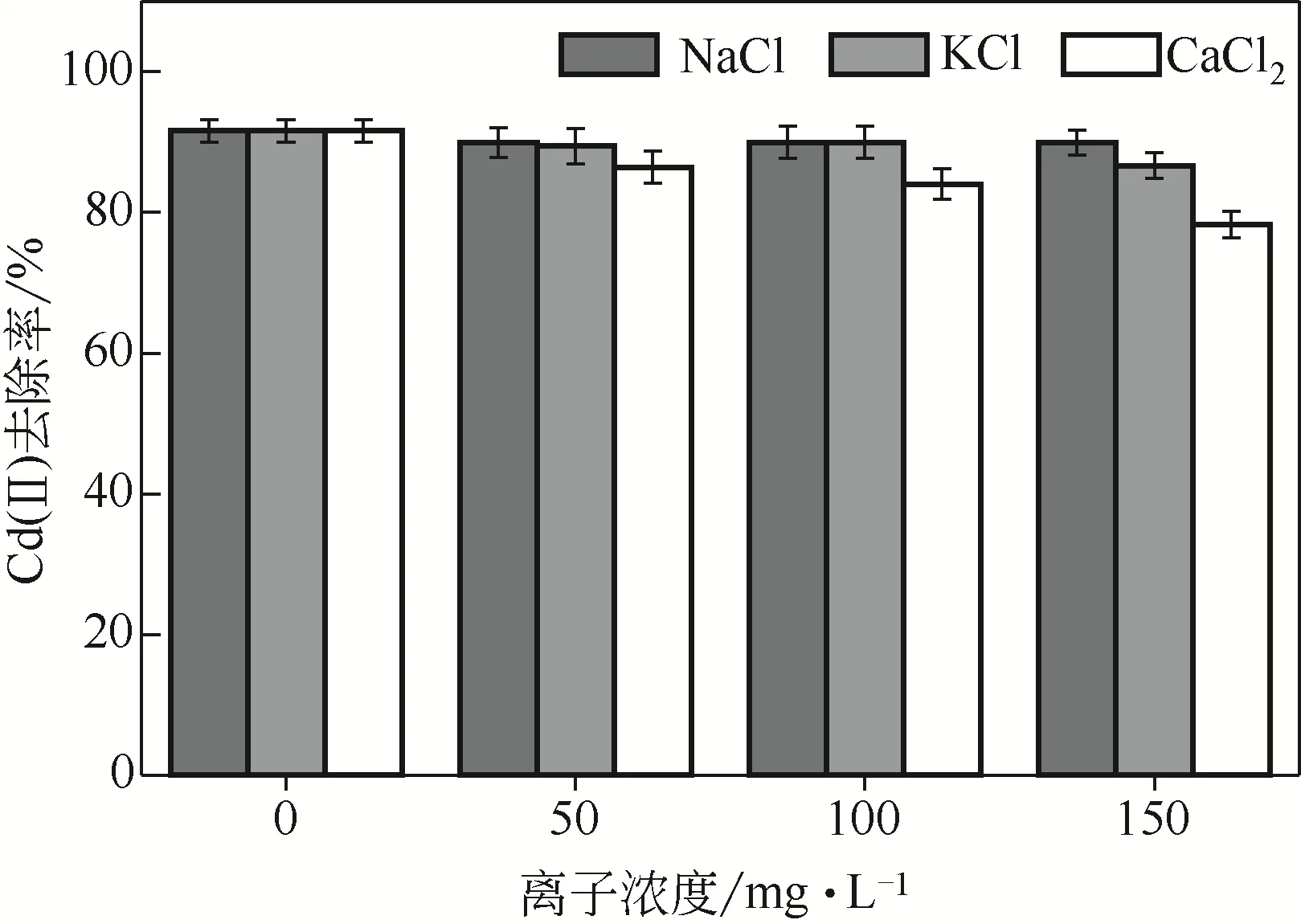
图12 常见阳离子对Cd(Ⅱ)吸附效果的影响
3 结论
(1)经过重金属浓度梯度筛选,通过PCR技术对其中菌种丰富度进行分析,菌种丰度顺序为Lactococcus<Stenotrophomonas<Serratia<Pseudomonas,通过文献分析均对Cd(Ⅱ)有较好的耐受性和吸附能力。
(2)本研究所用生物吸附剂对Cd(Ⅱ)有较好的吸附性能,其最佳吸附条件为pH=4~5,吸附时间48h,吸附剂用量(湿重)50g/L,Cd(Ⅱ)初始浓度100mg/L,对Cd(Ⅱ)的最大去除率可达91%±2%。
(3)本文中的生物吸附剂对Cd(Ⅱ)的吸附过程更加符合准一级动力学和Langmuir模型,影响吸附反应的主要原因是化学键的形成,对Cd(Ⅱ)的最大单分子层吸附量为34.4mg/g。通过BET分析显示材料具有介孔结构、比表面积丰富,有利于吸附作用的进行。FTIR-ATR结果说明材料具有丰富的重金属结合点位,—COOH、—OH、—NH、—CH基团参与了Cd(Ⅱ)的吸附过程。
(4)通过吸附解析得到生物吸附剂重复使用3次仍能保持较好的吸附效果,具有较高的经济实用性;水环境中常见阳离子对Cd(Ⅱ)的竞争吸附结果显示出其对Cd(Ⅱ)吸附影响的大小顺序依次为Na+<K+<Ca2+。
综上所述,通过将重金属污染的原位混合微生物进行重金属浓度梯度筛选后,再以包埋固定化方式制备的生物吸附剂对水环境中重金属离子的去除具有良好的效果。

