基于N-肉桂基磺酰胺的环化硫氰化合成3,4-二取代的1,2,3,4-四氢喹啉硫氰酸酯
陈甫雪,袁乐霞,邱佳申,吴迪,尹宏权
(北京理工大学 化学与化工学院,北京 100081)
烯烃的官能化过程是有机合成中最重要的反应之一,可利用烯烃合成卤代化合物[1-3]、三氟甲硫基化合物[4-5]、苯硒基化合物[6]或通过环化反应构建稠和的杂环化合物[7],其中,通过C=C键的硫氰化环化去合成硫氰酸酯备受关注.由于硫氰酸酯类化合物大多具有生物活性而且广泛存在于药物和农药中[8-10],且可以通过一定条件转化为其他重要的含硫化合物,比如硫醚 、硫醇、二硫化物[11-13]、含硫杂环和硫代硫酸盐[14-15]等.GUO等[16]研究了使用KSCN和过量的过硫酸钾(K2S2O8),由2-乙烯基芳基胺和2-乙烯基苯分别制备4-硫氰基甲基苯并噁嗪和亚氨基异苯并呋喃的方法(图1(a)).YU等[17]发现了由烯胺酮合成3-硫氰酸根合4H-铬-4-酮(图1(b)).LI等[18]研究了肟在FeCl3催化条件下转化为异噁唑啉(图1(c)).文献调研发现,大多数由烯烃转化为含硫氰基化合物的过程都涉及环化形成C-O新键,而硫氰化C环化构建新的C-C键的反应研究十分稀少,具有一定难度.之前,本课题组CHEN等[19]研究了在添加氧化剂K2S2O8的条件下N-芳基丙烯酰胺的硫氰基自由基加成环化反应,生成了3,3-二取代羟基吲哚,但仅通过构建C-C键生成五元环(图1(d)). 本文研究了基于N-肉桂酰磺酰胺和N-硫氰基糖精之间的硫氰化C环化反应,不需要添加任何额外的氧化剂即可生成具有六元环的3,4-二取代的1,2,3,4-四氢喹啉.在这一过程中,不仅生成了硫氰酸酯,还同时得到了存在于许多具有生物活性的天然产物和与药理有关的治疗剂中的非常常见的结构单元四氢喹啉[20].

图1 烯烃的硫氰化环化反应Fig.1 Thiocyanation-cyclization of alkenes
1 实验部分
1.1 主要实验仪器
熔点检测仪(双目显微镜XT4A熔点仪);红外光谱仪(布鲁克ALPHA FT-IR光谱仪);核磁共振仪(Brucker Avance400或Brucker Avance700);高分率质谱仪(Apex IV FTMS).
1.2 实验方法
1.2.1底物的合成步骤
将干燥的250 mL 双口圆底烧瓶通氩气置换.按顺序加入取代苯胺(5.0 mmol,1.0 equiv)、三乙胺(15.0 mmol,3.0 equiv)和无水二氯甲烷(25 mL),在0 ℃冰浴条件下少量多次加入甲苯磺酰氯(10.0 mmol,2.0 equiv).15 min后加入DMAP(0.25 mmol,0.05 equiv),在25 ℃下搅拌8 h.用饱和NaHCO3水溶液淬灭反应,用CH2Cl2萃取水相.将有机萃取物合并后用无水硫酸钠干燥,过滤并减压浓缩,无需进一步纯化进行下一步.将上一步的粗产品全部加入氩气置换后的反应瓶,加入无水THF(50 mL).在0 ℃冰浴条件下,添加NaH(60%的矿物油分散液,20.0 mmol,4.0 equiv).反应搅拌30 min后,加入新制备的肉桂基溴化物溶液(10.0 mmol在20.0 mL THF中的溶液),在25 ℃下搅拌8 h.将反应冷却至0 ℃,用饱和NH4Cl水溶液淬灭.用EtOAc萃取水相.将有机萃取物合并后用无水硫酸钠干燥,过滤并减压浓缩.通过硅胶色谱法纯化(石油醚∶乙酸乙酯=20∶1),得到底物苯磺酰胺.合成路线如图2所示.

图2 底物的合成路线Fig. 2 Synthesis route of substrates
1.2.2四氢喹啉硫氰酸酯的合成步骤
将干燥的 25 mL 反应管通氩气置换.按顺序加入苯磺酰胺1(0.05 mmol,1.0 equiv)和无水ZnCl2(0.01 mmol,0.2 equiv),随后添加HFIP(1,1,1,3,3,3-六氟-2-丙醇)(0.5 mL).在避光条件下,快速称N-硫氰基糖精2a[21](0.075 mmol,1.5 equiv)加入,在40℃水浴锅中反应4 h.通过硅胶色谱法纯化(石油醚:乙酸乙酯=10:1),得到四氢喹啉硫氰酸酯.合成路线如图3所示.
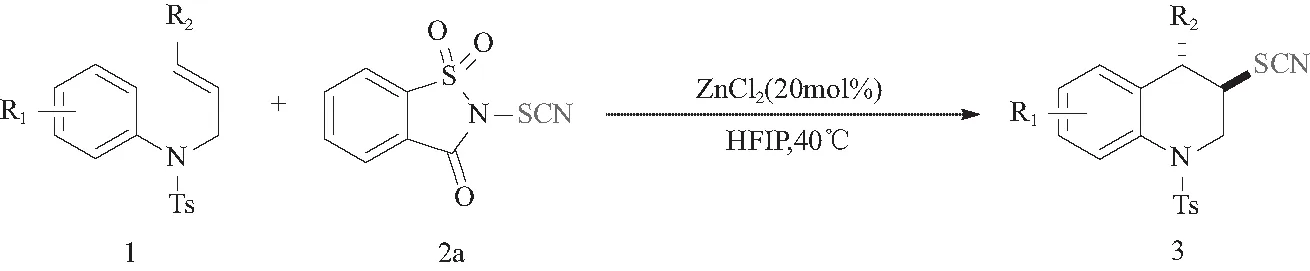
图3 四氢喹啉硫氰酸酯的合成路线Fig. 3 Synthesis route of tetrahydroquinoline thiocyanates
得到检测数据如下:
3,4-反式-4-苯基-3-硫氰基-1-甲苯磺酰基-1,2,3,4-四氢喹啉(3a):白色固体;产率86%(18.0 mg);熔点187~189 ℃;1H NMR(400 MHz,CDCl3):δ7.88~7.86(d,J= 8.0 Hz, 1H),7.64~7.62(d,J= 8.4 Hz,2H),7.33~7.31(d,J= 8.0 Hz,2H),7.27~7.24(m,2H),7.21~7.17(m,2H),7.07~7.03(dt,J= 8.0,1.2 Hz,1H),6.72~6.70(d,J=8.0 Hz,1H),6.61~6.60(d,J=7.2 Hz,2H),4.77~4.72(dd,J=14.0,3.6 Hz,1H),4.02~3.99(d,J=10.4 Hz,1H),3.78~3.71(m,1H),3.15~3.09(td,J=11.2,3.6 Hz,1H),2.46(s,3H);13C{H}NMR(100 MHz,CDCl3):δ144.7,140.8,136.3,135.5,131.3,130.6,130.3,128.8,128.7,127.9,127.7,127.5,126.2,125.1,109.3(SCN),50.8,50.1,47.8,21.6;IR(KBr):2156(SCN),1647,1595,1487,1454,1350,1165 cm-1;HRMS(ESI)理论值C23H24N3O2S2[M+NH4]+:438.1304,实验值:438.1298.通过单晶X射线分析(CCDC 1969405)确认了产物3a的结构,如图4所示.
3,4-反式-6-氟-4-苯基-3-硫氰基-1-甲苯磺酰基-1,2,3,4-四氢喹啉(3b):白色固体;产率73% 16.0 mg);熔点108~109 ℃;1H NMR(400 MHz,CDCl3):δ7.87~7.83(dd,J=9.2,5.2 Hz,1H),7.62~7.60(d,J=8.4 Hz,2H),7.36~7.33(d,J=8.4 Hz,2H),7.30~7.26(m,2H),7.22~7.18(m,2H),7.00~6.95(dt,J=8.0,2.4 Hz,1H),6.58~6.56(d,J=7.2 Hz,2H),6.41~6.38(dd,J=9.2,2.4 Hz,1H),4.78~4.73(dd,J=14.0,3.6 Hz,1H),3.94~3.91(d,J=10.8 Hz,1H),3.75~3.68(m,1H),3.09~3.03(td,J=11.6,3.6 Hz,1H),2.48(s,3H);13C{H}NMR(100 MHz,CDCl3):δ160.5(d,1JC-F=245.6 Hz),144.9,139.8,136.0,133.8(d,3JC-F=7.4 Hz),131.5(d,4JC-F=2.7 Hz),130.4,129.0,128.6,128.2,127.6,127.4(d,3JC-F=8.3 Hz),116.7(d,2JC-F=23.3 Hz),115.2(d,2JC-F=22.6 Hz),109.0(SCN),51.0,50.2,47.2,21.6;IR(KBr):2154(SCN),1489,1361,1168 cm-1;HRMS(ESI)理论值C23H23FN3O2S2[M+NH4]+:456.1210,实验值:456.1209.

图4 四氢喹啉硫氰酸酯3a的单晶结构图Fig.4 X-Ray structure of tetrahydroquinoline thiocyanate 3a
3,4-反式-6-氯-4-苯基-3-硫氰基-1-甲苯磺酰基-1,2,3,4-四氢喹啉(3c):白色固体;产率79% 18.0 mg);熔点185~187 ℃;1H NMR(400 MHz,CDCl3):δ7.84~7.82(d,J=9.2 Hz,1H),7.64-7.62(d,J=8.0 Hz,2H),7.36-7.34(d,J=8.0 Hz,2H),7.30-7.26(m, 2H),7.24~7.19(m,2H),6.69(s,1H),6.59~6.57(d,J=7.2 Hz,2H),4.74~4.70(dd,J=14.4,3.2 Hz,1H),3.95-3.93(d,J=10.8 Hz,1H),3.74~3.68(m,1H),3.08~3.02(td,J=11.2,3.6 Hz,1H),2.48(s,3H);13C{H}NMR(100 MHz,CDCl3):δ145.0,139.8,135.9,134.2,133.0,131.8,130.4,130.2,129.0,128.6,128.3,128.1,127.5,126.6,109.0(SCN),50.7,50.0,47.3,21.7;IR(KBr):2154(SCN),1597,1479,1361,1166 cm-1;HRMS(ESI)理论值C23H23ClN3O2S2[M+NH4]+:472.0915,实验值:472.0923.
3,4-反式-6-溴-4-苯基-3-硫氰基-1-甲苯磺酰基-1,2,3,4-四氢喹啉(3d):白色固体;产率80%(20.0 mg);熔点181~183 ℃;1H NMR(400 MHz,CDCl3):δ7.77~7.75(d,J=8.0 Hz,1H),7.64~7.62(d,J=8.0 Hz,2H),7.39~7.34(m,3H),7.30~7.26(m,2H),7.23~7.19(m,2H),6.84~6.83(dd,J=2.4,0.8Hz,1H),6.60~6.59(d,J=7.2 Hz,2H),4.73~4.69(dd,J=14.4,3.6 Hz,1H),3.96~3.94(d,J=10.4 Hz,1H),3.74~3.68(m,1H),3.09~3.03(td,J=11.2,3.6 Hz,1H),2.48(s,3H);13C{H}NMR(100 MHz,CDCl3):δ145.0,139.8,135.9,134.7,133.3,133.1,131.0,130.5,129.0,128.6,128.3,127.5,126.8,119.6,109.0(SCN),50.6,49.9,47.3,21.7;IR(KBr):2154(SCN),1595,1477,1454,1354,1166 cm-1;HRMS(ESI)理论值C23H23BrN3O2S2[M+NH4]+:516.0410,实验值:516.0412.
3,4-反式-6-甲基-4-苯基-3-硫氰基-1-甲苯磺酰基-1,2,3,4-四氢喹啉(3e):白色固体;产率89%(19.3 mg);熔点175~177 ℃;1H NMR(400 MHz,CDCl3):δ7.75~7.73(d,J=8.8 Hz,1H),7.64~7.62(d,J=8.0 Hz,2H),7.33~7.31(d,J=8.0 Hz,2H),7.28~7.24(m,2H),7.21~7.17(m,2H),7.07~7.05(dd,J=8.8,1.6 Hz,1H),6.60~6.58(d,J=7.2 Hz,2H),6.49(s,1H),4.74~4.70(dd,J=14.0,3.6 Hz,1H),3.97~3.94(d,J=10.4 Hz,1H),3.74~3.68(m,1H),3.12~3.04(td,J=11.6,3.6 Hz,1H),2.46(s,3H);13C{H}NMR(100 MHz,CDCl3):δ144.6,140.9,136.3,136.1,133.0,131.0,130.8,130.3,128.8,128.7,128.7,127.9,127.6,125.1,109.4(SCN),50.9,50.1,48.0, 21.6,20.9;IR(KBr):2154(SCN),1597,1492,1452,1352,1166 cm-1;HRMS(ESI)理论值C24H26N3O2S2[M+NH4]+:452.1461,实验值:452.1454.
3,4-反式-6-甲氧基-4-苯基-3-硫氰基-1-甲苯磺酰基-1,2,3,4-四氢喹啉(3f):白色固体;产率76%yield(17.0 mg);熔点147-149 ℃;1H NMR(400 MHz,CDCl3):δ7.80-7.78(d,J=8.8 Hz,1H),7.61~7.59(d,J=8.0 Hz,2H),7.33~7.31(d,J=8.0 Hz,2H),7.26~7.23(m,2H),7.19~7.15(m,2H),6.84~6.81(dd,J=8.8,2.8 Hz,1H),6.56~6.54(d,J=7.6 Hz,2H),6.17~6.17(d,J=2.8 Hz,1H),4.77~4.72(dd,J=14.0,3.6 Hz,1H),3.93~3.90(d,J=11.2 Hz,1H),3.74~3.67(m,1H),3.63(s,3H,OCH3),3.07~3.00(td,J=11.2,3.6 Hz,1H),2.47(s,3H);13C{H}NMR(100 MHz,CDCl3):δ157.6,144.6,140.4,136.2,133.0,130.3,128.8,128.7,128.5,128.0,127.7,126.9,115.1,113.5,109.2(SCN),55.4,51.1,50.2,47.6,21.6;IR(KBr):2154(SCN),1610,1494,1352,1163 cm-1;HRMS(ESI)理论值C24H26N3O2S2[M+NH4]+:468.1410,实验值:468.1413.
3,4-反式-8-苯基-7-硫氰基-5-甲苯磺酰基-5,6,7,8-四氢-[1,3]二氧杂[4,5-g]喹啉(3g):白色固体;产率65%yield(15.0 mg);熔点166-167 ℃;1H NMR(400 MHz,CDCl3):δ7.66~7.64(d,J=8.4 Hz,2H),7.36(s,2H),7.34(s,1H),7.24~7.23(m,1H),7.19~7.15(t,J=7.6 Hz,2H),6.55~6.54(d,J=7.2 Hz,2H),6.09(s,1H),5.95~5.93(dd,J=8.4,1.2 Hz,2H),4.75~4.71(dd,J=14.0,3.6 Hz,1H),3.87~3.84(d,J=10.8 Hz,1H),3.71~3.64(m,1H),3.05-2.98(td,J=11.6,3.6 Hz,1H),2.48(s,3H);13C{H}NMR(100 MHz,CDCl3):δ147.0,146.3,144.7,140.6,136.0,130.3,129.3,128.8,128.6,128.0,127.7,125.2,109.2(SCN),108.9,106.3,101.7,51.2,50.3,47.6,21.6;IR(KBr):2154(SCN),1597,1504,1483,1359,1247,1165,1090 cm-1;HRMS(ESI)理论值C24H24N3O4S2[M+NH4]+:482.1203,实验值:482.1208.
N-肉桂基-N-甲基-4-硫代氰基苯胺(3h):淡黄色油状;产率82%yield(11.5 mg);1H NMR(400 MHz,CDCl3):δ7.44~7.41(d,J=8.8 Hz,2H),7.36~7.29(m,4H),7.25~7.22(m,1H),6.75~6.73(d,J=9.2 Hz,2H),6.49~6.45(d,J=16.0 Hz,1H),6.22~6.15(dt,J=15.6,5.2 Hz,1H),4.13~4.11(dd,J=5.6,1.6 Hz,2H),3.04(s,3H,CH3);13C{H}NMR(100 MHz,CDCl3):δ150.9,136.5,134.7,131.7,128.6,127.7,126.4,124.1,113.4,112.6,106.8(SCN),54.4,38.2;IR(KBr):2151(SCN),1591,1506,1355,1198 cm-1;HRMS(ESI)理论值C17H17N2S[M+H]+:281.1107,实验值:281.1114.
N-(3,4-二硫氰基丁基)-4-甲基-N-苯基苯磺酰胺(3i):白色固体;产率54%yield(11.3 mg);熔点113~114 ℃;1H NMR(400 MHz,CDCl3):δ7.48~7.46(d,J=8.0 Hz,2H),7.37~7.35(m,3H),7.28~7.26(d,J=8.8 Hz,2H),7.09~7.07(m,2H),4.00~3.94(m,1H),3.64~3.60(m,2H),3.47~3.42(dd,J=14.0,6.8 Hz,1H),3.31~3.25(dd,J=14.0,7.2 Hz,1H),2.44(s,3H),2.22~2.14(m,1H),1.90~1.82(m,1H);13C{H}NMR(100 MHz,CDCl3):144.1,138.4,134.3,129.7,129.6,128.6,128.6,127.9,110.6(SCN),108.9(SCN),47.3,46.3,38.8,31.9,21.6;IR(KBr):2154(SCN),1734,1595,1491,1346,1163 cm-1;HRMS(ESI)理论值C19H23N4O2S3[M+NH4]+:435.0978,实验值:435.0982.
1.2.34-苯基-3-硫氰基-1-甲苯磺酰基-1,2,3,4-四氢喹啉3a的转化
准备干燥的25 mL 反应管,加入硫氰酸酯3a(42.1 mg,0.1 mmol,1.0 equiv)和无水THF(2.0 mL). 将混合物冷却至0℃后,分别逐滴加入在1 mol/L THF中的Me3SiCF3(29.0 μL,0.2 mmol,2.0 equiv)和TBAF(20 μL,0.02 mmol,0.2 equiv).在Ar环境下0℃反应30 min后,升温至23 ℃再搅拌12 h.然后将反应物用EtOAc萃取.合并的有机层用盐水洗涤,经无水硫酸钠干燥,并在减压下浓缩.通过硅胶色谱法纯化(PE:EtOAc=20:1),以66%的产率得到硫三氟甲基化产物4a,为白色固体.转化路线如图5所示.

图5 四氢喹啉硫氰酸酯3a的转化路线Fig.5 Transformation route of tetrahydroquinoline thiocyanate 3a
得其检测数据:熔点149~151 ℃;1H NMR(400 MHz,CDCl3):δ7.97~7.94(d,J=8.4 Hz,1H),7.61~7.59(d,J=8.0Hz,2H),7.30~7.28(d,J=8.4 Hz,2H),7.24~7.18(m,2H),7.14~7.11(m,2H),7.04~7.00(t,J=7.6,1H),6.70~6.68(d,J=8.0 Hz,1H),6.46~6.44(d,J=7.6 Hz,2H),4.79~4.75(dd,J= 14.0,3.6 Hz,1H),3.76~3.73(d,J=11.2 Hz,1H),3.66~3.60(m,1H),3.32~3.25(td,J=11.2,3.6 Hz,1H),2.46(s,3H);13C{H}NMR(175 MHz,CDCl3):δ144.4,141.4,136.6,135.9,131.2,130.8,130.2(d,1JC-F=305.6 Hz),130.1,128.8,128.4,127.5,127.5,127.4,126.0,125.0,51.5,49.3,44.3,21.6;19F{H}NMR(376 MHz,CDCl3):δ-38.9(s);IR(KBr):1 597,1 487,1 456,1 361,1 261,1 166,1 112 cm-1;HRMS(ESI)理论值C23H21F3NO2S2[M+H]+:464.0960,实验值:464.0959.
2 结果与讨论
2.1 实验条件的优化
以N-肉桂基磺酰胺(1a)作为标准底物,以20 mol%的Zn(OTf)2作为催化剂来优化反应条件(图6),结果见表1.使用N-硫氰基糖精2a作为亲电硫氰基试剂,在CH2Cl2中环化产物3a的收率低于10%,同时得到35%的双键二硫氰化取代副产物3aa(表1,条目1).使用其他硫氰基试剂2b或2c代替2a,未发生反应或只有微量产物(条目2~3).在较高的温度40 ℃下,反应略有加速,产率为14%,而降至0 ℃则完全没有反应(条目4~5).随后在40 ℃进行溶剂筛选发现,THF、DMF、甲苯和MeOH较CH2Cl2的结果较差(条目6~9),而且在THF中1a分解为4-甲基-N-苯基苯磺酰胺3ab(条目6).出乎意料的是,使用1,1,1,1,3,3,3-六氟-2-丙醇(HFIP)作为溶剂(条目10),产率提高至52%,这可能是由于HFIP具有活化底物的独特性能.然后在HFIP中尝试了除Zn(OTf)2以外的路易斯酸.除了Ce(OTf)3给出同样的52%收率以外,所有其他的金属都没有显示催化活性(条目11~15).使用ZnCl2的收率提高到了86%(条目16),而在没有ZnCl2的情况下只有29%(条目17).与CH2Cl2中的Zn(OTf)2相似,HFIP中的ZnCl2催化剂效率在更高或更低的反应温度下均被破坏(条目18~19),其中在60 ℃时1a大部分分解为3ab(产率48%).此外,减少催化剂负载量为10 mol%或添加溶剂为1 mL都降低了3a的产率(条目20~21).因此,得到最佳反应条件:N-肉桂基-4-甲基-N-苯基苯磺酰胺1a(0.05 mmol,1.0 equiv)与N-硫氰基糖精2a(0.075 mmol,1.5 equiv)在氯化锌(20 mol%)作为催化剂、六氟异丙醇(0.5 mL)作为溶剂的条件下,在40 ℃水浴条件下反应4 h.通过X-射线单晶衍射分析以及核磁共振氢谱的耦合常数计算可知目标产物3a为反式构型,且通过对其进行手性HPLC检测(Daicel OD-H柱,正己烷∶异丙醇=98∶2,1.0 mL/min,254 nm)发现,产物是一对对映异构体,其ee%值为0.
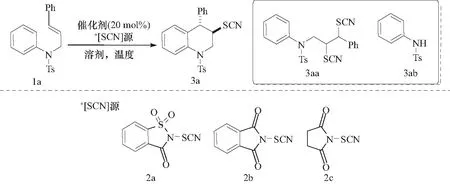
图6 标准底物1a的反应条件优化Fig.6 The optimization of reaction conditions of standard substrate 1a

表1 合成四氢喹啉硫氰酸酯3a的条件优化Tab.1 Optimal reaction conditions of tetrahydroquinoline thiocyanate 3a
2.2 底物的拓展
根据最优条件进行底物的拓展,见图7.在苯磺酰胺的对位有卤素取代基(F,Cl,Br)时,分别以73%,79%和80%的收率得到了相应的硫氰化环化产物(3b~3d).其中,氯原子取代和溴原子取代的底物在标准条件下反应微弱,当延长反应时间到10 h仍有原料未能反应.因此将温度升至60 ℃发现在4 h之内原料全部反应完全,且有较好的收率.当苯磺酰胺的对位连有吸电子基团如甲基(Me)或甲氧基(OMe)时,分别以89%和76%的收率得到目标产物(3e~3f).另外,当苯磺酰胺的苯环上连有二氧戊烷时,反应在标准条件下正常进行且以65%的产率获得四氢喹啉(3g).随后考察了N-Ts基团对该反应过程的影响,首先将Ts保护基团换作甲基保护,很遗憾没有得到目标产物而是以82%的收率得到了苯环取代产物,可能是碳碳双键的活性降低所导致的(3h).当使用苯基肉桂醚作为底物参与反应时,无论是延长反应时间还是升高温度产率都没有显著提高,反应微弱(3i).这说明在这类反应中,N-Ts基团是必要的.

图7 底物的拓展Fig.7 Scope of N-cinnamyl sulfonamide
2.3 实验机理的探究
在最优条件下,通过控制实验探究反应机理.当使用2,2,6,6-四甲基哌啶-氮氧化物(TEMPO,1.0 equiv)和2,6-二叔丁基对甲酚(BHT,1.0 equiv)来做自由基捕获试剂时,没有得到目标产物3a,而且利用高分辨质谱分别检测到了TEMPO捕获产物3ac和BHT捕获产物3ad,如图8(a)和8(b)所示.这初步表明此反应过程可能涉及自由基反应机理,为进一步验证此想法,进行了自由基钟实验:利用(1-环丙基乙烯基)苯1j在标准条件下与硫氰基试剂2a进行反应得到了开环产物5,并通过高分辨质谱进行了检测,如图8(c)所示.
通过上述控制实验及相关文献[22],提出了反应可能的机理,如图9所示.首先硫氰基试剂2a在加热条件下均裂为硫氰基自由基和糖精氮自由基A,随后硫氰基自由基与N-肉桂基-4-甲基-N-苯基苯磺酰胺1a上的C=C双键进行加成得到苄基自由基B,再进行亲电环化得到芳基自由基C,然后芳基自由基C由A进行氧化成为芳基阳离子中间体D并伴随着糖精阴离子中间体的产生,最后芳基阳离子中间体D快速去质子化得到目标产物3a,而糖精阴离子中间体则质子化得到糖精.

图8 控制实验Fig.8 Control experiments

图9 可能的机理Fig.9 Possible mechanism
3 结 论
研究了新发现的阳离子硫氰基试剂N-硫氰基糖精的新的自由基转化过程.通过使用亲电的N-硫氰基糖精,在HFIP中利用ZnCl2催化对N-肉桂基磺酰胺进行了硫氰化环化反应,在温和的反应条件下通过构建新的C-C键,一步有效合成了六元杂环化合物3,4-二取代的1,2,3,4-四氢喹啉硫氰酸酯,其可以通过系列转化得到其他重要的含硫化合物.

