O3对射流火焰燃烧特性影响的数值研究
徐 琛,孙继昊,赵宁波
(1.中国航空综合技术研究所,北京 100028;2.哈尔滨工程大学动力与能源工程学院,哈尔滨150001)
1 引言
为大幅降低污染物排放,现代燃气轮机广泛采用贫预混低排放燃烧技术[1-2]。其中,如何实现贫预混条件下的燃烧火焰稳定控制成为工业界与学术界共同关注的焦点。
作为一种先进的强化与稳定燃烧的方式,非平衡等离子体放电通过产生高能电子、离子、自由基(如O,OH)以及激发态分子(如O2*,O3)来调控化学反应路径,提高燃烧反应速率[3-4]。现有研究表明,O3存活时间相对较长,可以被输运至火焰区,是非平衡等离子体实现助燃和提高火焰稳定性的最重要组分之一[5]。Dong 等[6]对甲烷射流火焰的数值模拟研究表明,O3的加入可以提高火焰的传播速度,使回流区内涡结构变得更加连续。Eha 等[7]在针对甲烷/空气低旋流火焰开展的实验和数值模拟研究中,同样发现O3能提高层流火焰的传播速度和火焰拉伸率,使得火焰可以在更强的湍流下稳定燃烧。Zhang 等[8]数值分析了O3对合成气火焰特性及熄火极限的影响,指出O3对于提高层流火焰速度和拓宽稳定燃烧边界具有显著影响。此外,Tachibana[9]和Wilk[10]等分别从实验角度分析了O3对燃烧污染物排放的影响,其结果一致表明,O3的加入虽然可以降低CO、UHC 及碳烟的排放,但是会导致NOx排放略有增加。
鉴于O3对燃烧火焰形态及典型组分浓度影响的复杂性,本文以甲烷/空气射流火焰为研究对象,采用二维数值模拟方法分析不同O3浓度对火焰位置及CO、NO污染物排放的影响。
2 物理模型与计算域网格划分
参考Sandia实验室的开放空间射流火焰研究[11],本文的数值物理模型如图1(a)所示。其中,射流燃料为25%甲烷和75%空气(摩尔分数)的混合物,其速度为49.6 m/s,管径D为7.2 mm;值班燃料为φ=0.77的甲烷已燃气,其速度为11.4 m/s,管径为18.2 mm;伴流空气流速为0.9 m/s。综合考虑物理模型的对称性和数值计算量,采用图1(b)所示的二维计算域进行数值分析。
数值研究过程中,保证燃料量和氧化剂量不变,通过改变射流燃料中O3摩尔分数来分析O3浓度对燃烧特性的影响。表1给出了不同算例下的射流燃料组分。

表1 射流燃料组分摩尔分数 %Table 1 Species mole fractions of jet fuel
为满足网格无关性要求,图2给出了算例0的网格无关性验证结果。图中,X/D为距离喷嘴的相对高度,纵坐标为对称轴上的轴向速度。从图中可以看出,当网格数大于5 500时,计算结果基本不随网格数的增加而改变,认为满足网格无关性要求。
3 数值方法选取及验证
针对上述射流火焰无强旋流这一特性,选取Standardk-ε、Standardk-ω湍流模型进行湍流模型验证,并采用绝热条件下的标准壁面函数对近壁面进行处理。考虑到湍流燃烧中不同基元反应时间尺度的差异性,选取EDC 模型、组分输运PDF 模型对燃烧模型进行验证。为深入分析O3对火焰形态及燃烧反应过程中典型组分的影响,采用341 步甲烷燃烧含O3详细反应动力学机理[2]。
图3 给出了算例0 数值模拟结果与实验数据[11]的对比。从图中可以看出,采用Standardk-ε湍流模型和EDC 燃烧模型可以较好地计算得到甲烷/空气射流火焰的温度场及典型组分浓度分布,后续数值模拟工作将全部基于该模型进行。在X/D>40处,模拟结果与实验数据之间误差变大,这主要是由于火焰后方的已燃气与环境空气剧烈掺混,而二维网格不能很好地模拟这一现象所致。考虑到本文主要分析O3对火焰形态及燃烧过程中CO 和NOx的生成特性的影响,认为所选取的数值模型仍具有一定的适用性。

图3 算例0的数值结果与实验数据的对比Fig.3 Comparison between numerical results and experimental data of case 0
4 结果分析与讨论
4.1 O3浓度对火焰形态的影响
由于CH自由基存活时间较短且基本上只在火焰面位置生成,所以其一定程度上可以反映火焰的形态特征。为明确不同O3浓度对火焰形态的影响,图4 给出了算例0~算例5 条件下的CH 自由基质量分数云图。从图中可以看出,对于算例0和算例1而言,在火焰根部位置处均出现了火焰“断裂”现象。而随着O3浓度的不断增加,CH 自由基高浓度区域逐渐向来流方向发展,且CH 自由基浓度分布变得相对较为连续。当射流入口O3浓度达到0.6%时,火焰根部断裂现象基本消失。

图4 CH质量分数分布云图Fig.4 Mass fraction distribution of CH
为分析上述现象产生的原因,图5 给出了不同O3浓度体条件下燃料的点火延迟时间。可见,随着射流燃料中O3浓度的增加,点火延迟时间逐渐缩短,并且这种效应在低温点火条件下更为明显。点火延迟时间的缩短使得算例1~算例5中的燃料在靠近喷嘴处被氧化,燃烧反应在空间上向来流方向发展。

图5 O3浓度对点火延迟时间的影响Fig.5 The influence of O3 concentration on ignition delay time
为明确O3对甲烷氧化反应的影响,以算例0 和算例5为例开展甲烷氧化敏感性分析,其结果如图6所示。可以看出,O3的加入使得算例5 中甲烷氧化对H+CH4=CH3+H2和O+CH4=OH+CH3的敏感性系数略有增加,并且算例0和算例5对甲烷氧化最为敏感的反应均为OH+CH4=CH3+H2O。针对这一现象,图7 给出了OH+CH4=CH3+H2O 反应速率和OH 自由基浓度在对称轴上的分布情况。如图所示,随着O3浓度的增加,该反应在更加靠近喷嘴处发生,即甲烷的氧化反应会更早进行。这是由于O3的强氧化性使得OH 自由基浓度有所升高并更早生成,从而使得燃料燃烧的氧化区提前。然而值得指出的是,随着O3浓度的增加,反应OH+CH4=CH3+H2O的最大反应速率会有所降低。其主要原因是,O3浓度增加使得甲烷氧化反应提前,后方甲烷浓度降低。此外,在本文所研究的O3浓度范围内,少量O3的加入即可使燃烧反应的氧化区向来流方向移动,且OH 自由基最大浓度略有增加,但随着O3浓度的继续增加,氧化区移动现象和OH自由基最大浓度变化不再显著。
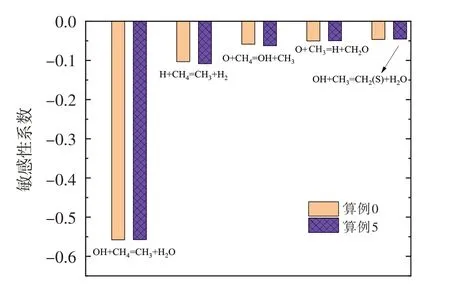
图6 算例0和算例5的甲烷氧化敏感性分析结果Fig.6 Sensitive analysis of CH4 oxidation of case 0 and case 5
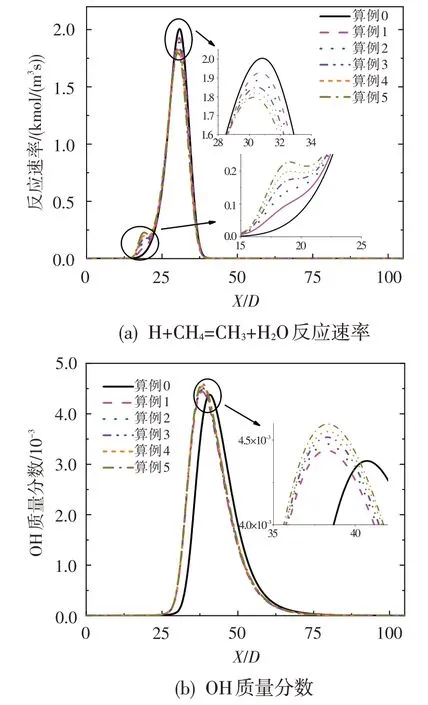
图7 OH+CH4=CH3+H2O反应速率和OH质量分数沿对称轴的分布Fig.7 Reaction rate of OH+CH4=CH3+H2O and OH mass fraction along axis
4.2 O3浓度对典型组分的影响
图8 给出了CO 质量分数沿对称轴的变化规律。可看出,由于O3具有较强的氧化性,射流火焰中加入少量O3即可使CO 提前生成且CO 最大浓度增加,继续加入O3时变化不再明显。此外,O3的加入能降低火焰后方的CO 浓度,但随着O3浓度的增加,火焰后方的CO浓度下降趋势减弱。因此,O3可以强化燃烧,提高燃烧效率并降低CO污染物排放。
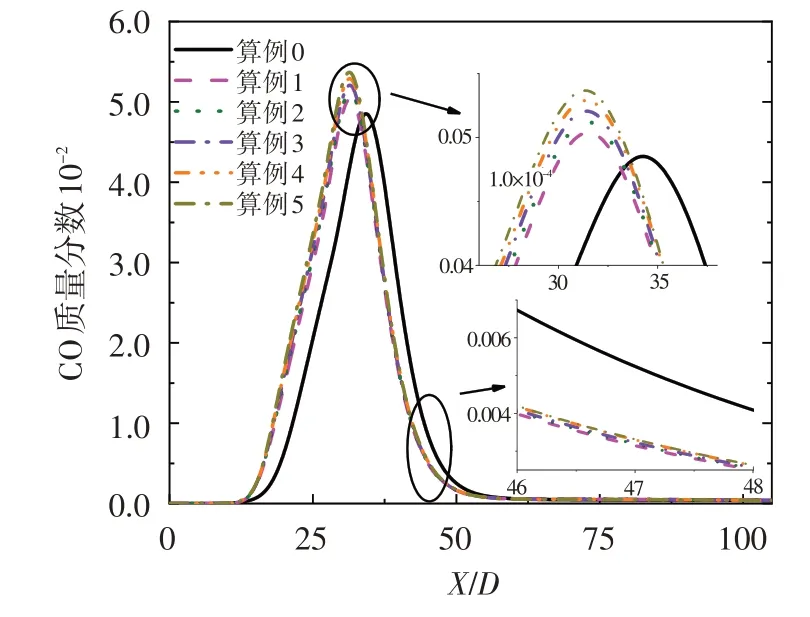
图8 CO质量分数沿对称轴的分布Fig.8 Mass fraction of CO along axis
为分析O3加入对射流火焰中NO 生成的影响,图9 给出了不同算例条件下NO 质量分数和生成速率沿对称轴的分布情况。可以看出,NO生成量和最大生成速率均随着O3浓度的增加而有所上升,并且在本文的研究范围内,NO生成速率增大的趋势会随着O3浓度的增加而减弱。此外,由于O3的加入,在X/D=25 之前的低温燃烧区内,NO 生成的逆反应速率有所增大,并且在X/D=17附近达到最大;同时,随着O3浓度的增加,逆反应速率逐渐增大。
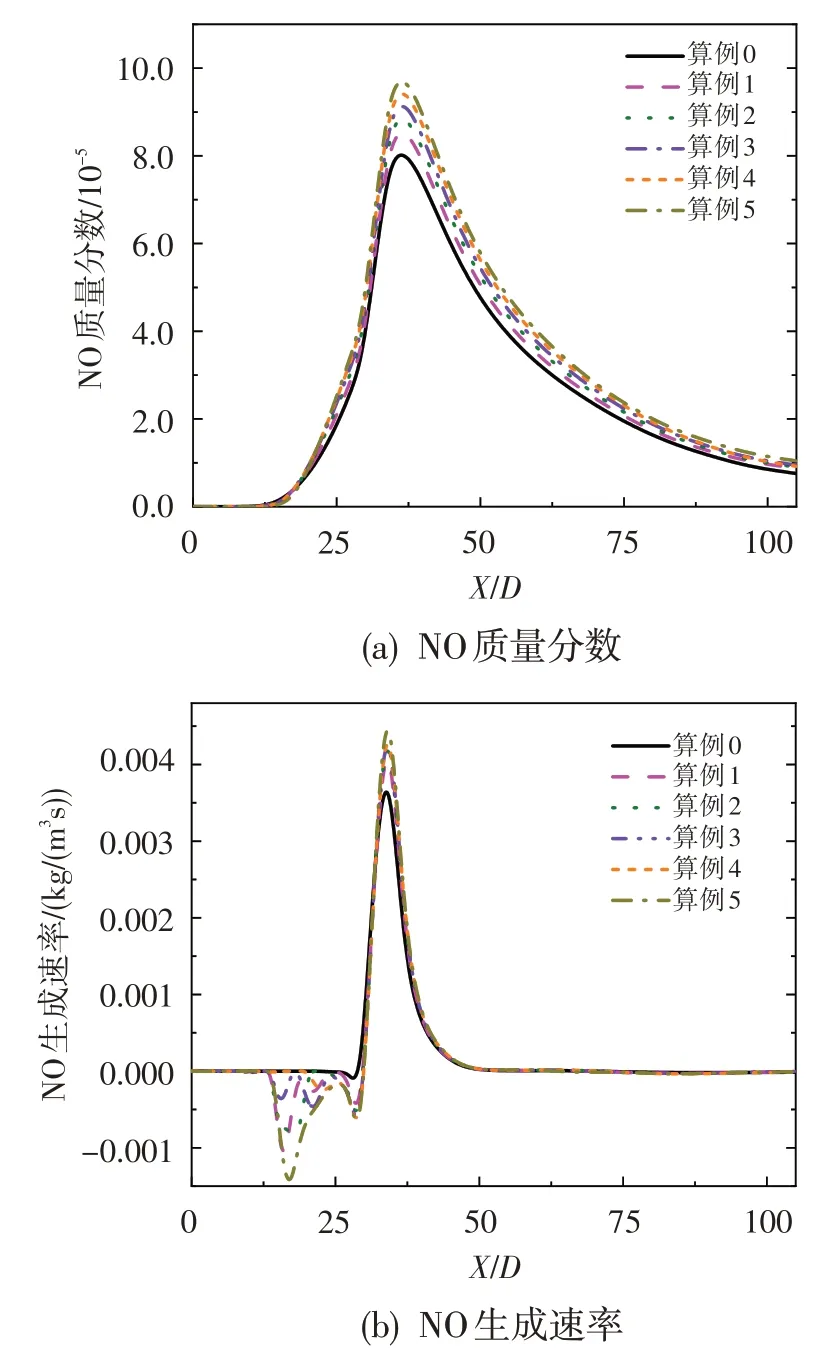
图9 NO质量分数和生成速率沿对称轴的分布Fig.9 Mass fraction of NO and NO production rate along axis
为揭示NO 逆反应速率随O3浓度的变化机理,图10 给出了算例1~算例5 中O3+NO=O2+NO2反应速率沿对称轴的分布情况。如图所示,随着O3浓度的增加,该反应的正反应速率逐渐增大,并且其最大反应速率处恰好对应于图8 中NO 逆反应速率最大处。NO 逆反应速率增大的原因,主要是由于O3的强氧化性将一部分NO转变为了NO2。

图10 O3+NO=O2+NO2反应速率沿轴线的分布Fig.10 Reaction rate of O3+NO=O2+NO2 along axis
由于反应N2+O=NO+N(R1)活化能较大,限制了热力型NO的生成速率,而反应CH+N2=HCN+N(R2)、反应N2+O+(M)=N2O+(M)(R3)分别为NO 生成的快速型机理和N2O 中间体机理的起始反应,限制了快速型NO和N2O中间体NO的生成速率[12]。为明确O3对NO 生成速率的影响,图11 分别给出了上述三个反应在不同O3浓度下反应速率沿轴线的分布,并给出了不同算例下对称轴上温度的变化规律。从图中可以看出,随着O3浓度的增加,对称轴上最高温度略有上升,但温度变化量很小,可认为在本文所研究的范围内,温度对O3浓度变化不敏感。而从反应R1、R2及R3的速率分布看,随着O3浓度的增加,三个反应的反应速率均有所增大,但反应R3的速率变化不明显,即N2O中间体机理对O3不敏感,O3主要促进了热力型NO和快速型NO的生成。对比图11(a)、图10(b)及图7(b)可以看出,O3对热力型NO生成的促进不在于提高燃烧温度,而主要在于O3的氧化性能够使燃烧区域生成较多的中间组分自由基(如OH)从而促进NO的生成。

图11 温度及反应R1、R2、R3沿轴线的分布Fig.11 Temperature and reaction rate of R1,R2 and R3 along axis
虽然燃烧室NOx排放主要为NO,但NO 在大气中又可被氧化为NO2[12],因此明确NO2在火焰后方的生成特性十分必要。图12 给出不同算例下NO2及总NOx(NO+NO2)质量分数沿对称轴的分布情况。对比图12、图9 及图10 可知,NO2占NOx的比例较小,NOx中的主要成分为NO[12];且随着O3浓度的增加,在X/D=25 之前NO 经反应O3+NO=O2+NO2生成NO2的速率加快,进而导致该位置NO2浓度增加。此外,少量O3的加入即可显著增加火焰后方(X/D>50处)NO2生成量,但随着O3的继续加入,火焰后方NO2生成量的增加不再显著。
图13 给出NO2的生成路径图,其中线的粗细表示反应对组分生成或消耗的贡献大小。对比图12、图13可以看出,在NO2浓度达到第一个峰值(X/D=17附近)后,生成的NO2又经反应NO2+H=NO+OH 转化为NO;而在火焰后方,NO 又经反应NO+O+(M)=NO2+M和反应HO2+NO=NO2+OH氧化为NO2。
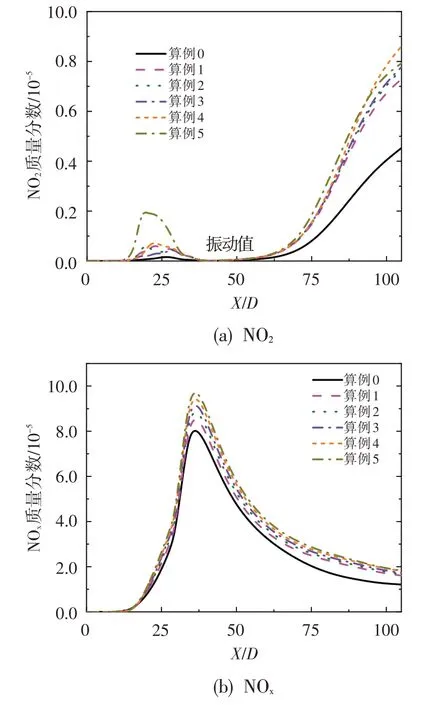
图12 NO2及NOx质量分数沿对称轴的分布Fig.12 Mass fractions of NO2 and NOx along axis
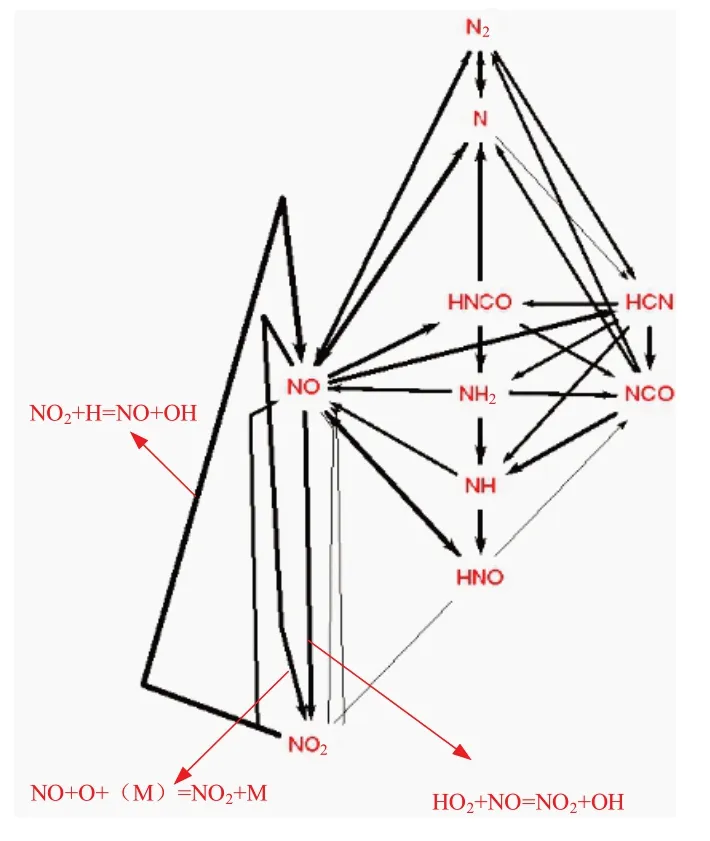
图13 NO2生成路径图Fig.13 NO2 generation path
5 结论
(1)O3可以使燃烧更加稳定,提高燃烧效率并降低CO 排放。在射流燃料中添加O3后,O3的强氧化性使得OH 自由基在更靠近喷嘴的位置处生成,燃烧反应的氧化区提前,导致甲烷氧化反应OH+CH4=CH3+H2O 提早进行,火焰向喷嘴处发展;当射流燃料中O3浓度达到0.6%时,火焰根部断裂现象消失。
(2)O3的加入会增大NO生成速率,且NO生成速率随着O3浓度的增加而逐渐增加。主要原因是O3促进了热力型NO 和快速型NO 的生成,而N2O 中间体机理对O3不敏感;O3主要通过其强氧化性生成较多的自由基(如O、OH)对热力型NO的生成进行贡献,而不是通过温度增加加快反应N2+O=NO+N的反应速率。
(3)O3可以使NO 在低温燃烧区经反应O3+NO=O2+NO2被氧化为NO2,且该反应速率会随着O3浓度的增加而逐渐增大。NO2浓度达到第一个峰值后,生成的NO2又经反应NO2+H=NO+OH 转化为NO;而在火焰后方,NO又经反应NO+O+(M)=NO2+M和反应HO2+NO=NO2+OH氧化为NO2。

