茄子黄萎病研究进展
孙婷婷 赵明辉 李淑敏 胡宝忠 孟令波

摘 要:茄子(Solanum melongena L.)是茄属的第三大栽培作物,在我国各地广泛种植。茄子黄萎病又称凋萎病,俗称“半边疯”,是威胁茄子生产最严重的病害之一,由大丽轮枝菌(Verticillium dahliae Kleb.)引起的一种世界性土传维管束病害,发生普遍,危害严重,可大幅度降低茄子的产量和品质。因此,了解和掌握茄子黄萎病发病症状及其规律,及早预防,以减少它的危害十分必要。笔者围绕近年来在茄子黄萎病发病症状、致病机制、抗黄萎病机制和综合防控等方面的研究成果,论述了茄子黄萎病研究进展,旨在为茄子抗黄萎病分子育种提供借鉴和参考,进而促进我国茄子产业的可持续发展。
关键词:茄子;黄萎病;大丽轮枝菌;抗病机制
中图分类号:S641.1 文献标志码:A 文章编号:1673-2871(2021)04-008-07
Abstract: Eggplant ranks the third most cultivated crop in genus Solanum, which is widely cultivated in China. Eggplant Verticillium wilt is one of most serious disease threatening eggplant production caused by Verticillium dahliae Kleb., a worldwide soil-borne vascular disease, which can cause severe damage, resulting in seriously eggplant reduction of yield and quality. Therefore, it is necessary for us to understand the symptoms and rules of eggplant Verticillium wilt and prevent the pathogen infection early in order to reduce losses. We summarized the recent research progress on the symptom, characteristics, pathogenesis and disease resistance of Verticillium wilt in eggplant, aiming to facilitate molecular breeding of Verticillium wilt resistant cultivar and promote the healthy development of eggplant industry in China.
Key words: Eggplant; Verticillium wilt; Verticillium dahliae; Disease resistance mechanism
茄子(Solanum melongena L.)是世界上重要的茄属蔬菜作物,其地位仅次于马铃薯(S. tuberosum)和番茄(S. lycoperscicum)[1-2]。2018年,全世界茄子产量为5360万t,而我国产量达到3410万t,占世界总产量的63.62% (http://www.fao.org),中国已成为世界上最大的茄子生产国和消费国。随着茄子设施栽培的迅速发展,近年来,茄子黄萎病在我国一些地区发生严重,产量损失为20%~40%,严重影响了茄子产业的发展[3]。茄子黄萎病是由大丽轮枝菌(Verticillium dahliae Kleb.)侵染引起的一种世界性的土传维管束病害,日本曾经大面积暴发茄子黄萎病,导致茄子严重减产 [4];美国也曾因茄子黄萎病,产量损失30%~80%[5]。因茄子黄萎病病原菌存在着不同的生理小种(大丽轮枝菌生理小种race 1、race 2),其微菌核在土壤中存活可达数年,防治难度大,是危害茄子的三大病害之一,可大幅度降低茄子的产量和品质。近几年,有关茄子黄萎病的研究主要集中在抗病种质选育、抗性基因筛选鉴定等方面,相比于茄科其他作物,茄子黄萎病的研究进展缓慢。笔者就茄子黄萎病研究动态进行综述,并对未来茄子黄萎病研究方向进行展望,以期为今后茄子黄萎病抗病育种提供理论参考。
1 茄子黄萎病发病症状
茄子黄萎病病原菌从茄子根部侵染,自下而上或从一边向全株发展,最终可导致全株枯萎死亡(图1-A)。茄子黄萎病很少在苗期发病,多在门茄坐果后表现出症状。发病初期只有部分组织出现萎蔫等症状,茄子靠近底部的叶片叶缘及叶脉间开始发黄(图1-B~C),慢慢发展为半叶或整叶变黄,叶缘部卷曲,有时感病植株仅限于半边叶片发病,引起叶片歪曲,因此该病也被称为“半边疯”。病株在高温干旱时呈萎蔫状态,夜晚或阴雨天可恢复,后期随着病情发展,全叶变褐、萎蔫枯死,严重时病株叶片下垂或脱落。發病植株矮小、萎缩,果实较小,纵切根茎部,可见木质部维管束变褐(图1-D~E)[6-8]。
2 茄子黄萎病致病机制
黄萎病的致病机制目前主要有两种学说:堵塞学说和毒素学说。堵塞学说认为由于病原菌的菌丝和孢子在导管中大量繁殖,刺激周围细胞产生侵填体等物质从而堵塞导管,使水分、养分运输发生困难,最终导致寄主植物死亡[9]。毒素学说则认为病原菌在侵染寄主植物时产生了有毒物质致使植物萎蔫死亡。而一些学者在两种学说的基础上,提出了黄萎病的致病机制可能是木质部导管堵塞和病原菌产生毒素共同作用的结果[10-12]。
2.1 病原菌
我国茄子黄萎病的病原菌主要为大丽轮枝菌,隶属于子囊菌门(Ascomycota)、粪壳菌纲(Sordariomycetes)、围小丛壳菌目(Glomerellales)、皱褶球壳菌科(Plectosphaerellaceae)、轮枝菌属(Verticillium)[13]。大丽轮枝菌在培养基上培养可见白色或淡白色菌丝(图1-F),分生孢子梗细长、直立,呈轮状分枝,轮状枝1~4层(图1-I、1-J),每轮有3~5个小分枝。分生孢子着生于分枝顶端,长卵圆形,无色,单胞,大小3~5 μm。菌丝后期可形成抗逆性很强的休眠体——黑色微菌核(图1-H),环境条件适宜时微菌核萌发出菌丝(图1-G)从茄子根部进行侵染和繁殖。迄今为止仍未见大丽轮枝菌有性态的报道[14]。
2.2 病原菌侵染循环
茄子黄萎病是一种世界性的土传维管束病害,大丽轮枝菌主要以微菌核、厚垣孢子、休眠的菌丝体等形态在土壤、植物病残体中越冬,这些休眠体可作为第二年的初侵染源在条件适宜时萌发,萌发后的菌丝受寄主植物根系分泌物的影响而延伸到根系表面,大丽轮枝菌便进入侵入阶段。研究表明,大丽轮枝菌可以定殖在根部任何位置[15],潜在的侵入位点也可能是侧根的萌发处[16]。许多病原真菌在穿透完整植物表皮细胞的过程中形成了相应的侵染结构,主要包括附着胞、侵入钉等[17]。当大丽轮枝菌成功侵入寄主植物的表皮细胞后,菌丝向维管束方向扩展。随着侵染的逐渐深入,菌丝大量繁殖并产生分生孢子,在蒸腾作用下分生孢子从根部随着汁液流向植物的茎叶,首先在寄主叶片上观察到萎蔫等症状,最终可导致全株枯萎死亡。病原菌留存在寄主体内或土壤中,进入下一个侵染循环。
田间茄子黄萎病主要靠风雨、灌溉以及农事操作等途径进行传播。设施栽培尤其常年连作有利于病原菌的积累。此外,温度、湿度等也是决定茄子黄萎病发生的重要因素[18]。该病发病的适宜温度为23~26 ℃,低于23 ℃则发病缓慢,高于35 ℃则出现隐症,最适菌丝生长的pH为6.0~7.0。湿度大、土壤板结黏重的地块发病重;土壤疏松、有机质丰富、通风效果好的地块则发病轻。
2.3 病原菌致病相关基因研究进展
目前,部分学者认为病原菌大丽轮枝菌主要依靠分泌到细胞外的毒素,如细胞壁降解酶与效应因子等在植物侵染与致病过程中发挥功能。其中细胞壁降解酶类(cell-wall-degrading enzymes,CWDEs)被认为是决定病原菌能否成功侵入寄主植物的重要因素,Klosterman等[19]研究发现在大丽轮枝菌基因组中存在大量与植物细胞壁降解酶类相关的基因。CWDEs在大丽轮枝菌侵染过程中主要发挥两个功能,一是降解寄主植物细胞壁有助于病原菌侵染 ;二是降解的细胞壁多糖可为病原菌提供营养[20]。研究表明,在大丽轮枝菌侵染植物时,CWDEs相关基因表达量明显上升,而将CWDEs合成相关的基因突变或敲除后,大丽轮枝菌降解纤维素能力以及致病力均降低[21-23]。由此可见,CWDEs在大丽轮枝菌侵染过程中发挥重要的作用。
效应因子由病原菌分泌,可以调控植物的免疫防御,在真菌与植物的互作过程中发挥重要作用[24]。近年来,一些大丽轮枝菌的效应因子相继被发现,如 JONGE等[25]在大丽轮枝菌生理小种 race 1 中分离得到一个效应因子Ave1,该效应因子被番茄细胞表面受体识别后,可介导番茄对 race 1的抗性;Castroverde等[26]通过在烟草中稳定表达 Ave1,可诱导植物防御相关基因的表达。Liu等[27]在大丽轮枝菌中发现一类缺乏信号肽的效应因子Vd Isc1,可通过抑制植物SA 的产生进而辅助大丽轮枝菌的侵染。Kombrink等[28]在大丽轮枝菌中发现一类效应因子Lys M,可结合在真菌细胞壁几丁质上,防止病原菌在侵染寄主时自身细胞壁被植物几丁质酶降解,Lys M被敲除后,大丽轮枝菌的致病力降低。
此外,一些与大丽轮枝菌营养代谢调控及生长发育相关的基因被敲除后也会影响大丽轮枝菌的致病力。如参与大丽轮枝菌细胞壁合成的Vd NRS/ER[29]、参与维生素B1运输的Vd Thit[30]、参与菌丝生长与孢子产生的Vd Sge1[31]等基因被敲除后均影响大丽轮枝菌的致病力。
3 茄子抗黄萎病研究进展
3.1 茄子抗黄萎病的生理机制
寄主植物受病原菌侵染后会产生一系列生理生化反应。通常首先是细胞膜透性的改变和電解质的渗漏,继而出现呼吸作用和光合作用的变化。一般认为感病植物呼吸作用增强,涉及生物合成速度加快、氧化磷酸化作用的解偶联、末端氧化酶系统的变化以及线粒体结构的破坏等复杂机制;而光合作用减弱主要是由于病原菌破坏了绿色组织,减少了光合作用面积。此外,当病原菌入侵植株后,寄主植株则会在细胞或组织水平上发生形态结构的变化,如表皮木质化、内部组织木栓化或者形成胶状物、侵填体等阻塞导管。研究表明,黄萎病病原菌侵入茄子茎内木质部导管之后,随即诱导茄子产生富含β-1,3-葡聚糖的球状结构,积淀于游离的纤维素、果胶、葡萄糖苷等构成的基质上,形成封闭位点,阻止大丽轮枝菌菌丝体继续生长[32]。
茄子除在细胞或组织水平上发生形态结构的变化以限制黄萎病病原菌的入侵外,体内与抗病防御相关的酶,如过氧化物酶(POD)、苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)等[33]活性也会相应增强。此外还会合成抗病相关蛋白、植物抗毒素萜类或多酚类等一些抗菌活性物质[34]。
3.2 茄子抗黄萎病相关基因研究进展
由大丽轮枝菌引起的茄子黄萎病会造成重大经济损失。但迄今为止,人们对该病的致病机制了解得尚不透彻。茄科作物中最早对抗黄萎病基因工程取得突破性进展的是番茄。早在1951年,Schaible等[35]就报道了有关番茄抗黄萎病的基因Ve,并证实其对大丽轮枝菌具有抗性。而有关茄子抗黄萎病相关基因的研究起步较晚,Fei等[36]采用 RACE 技术从野生茄子托鲁巴姆Solanum torvum中克隆到StVe基因,全长3640 bp(登录号为 AY311527),StVe与番茄Ve基因在核酸水平上具有较高的同源性。史仁玖等[37]也通过 RT-PCR和RACE技术从S. torvum中扩增克隆到1个含有3153 bp开放阅读框的抗黄萎病基因StoVe1,该基因编码的蛋白序列具有很强的功能区段保守性。陈玉辉等[38]研究发现,转StVe基因的番茄叶片总可溶性蛋白可抑制大丽轮枝菌生理小种1的生长。2011年,王忠等[39]从S. torvum中克隆鉴定到了StDAHP、Strp116、Stcyp450等12个黄萎病抗性基因,其中的StDAHP可编码生成莽草酸途径的关键酶DAHP,并通过激发相关酶的活性来提高S. torvum对大丽轮枝菌的抗性。
近年来,有关miRNA参与茄子黄萎病防卫反应的研究也取得了一定进展。Yang等[40]用大丽轮枝菌诱导茄子后发现6个miRNA家族出现了显著差异表达,包括miR93和miR482。其中miR93参与对大丽轮枝菌的抗性主要通过负调控靶基因TIR1参与泛素降解途径;获得的miR482e过表达马铃薯植株较野生型对大丽轮枝菌更为敏感。牟小颖[41]以茄子miR395为研究对象,通过对大丽轮枝菌胁迫下的表达模式、转基因茄子的抗病性以及相关生理生化等指标进行分析,探究了miR395茄子在抗黄萎病中的作用,结果发现miR395的表达与其预测靶基因的表达呈负相关,且过表达miR395的转基因植株对大丽轮枝菌的侵染变得更敏感,说明miR395通过负调控其靶基因来参与对病原菌的防卫反应。刘新儒[42]在感染黄萎病的茄子中新发现了一个miRNA miRm0002,长度为21 bp,其受黄萎病菌诱导后上调表达,为进一步验证miRm0002的功能,构建了miRm0002过表达和抑制表达转基因茄子株系,进一步对抗病防卫生理指标进行了分析,结果表明,miRm0002可能通过抑制生长素信号通路来参与茄子对黄萎病的防卫反应。
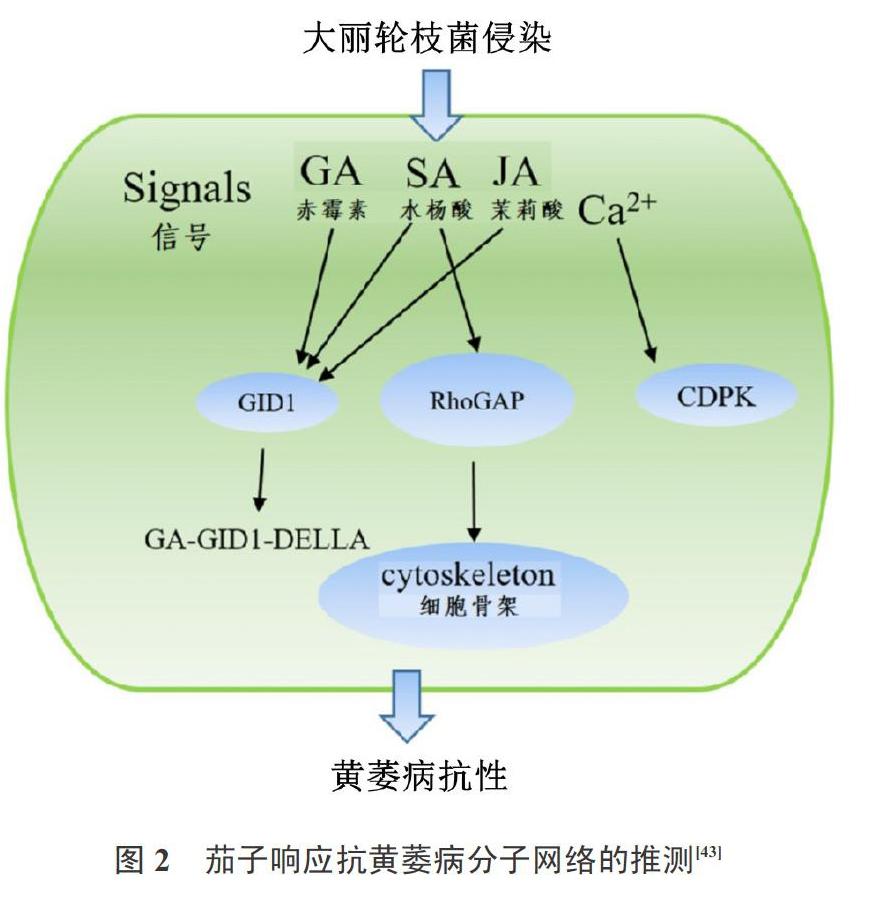
为进一步揭示茄子抗黄萎病的分子机制,Yang等[43]分别测定了大丽轮枝菌侵染6 、12 、24 和48 h的茄子转录组,结果表明大丽轮枝菌侵染6~48 h和对照相比共有111个共同的差异表达基因,且大多数的差异表达基因富集于“信号转导”。此外作者推测了茄子响应抗黄萎病的分子网络(图2),表明多个信号途径(包括GA、JA、SA和Ca2+)共同参与茄子黄萎病的防卫响应,且信号途径间的相互作用可能对茄子抗黄萎病有重要影响。
<\\LENOVO-FAN\fapai\中国瓜菜\2021-4期-定稿\2021-4期-莹莹1\Image\image2.jpeg>
图2 茄子响应抗黄萎病分子网络的推测[43]
4 茄子黄萎病防控研究进展
4.1 抗性品种选育
通过选育抗病的茄子品种防治茄子黄萎病,被国内外科研工作者和茄子种植户认为是当前最经济的措施。刘厚忠、李烨[44]以日本丸种株式会社墨染茄为母本,以黑龙江龙茄1号为父本育成早熟茄子一代杂种——哈茄V8,植株长势强,抗倒伏,中抗黄萎病。杨爱国等[45]以自交系Ly09-1为母本、自交系Ly06-6为父本选育而成的杂交1代中熟青茄品种洛茄5号,商品价值高,田间种植可抗多种真菌病和病毒病。此外,长茹1号、吉茄1号、鲁茄1号、辽茄3号、长茹3号、驻茄11号等品种均较为抗病[46]。
4.2 嫁接防治
由于茄子黄萎病菌主要从寄主植物的根部侵入,因此采用嫁接技术防治茄子黄萎病是最为有效的措施之一[47]。冯东昕等[48]以5种野生茄品种为嫁接砧木,以栽培种七叶茄为接穗,研究了嫁接对茄子黄萎病抗性及农艺性状的影响,结果表明嫁接苗的农艺性状均优于自根苗,但抗病性存在差异,其中以粘毛茄和野生茄托鲁巴姆为砧木嫁接的茄子对黄萎病的抗性最强。张淑红等[49]以茄子根际土壤为试验材料,以托鲁巴姆为砧木,以感病品种西安绿茄为接穗,利用 Biolog技术研究嫁接和接种黄萎病菌对茄子根际土壤微生物群落结构的影响。结果表明:嫁接可提高茄子根际土壤微生物活性,并增强对碳源的利用能力,使茄子根际土壤微生物分布均匀;接种黄萎病菌后可丰富茄子根际土壤微生物的多样性。
4.3 化学药剂防治
目前,茄子黄萎病的防控仍以化学防治为主,使用较多的为土壤熏蒸剂或真菌杀菌剂,通过减少土壤内病原菌微菌核的数量来进一步控制该病的发生[50]。一些学者通过田间药效试验筛选出对茄子黄萎病具有一定防治效果的过氧乙酸、过氧化氢、水杨酸等药劑,并且对茄子根系活力有促进作用,对根际微生物及其动态变化有显著的影响[18]。但化学防治方法如若使用不当可对植物产生药害,导致病原物产生抗药性,且易破坏土壤微生物多样性,农药的高残留还可造成环境污染。茄子属于鲜食蔬菜,在采用化学方法防控黄萎病时一定要慎重。
4.4 生物防治
生物防治是指利用有益生物或其产物来防控有害生物的一种方法。由于其具有对人畜无害、对环境友好等特点,近年来逐渐成为研究热点。目前生物防治茄子黄萎病主要利用大丽轮枝菌的拮抗微生物,包括真菌(木霉、曲霉、镰刀菌、丛枝菌根真菌)、细菌(芽孢杆菌、黄色孢杆菌、棒状杆菌等)、放线菌(链霉菌)等[51]。
朱廷恒等[52]研究表明,木霉菌株T97对大丽轮枝菌有较强的生长竞争优势,用T97的培养物处理土壤,对茄子黄萎病的防治效果为66%~81%。林多多等[53]试验结果表明,枯草芽孢杆菌产生的挥发性物质对大丽轮枝菌丝生长具有较强的抑制作用。林玲等[54]分离筛选到6株对大丽轮枝菌具有强拮抗活性的内生细菌,盆栽试验发现其中3个菌株对茄子黄萎病的防治效果在80%以上。朱海霞等[55]研究发现放线菌菌株SC11和SE2的菌体、发酵液和发酵滤液对黄萎病菌有显著的抑制作用;菌株组合对茄子黄萎病防效显著,防治效果达到 71.48%。张宁等[56]在陕西采集土样中分离筛选到对黄萎病菌抑制性较好的17个菌株,其中抑菌活性最高可达90%。郑继东等[57]研究结果表明:接种丛枝菌真菌(AMF)不仅可以促进茄子生长,而且还能有效降低茄子黄萎病的发病率。
5 展 望
茄子是深受大众喜爱的蔬菜之一,近年来栽培品种单一、过度连作以及设施栽培环境不良等因素导致茄子黄萎病的频繁发生和蔓延,严重影响了我国茄子产业化、规模化的发展趋势,降低了茄子的产量和品质,造成了重大经济损失。虽然我国在茄子黄萎病防治研究方面已取得阶段性进展,但与番茄、马铃薯、棉花等作物相比还存在较大差距。
在自然界中,植物和病原菌共同进化,因此,茄子黄萎病的研究应着手于病原菌和寄主两个层面。随着茄子基因组测序成功[58]以及抗病分子生物学的发展,茄子与病原菌互作的分子机制逐渐成为研究热点,相信茄子与病原菌互作机制将被揭示。此外,生物防治具有无污染、安全环保等特点,在茄子黄萎病防治中推广应用潜力巨大,应大力加强生防制剂的研发。
参考文献
[1] XU X,PAN S K,CHENG S F,et al.Genome sequence and analysis of the tuber crop potato[J].Nature,2011,475:189-195.
[2] SATO S,TABATA S,HIRAKAWA H,et al.The tomato genome sequence provides insights into fleshy fruit evolution[J].Nature,2012,485(7400):635-641.
[3] 李怀芳,刘凤权,黄丽丽.园艺植物病理学[M].2版.北京:中国农业大学出版社,2009.
[4] HASHIMOTO K.Studies on Verticillium wilt of eggplant[J].Bulletin of Saitama Horticultural Experiment Station,1989,2(3):110.
[5] CICCARESE F,AMENDUNI M,CHIAVONE D,et al.Effect of Verticillium wilt on the yield of susceptible and “slow wilting” resistant eggplants in the field[J].Phytopathologia Mediterranea,1994,33(3):212-216.
[6] FRADIN E F,THOMMA B P H J.Physiology and molecular aspects of Verticillium wilt diseases caused by V.dahliae and V.alboatrum[J].Molecular Plant Pathology,2006,7(2):71-86.
[7] 胡建坤,黄蓉,方荣,等.茄子黄萎病苗期人工接种技术研究[J].江西农业大学学报,2017,39(6):1131-1138.
[8] MAHESH H M,MURALI M,PAL M A C,et al.Salicylic acid seed priming instigates defense mechanism by inducing PR-Proteins in Solanum melongena L.upon infection with Verticillium dahliae Kleb[J].Plant Physiology and Biochemistry,2017,117:12-23.
[9] BENHAMOU N.Ultrastructural and cytochemical aspects of the response of eggplant parenchyma cells in direct contact with Verticillium-infected xylem vessels[J].Physiological and Molecular Plant Pathology,1995,46(4):321-338.
[10] PEGG G F.Phytotoxin production by Verticillium alboatrum Reinke et Berthold[J].Nature,1965,208:1228-1229.
[11] 陈旭升,陈永萱,黄骏麒.黄萎病菌致萎毒素引起棉苗维管系统变化的电镜观察[J].棉花学报,1998,10(2):3-5.
[12] 房卫平,祝水金,季道藩.棉花黄萎病菌与抗黄萎病遗传育种研究进展[J].棉花学报,2001,13(2):116-120.
[13] 庞叶洲.大丽轮枝菌侵染对茄子幼苗生理特性及基因表达的影响[D].杭州:浙江大学,2019.
[14] 刘晶晶.茄子黄萎病病原菌分化、检测及生物防治的研究[D].杭州:浙江大学,2019.
[15] PRIETO P,NAVARRO-RAYA C,VALVERDE-CORREDOR A,et al.Colonization process of olive tissues by Verticillium dahliae and its in planta interaction with the biocontrol root endophyte Pseudomonas flurescens PICF7[J].Microbial Biotechnology,2009,2(4):499-511.
[16] ZHANG W W,JIANG T F,CUI X,et al.Colonization in cotton plants by a green fluorescent protein labelled strain of Verticillium dahliae[J].European Journal of Plant Pathology,2013,135(4):867-876.
[17] ZHAO Y L,ZHOU T T,GUO H S.Hyphopodium-specific vdNoxB/VdPls1-dependent ROS-Ca2+ signaling is required for plant infection by Verticillium dahliae[J].PLos Pathogens,2016,12(7):e1005793.
[18] 唐保宏.茄子黃萎病系统诱导抗性机理及应用技术研究[D].沈阳:沈阳农业大学,2003.
[19] KLOSTERMAN S J,SUBBARAO K V,KANG S,et al.Comparative genomics yields insights into niche adaptation of plant vascular wilt pathogens[J].PLos Pathogens,2011,7(7):e1002137.
[20] LIU S Y,CHEN J Y,WANG J L,et al.Molecular characterization and functional analysis of a specific secreted protein from highly virulent defoliating Verticillium dahliae[J].Gene,2013,529(2):307-316.
[21] MARUTHACHALAM K,KLOSTERMAN S J,KANG S,et al.Identification of pathogenicity-related genes in the vascular wilt fungus Verticillium dahliae by Agrobacterium tumefaciens-mediated T-DNA insertional mutagenesis[J].Molecular Biotechnology,2011,49(3):209-221.
[22] EBOIGBE L,TZIMA A K,PAPLOMATAS E J,et al.The role of the beta-1,6-endoglucanase gene vegB in physiology and virulence of Verticillium dahliae[J].Phytopathologia Mediterranea,2014,53(1):94-107.
[23] CHEN J Y,XIAO H L,GUI Y J,et al.Characterization of the Verticillium dahliae exoproteome involves in pathogenicity from cotton-containing medium[J].Frontiers in Microbiology,2016,7:01709.
[24] STERGIOPOULOS I,DE WIT P J G M.Fungal effector proteins[J].Annual Review of Phytopathology,2009,47:233-263.
[25] DE JONGE R,BOLTON M D,KOMBRINK A,et al.Extensive chromosomal reshuffling drives evolution of virulence in an asexual pathogen[J].Genome Research,2013,23(8):1271-1282.
[26] CASTROVERDE C D M,NAZAR R N,ROBB J.Verticillium Ave l effector induces tomato defense gene expression independent of Ve1 protein[J].Plant Signaling & Behavior,2016,11(11):el245254.
[27] LIU T L,SONG T Q,ZHANG X,et al.Unconventionally secreted effectors of two filamentous pathogens target plant salicylate biosynthesis[J].Nature Communications,2014,5:4686.
[28] KOMBRINK A,ROVENICH H,SHI-KUNNE X Q,et al.Verticillium dahliae LysM effectors differentially contribute to virulence on plant hosts[J].Molecular Plant Pathology,2017,18(4):596-608.
[29] SANTHANAM P,BOSHOVEN J C,SALAS O,et al.Rhamnose synthase activity is required for pathogenicity of the vascular wilt fungus Verticillium dahliae[J].Molecular Plant Pathology,2017,18(3):347-362.
[30] HOPPENAU C E,VAN-TUAN T,KUSCH H,et al.Verticillium dahliae VdTHI4,involved in thiazole biosynthesis,stress response and DNA repair functions,is requred for vascular disease induction in tomato[J].Environmental and Experimental Botany,2014,108(S1):14-22.
[31] SANTHANAM P,THOMMA B P H J.Verticillium dahliae Sge1 differentially regulates expression of candidate effector genes[J].Molecular Plant-Microbe Interactions,2013,26(2):249-256.
[32] BENHAMOU N.Ultrastructural and cytochemical aspects of the response of eggplant parenchyma cells in direct contact with Verticillium-infected xylem vessels[J].Physiological and Molecular Plant Pathology,1995,46(4):321-338.
[33] 赵明敏,刘正坪,胡俊.茄子黄萎病菌毒素对茄子体内几种酶活性的影响[J].华北农学报,2003,18(2):70-73.
[34] FRADIN E F,THOMMA B P H J.Physiology and molecular aspects of Verticillium wilt diseases caused by V. dahliae and V. alboatrum[J].Molecular Plant Pathology,2006,7(2):71-86.
[35] SCHAIBLE L,CANNON O S,WADDOUPS V.Inheritance of resistance to Verticillium wilt in a tomato cross[J].Phytopathology,1951,41(10):986-990.
[36] FEI J,CHAI Y R,WANG J,et al.cDNA cloning and characterization of the Ve homologue gene StVe from Solanum torvum Swartz[J].DNA Sequence,2004,15(2):88-95.
[37] 史仁玖,殷玥,王忠,等.野生茄子(Solanum torvum)抗黄萎病相关基因 Sto Ve1 的克隆与分析[J].植物生理学通讯,2006,42(4):638-642.
[38] 陈玉辉,赵凌侠,柴友荣,等.抗黄萎病基因 StVe 转化番茄的研究[J].园艺学报,2008,35(5):693-700.
[39] 王忠,楊清.黄萎病菌胁迫下野生茄子托鲁巴姆防卫反应的生理生化分析[J].中国生物工程杂志,2011,31(7):65-71.
[40] YANG L,JUE D W,LI W,et al.Identification of miRNA from eggplant(Solanum melongena L.)by small RNA deep sequencing and their response to Verticillium dahliae infection[J].PLos One,2013,8(8):e72840.
[41] 牟小颖.茄子黄萎病防卫反应相关miR395的功能研究[D].南京:南京农业大学,2015.
[42] 刘新儒.miRm0002在茄子对黄萎病防卫反应中的功能研究[D].南京:南京农业大学,2017.
[43] YANG X,ZHANG Y,CHENG Y F,et al.Transcriptome analysis reveals multiple signal network contributing to the Verticillium wilt resistance in eggplant[J].Scientia Horticulturae,2019,256:108576.
[44] 刘厚忠,李烨.茄子新品种哈茄V8的选育[J].中国蔬菜,2018(3):72-74.
[45] 杨爱国,朱永,霍红,等.高产抗病茄子新品种‘洛茄5号的选育[J].中国瓜菜,2019,32(11):80-82.
[46] 王勇,姜俊,赵红星,等,茄子新品种驻茄11号的选育[J].中国蔬菜,2018(12):75-77.
[47] 周宝利,刘娜,叶雪凌,等.嫁接茄子根系分泌物变化及其对黄萎菌的影响[J].生态学报,2011,31(3):749-759.
[48] 冯东昕,李宝栋,马宾生,等.嫁接对茄子黄萎病的抗性及某些生物学性状的影响[J].中国蔬菜,2000(4):13-15.
[49] 张淑红,詹林玉,王月,等.托鲁巴姆与西安绿茄嫁接对茄子根际土壤微生物群落结构的影响[J].沈阳农业大学学报,2018,49(2):196-202.
[50] 姚小桐.生物熏蒸结合枯草芽孢杆菌防控茄子黄萎病及对土壤养分影响[D].哈尔滨:东北农业大学,2018.
[51] BERG G,BALLIN G.Bacterial antagonists to Verticillium dahliae Kleb.[J].Journal of Phytopathology,1994,141:99-110.
[52] 朱廷恒,邢小平,孙顺娣.木霉T97菌株对几种植物病原真菌的拮抗作用机制和温室防治试验[J].植物保护学报,2004,31(2):139-144.
[53] 林多多,居正英,王明江,等.茄子黄萎病生防内生细菌Jaased1 产生的抑菌物质特性初步分析[J].江苏农业科学,2009(6):153-156.
[54] 林玲,乔勇升,周益军,等.茄子黄萎病生防内生细菌的筛选、鉴定及胞外抗菌物质的特性[J].中国生物防治,2010(S1):40-46.
[55] 朱海霞,马永强,卢蒙,等.不同生防放线菌组合防治枯、黄萎病研究[J].西北农林科技大学学报(自然科学版),2009,37(7):153-159.
[56] 张宁,韩立荣,孙平平,等.拮抗茄子黄萎病菌土壤放线菌的分离筛选和鉴定[J].植物保护学报,2012,39(2):109-114.
[57] 周宝利,郑继东,毕晓华,等.丛枝菌根真菌对茄子黄萎病的防治效果和茄子植株生长的影响[J].生态学杂志,2015,34(4):1026-1030.
[58] HIRAKAWA H,SHIRASAWA K,MIYATAKE K,et al.Draft genome sequence of eggplant(Solanum melongena L.):the representative Solanum species indigenous to the old world[J].DNA Reserach,2014,21(6):649-660.

