大豆分离蛋白-灵芝孢子油乳状液体系构建及其稳定性研究
范 祺,张 明,张博华,王崇队,杨立风,孟晓峰,马 超
(中华全国供销合作总社济南果品研究院,山东济南 250014)
灵芝孢子油是从灵芝孢子中提取的脂质活性物质,主要化学成分为不饱和脂肪酸、灵芝三萜类、灵芝酸、灵芝多糖、蛋白质、氨基酸等,有抗肿瘤、调节免疫力、保护神经系统、降血脂、防治白血病、保肝护肝等活性,具有很高的药用价值[1-2]。虽然灵芝孢子油中不饱和脂肪酸含量高,但在自然环境下极易被氧化。受光照、温度、氧气等因素的影响,灵芝孢子油中的活性物质被氧化后,会产生有害物质,严重降低灵芝孢子油的保健功效[3-4]。
乳状液体系在包埋、保护、运载、成本和生物相容度方面具有独特的优势[5],如将不饱和脂肪酸作为油相,既能提高乳状液的营养价值,也能提高不饱和脂肪酸的抗氧化性[6]。大豆分离蛋白是一种良好的乳化剂,具有亲水亲油平衡特性,在溶液中可迅速分散在油水界面上,通过结构变化重新排布,形成凝胶化界面层保持乳液稳定[7]。大豆分离蛋白制备的乳状液可以有效包埋DHA、鱼油、肉桂精油等[8-10]。大豆异黄酮、茶多酚、抗坏血酸的抗氧化作用可应用于肉制品加工、油脂储藏及焙烤食品、乳制品、油炸食品的制作,也可用于各种饮料的配制,添加了抗氧化剂的乳状液具有良好的稳定性[11]。
本文利用大豆分离蛋白的乳化特性构建水包油型乳状液,将灵芝孢子油作为油相包埋在内部,研究大豆分离蛋白和油浓度对乳状液体系稳定性的影响;同时添加大豆异黄酮、茶多酚和抗坏血酸等几种常用的抗氧化剂,通过储藏试验,以过氧化值为指标,研究乳状液的抗氧化稳定性,以期获得稳定性强、抗氧化效果好的大豆分离蛋白-灵芝孢子油乳状液体系,为灵芝孢子油在食品保健领域的应用及液体口服类产品的开发提供理论支持。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(纯度>90%),索莱宝试剂公司;灵芝孢子油,浅黄色液体,CO2超临界萃取所得,购于冠县合作社;大豆异黄酮、儿茶素、抗坏血酸(纯度均≥98%),购于阿拉丁试剂公司;无水乙醇、十二烷基硫酸钠、甲醇、盐酸、氢氧化钠等试剂,均为分析纯,购于上海生工股份有限公司。
1.2 仪器与设备
AH 2100 型高压均质机,美国安拓思有限公司;高速剪切乳化均质仪,德国艾卡有限公司;UV1000 紫外-可见分光光度计,上海天美科学仪器有限公司;NanoBrook Omni 粒径分析仪,配备Zeta 电位测量选件,美国布鲁克海文仪器公司;ME104 电子天平,梅特勒-托利多仪器有限公司;BSC-150 恒温培养箱,上海博讯实业有限公司医疗设备厂。
1.3 试验方法
1.3.1 乳状液的制备
将大豆分离蛋白溶解于水中,室温下缓慢搅拌1 h使蛋白质充分溶解,将pH 值调至7.0,配制质量分数4%(g/g,下同)的大豆分离蛋白母液,放入4 ℃冰箱保存备用。将大豆分离蛋白母液与灵芝孢子油按一定比例混合,并加入一定质量的抗氧化剂(大豆异黄酮、茶多酚、抗坏血酸),使体系质量达到100 g。通过高速剪切乳化均质仪以10 000 r/min 的转速剪切1 min 制成粗乳液,再用高压均质机在500 bar、4 ℃条件下均质3 次制备乳状液。
1.3.2 大豆分离蛋白浓度、油浓度对乳状液性质的影响
油浓度为0.5%,大豆分离蛋白浓度设置为0.1%、0.2%、0.5%、1.0%、2.0%,测定乳状液的粒径分布、ζ-电位、离心稳定性,考察蛋白浓度对乳状液的影响。
大豆分离蛋白浓度为0.5%,油浓度设置为0.1%、0.2%、0.5%、1.0%、2.0%,测定乳状液的粒径分布、ζ-电位、离心稳定性,考察油浓度对乳状液的影响。所有样品均进行3 次重复。
1.3.3 乳状液储藏过程中的稳定性
将制备好的乳状液(油浓度为0.5%、大豆分离蛋白浓度为0.5%)置于恒温培养箱中(温度设置为25 ℃)储藏10 d,并在第1、2、5、7、10 天测定乳状液的粒径、ζ-电位和过氧化值变化。
1.3.4 乳状液的抗氧化稳定性
对照组为灵芝孢子油加入水中,与水混合,最终油浓度为0.5%。将添加了0.1%质量浓度的抗氧化剂的乳状液和对照组放置于恒温培养箱中(温度设置为25 ℃)储藏10 d,并分别在第1、2、5、7、10 天测定过氧化值。
1.4 测定指标与方法
1.4.1 粒径和ζ-电位的测定
采用动态光散射法(DLS)用于大豆分离蛋白-灵芝孢子油乳状液的表征。取20 μL 乳状液样品,用水溶液稀释100 倍。在25 ℃条件下,激光衍射角为173°、折射指数为1.450,测定样品的粒径分布及ζ-电位。
1.4.2 离心稳定性的测定
在2 mL 离心管中准确加入2 mL 乳状液,800 r/min离心10 min[12],在距离心管底部1 cm 处取样30 μL,加入5 mL、0.1%十二烷基硫酸钠溶液,混匀后在500 nm 下测定吸光度,每个样品重复测定3 次,结果取平均值。乳状液稳定系数采用式(1)进行计算。
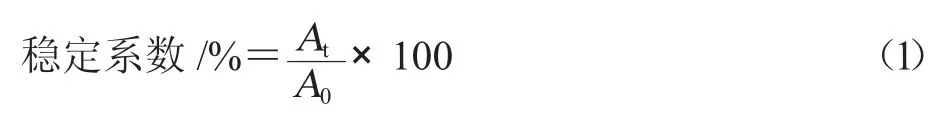
式中,A0为离心前乳状液的吸光度;At为离心后乳状液的吸光度。
1.4.3 过氧化值测定
不饱和脂肪酸在空气中易与氧气反应而酸败,氧化过程中活性氧的含量(即过氧化值,用碘的毫克当量表示,单位为mmol/kg)能够反映油脂和脂肪酸的氧化程度[13]。按《GB 5009.227—2016 食品中过氧化值的测定》测定样品的过氧化值[14]。
1.5 数据处理
所有数据采用Origin 9.0 软件绘图,采用SPSS 19.0处理软件中T-test 方法进行显著性分析。
2 结果与分析
2.1 蛋白和油浓度对乳状液粒径的影响
2.1.1 蛋白浓度对乳状液粒径的影响
不同大豆分离蛋白浓度下的乳状液粒径分布如图1所示。由图可知,所有的乳状液呈现双峰分布,第一个峰代表的是乳状液中游离蛋白的粒径,第二个峰为乳状液颗粒分布[15]。当大豆分离蛋白浓度为0.1%时,乳状液的两个峰分别在272 nm 和2 080 nm 处;当大豆分离蛋白浓度增加时,乳状液粒径变小,说明乳状液稳定性有所改善。如大豆分离蛋白浓度为0.2%时,乳状液两个峰分别为200 nm 和800 nm;当大豆分离蛋白浓度为0.5%时,乳状液的粒径达到最小值,分别为160 nm 和695 nm。继续增大大豆分离蛋白浓度,乳状液的粒径变大,这可能是因为大豆分离蛋白在水中的溶解度有限,浓度过高,蛋白之间相互聚集,导致乳状液粒径变大。

图1 不同蛋白浓度下乳状液的粒径分布Fig.1 Size distribution of emulsions with different protein concentrations
2.1.2 油浓度对乳状液粒径的影响
不同油浓度条件下的乳状液粒径分布如图2(见下页)所示。由图可知,所有的乳状液均呈现双峰分布,随着油浓度的增加,乳状液粒径逐渐增大;当油浓度为0.1%时,粒径最小,两个峰分别为120 nm 和600 nm。油浓度为0.2%、0.5%和1.0%时,乳状液粒径小幅增加。当乳状液中油浓度为2.0%时,乳状液粒径分布明显变大,说明油浓度增加,大豆分离蛋白的包埋能力有限,颗粒之间容易发生絮集,导致粒径变大。
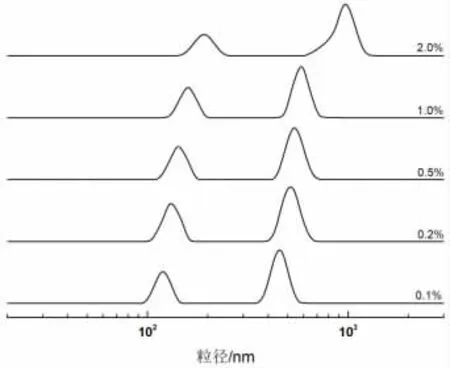
图2 不同油浓度条件下乳状液的粒径分布Fig.2 Size distribution of emulsions with different oil concentrations
2.2 蛋白和油浓度对乳状液ζ-电位的影响
ζ-电位是用来表征乳状液稳定性的重要指标。大豆分离蛋白的等电点为4.5~4.6,所有乳状液的电位在pH为7 的条件下都是负值[16]。在图3 中,0.1%大豆分离蛋白的乳状液电位绝对值为32.15 mV,随着蛋白浓度的进一步提高,电位一直增大。大豆蛋白浓度超过1.0%之后,ζ-电位绝对值下降明显。当蛋白浓度为2.0%时,为59.29mV。

图3 不同蛋白浓度下乳状液的ζ-电位Fig.3 ζ-potential of emulsions with different protein concentrations
图4 为不同油浓度下乳状液的ζ-电位,当油浓度为0.1%时,ζ-电位绝对值为75.15 mV。当油浓度提高到1%时,乳状液的ζ-电位绝对值明显变小,为48.2 mV;当油浓度为2.0%时,ζ-电位绝对值进一步下降。当粒子的ζ-电位绝对值大于30 mV 时,通常被认为是稳定的[17]。在乳状液中存在空间排阻效应,粒子的ζ-电位绝对值大于20 mV 时,也可能使粒子稳定分散于溶液中,当油浓度过高时,乳状液乳化能力有限,不能阻止粒子之间的聚集[18]。

图4 不同油浓度下乳状液的ζ-电位Fig.4 ζ-potential of emulsions with different oil concentrations
2.3 大豆分离蛋白和油浓度对乳状液离心稳定性的影响
2.3.1 大豆分离蛋白浓度对乳状液离心稳定性的影响
图5 为大豆分离蛋白浓度对乳状液离心稳定性的影响。由图可以看出,随着大豆分离蛋白浓度的升高,离心稳定系数先增大后减少,当蛋白浓度为1.0%时,离心稳定系数最大,为88%,表明此时的乳状液最稳定。当大豆蛋白浓度为2.0%时,乳状液的离心稳定系数下降为76%。根据斯托克斯定律,提高分层稳定性可以通过减小液滴粒径、升高连续相黏度或者减小液滴和连续相之间的密度差来达到。按照这个定律分析乳状液稳定性的变化趋势,大豆分离蛋白浓度在0.1%~1.0%时,乳状液稳定性逐步上升,分析原因是连续相中未吸附的粒子的存在形成了粒子和液滴之间的三维网络结构,升高了连续相的黏度,减缓了液滴的迁移;另一方面大豆分离蛋白包覆在油滴表面增加了油滴的密度,减小了油滴和连续相的密度差;之后,由于大豆蛋白在界面及液相中的相互缠结,促进了液滴之间的絮凝,从而导致过高浓度的大豆蛋白降低了乳液的分层稳定性[19-20]。

图5 大豆分离蛋白浓度对乳状液离心稳定性的影响Fig.5 Effect of soybean protein isolate concentration on centrifugal stability of emulsions
2.3.2 油浓度对乳状液离心稳定性的影响
图6 为油浓度对乳状液离心稳定性的影响,可以看出随着油浓度的提升,灵芝孢子油乳状液离心稳定性不断下降,由90%逐步下降为27%,这是由于油浓度过高,而大豆蛋白的乳化能力有限,不能形成足够多的乳状液颗粒,不能减小油滴和连续相的密度差,从而导致乳状液不稳定[21]。根据上述结果,选择0.5%浓度的大豆分离蛋白和0.5%灵芝孢子油含量来制备乳状液比较合适。
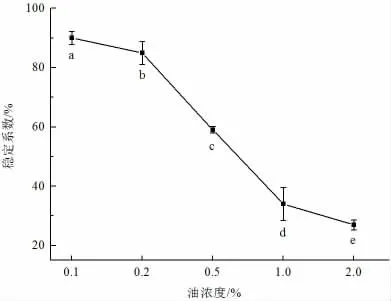
图6 不同油浓度对乳状液离心稳定性的影响Fig.6 Effect of different oil concentrations on the centrifugal stability of emulsions
2.4 乳状液的储藏稳定性
2.4.1 储藏过程中乳状液粒径的变化
图7 为0.5%大豆分离蛋白-0.5%灵芝孢子油乳状液储藏10 d 内的粒径变化图。由图可知,乳状液粒径在前2d 变化不明显,在第2 天时,乳状液粒径峰位于150 nm和700 nm 左右。当储藏至第5 天时,粒径出现明显的增大,两个峰分别位于190 nm 和1 400 nm 处。第7 天,乳状液粒径又进一步增大。第10 天时乳状液粒径几乎只剩下一个单峰,位于2 500 nm 处左右,此时乳状液出现了大颗粒聚集。

图7 乳状液储藏过程中的粒径变化Fig.7 Size distribution of emulsions during storage
2.4.2 储藏过程中乳状液电位的变化
图8 为0.5%大豆分离蛋白-0.5%灵芝孢子油乳状液储藏10 d 内的ζ-电位变化图。由图可以看出,乳状液在储藏2d 后ζ-电位变化不明显,第2 天绝对值为58.46 mV。储藏至第5 天时,乳状液的ζ-电位绝对值明显变小,为36.71 mV。储存至第10 天时,ζ-电位的绝对值最小,为10.29 mV。乳状液的绝对值小于20 mV,说明此时的乳状液已经不稳定。
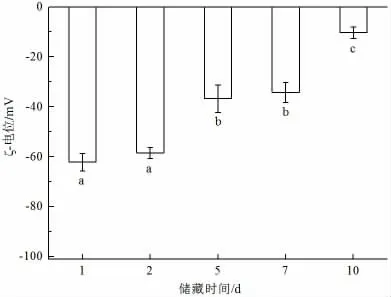
图8 乳状液储藏过程中ζ-电位变化Fig.8 ζ-potential of emulsions during storage
2.5 乳状液的氧化稳定性
图9(见下页)为储藏过程中乳状液的氧化稳定性,为0.5%大豆蛋白与0.5%灵芝孢子油经均质制备而成的乳状液,并在其中加入了不同种类的抗氧化剂。在第1 天时,所有乳状液的过氧化值基本接近,其中对照组的过氧化值最大,为0.45 mmol/kg。储藏至第2 天时,对照组的过氧化值明显增大,为2.25 mmol/kg,其次为乳状液(0.98 mmol/kg)。而加入抗氧化剂保护的乳状液,过氧化值变化不明显。储藏至第5 天时,差距进一步拉大,加入抗氧化剂的保护优势凸显出来,三者差距不大,对照组为3.76 mmol/kg,乳状液的过氧化值之间为2.75 mmol/kg。储藏至第7 天时,对照组与乳状液的差距明显,茶多酚和抗坏血酸具有良好的保护效果,相比对照组的7.77 mmol/kg,仅为1.2 mmol/kg。储藏到第10 天时,过氧化值大小顺序为对照>乳状液>大豆异黄酮>抗坏血酸>茶多酚,过氧化值分别为10.12、7.15、4.04、2.88、1.88 mmol/kg。与对照组相比,乳状液的过氧化值降低了29.24%,加入了茶多酚的乳状液则降低了81.42%。说明乳状液对灵芝孢子油具有良好的保护效果,加入抗氧化剂后,保护效果进一步增强,其中茶多酚的效果最好。

图9 乳状液储藏过程中过氧化值变化Fig.9 Peroxide values of emulsions during storage
3 结论
本文利用大豆分离蛋白的乳化特性构建水包油型乳状液,将灵芝孢子油作为油相包埋在内部,通过研究蛋白和油浓度对乳状液体系稳定性的影响,构建最佳的乳状液包埋体系。制备的乳状液均呈现双峰分布。当蛋白浓度为0.1%~0.5%时,随着蛋白浓度的增加,乳状液粒径分布变小,说明乳状液稳定性有所改善。制备的乳状液的ζ-电位绝对值均大于20 mV。随着大豆蛋白浓度的升高,乳状液离心稳定系数增大,由最低的25%提升到88%,当蛋白浓度为1.0%时,离心稳定系数最大,表明此时的乳状液最稳定。随着油浓度的提升,灵芝孢子油乳状液离心稳定性在不断下降。当油浓度为1.0%时,乳状液离心稳定系数很低。综合粒径和电位数据,当蛋白浓度为0.5%和油浓度为0.5%时,能制得稳定性较好的乳状液。当储藏至第5 天,粒径出现明显的增大,ζ-电位绝对值变小。储藏到第10 天时,过氧化值从大到小的顺序分别为对照>乳状液>大豆异黄酮>抗坏血酸>茶多酚。表明大豆分离蛋白制备的乳状液可以有效包埋灵芝孢子油,并能有效增强灵芝孢子油的氧化稳定性。本文为灵芝孢子油在食品保健领域的应用以及液体口服类产品的开发提供理论支持。

