一种典型钒钛系SCR催化剂SO 3生成特性研究
尹子骏,苏胜,卿梦霞,赵志刚,王中辉,王乐乐,江龙,汪一,胡松,向军
(1华中科技大学煤燃烧国家重点实验室,湖北武汉430074;2长沙理工大学能源与动力工程学院,湖南长沙410114;3西安热工研究院有限公司苏州分公司,江苏苏州215153)
引 言
燃煤电厂污染物超低排放已成为国家重大需求和主流趋势[1-2]。目前,我国燃煤电厂中基本都装配有除尘及脱硫脱硝设备以除去烟气中SO2、NOx和灰尘。在脱硝设备使用最多的是选择性催化还原(SCR)脱硝技术。该技术一般采用NH3等作为脱硝还原剂,脱硝催化剂以钒钛基催化剂为代表,可将烟气中NO等气体还原为对环境无害的N2,但同时SCR催化剂也会将烟气中部分SO2催化氧化成SO3[3-5]。研究表明,在SCR脱硝系统中,有0.3%~2%SO2会被催化氧化为SO3[6-8]。SO3生成对燃煤电厂的安全运行具有显著的不利影响,SO3会与SCR系统逃逸的NH3结合形成硫酸氢铵(ABS),黏性很强的ABS会沉积在SCR脱硝催化剂的表面使催化剂中毒,同时也会黏附在下游空预器等换热元件上,造成其堵塞[9-11],对电厂安全运行产生严重影响。
目前,针对燃煤烟气SCR脱硝过程中SO3生成特性的相关研究还较少。SCR脱硝过程中影响SO2氧化成SO3的关键因素以及SO3生成机理尚不清楚。Alvarez等[12]研究发现,SO2/SO3的转化率与烟气流速及SCR催化剂表面积有关,烟气流速和催化剂比表面积越大,SO2/SO3转化率越小。Baltin等[13]研究发现,温度对催化剂表面SO2氧化起着重要的作用,温度越低,SO2/SO3转化率越小。Dunn等[14]研究发现对于钒钛催化剂,在O2浓度高于18%时,O2的加入对SO3的生成基本没有影响。张悠[15]发现在钒钛催化剂上,SO3生成量会随SO2浓度增加而增加。目前相关研究表明,影响SCR脱硝过程中SO3生成特性的因素复杂,但针对这些因素的影响机制缺乏系统深入的研究,因此很难从根本上揭示SCR催化剂表面SO3生成的关键机理。本文针对复杂的烟气组分及反应条件,系统研究各种关键因素对SCR催化剂表面SO3生成影响机制,探究SO3生成过程中反应动力学特性,对于揭示SCR脱硝过程中SO3生成特性及关键机理具有重要意义。
1 实验过程及方法
1.1 实验样品与分析
实验采用的催化剂样品取自某燃煤电厂新鲜的典型商业钒钛系SCR脱硝催化剂。实验中将催化剂先进行粉碎筛分,取粒径在0.425~1 mm之间的催化剂作为实验样品。实验前,所有样品均在105℃真空条件下干燥12 h,随后置于真空干燥皿中密封保存待用。
研究中使用EDAX公司生产的EagleⅢ型分析仪对催化剂进行X射线荧光光谱分析(XRF),获得的催化剂表面各成分的含量如表1所示。实验同时采用了比表面积测定仪(Micromeritics ASAP 2020M)分析催化剂的物理结构,采用Brunauer-Emmett-Teller(BET)三点法测量催化剂的比表面积、孔体积和孔径分布,测量结果如表2。

表1 催化剂化学成分的检测结果(质量分数)Table 1 Test results of XRF of catalyst

表2 催化剂比表面积检测结果Table 2 Test results of BET of catalyst
1.2 实验系统
SO3生成特性实验在如图1所示固定床实验反应系统上进行。实验系统由质量流量计、混气瓶、固定床反应器、小型立式管式炉、冷凝管及尾气处理系统等组成。反应系统中石英反应器内径为Φ20 mm,长0.6 m。SCR催化剂样品放置在反应器中部的石英筛板上,采用电加热炉控制反应温度。
在气体分配系统中,高纯度钢瓶气体(N2、O2、SO2)用作气源,质量流量计用来精确控制这些气体的比例,反应气体最终在混气瓶中混合均匀后通入反应器。

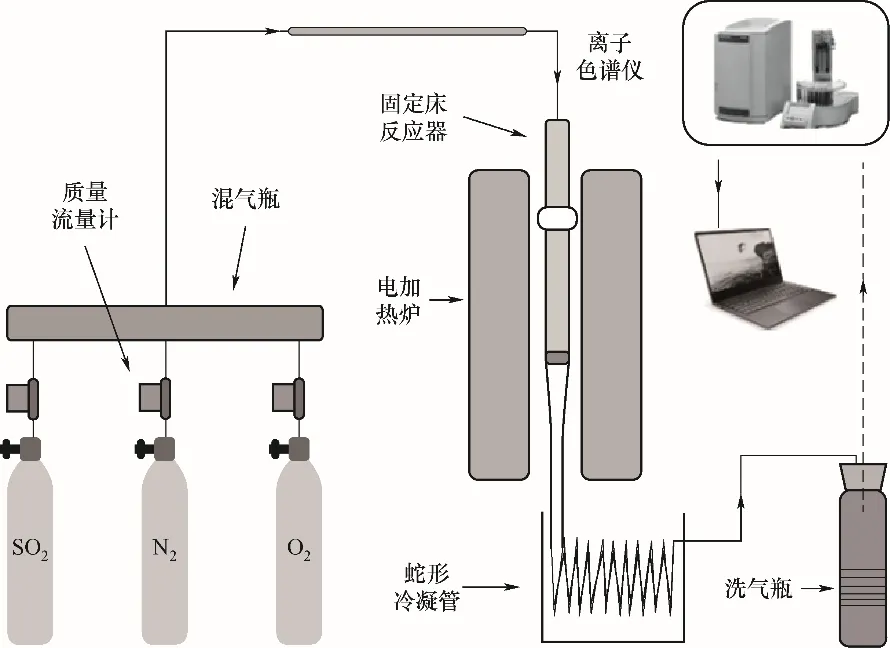
图1 实验系统装置图Fig.1 Schematic diagram of experimental setup

1.3 实验方法
实验过程中,气体的总流量为1 L/min,实验中催化剂的用量为1 g,每次实验的反应时间为1 h。由于SO3化学性质十分活泼,其他的物质很容易与其进行反应,因此直接测量十分困难;而且反应后气体中SO3的浓度一般很低,相对高浓度的SO2对SO3的准确测量有很大影响。考虑到控制冷凝法收集SO3是一种广泛采用的方法[16],可以精确收集到反应后气体中的SO3,因此本研究中采用了控制冷凝法收集反应后气体中SO3。控制冷凝法收集SO3原理是利用水浴把反应后气体温度严格控制在85℃,使SO3在蛇形冷凝管中冷凝并收集;同时,采用浓度为20 mmol/L的NaOH溶液吸收气体中的SO2,同时向其中加入浓度为30%的H2O2溶液使SO2完全氧化为S。反应完成后,用去离子水多次洗涤冷凝管,并收集溶液定容至250 ml;之后采用离子色谱对定容后的冷凝液以及吸收液中SO42-浓度进行测量,以获得气体中SO2和SO3的物质的量。
1.4 实验工况及参数
实验过程中,根据燃煤电厂SCR脱硝装置中的实际反应条件选取具体实验参数,如表3所示。

表3 SO3生成实验的实验工况参数Table 3 Experimental condition parameters of SO 3 generation experiment
实验中,SCR催化剂表面SO3生成特性评价用SO2的转化率来表示,如式(1)所示。
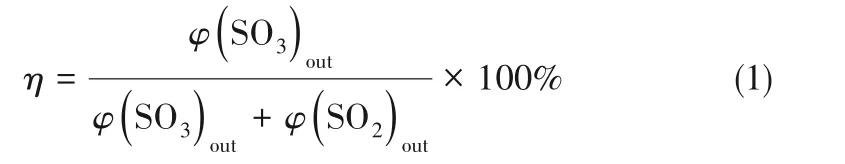
式中,η表示SO2的转化率,%;φ(SO2)out表示反应1 h后反应器出口气体被洗气瓶收集的SO2的物质的量,mol;φ(SO3)out表示反应1 h后反应器出口气体被冷凝管收集的SO3的物质的量,mol。
2 实验结果与讨论
2.1 实验系统硫总量平衡分析
由于SO2和SO3的化学性质比较活泼,为了保证实验过程与测量的准确性,研究过程中首先对反应系统的硫元素进行了质量平衡分析。在气体总流量为1 L/min、反应温度为400℃、气氛条件为3%O2及不同SO2浓度条件下,将催化剂放入反应系统进行实验,控制反应时间1 h,同时收集反应过程中反应器出口吸收液中SO2以及冷凝管中SO3,生成总量如表4所示。由表4中结果可以看出,在不同的反应条件下,实验系统中反应器进、出硫元素总量基本是相等的,硫元素收集率达到约95%,部分损失的硫元素可能是由于测量的误差造成。Maddalone等[17]利用稀硫酸加热法产生SO3气体,通过改变H2O、H2SO4的含量,发现控制冷凝法对H2SO4回收率在89%~100%范围内波动。而本文研究过程中控制冷凝法的收集率达到约95%,证明了实验系统及实验过程与测量方法的可靠性,也充分说明了本文研究采用的SO2转化率定义可以用来对SO2向SO3的转化特性进行分析。
2.1.2 混播禾草种类对混播植物POD活性的影响 A2处理禾草POD活性最高,其次是A3处理。其中,A2处理禾草POD活性分别比A1,A3和A4处理高250.04%,20.22%和350.42%倍,差异均达极显著水平(P<0.01);A3处理禾草POD活性分别比A1和A4处理高191.18%和274.68%(P<0.01)。A1和A4处理之间差异不显著(表1)。A1处理下苜蓿POD活性比A4处理高19.47%(P<0.01);A3处理POD活性比A4处理高16.40%(P<0.05);其余处理之间无显著差异。
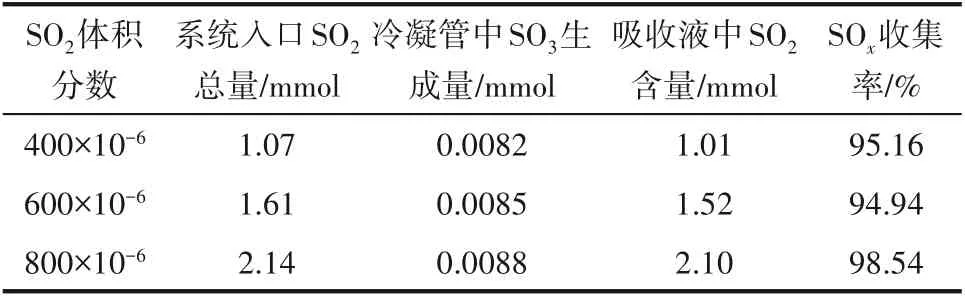
表4 不同SO2浓度下反应系统SO x收集率Table 4 SO x collection rate of reaction system under different SO 2 concentration
2.2 气体流量的影响
本文研究过程中,在其他条件保持一定的情况下,随着催化剂粒径的减小,SO2转化率不再增加则说明气体内扩散对该化学反应的影响基本消除。选取三种催化剂的粒径,分别为0.425~1 mm、0.25~0.425 mm、<0.25 mm,三种粒径对应的SO2转化率均在16%左右,可认为当催化剂粒径为0.425~1 mm时气体内扩散的影响很小,因此后续的实验研究过程均在催化剂粒径0.425~1 mm的条件下进行。
研究过程中为了消除气体外扩散的影响,通过改变气体流量与催化剂的体积使得反应过程中空速一定,并考察对SO2转化率的影响。气体流量与气体扩散有关,化学反应主要由气体扩散与化学反应动力学所控制[14],当反应速率不再随着气体流量的增加而变化时,表明气体扩散对反应影响基本消除。反应温度为360℃,空速10000 h-1,不同流量条件下催化剂表面SO2转化率的变化规律如图2所示。实验结果显示,当气体总流量由0.5 L/min增加到1 L/min时,SO2转化率随流量的增加显著增加,这主要是由于反应过程中流量增加会提高催化剂表面传质系数[18]。而当流量进一步增加至1.5 L/min时,催化剂表面SO2转化率基本不再随流量增加而改变。这表明当流量大于1 L/min时,气体外扩散对反应影响基本消除,因此后续的实验研究过程均在1 L/min流量的条件下进行。
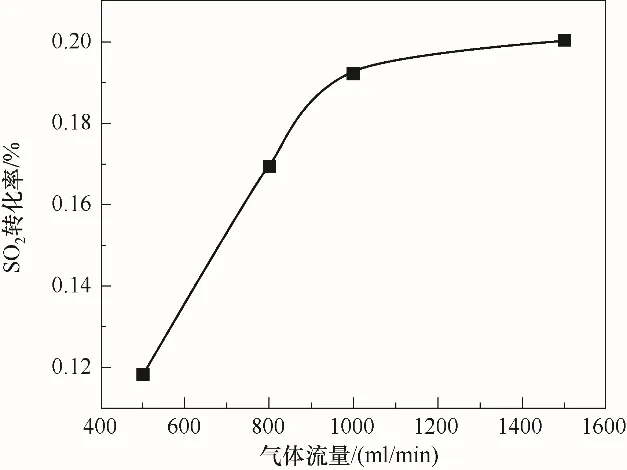
图2 SO2转化率随流量的变化规律Fig.2 Variation of SO2 conversion with flowrate
2.3 温度对催化剂表面SO3生成特性的影响
当气体总流量为1 L/min,空速为10000 h-1时,不同温度条件下催化剂表面SO2转化率规律如图3所示。实验结果表明,当反应温度从280℃升高到320℃时,催化剂表面上SO2转化率变化很小;而当反应温度继续升高到360℃过程中,SO2转化率随着反应温度升高明显增加;随着反应温度进一步升高至400℃,SO2转化率提高十分显著,这表明反应温度对催化剂表面SO3的生成具有重要的影响。研究过程中,温度在280℃,SO2浓度600×10-6时的转化率比SO2浓度在400×10-6时的低,这是由于该反应为可逆反应,反应物浓度增加时反应中相应消耗的SO2总量小于SO2的增加量。而当温度增加到400℃时,两者差异很小,此时温度已成为限制SO2转化率的主要因素,SO2浓度对其的影响较小。
实验过程中所采用的SCR催化剂为V2O5-WO3/TiO2催化剂,温度增加会使V2O5的活性增加[19-21],有利于脱硝反应的进行;然而相关研究表明[22],催化剂中V2O5对SO2氧化也起着重要的作用。实验过程中,当温度高于320℃时,催化剂中主要活性组分V2O5开始明显促进SO2氧化。Kobayashi等[23]研究发现,气态SO3的形成过程中伴随着高价钒与低价钒的转化,而SCR催化剂的活性主要取决于该转化反应进行的快慢,该反应一般发生在约350℃。因此实验过程中,当反应温度从320℃升高到400℃时,催化剂表面SO2转化率也明显增加。研究结果同时说明,脱硝反应过程中为抑制SO3生成,应该适度控制反应温度。
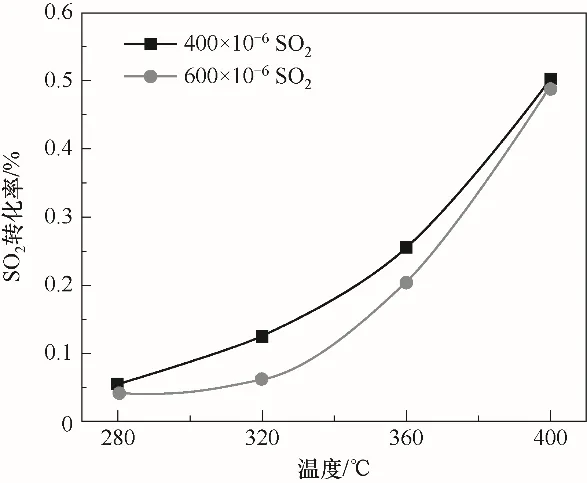
图3 SO2转化率随温度的变化规律Fig.3 Variation of SO2 conversion with temperature
2.4 SO2浓度对催化剂表面SO3生成特性的影响
图4显示了当反应温度为360℃、气体总流量为1 L/min、空速为10000 h-1时,SO2转化率和SO3生成量随初始SO2浓度变化规律。实验结果表明,随着反应气氛中SO2浓度逐渐增加,SO2转化率逐渐降低,但SO3生成量随SO2浓度增加呈现增加的趋势。实验过程中,由于反应气氛中SO2浓度相对较高,SO2的扩散速率比SO2被氧化的速率大,因此此时总反应速率可能主要取决于SO2被氧化的化学反应速率。该反应过程为可逆反应,当SO2浓度增加时,该反应平衡会正向移动,SO3生成量因此增加;但由于反应平衡常数不会随着反应物浓度的改变而改变,因此反应中相应消耗的SO2总量小于SO2的增加量,所以SO2氧化反应的总体转化率减小[24]。
2.5 O2浓度对催化剂表面SO3生成特性的影响
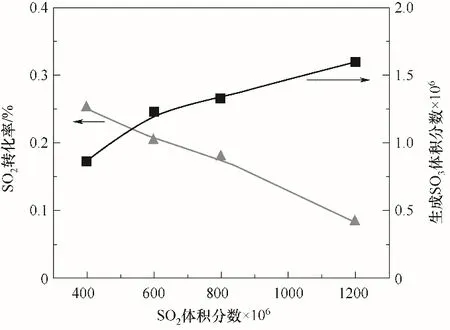
图4 SO2转化率随SO2浓度的变化规律Fig.4 Variation of SO2 conversion with SO2 concentration
SO2浓度为600×10-6、气体总流量为1 L/min、空速为10000 h-1时,SO2转化率随O2浓度变化规律如图5所示。结果显示,当反应系统中的O2浓度在0~3%范围内时,SO2的转化率会随着O2浓度的增加而增加;当O2浓度从3%增加至10%时,SO2的转化率基本保持不变。研究结果总体表明,在当前实验条件下,气氛中O2浓度的增加对SO3生成影响并不显著。Ji等[25]研究表明,SO3的生成并不是SO2直接被O2氧化的结果,V2O5将SO2氧化后会被还原成低价钒(V3+),然后V3+会被O2提供的O自由基等氧化成V5+,从而完成催化循环过程。实际上,实验条件下气体中O2含量远远大于SO2的含量,O2提供的O自由基远大于上述氧化反应所需的O自由基。因此当气体中O2浓度继续增加时,催化剂表面吸附的氧含量会达到饱和状态[20],此时气体中O2含量的变化对SO2的氧化影响并不明显。
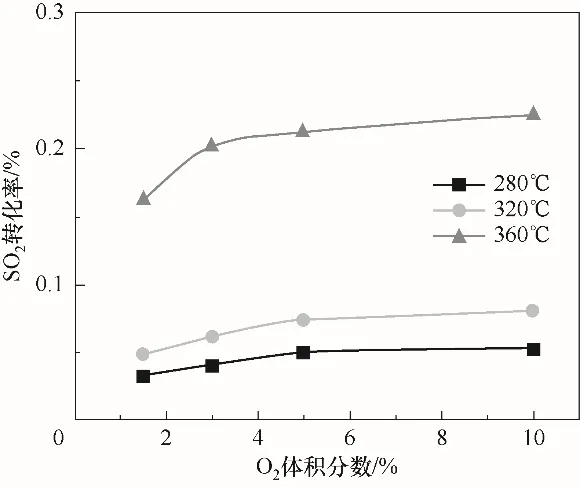
图5 SO2转化率随O2浓度的变化规律Fig.5 Variation of SO2 conversion with O2 concentration
3 SO3生成反应动力学分析
3.1 动力学模型的建立
SO2氧化过程的主要化学反应方程见式(2),建立该反应的动力学模型可得到各物质的浓度和温度对该过程反应速率的影响[26]。对于化学反应速率的定义,通常采用的是反应物物质的量n与反应时间的比值[式(3)]。

由于反应主要发生在催化剂固体表面,当反应系统达到稳定后,各物质的浓度及温度等不会随着时间发生变化。因此,该反应的反应速率可定义为各物质流经催化剂的摩尔流率与催化剂的质量的比值[27],如式(4)所示。

其中,Ni为各物质的摩尔流率,mol/min;W为催化剂的质量。
根据SO2转化率的定义以及摩尔流率的定义,可得到化学反应速率的表达式(5)。

式中,ηSO2为SO2转化率;[NSO2]0为反应器进口SO2的初始摩尔流率。化学反应速率经过进一步变换后如式(6)和式(7)所示。
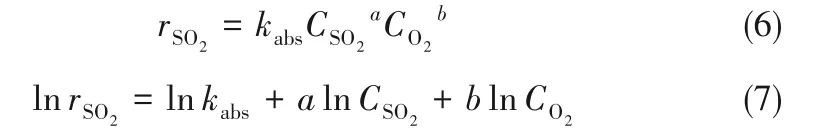
其中,kabs为表观速率常数。它的值只和温度相关,如果表观速率常数的值越大,该反应也会更容易进行。a为SO2的反应级数,b为O2的反应级数,级数反映了该物质的浓度对反应速率的影响[28]。为明确地反映出温度对表观速率常数的影响,针对Arrhenius公式(8)进行变换可得到式(9)。
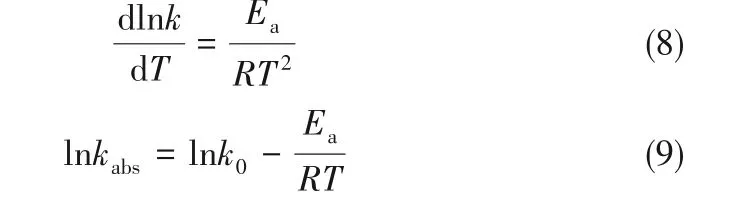
其中,Ea为该反应所需的活化能,常数R为8.314 J/(mol·K)。当已知表观速率常数kabs和温度,便可计算出该反应所需的活化能[29]。
3.2 反应级数与反应活化能分析
根据实验结果,SO2浓度与SO2氧化速率之间关系如图6所示。从图6中结果可发现,SO2氧化反应速率随着SO2浓度的增大而增加,温度升高时,SO2氧化反应速率也随着增加。研究过程中,温度360℃时,SO2浓度的增加导致氧化反应速率从4.5 μmol/(g·min)增 加 到8.7μmol/(g·min),SO2浓 度 为600×10-6时,温度的升高导致氧化反应速率从1.1 μmol/(g·min)增加到14.3μmol/(g·min),温度对SO2氧化速率的影响更为显著。图7显示了SO2氧化速率对数与SO2浓度对数之间的拟合关系,由式(7)可知该图中不同直线的斜率为不同温度下SO2的反应级数。拟合得到280、320、360和400℃下SO2的反应级数分别为0.57、0.65、0.60和0.55,SO2平均反应级数为0.59。

图6 SO2浓度对SO2氧化速率的影响Fig.6 Dependence of SO2 conversion rate on SO2 concentration
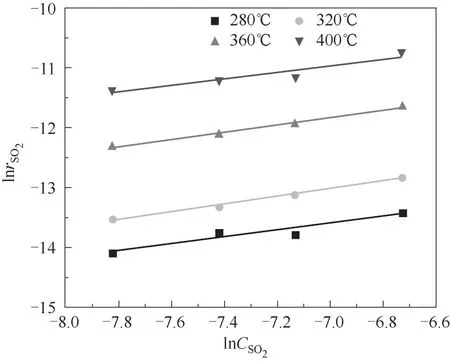
图7 不同温度下ln r SO2与ln C SO2的关系Fig.7 ln r SO2-ln C SO2 at various temperatures
实验得到O2浓度与SO2氧化速率之间的关系如图8所示,图8表明,当反应系统中O2浓度大于3%时,SO2氧化速率没有随着O2浓度的增加而变化。图9显示了当O2浓度大于3%,SO2氧化速率对数与O2浓度对数之间的拟合关系,图中不同曲线的斜率为不同温度下O2的反应级数,可以发现当O2浓度大于3%时,不同温度下O2反应级数均趋近于0。对比SO2平均反应级数,表明SO2浓度是影响该化学反应速率的主要因素之一,而O2浓度不是当前实验条件下SO2氧化化学反应速率的限制因素。这也与前文的研究结论一致,该反应条件下,催化剂表面吸附的氧含量已经处于饱和状态,继续增加O2浓度并不会使催化剂表面氧含量进一步增加,因此当O2大于3%时,气体中O2浓度的变化对SO2的转化几乎没有影响。
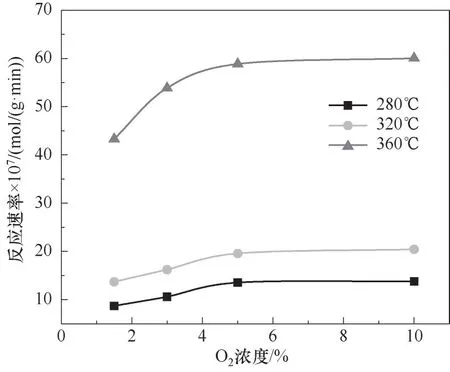
图8 O2浓度对SO2氧化速率的影响Fig.8 Dependence of SO2 conversion rate on O2 concentration
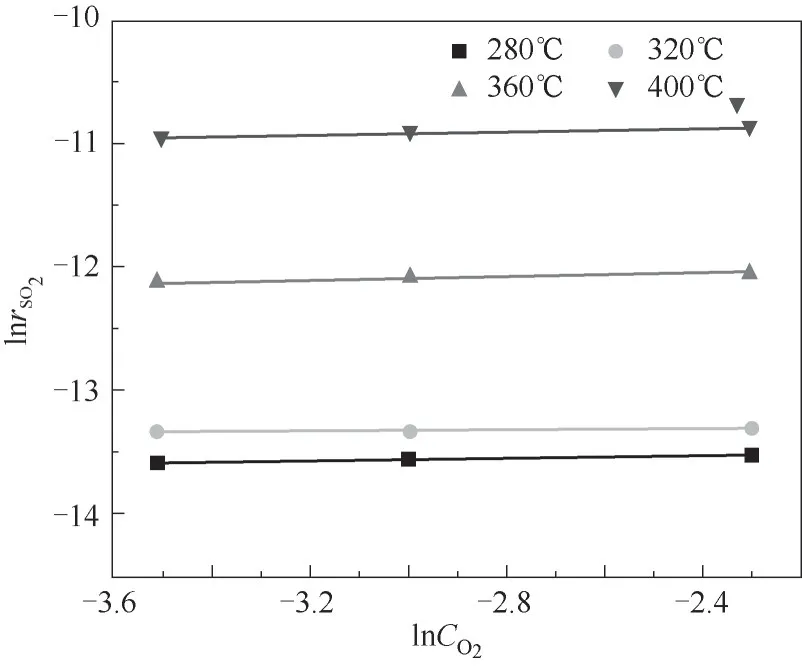
图9 不同温度下ln r SO2与ln C O2的关系Fig.9 ln r SO2-ln C O2 at various temperatures
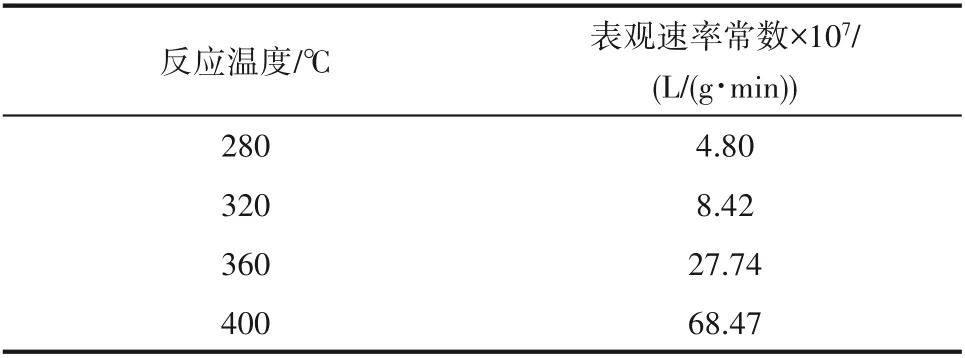
表5 表观速率常数与反应温度的关系Table 5 Relationship between rate constant and reaction temperature
当SO2与O2的反应级数确定后,可得出不同反应温度下的表观速率常数,如表5所示。研究结果表明,表观速率常数随着反应温度的增加显著增加。表观速率常数lnkabs和1/T的关系如图10所示,图中拟合直线的斜率为-8.47。结合式(9),本文通过研究计算表明该化学反应在温度范围280~400℃下的表观活化能为70.39 kJ/mol。Dunn等[14]研究得到该反应的化学反应活化能为85 kJ/mol,与本文的计算结果有一定的差别,由于本实验中所采用的催化剂为电厂现役催化剂,因此计算得到数值偏低,反应速率偏大。研究表明[30],SCR催化剂NO还原反应活化能约为21 kJ/mol,与SO2氧化的反应活化能相比较小,因此SO2氧化速率比NH3还原NO速率慢。
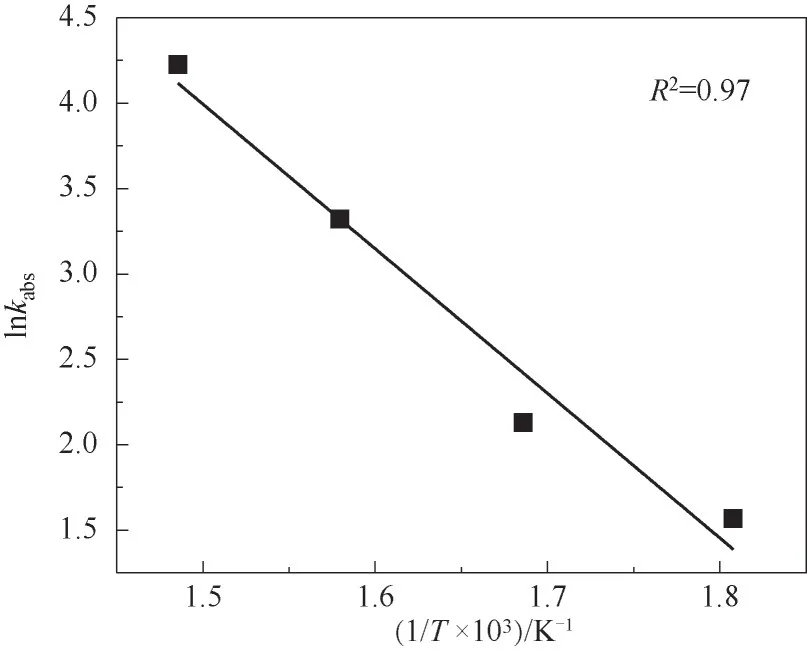
图10 SO2氧化的ln k abs与1/T关系曲线Fig.10 Curve of ln k abs-1/T for SO2 oxidation
4结 论
(1)SCR脱硝反应过程中,反应温度对钒钛系SCR脱硝催化表面SO3生成具有显著影响。温度的增加会使V2O5的活性增加,从而促进催化剂表面SO3的生成;SO2浓度增加会提高SO3生成反应速率,也会促进SO3生成;当反应气氛中O2大于3%时,O2浓度变化对SO2的转化几乎没有影响。
(2)SCR催化剂表面SO2氧化生成SO3反应过程中SO2的平均反应级数为0.59,当O2浓度大于3%时,O2反应级数均趋近于0,这表明SO2浓度是影响该化学反应过程的主要因素之一。化学反应动力学分析表明,SO2氧化反应的反应活化能约为70.39 kJ/mol,高于SCR脱硝过程中NH3还原NO反应过程活化能,SCR催化剂表面SO2氧化速率相比于NH3还原NO反应速率慢。
(3)为了抑制SCR催化剂表面SO3的生成,适当调控SCR脱硝过程中的温度等方法也能够降低SCR脱硝过程中SO3的生成。

