制备方法对纳米熔盐储热性能及形成机理的影响
熊亚选,钱向瑶,李烁,孙明远,王振宇,吴玉庭,徐鹏,丁玉龙,马重芳
(1北京建筑大学供热供燃气通风及空调工程北京市重点实验室,北京100044;2北京工业大学传热强化与过程节能教育部重点实验室,北京100124;3伯明翰大学伯明翰储能中心,英国伯明翰B15 2TT)
引 言
聚光太阳能热发电实现连续稳定发电的关键是大规模熔盐储热技术的耦合[1]。熔盐具有储热温度高、饱和蒸气压力低、工作范围宽、密度大、储热密度高、成本低、高温稳定性好、环境友好等优点,是优异的大规模储热工质,并受到核反应堆传热、谷电储热、工业余热回收等领域的广泛关注。

为了优选纳米熔盐的大规模制备方法,探索纳米熔盐的强化机理,本文同时采用水溶液法和高温熔融法,将SiO2纳米颗粒分散到二元硝酸盐中,按照不同的搅拌时间分别制备相纳米熔盐,采用差示扫描量热法、热重分析法和微观形貌分析法研究两种制备方法所制备纳米熔盐的潜热、显热、微观形貌等的差异,确定纳米熔盐的最佳搅拌时间;进一步比较两种制备方法的制备工艺过程,综合分析纳米熔盐制备过程中能耗、工艺复杂程度等,综合优选纳米熔盐的大规模制备方法。通过微观形貌测试,分析两种方法制备纳米熔盐的微观形貌差异;通过分析现有文献对纳米熔盐强化机理的解释,通过分析纳米颗粒形貌特性,结合纳米熔盐的制备工艺过程,提出纳米熔盐制备过程中的形成机理,并对两种方法制备纳米熔盐的储热性能强化进行定性解释。
1 实验材料及方法
1.1 实验材料
实验以NaNO3、KNO3分析纯作为组分盐,用于制备二元基盐[60%(质量)NaNO3-40%(质量)KNO3]。纳米材料采用粒径20 nm的SiO2纳米颗粒。表1为所选组分盐和纳米颗粒的基本特性。
1.2 材料制备
1.2.1 基盐 本实验中,按照以下步骤制备基盐:①用蒸发皿分别盛适量NaNO3和KNO3分析纯,放入真空干燥箱,温度设定170℃,干燥不少于24 h,冷却至室温;②用天平(METTLER TOLEDO,MEI 104)按照质量比例分别称取6 g的NaNO3和4 g的KNO3,混合后放入高速粉碎机,搅拌10 s;③将搅拌后的混合物放入真空干燥箱,温度设定170℃,作为制备纳米熔盐的基盐。
1.2.2 纳米熔盐 (1)水溶液法水溶液法制备纳米熔盐按照以下步骤进行配制:①用电子天平按比例称取基盐和SiO2纳米颗粒样品;②将纳米颗粒样品放入盛有去离子水的烧杯中,用玻璃棒初步搅拌后放入超声振荡器中,按照预定的时间进行搅拌,形成纳米颗粒悬浮液;③将基盐样品放入纳米颗粒悬浮液中,用玻璃棒搅拌至熔盐样品完全溶解,制得纳米熔盐悬浮液;④将纳米熔盐悬浮液放入真空干燥箱中,设定加热温度95℃,直至水分蒸干,制得纳米熔盐粉体;⑤将干燥箱加热温度升高至170℃,干燥纳米熔盐粉体不少于24 h,制得纳米熔盐样品。
(2)高温熔融法高温熔融法制备纳米熔盐按照以下步骤进行:①用电子天平按比例称取基盐和SiO2纳米颗粒样品;②将基盐样品放入石英坩埚中,设定加热温度300℃,将基盐样品加热至熔融状态,放入磁力搅拌转子,初步搅拌后形成熔盐熔体;③将SiO2纳米颗粒样品放入熔盐熔体中,按照预设时间,以800 r/min转速匀速搅拌;④将搅拌完成后的纳米熔盐自然冷却至200℃,放入真空干燥箱备用。
本实验中,制备纳米熔盐的搅拌时间分别为30、45、60、75、90、105、120、135、150、165 min等10种搅拌时长。
1.3 纳米熔盐储热性能表征
本实验采用集成差示扫描量热法和热重分析法的同步热分析仪(STA 449 F3)对基盐和纳米熔盐的熔点、熔化潜热和比热容进行测量。具体方法为,将纳米熔盐样品称重,放入铝坩埚后置入同步热分析仪内,以99.999%高纯氮气作为保护气和清扫气,然后进行以下加热-冷却循环:
(1)同步热分析仪将样品从室温加热至170℃,保持20 min,以除去样品中可能的水分;(2)以10 K/min的加热速率进行加热,将样品从170℃加热至500℃,恒温保持20 min;(3)以10 K/min的降温速率进行冷却,将样品温度从500℃冷却至100℃。
每一种纳米熔盐随机取3个样品,在相同实验条件下,对每个样品重复测量三次,取平均值,确保实验结果准确、可靠。将已知比热容的蓝宝石标准样品与纳米熔盐样品的DSC曲线对比,按式(1)计算纳米熔盐样品的比热容:
式中,cp,std和cp,sam分别为标准样品(蓝宝石)和被测样品的比热容,J/(g·K);hstd和hsam分别为标准样品与参考空坩埚的DSC信号差、被测样品与参考空坩埚的DSC信号差,mW;mstd和msam分别为标准样品和被测样品的质量,g;
纳米熔盐的熔点和熔化潜热依据热流测试曲线,根据标准ASTM E967-18进行确定。
1.4 纳米熔盐微观结构表征
从为微观上研究制备方法对纳米熔盐的影响,实验采用扫描电子显微(日立高新SU8000)拍摄最佳搅拌条件下制备纳米熔盐的微观形貌,SEM图中颜色深浅代表着材料成分的区别。

表1 组分盐和纳米材料的基本特性Table 1 Basic characteristics of component salts and nanoparticles
1.5 测量结果的不确定度分析
本文测量的纳米熔盐熔点、熔化潜热和比热容三个关键储热性能参数,这三个性能参数受不同因素的影响,因此需要对测量结果进行不确定度分析。熔点的测量不确定度由温度重复测量的标准不确定度和同步热分析仪温度的示值不确定度组成,熔化潜热的测量不确定度由热流计重复测量的标准不确定度和同步热分析仪温度的示值不确定度组成,而比热容测量结果不确定度的影响因素更多,包括蓝宝石标样的比热容、DSC信号和质量,被测样品的质量,参考空坩埚的DSC信号等。
通过测量、计算不同测量结果的A类和B类标准不确定度,各性能参数测量结果的不确定度按式(2)~式(4)计算
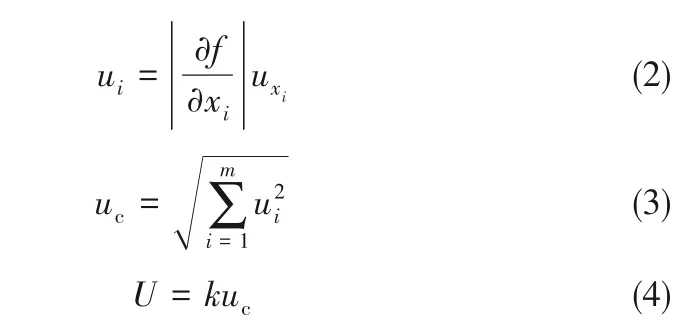
式中,f为被测变量xi的函数;uxi为被测量的标准不确定度;ui为被测量的标准不确定度分量;uc测量结果的合成不确定度;U为被测量的展申不确定度(本文k取2.0)。
按照上述方法,计算得到纳米熔盐熔点、熔化潜热和比热容的不确定度分别为0.32℃、0.56 J/g和0.025 J/(g·K)。
2 实验结果与讨论
2.1 纳米熔盐制备工艺过程能耗分析
纳米熔盐应用于工业过程中,一般都是大批量生产,大规模应用。若纳米熔盐在储热工程现场进行制备,制备的纳米熔盐直接充入储热系统。
实际工程中,纳米熔盐可以在储热工程现场制备,也可以在制造商处制备。如果纳米熔盐在大型储热工程现场制备,实验室中的水溶液法和高温熔融法制备工艺改造为如图1所示的工艺流程。在储热工程现场,制备好的纳米熔盐直接充入储热罐。
在储热工程现场,采用水溶液法制备纳米熔盐主要涉及以下过程能耗:①去离子水制备过程耗能qAS,1(一般1 g基盐添加10 ml去离子水);②纳米熔盐搅拌过程耗能qAS,2,包括获得基盐溶液制备搅拌、纳米颗粒悬浮液搅拌和纳米熔盐悬浮液搅拌过程;③纳米熔盐悬浮液水分蒸发过程耗能qAS,3;④纳米熔盐粉体熔化过程耗能qAS,4;⑤储热系统充装纳米熔盐过程耗能qAS,5。
因此,水溶液法制备纳米熔盐过程的总能耗qAS用式(5)计算:
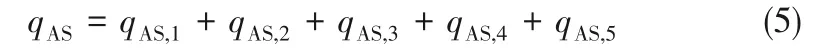

图1 改后的纳米熔盐工程现场制备工艺Fig.1 Improved preparation processes for in-situ preparation of molten salt nanofluids
工程现场采用高温熔融法制备纳米熔盐的过程主要涉及以下耗能:①基盐初熔过程耗能qHM,1;②纳米熔盐搅拌过程耗能qHM,2;③储热系统充装纳米熔盐耗能qHM,3。
因此,高温熔融法制备纳米熔盐过程中的总能耗qHM用式(6)计算:
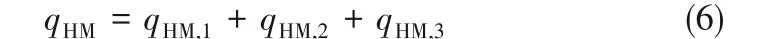
对比式(5)和式(6),可以看到,水溶液法中的纳米溶液搅拌过程耗能qAS,2、纳米熔盐粉体熔化过程耗能qAS,4和储热系统充装纳米熔盐过程耗能qAS,5分别与高温熔融法中的纳米熔盐搅拌过程耗能qHM,2、基盐初熔过程耗能qHM,1及储热系统充装纳米熔盐耗能qHM,3近似相等。因此,在储热工程现场,水溶液法比高温熔融法制备纳米熔盐多消耗的能量q用式(7)计算

由式(7)可以看到,水溶液法制备纳米熔盐多消耗的能量为去离子水制备过程能耗和纳米熔盐悬浮液水分蒸发过程能耗的总和。在大型储热工程中,纳米熔盐的用量非常大,如50 MW装机容量、储热7.5 h的聚光太阳能热发电系统,储热系统至少需要28000 kg熔盐。若采用水溶液法制备28000 kg的纳米熔盐则需要耗费280000 kg去离子水,水分蒸发过程能耗高达639.2 GJ,这对储能工程现场也是一个很大的经济和用能负担。因此,在储能工程现场制备纳米熔盐时,高温熔融盐法在能耗方面比水溶液法具有绝对优势,更适用于纳米熔盐的大规模生产。
2.2 制备方法对储热性能的影响
本课题组前期工作[21]已经对实验仪器和实验方法进行了精确度验证,测量系统误差满足本实验测量的精度要求。
(1)纳米熔盐相变潜热 从表2可以看到,在相变潜热方面,水溶液方法搅拌30和45 min时制备纳米熔盐的熔化潜热均低于基盐;随着搅拌时间的延长,纳米熔盐的熔化潜热总体上呈现先升高,后下降的趋势,最大提升4.86%。对于高温熔融法,随着搅拌时间的延长,所制备纳米熔盐的熔化潜热存在一定的波动,但熔化潜热均高于基盐,最大升高5.80%,且高温熔融法制备纳米熔盐的熔化潜热总体上高于水溶液法。在熔点方面,随着搅拌时间的延长,水溶液方法制备纳米熔盐的熔点均低于基盐,但存在微小波动,最大降低8.3℃。随着搅拌时间的延长,高温熔融法制备纳米熔盐的熔点基本保持稳定,降幅略低于水溶液法,最大降低7.9℃。因此,从熔化潜热和熔点上难以确定最佳搅拌时间及两种方法的优劣。
制备方法对熔盐的影响也反映在热流曲线上。如图2所示,在基盐中添加纳米颗粒后,由于搅拌时间不同,纳米熔盐的热流曲线也发生了明显变化。从图2(a)看到,水溶液法搅拌30 min制备纳米熔盐热流曲线的峰值升高,且向左侧偏移。水溶液法在其他搅拌时间下制备数纳米熔盐的峰值均降低、且向右发生了移位。从图2(b)看到,采用高温熔融法制备纳米熔盐的热流曲线峰值也均低于基盐,但熔化区间明显变宽。但纳米熔盐的热流曲线分布比较集中,说明高温熔融法制备工艺的影响因素较少。总的来看,两种方法制备纳米熔盐的熔化过程均发生了不同程度的变化,说明除纳米材料对熔盐产生影响外,制备过程对纳米熔盐的相变过程产生了一定影响,但高温熔融法制备纳米熔盐工艺过程影响较小。
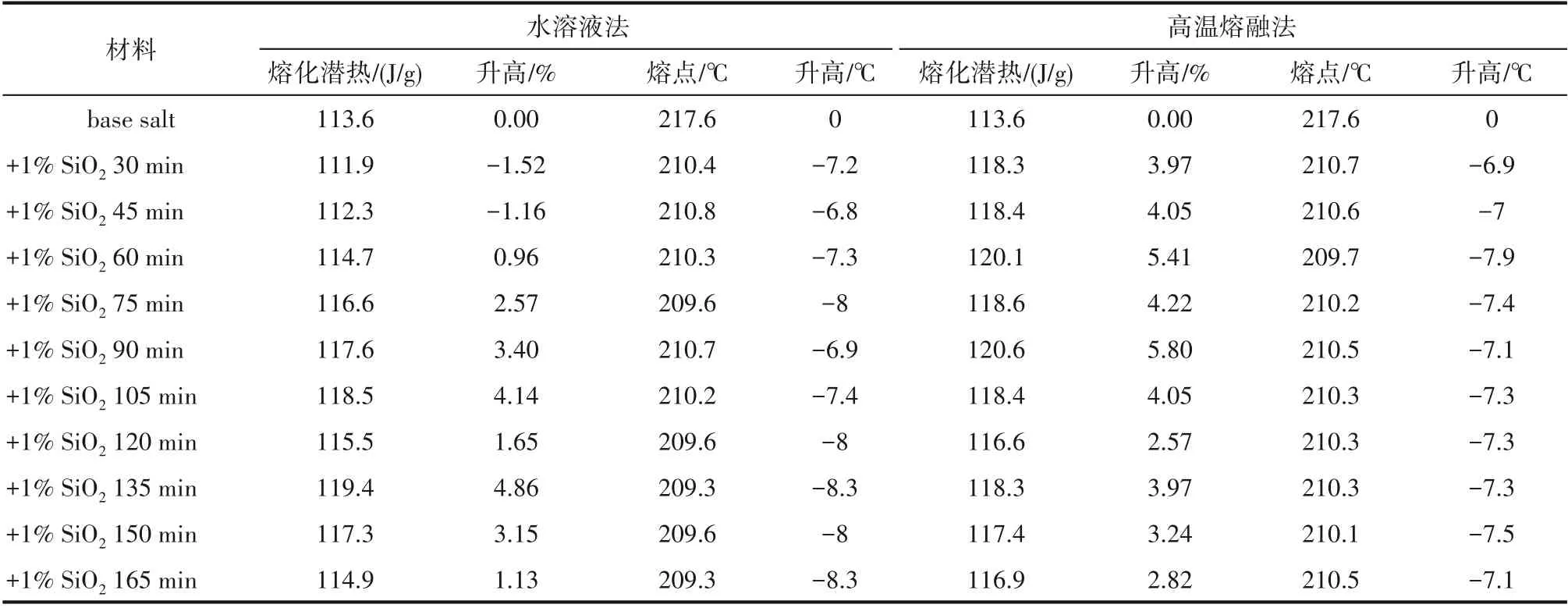
表2 纳米熔盐的熔点和相变潜热Table 2 Melting point and latent heat of molten salt nanofluids
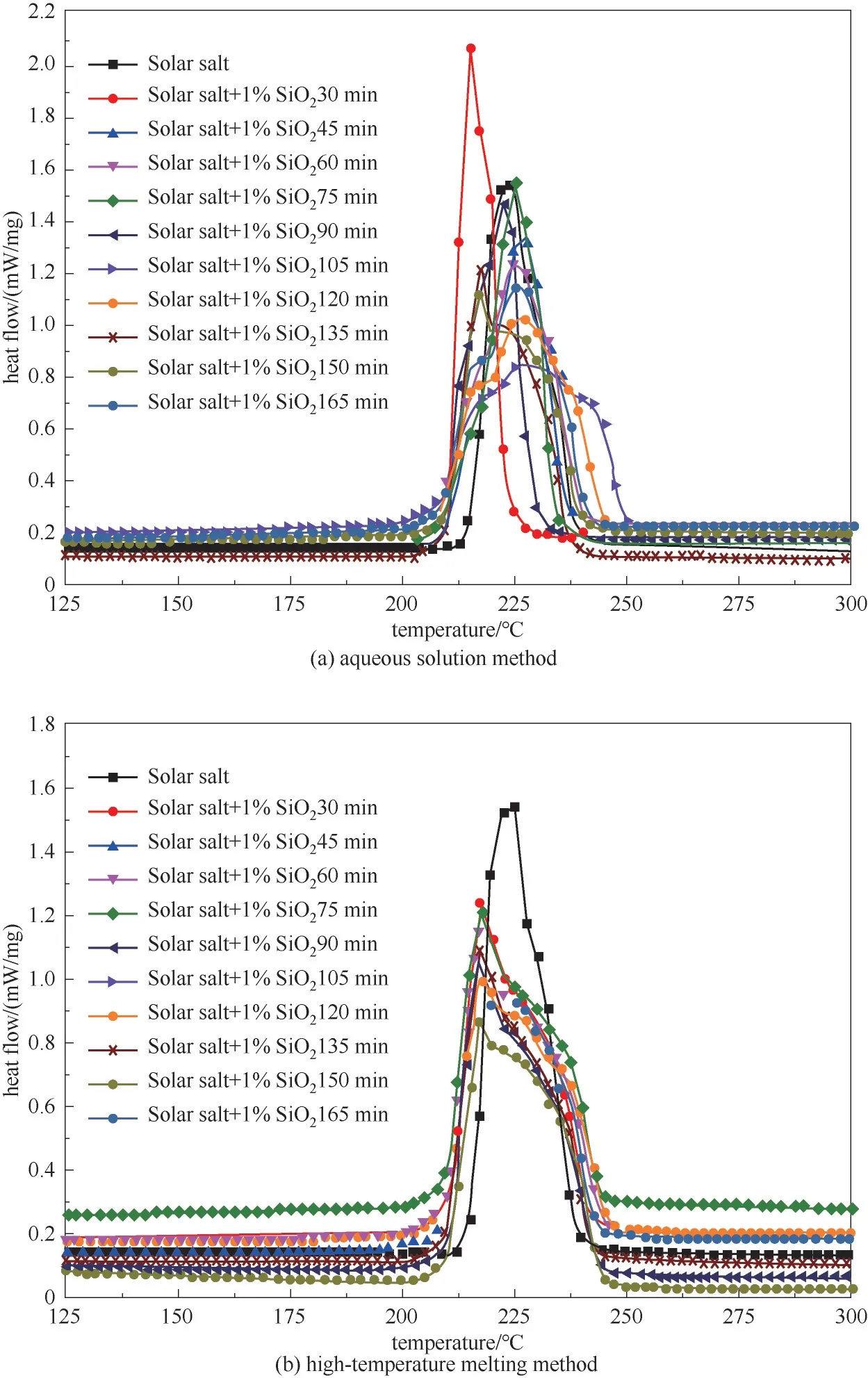
图2 纳米熔盐的热流曲线Fig.2 Heat flow of molten salt nanofluids prepared by both methods
(2)纳米熔盐显热 比热容越大,则材料的显热储热能力越强,储热密度越大。图3为两种方法所制备纳米熔盐在250~300℃间的平均比热容。可以看到,随着搅拌时间的延长,两种方法制备纳米熔盐的平均比热容均呈现先升高,然后下降的趋势,且均在搅拌90 min时达到最大值。其中,水溶液法制备纳米熔盐的平均比热容最大提升17.38%(搅拌90 min),而高温熔融法制备纳米熔盐的平均比热容最大提升高达45.56%(搅拌90 min)。
图4为两种方法制备纳米熔盐比热容随温度变化。可以看到,随着温度的升高,各纳米熔盐的比热容均随温度的升高近似线性升高,不存在比热容值突变的情况。从图4可以明显看到,无论采用那种制备方法,搅拌90 min制备的纳米熔盐比热容均达到最高,是最佳搅拌时间。搅拌时间过短、过长都会导致备纳米熔盐的比热容降低。
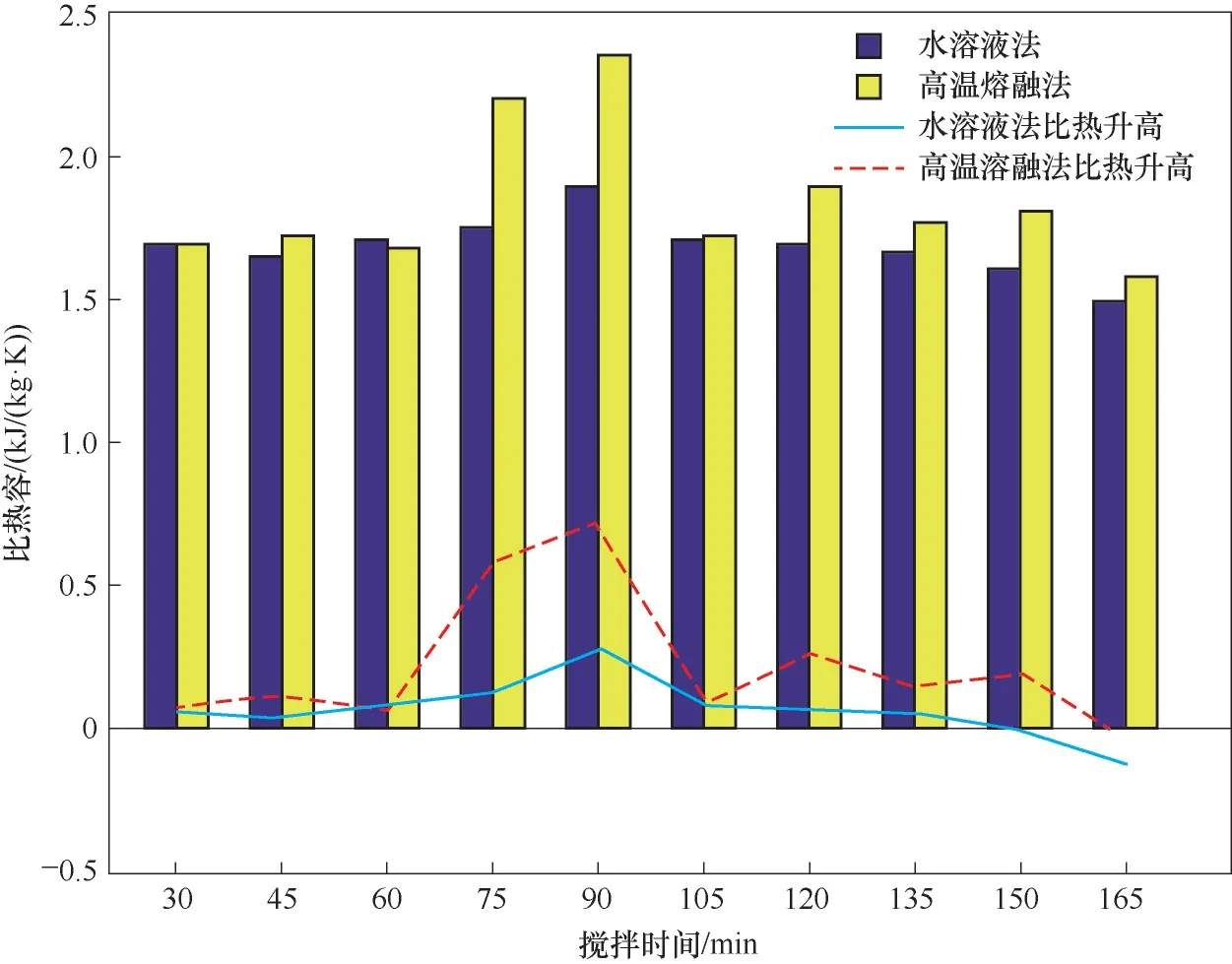
图3 两种方法制备纳米熔盐的平均比热容Fig.3 Average specific heat of molten salt nanofluids by both methods
从纳米熔盐比热容的对比可以看到,在最佳搅拌时间90 min时,高温熔融法制备纳米熔盐的平均比热容比水溶液法高28.18%,高温熔融法在纳米比热容的提升上明显优于水溶液法。
2.3 制备方法对微观形貌的影响
图5所示为两种制备方法搅拌90 min时配制纳米熔盐的微观形貌。
图5(a)为高温熔融法搅拌90 min配制纳米熔盐的微观形貌。可以看到,在纳米熔盐面形成了许多大小相对均匀、分布也相对均匀的晶体颗粒,且大多数粒径在200 nm左右,纳米熔盐主体颗粒粒径较细小。表明SiO2纳米颗粒[20 nm,1.0%(质量)]与基盐相互作用更加充分,纳米材料分布较为均匀。图6(b)为水溶液法搅拌90 min配制纳米熔盐的微观形貌。可以看出,纳米熔盐主体中两种组分盐(硝酸钠、硝酸钾)相互镶嵌的特征还明显存在[4],但在两种组分熔盐结合处及熔盐表面形成了与基盐颜色不同的物质,且在图中上方发现了类似棉糖状物质。对比发现,通过90 min搅拌,高温熔融法制备纳米熔盐中形成了明显的晶体颗粒,且数量众多,结构更加致密,颗粒大小均匀,分布也相对均匀。而采用水溶液制备纳米熔盐中并没有发现明显的晶体颗粒,仅发现一些棉糖状物质。因此,纳米熔盐的储热性能与纳米熔盐中形成的晶体颗粒数量和大小相关。
2.4 纳米熔盐形成与性能强化机理分析
纳米流体的形成和性能强化机理是掌握纳米材料制备方法和应用的关键。由于传统纳米流体与熔盐在热物性上存在明显区别,纳米熔盐的形成和强化机理近年来也受到研究人员的重视,通过实验研究[22-23]和分子动力学模拟[24-26]的方法,提出了不同的机理解释[27-30],但这些机理描述都存在一定的局限性,或者难以解释强化的细节问题,或者存在解释上的矛盾。
2.4.1 纳米熔盐的形成 二氧化硅纳米颗粒晶体在空间上以无定型结构存在,内部原子排列为不规则Si—O四面体支化网状结构。由于二氧化硅纳米颗粒(<100 nm)尺寸很接近原子尺寸,颗粒表面缺少配位原子的Si原子和O原子存在很多悬空键,使得二氧化硅纳米颗粒具有高不饱和性、高化学活性、高比表面能及强亲水力,易于与水作用,在纳米颗粒表面形成羟基,活性降低。
对于制备纳米熔盐的水溶液法,由1.2.2节的制备步骤可以看到,在其制备工艺的第二步,即二氧化硅纳米颗粒与水混合,制备二氧化硅纳米颗粒悬浮液的过程。当二氧化硅纳米颗粒遇到水分子时,二氧化硅纳米颗粒[图6(a),其中橘红色的圆代表二氧化硅颗粒中的氧原子]表面缺少配位原子的众多高活性Si原子和O原子会夺取水分子中的OH基团和H原子,搅拌过程中在纳米颗粒表面形成大量距离不等、存在活性差异的中性基团,即羟基[图6(b)及图6(d)~(e)中的绿色部分]。混合之后的搅拌加速了二氧化硅纳米颗粒表面羟基的形成。

图4 两种方法制备纳米熔盐的比热容随温度变化Fig.4 Specific heat of molten salt nanofluids by both methods

图5 搅拌90 min制备纳米熔盐的微观形貌Fig.5 Micromorphology of molten salt nanofluids prepared by mixing for 90 min
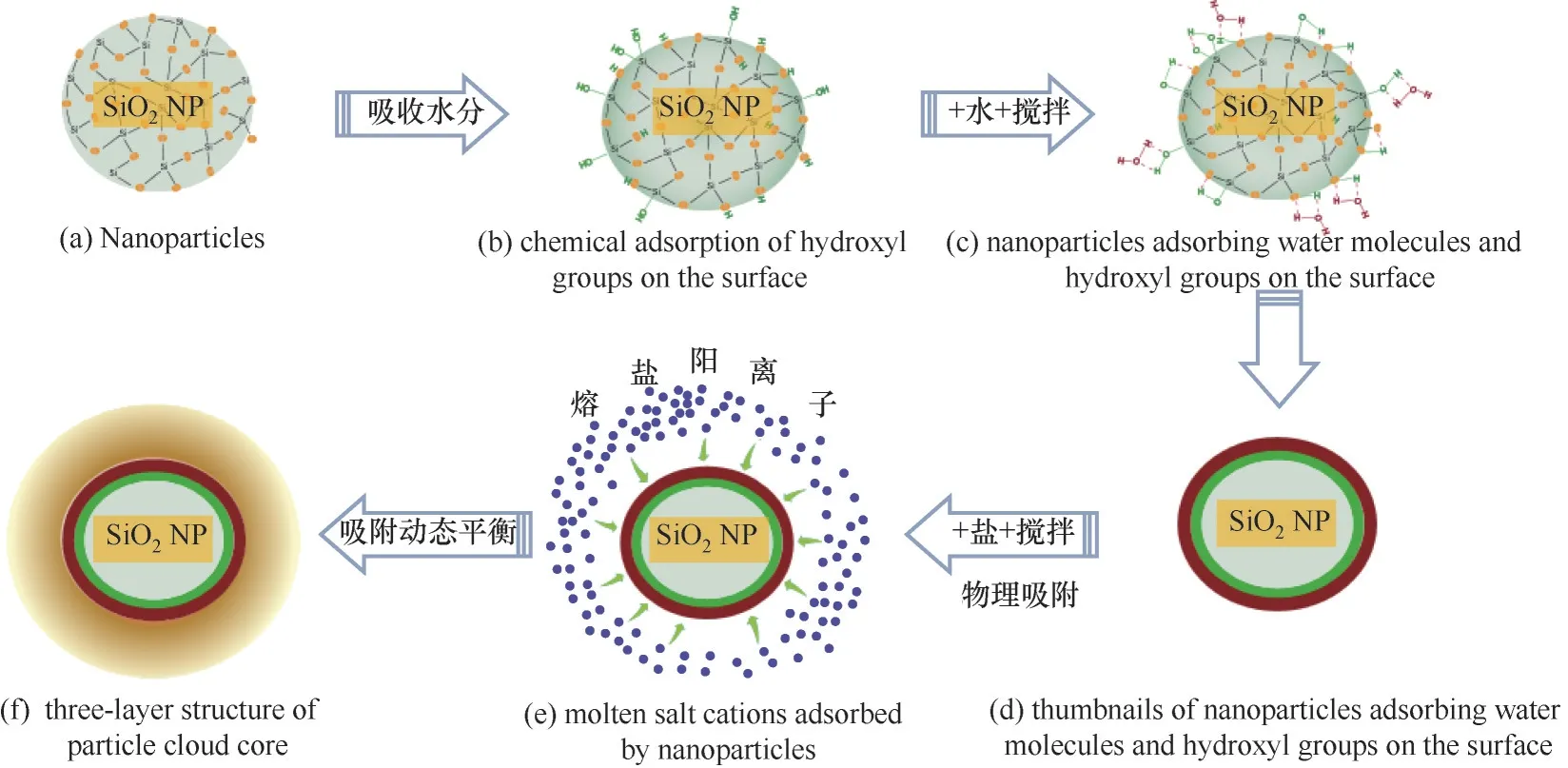
图6 水溶液法制备纳米熔盐的形成机理Fig.6 Formation mechanismof molten salt nanofluids prepared by aqueous solution metho d
随着搅拌时间的延长,纳米颗粒表面上空间距离较近[小于3Å(1Å=0.1 nm)时]的羟基间会相互作用,合成连生羟基,形成氢键。水分子还会与颗粒表面的自由羟基(isolated hydroxyl)或双生羟基(pairing hydroxyl)结合,形成氢键,吸附水分子。搅拌持续一定时间后,二氧化硅纳米颗粒表面的部分高活性Si原子和O原子与水形成氢键,被水分子占据;另一部分高活性Si原子和O原子上形成高稳定的连生羟基型氢键[图6(c)及图6(d)~(e)中的深红色部分]。如果搅拌时间较短,软团聚的纳米颗粒还没有完全散开,软团聚的纳米颗粒仍以软团聚的形式存在。随着纳米颗粒悬浮液与基盐溶液的混合,由于纳米颗粒表面已完全覆盖氢键,熔盐分子与二氧化硅纳米颗粒表面的氢键发生弱静电作用。在纳米颗粒与熔盐分子间范德华力及与氢键间弱静电力的作用下(纳米颗粒与水分子间的静电作用力远低于与纳米颗粒间的范德华力),熔盐分子被物理吸附到纳米颗粒表面上[图6(e)],形成叠层式熔盐分子物理吸附层。对于一定粒径的纳米颗粒,在纳米颗粒最佳浓度及最优搅拌时间时,纳米颗粒表面最终形成一层羟基紧贴壁面、水分子紧紧氢键吸附、熔盐分子外部多层物理吸附包裹的固态颗粒云核,如图6(f)所示。此时,以二氧化硅纳米颗粒为中心形成的云核,在某一温度下,其最外层的熔盐分子处于力学准平衡状态。在外部能量作用下,如纳米熔盐悬浮液被加热,最外层熔盐离子很容易脱离云核。在纳米熔盐溶液加热(温度低于溶液沸点)蒸发去除水分的过程中,溶液中的水分子逐渐蒸发,离开溶液。随着水分逐渐蒸干,云核中的熔盐分子结晶到纳米颗粒表面。云核周围的部分熔盐分子也会在云核表面结晶,形成较大的晶体颗粒。此外,由于水分子与熔盐分子之间的范德华力和静电力作用,溶液中的部分水分子会与云核最外层及主体溶液中熔盐分子结合,形成水合盐。对于高温熔融法制备纳米熔盐的工艺,由1.2.2节可以看到,在纳米熔盐的制备过程中,纳米颗粒直接与熔融状态的盐离子混合,通过搅拌,纳米颗粒与熔盐粒子之间进行充分相互作用。由于纳米颗粒表面没有羟基,表面O原子和Si原子仍然处于悬空状态,具有高不饱和性和高化学活性,因此,熔盐分子被直接吸附到纳米颗粒表面,纳米颗粒表面的第一层通过化学吸附的形式呈现,外层在纳米颗粒作用力和静电力的作用下形成物理吸附,最终形成的云核结构如图7所示。与水溶液法形成的颗粒云核的区别在于,高温熔融法形成的颗粒云核内没有羟基和氢键,而是通过化学吸附的一层熔盐离子。
2.4.2 纳米熔盐比热容的强化 对于水溶液法制
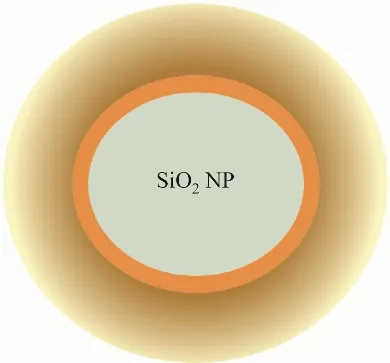
图7 高温熔融法制备纳米熔盐中形成的颗粒云核结构Fig.7 Structure of cloud nuclei formed in molten salt nanofluids prepared by high-temperature melting method
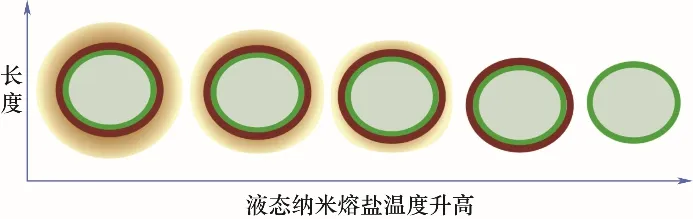
图8 水溶液法颗粒云核直径随温度的变化Fig.8 Change of cloud nuclei diameter over temperature
备的纳米熔盐,由于氢键作用力高于范德华力和静电力的作用,在纳米熔盐加热至熔化的过程中,依靠范德华力和静电力存在于固态云核中的最外层熔盐分子会最先失去平衡,远离纳米颗粒,达到新的平衡。随着熔盐温度的不断升高,固态云核内的熔盐分子逐渐远离纳米颗粒,固态云核尺寸逐渐减小,如图8所示。
当纳米熔盐温度升高至接近分解温度时,纳米颗粒表面吸附的熔盐离子全部离开纳米颗粒,氢键断裂,水分子从纳米颗粒表面脱离后析出,羟基不发生变化。随着纳米熔盐温度的降低,由于电中性的羟基不会与熔盐李四发生静电作用,因此,熔盐离子随着系统温度的降低,通过纳米颗粒与熔盐离子键的范德华力及熔盐离子间的静电力吸附、靠近纳米颗粒表面,逐渐形成新的云核。且随着温度的降低,云核直径不断增大。
在纳米熔盐中云核粒径减小、熔盐离子远离纳米颗粒表面,及颗粒云核粒径增大、熔盐离子靠近纳米颗粒表面的过程中,熔盐离子被吸附或解吸的过程中必然吸收或释放多余的热量,液态纳米熔盐表现为比热容的升高。高温熔融法制备的纳米熔盐在升温和降温过程中表现出类似的过程,只是该方法形成的颗粒云核表面的化学吸附层的作用,使得该方法制备纳米熔盐的比热容更高。
2.4.3 纳米熔盐熔化潜热的强化 纳米颗粒与熔盐结合后形成大量的微小云核,这些云核随着熔盐温度的升高直径会减小(外层熔盐离子远离纳米颗粒),造成2.4.2节中的纳米熔盐比热容升高。不可否认,纳米云核形成后,云核会对周围未实质进入云核的主体熔盐产生吸引力,该吸引力在熔盐离子原子核之间、电子之间排斥力的作用下达到力的平衡。一旦有外部能量的输入,局部的力平衡就会打破,而后形成新的动态力平衡。由于颗粒云核的形成与存在,纳米熔盐熔化的过程中必然要克服云核对周围主体熔盐施加的作用力,即需要额外的能量使主体熔盐熔化。但由于主体熔盐距离云核中的纳米颗粒距离较远,上述吸引力(范德华力)较弱,因此,纳米熔盐的熔化潜热提升幅度较小。
2.4.4 纳米熔盐微观结构的异同 从前面的分析可以看到,两种制备方法形成纳米熔盐中的颗粒云核在结构上存在差异。
水溶液法制备纳米熔盐中的云核在经历高温前,云核由紧贴颗粒表面的羟基、以氢键吸附的外层水分子、外部物理吸附的多层熔盐分子组成。经历高温熔化及升温后,水分子从云核中脱除,此时的云核仅由紧贴颗粒表面的中性基团-羟基和外部物理吸附的多层熔盐分子组成。纳米颗粒与熔盐分子间主要存在范德华力。
通过高温熔融法所制备的纳米熔盐经历高温加热后,纳米颗粒表面被化学吸附的熔盐分子层保持稳定,云核结构不会发生变化,云核始终由紧贴颗粒表面的单层化学吸附熔盐离子和外部多层吸附熔盐分子组成。熔盐离子具有强电负性,纳米颗粒与熔盐分子间主要存在范德华力和静电力,颗粒云核的更密实,破坏云核需要的能量更高。
物质的结构变化必定会造成物质属性及形貌的变化。纳米熔盐中云核的形成提升的纳米熔盐的储热性能,同时改变为纳米熔盐的围观结构。而两种方法制备纳米熔盐的工艺不同,造成了纳米熔盐云核的结构不同,从而造成两种纳米熔盐的围观结构存在差异。
3结 论
利用水溶液法和高温熔融法,通过改变搅拌时间制备相同组分的纳米熔盐,通过工艺过程能耗分析、实验研究和理论分析,对比两种方法制备纳米熔盐的储热性能,提出纳米熔盐的形成和强化机理。主要得到以下结论。
(1)高温熔融法制备纳米熔盐工艺过程简单,能耗低,更适用于纳米熔盐的大批量制备,最佳搅拌时间90 min;
(2)制备方法对纳米熔盐的熔化潜热和熔点影响较小,但对纳米熔盐的比热容影响大;在最佳搅拌时间条件下,高温熔融法制备纳米熔盐的平均比热容比基盐提高45.56%,比水溶液法制备纳米熔盐的比热容高28.18%;
(3)在最佳搅拌时间条件下,高温熔融法制备纳米熔盐中形成了较多粒径较小、颗粒均匀的晶体颗粒,而水溶液法制备纳米熔盐中形成的颗粒更大,数量较少,且出现了绵糖状结构;
(4)水分是影响水溶液法和高温熔融法制备纳米熔盐中云核结构的关键,云核的结构决定着纳米熔盐储热性能的强化程度和微观结构变化。

